szereg elektrochemiczny
szereg elektrochemiczny
szereg elektrochemiczny
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
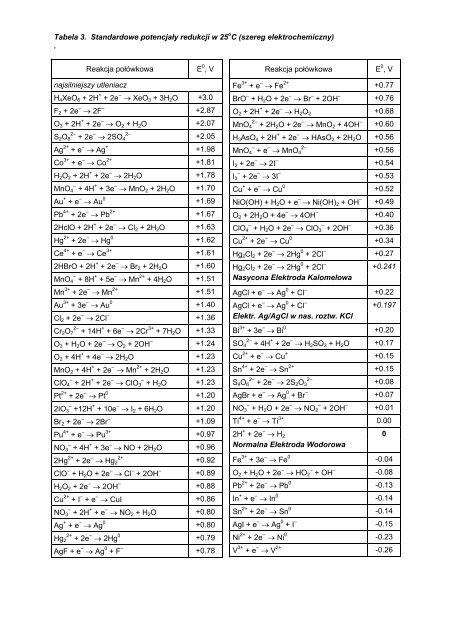
Tabela 3. Standardowe potencjały redukcji w 25 o C (<strong>szereg</strong> <strong>elektrochemiczny</strong>).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , Vnajsilniejszy utleniaczH 4 XeO 6 + 2H + + 2e – → XeO 3 + 3H 2 O +3.0F 2 + 2e – → 2F – +2.87O 3 + 2H + + 2e – → O 2 + H 2 O +2.07S 2 O 2– 8 + 2e – 2–→ 2SO 4 +2.05Ag 2+ + e – → Ag + +1.98Co 3+ + e – → Co 2+ +1.81H 2 O 2 + 2H + + 2e – → 2H 2 O +1.78MnO – 4 + 4H + + 3e – → MnO 2 + 2H 2 O +1.70Au + + e – → Au 0 +1.69Pb 4+ + 2e – → Pb 2+ +1.672HclO + 2H + + 2e – → Cl 2 + 2H 2 O +1.63Hg 2+ + 2e – → Hg 0 +1.62Ce 4+ + e – → Ce 3+ +1.612HBrO + 2H + + 2e – → Br 2 + 2H 2 O +1.60MnO – 4 + 8H + + 5e – → Mn 2+ + 4H 2 O +1.51Mn 3+ + 2e – → Mn 2+ +1.51Au 3+ + 3e – → Au 0 +1.40Cl 2 + 2e – → 2Cl – +1.36Cr 2 O 2– 7 + 14H + + 6e – → 2Cr 3+ + 7H 2 O +1.33O 3 + H 2 O + 2e – → O 2 + 2OH – +1.24O 2 + 4H + + 4e – → 2H 2 O +1.23MnO 2 + 4H + + 2e – → Mn 2+ + 2H 2 O +1.23ClO – 4 + 2H + + 2e – → ClO – 3 + H 2 O +1.23Pt 2+ + 2e – → Pt 0 +1.202IO – 3 +12H + + 10e – → I 2 + 6H 2 O +1.20Br 2 + 2e – → 2Br – +1.09Pu 4+ + e – → Pu 3+ +0.97NO – 3 + 4H + + 3e – → NO + 2H 2 O +0.962Hg 2+ + 2e – 2+→ Hg 2 +0.92ClO – + H 2 O + 2e – → Cl – + 2OH – +0.89H 2 O 2 + 2e – → 2OH – +0.88Cu 2+ + I – + e – → CuI +0.86NO – 3 + 2H + + e – → NO 2 + H 2 O +0.80Ag + + e – → Ag 0 +0.80Hg 2+ 2 + 2e – → 2Hg 0 +0.79AgF + e – → Ag 0 + F – +0.78Fe 3+ + e – → Fe 2+ +0.77BrO – + H 2 O + 2e – → Br – + 2OH – +0.76O 2 + 2H + + 2e – → H 2 O 2 +0.68MnO 4 2– + 2H 2 O + 2e – → MnO 2 + 4OH – +0.60H 3 AsO 4 + 2H + + 2e – → HAsO 2 + 2H 2 O +0.56MnO 4 – + e – → MnO 42–+0.56I 2 + 2e – → 2I – +0.54I 3 – + 2e – → 3I – +0.53Cu + + e – → Cu 0 +0.52NiO(OH) + H 2 O + e – → Ni(OH) 2 + OH – +0.49O 2 + 2H 2 O + 4e – → 4OH – +0.40ClO 4 – + H 2 O + 2e – → ClO 3 – + 2OH – +0.36Cu 2+ + 2e – → Cu 0 +0.34Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.27Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.241Nasycona Elektroda KalomelowaAgCl + e – → Ag 0 + Cl – +0.22AgCl + e – → Ag 0 + Cl – +0.197Elektr. Ag/AgCl w nas. roztw. KClBi 3+ + 3e – → Bi 0 +0.20SO 4 2– + 4H + + 2e – → H 2 SO 3 + H 2 O +0.17Cu 2+ + e – → Cu + +0.15Sn 4+ + 2e – → Sn 2+ +0.15S 4 O 6 2– + 2e – → 2S 2 O 32–+0.08AgBr + e – → Ag 0 + Br – +0.07NO 3 – + H 2 O + 2e – → NO 2 – + 2OH – +0.01Ti 4+ + e – → Ti 3+ 0.002H + + 2e – → H 2 0Normalna Elektroda WodorowaFe 3+ + 3e – → Fe 0 -0.04O 2 + H 2 O + 2e – → HO 2 – + OH – -0.08Pb 2+ + 2e – → Pb 0 -0.13In + + e – → In 0 -0.14Sn 2+ + 2e – → Sn 0 -0.14AgI + e – → Ag 0 + I – -0.15Ni 2+ + 2e – → Ni 0 -0.23V 3+ + e – → V 2+ -0.26
Tabela 3. Standardowe potencjały redukcji w 25 o C (<strong>szereg</strong> <strong>elektrochemiczny</strong>; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VCo 2+ + 2e – → Co 0 -0.28In 3+ + 3e – → In 0 -0.34Tl + + e – → Tl 0 -0.34PbSO 4 + 2e – → Pb 0 2–+ SO 4 -0.36Ti 3+ + e – → Ti 2+ -0.37In 2+ + e – → In + -0.40Cd 2+ + 2e – → Cd 0 -0.40Cr 3+ + e – → Cr 2+ -0.41Fe 2+ + 2e – → Fe 0 -0.44In 3+ + 2e – → In + -0.44S + 2e – → S 2– -0.48In 3+ + e – → In 2+ -0.49Ga + + e – → Ga 0 -0.53O 2 + e – –→ O 2 -0.56U 4+ + e – → U 3+ -0.61Se + 2e – → Se 2– -0.67Cr 3+ + 3e – → Cr 0 -0.74Zn 2+ + 2e – → Zn 0 -0.76Cd(OH) 2 + 2e – → Cd 0 + 2OH – -0.812H 2 O + 2e – → H 2 + 2OH – -0.83Te + 2e – → Te 2– -0.84Cr 2+ + 2e – → Cr 0 -0.91Mn 2+ + 2e – → Mn 0 -1.18V 2+ + 2e – → V 0 -1.19Ti 2+ + 2e – → Ti 0 -1.63Al 3+ + 3e – → Al 0 -1.66U 3+ + 3e – → U 0 -1.79Be 2+ + 2e – → Be 0 -1.85Mg 2+ + 2e – → Mg 0 -2.36Ce 3+ + 3e – → Ce 0 -2.48La 3+ + 3e – → La 0 -2.52Na + + e – → Na 0 -2.71Ca 2+ + 2e – → Ca 0 -2.87Sr 2+ + 2e – → Sr 0 -2.89Ba 2+ + 2e – → Ba 0 -2.91Ra 2+ + 2e – → Ra 0 -2.92Cs + + e – → Cs 0 -2.92Rb + + e – → Rb 0 -2.93K + + e – → K 0 -2.93Li + + e – → Li 0 -3.05najsilniejszy reduktorTabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VAg 2+ + e – → Ag + +1.98Ag + + e – → Ag 0 +0.80AgBr + e – → Ag 0 + Br – +0.07AgCl + e – → Ag 0 + Cl – +0.22AgCl + e – → Ag 0 + Cl – +0.197Elektroda Ag/AgCl w nas. roztw. KClAgF + e – → Ag 0 + F – +0.78AgI + e – → Ag 0 + I – -0.15Al 3+ + 3e – → Al 0 -1.66H 3 AsO 4 + 2H + + 2e – → HAsO 2 + 2H 2 O +0.56Au 3+ + 3e – → Au 0 +1.40Au + + e – → Au 0 +1.69Ba 2+ + 2e – → Ba 0 -2.91Be 2+ + 2e – → Be 0 -1.85Bi 3+ + 3e – → Bi 0 +0.202HBrO + 2H + + 2e – → Br 2 + 2H 2 O +1.60BrO – + H 2 O + 2e – → Br – + 2OH – +0.76Br 2 + 2e – → 2Br – +1.09Ca 2+ + 2e – → Ca 0 -2.87Cd 2+ + 2e – → Cd 0 -0.40Cd(OH) 2 + 2e – → Cd 0 + 2OH – -0.81Ce 4+ + e – → Ce 3+ +1.61Ce 3+ + 3e – → Ce 0 -2.48ClO – 4 + 2H + + 2e – → ClO – 3 + H 2 O +1.23ClO – 4 + H 2 O + 2e – → ClO – 3 + 2OH – +0.362HClO + 2H + + 2e – → Cl 2 + 2H 2 O +1.63
Tabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VClO – + H 2 O + 2e – → Cl – + 2OH – +0.89Cl 2 + 2e – → 2Cl – +1.36Co 3+ + e – → Co 2+ +1.81Co 2+ + 2e – → Co 0 -0.28Cr 2 O 7 2– + 14H + + 6e – → 2Cr 3+ + 7H 2 O +1.33Cr 3+ + e – → Cr 2+ -0.41Cr 3+ + 3e – → Cr 0 -0.74Cr 2+ + 2e – → Cr 0 -0.91Cs + + e – → Cs 0 -2.92Cu 2+ + e – → Cu + +0.15Cu 2+ + I – + e – → CuI +0.86Cu 2+ + 2e – → Cu 0 +0.34Cu + + e – → Cu 0 +0.52F 2 + 2e – → 2F – +2.87Fe 3+ + e – → Fe 2+ +0.77Fe 3+ + 3e – → Fe 0 -0.04Fe 2+ + 2e – → Fe 0 -0.44Ga + + e – → Ga 0 -0.532H + + 2e – → H 2 0Normalna Elektroda Wodorowa2H 2 O + 2e – → H 2 + 2OH – -0.832Hg 2+ + 2e – → Hg 22++0.92Hg 2+ + 2e – → Hg 0 +1.62Hg 2 2+ + 2e – → 2Hg 0 +0.79Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.27Hg 2 Cl 2 + 2e – → 2Hg 0 + 2Cl – +0.241Nasycona Elektroda Kalomelowa2IO 3 – +12H + + 10e – → I 2 + 6H 2 O +1.20I 2 + 2e – → 2I – +0.54I 3 – + 2e – → 3I – +0.53In 3+ + e – → In 2+ -0.49In 3+ + 2e – → In + -0.44In 3+ + 3e – → In 0 -0.34In 2+ + e – → In + -0.40In + + e – → In 0 -0.14K + + e – → K 0 -2.93La 3+ + 3e – → La 0 -2.52Li + + e – → Li 0 -3.05Mg 2+ + 2e – → Mg 0 -2.36MnO – 4 + e – 2–→ MnO 4 +0.56MnO – 4 + 4H + + 3e – → MnO 2 + 2H 2 O +1.70MnO – 4 + 8H + + 5e – → Mn 2+ + 4H 2 O +1.51MnO 2– 4 + 2H 2 O + 2e – → MnO 2 + 4OH – +0.60MnO 2 + 4H + + 2e – → Mn 2+ + 2H 2 O +1.23Mn 3+ + e – → Mn 2+ +1.51Mn 2+ + 2e – → Mn 0 -1.18NO – 3 + 2H + + e – → NO 2 + H 2 O +0.80NO – 3 + H 2 O + 2e – → NO – 2 + 2OH – +0.01NO – 3 + 4H + + 3e – → NO + 2H 2 O +0.96Na + + e – → Na 0 -2.71NiO(OH) + H 2 O + e – → Ni(OH) 2 + OH – +0.49Ni 2+ + 2e – → Ni 0 -0.23O 2 + e – –→ O 2 -0.56O 2 + H 2 O + 2e – → HO – 2 + OH – -0.08O 2 + 2H + + 2e – → H 2 O 2 +0.68O 2 + 4H + + 4e – → 2H 2 O +1.23O 2 + 2H 2 O + 4e – → 4OH – +0.40O 3 + 2H + + 2e – → O 2 + H 2 O +2.07O 3 + H 2 O + 2e – → O 2 + 2OH – +1.24H 2 O 2 + 2H + + 2e – → 2H 2 O +1.78H 2 O 2 + 2e – → 2OH – +0.88Pb 4+ + 2e – → Pb 2+ +1.67Pb 2+ + 2e – → Pb 0 -0.13PbSO 4 + 2e – → Pb 0 2–+ SO 4 -0.36Pt 2+ + 2e – → Pt 0 +1.20Pu 4+ + e – → Pu 3+ +0.97Ra 2+ + 2e – → Ra 0 -2.92Rb + + e – → Rb 0 -2.93S 2 O 2– 8 + 2e – 2–→ 2SO 4 +2.05SO 2– 4 + 4H + + 2e – → H 2 SO 3 + H 2 O +0.17S 4 O 2– 6 + 2e – 2–→ 2S 2 O 3 +0.08S + 2e – → S 2– -0.48Se + 2e – → Se 2– -0.67Sn 4+ + 2e – → Sn 2+ +0.15
Tabela 4.Standardowe potencjały redukcji w 25 o C (w porządku alfabetycznym symbolipierwiastków tworzących parę redoks; c.d.).Reakcja połówkowaE 0 , VReakcja połówkowaE 0 , VSn 2+ + 2e – → Sn 0 -0.14Sr 2+ + 2e – → Sr 0 -2.89Te + 2e – → Te 2– -0.84Ti 4+ + e – → Ti 3+ 0.00Ti 3+ + e – → Ti 2+ -0.37Ti 2+ + 2e – → Ti 0 -1.63Tl + + e – → Tl 0 -0.34U 4+ + e – → U 3+ -0.61U 3+ + 3e – → U 0 -1.79V 3+ + e – → V 2+ -0.26V 2+ + 2e – → V 0 -1.19H 4 XeO 6 + 2H + + 2e – → XeO 3 + 3H 2 O +3.0Zn 2+ + 2e – → Zn 0 -0.76