Uvod u atomsku fiziku J.J. Thomson –Atom je pozitivno nabijena ...
Uvod u atomsku fiziku J.J. Thomson –Atom je pozitivno nabijena ...
Uvod u atomsku fiziku J.J. Thomson –Atom je pozitivno nabijena ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
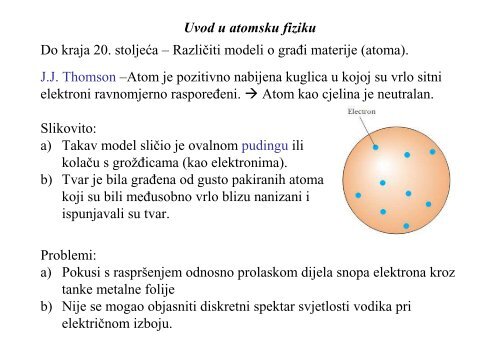
<strong>Uvod</strong> u <strong>atomsku</strong> <strong>fiziku</strong>Do kraja 20. stol<strong>je</strong>ća – Različiti modeli o grañi materi<strong>je</strong> (atoma).J.J. <strong>Thomson</strong> <strong>–Atom</strong> <strong>je</strong> <strong>pozitivno</strong> nabi<strong>je</strong>na kuglica u kojoj su vrlo sitnielektroni ravnom<strong>je</strong>rno rasporeñeni. Atom kao c<strong>je</strong>lina <strong>je</strong> neutralan.Slikovito:a) Takav model sličio <strong>je</strong> ovalnom pudingu ilikolaču s grožñicama (kao elektronima).b) Tvar <strong>je</strong> bila grañena od gusto pakiranih atomakoji su bili meñusobno vrlo blizu nanizani iispunjavali su tvar.Problemi:a) Pokusi s raspršen<strong>je</strong>m odnosno prolaskom di<strong>je</strong>la snopa elektrona kroztanke metalne foli<strong>je</strong>b) Ni<strong>je</strong> se mogao objasniti diskretni spektar sv<strong>je</strong>tlosti vodika prielektričnom izboju.
1911. Ernest Rutherford (1871.-1937.)-eksperiment koji <strong>je</strong> promi<strong>je</strong>nio spozna<strong>je</strong> o atomu-raspršen<strong>je</strong> α-čestica na tankim listićima zlata-rezultati: većina α-čestica prošla <strong>je</strong> kroz listiće zlata kao da su šuplji-neke α-čestice raspršile su se pod velikim kutem-neke α-čestice raspršile su se unazad -“To <strong>je</strong> tako nev<strong>je</strong>rojatno kao da ste ispalili metak u papir, a on se odbio nazadi pogodio vas.”
Rutherfordovo objašn<strong>je</strong>n<strong>je</strong> pokusa:-raspršen<strong>je</strong> pozitivnih α-čestica unazad može seostvariti <strong>je</strong>dino ako <strong>je</strong> pozitivan naboj atomakoncentriran u malom prostoru u odnosu na veličinuatoma – <strong>je</strong>zgri (a ne razmazan po atomu)-oko <strong>je</strong>zgre nalaze se elektroni, u relativno velikomprostoru izvan <strong>je</strong>zgre-elektroni ne padnu na <strong>je</strong>zgru <strong>je</strong>r se gibaju poputanjama – kao planeti oko SuncaTako <strong>je</strong> nastao Rutherfordov planeterni model atoma.Nedostaci modela:1. linijski spektri: atom emitira samo odreñene diskretne karakterističnefrekvenci<strong>je</strong> elektromegnetskog zračenja, i niko<strong>je</strong> druge2. stabilnost atoma: elektroni se gibaju oko <strong>je</strong>zgre i privlačna Coulombova silauzroku<strong>je</strong> centripetalnu akceleraciju elektrona; prema klasičnoj Maxwellovojteoriji elektromagnetizma, svaki naboj koji ubrzava (rotira fekvencijom f)trebao bi zračiti elektromagnetski val te iste frekvenci<strong>je</strong>; to bi za atomznačilo da elektroni koji se gibaju oko <strong>je</strong>zgre gube svoju energiju, radijusputan<strong>je</strong> im se smanju<strong>je</strong> i po spirali padaju na <strong>je</strong>zgru zračeći pri tomeelektromagnetske valove sve većih frekvencija; → kolaps atoma
Linijski atomski spektriUžareno ti<strong>je</strong>lo kao izvor sv<strong>je</strong>tlosti. Spektar <strong>je</strong> kontinuiran tj. sadržiraspod<strong>je</strong>lu intenziteta sv<strong>je</strong>tlosti po svim valnim duljinama. (Sunčevasv<strong>je</strong>tlost pokazu<strong>je</strong> takoñer kontinuirani spektar.)Električni izboj (Nasta<strong>je</strong> pri prolasku snopa elektrona kroz neki plin ustaklenoj ci<strong>je</strong>vi gd<strong>je</strong> se elektroni ubrzavaju razlikom potencijala izmeñudviju elektroda). Nakon sudara elektrona s atomima plina nasta<strong>je</strong>sv<strong>je</strong>tlost – emisijski spektar. Sv<strong>je</strong>tlost usm<strong>je</strong>rimo na spektrometar (ili rešetku). Neočekivan rezultat! U spektru nasta<strong>je</strong> samo nekoliko boja, odnosno"linija" ko<strong>je</strong> karakteriziraju atome plina.Pripadnu raspod<strong>je</strong>lu intenziteta sv<strong>je</strong>tlosti po diskretnim valnim duljinamaili linijama nazivamo linijskim spektrom.Valne duljine linija spektra odreñene su vrstom plina! Vodik da<strong>je</strong> uvi<strong>je</strong>k nizlinija s istim valnim duljinama, natrij ima svoj spektar, itd. Svaki atom ima svojkarakteristični spektar → odreñivan<strong>je</strong> kemijskih elemenata u plinu.
a) Emisijski spektar vodika, žive i neona.b) Apsorpcijski spektar vodika – nasta<strong>je</strong> prolaskomkontinuiranog spektra (Sunčeve sv<strong>je</strong>tlosti) kroz plin kemijskogelementa ko<strong>je</strong>g promatramo (vodika); tamne lini<strong>je</strong> na istimvalnim duljinama kao i emisijski spektar.
Linijski atomski spektri 2Lini<strong>je</strong> spektra, osim područja vidljive sv<strong>je</strong>tlosti, zalaze i u ultraljubičastoi infracrveno područ<strong>je</strong> valnih duljina elektromagnetskih valova, ko<strong>je</strong> okone vidi, ali se može detektirati npr. fotografski i dr.Linijski spektar vodika s pripadnim valnim duljinama:656,3 (H α ); 486,1 (H β ); 434,1 (H γ ); 410,2 (H δ )…; 364,6(H ∞ ) nm.3 lini<strong>je</strong> vodikova spektra su bile poznate nekoliko stotina godina.Za objašn<strong>je</strong>n<strong>je</strong> <strong>je</strong> trebalo nekoliko stol<strong>je</strong>ća.
Linijski atomski spektri 3J. Balmer (1885. god.) <strong>je</strong> pronašao pogodnu formulu u sl<strong>je</strong>dećem obliku:1 ⎛ 1 1= R⎜−λ ⎝ 2 n2 2λ = Valna duljina dane lini<strong>je</strong>.R = Rydbergova konstanta (J. Rydberg, 19/20. st.) R = 1,097⋅10 7 m -1n Ci<strong>je</strong>li broj, n = 3, 4, 5, 6, …n = 3 H αn = 4 H βn = 5 H γ…n = ∞ H ∞ = 364,6 nm Najkraća valna duljina u danom spektru(nalazi se u ultraljubičastom području valnih duljina).Balmerova serija = Niz valnih duljina opisanih gornjom <strong>je</strong>dnadžbom.⎞⎟⎠
Linijski atomski spektri 4Kasni<strong>je</strong> su otkrivene i druge spektralne seri<strong>je</strong> vodika. Poznate su poprezimenima njihovih pronalazača.Opći oblik <strong>je</strong>dnadžbe za tzv. valni broj (1/λ) za sve seri<strong>je</strong> vodikamožemo pisati slično Balmerovoj formuli:1 1 1⎛ ⎞= R⎜−λ m2 n2 ⎟⎝⎠n = m+1, m+2, …,C<strong>je</strong>lobrojni m pripada po<strong>je</strong>dinim serijama:mserijapodruč<strong>je</strong> valnih duljina (nm)1Lymanova91 - 122ultraljubičasto23BalmerovaPaschenova365 - 656821 - 1876vidljiva (veći dio)4Brackettova1459 - 4053infracrveno5Pfundova2280 - 17462
1 1 1R⎝ m n⎛ ⎞= ⎜ −λ2 2 ⎟⎠Linijski atomski spektri 5Izraz se ponekad piše kao izraz za frekvenci<strong>je</strong> sv<strong>je</strong>tlosti (ν = c/λ). Balmerova serija:⎛ 1 1ν = Rc⎜−⎝ 2 n2 2⎞⎟⎠n = 3, 4, 5, … Frekvencija sv<strong>je</strong>tlosti, koju emitira atom, može se pisati kao razlikadva člana, takozvana terma.Osim vodika, još nekoliko elemenata (koji daju linijske spektre prielektričnom izboju u plinu) kao He+ (<strong>je</strong>danput ionizirani helij), Li ++, isl., mogu se opisati sličnom formulom, Balmerovog oblika.
Struktura atomaKraj 19. st. i početak 20. st. Niz vrlo važnih otkrića!Diskretna struktura linijskih atomskih spektara.Planck (1901. god.) - <strong>Uvod</strong>i pojam kvanta energi<strong>je</strong>, E = hν (gd<strong>je</strong> <strong>je</strong>Planckova konstanta, h = 6,62⋅10 -34 Js)Einstein - Objasnio fotoelektrični efekt.Fotoelektrični efekt - Metal obasjan sv<strong>je</strong>tlošću oslobaña negativnonabi<strong>je</strong>ne čestice, elektrone.Pojava u kojoj snop sv<strong>je</strong>tlosti poput mnoštva čestica, kvanta energi<strong>je</strong> ilifotona, pada na metal i svoju energiju preda<strong>je</strong> elektronima, koji izvodetzv. rad izlaza (W) i napuštaju metal kao slobodni elektroni s kinetičkomenergijom (K = mv 2 /2); kinetička energija elektrona <strong>je</strong>dnaka <strong>je</strong> razlicienergi<strong>je</strong> upadnog fotona (hν) i rada izlaza metala, ili: K = hν - W
Struktura atoma 2Kraj 19. st. i početak 20. st. Niz vrlo važnih otkrića!E. Rutherford (početak 20. stol<strong>je</strong>ća, Engleska) - Izvodi pokuse u kojimasu foli<strong>je</strong> zlata bombardirane alfa česticama iz radioaktivnog urana;Te nabi<strong>je</strong>ne čestice su prolazile kroz metalni listić i otklanjale se, što <strong>je</strong>upućivalo na strukturu atoma planetarnog modela (središnji dio atoma ili<strong>je</strong>zgra ima glavninu mase poput Sunca u solarnom sustavu; oko <strong>je</strong>zgre segibaju elektroni kao planeti oko Sunca, a i u atomu <strong>je</strong> velika prazninaizmeñu <strong>je</strong>zgre i elektrona). (Meci kroz plast si<strong>je</strong>na!)Sav pozitivni naboj atoma skoncentriran <strong>je</strong> u <strong>je</strong>zgri, vrlo malogvolumena (s prom<strong>je</strong>rom <strong>je</strong>zgre oko 10 -14 m).U preostalom di<strong>je</strong>lu atoma (prom<strong>je</strong>ra blizu 10 -10 m), ili atomskomomotaču, nalazi se oblak negativnih elektronskih naboja.Ukupno <strong>je</strong> u atomu <strong>je</strong>dnaka količina + i – naboja, pa <strong>je</strong> atom električkineutralan.
Struktura atoma 3Jezgra atoma - Protoni, nositelji <strong>pozitivno</strong>g naboja, i neutroni koji suelektrički neutralni, i s masom približno <strong>je</strong>dnakom masi protona.U atomu <strong>je</strong> broj protona <strong>je</strong>dnak broju elektrona (redni broj atoma (Z) ilikemijskog elementa u periodnom sustavu elemenata).Masa elektrona <strong>je</strong> puno manja (1836 puta) od mase protona, pa <strong>je</strong>praktički sva masa atoma (oko 99,9 %) sadržana u <strong>je</strong>zgri.Elektron se giba oko <strong>je</strong>zgre po putanji, koja <strong>je</strong> u naj<strong>je</strong>dnostavni<strong>je</strong>mslučaju kružnica (npr. kod atoma vodika), a pri takvom gibanju ulogucentripetalne sile igra privlačna Coulombova sila izmeñu elektrona iprotona te vri<strong>je</strong>di <strong>je</strong>dnadžba:e4πεr2 202r = radijus putan<strong>je</strong>, v = brzina elektrona, ε 0 (dielektrična konstanta zavakuum) = 8,85⋅10 -12 C 2 /Nm 2 ), masa elektrona m = 9,11⋅10 -31 kg i nabo<strong>je</strong> = 1,6⋅10 -19 C.=mvr
Struktura atoma 4Elektron u atomu Centripetalno ubrzan<strong>je</strong> v 2 /r .v (obodna brzina) = oko 10 6 m/s.Zakoni klasične elektrodinamike Elektron bi zbog ubrzanja (prom<strong>je</strong>nevektora brzine na kružnoj putanji) trebao emitirati EM valove sfrekvencijom koju ima elektron kao kružnu frekvenciju na putanji oko<strong>je</strong>zgre. Zbog emisi<strong>je</strong> elektromagnetskog zračenja energija elektrona bi se trebalasmanjivati, te bi elektron trebao smanjiti radijus putan<strong>je</strong> i na kraju pasti u<strong>je</strong>zgru.To se ne dogaña u prirodi! Zaključu<strong>je</strong>mo: Na atom se ne moguprimi<strong>je</strong>niti zakoni klasične fizike.
Struktura atoma 5N. Bohr – Poznavao eksperimentalne rezultate o linijskim spektrima,fotoelektričnom efektu, raspršenju elektrona i alfa čestica na metalnimfolijama, i dr., te ideju kvanta energi<strong>je</strong> i fotona sv<strong>je</strong>tlosti, kao i poteškoćeu njihovoj interpretaciji.N. Bohr (1913.) - Objavio postulate o kvantiziranoj strukturi atoma:Prvi Bohrov postulat: Atom boravi u odreñenom stacionarnom stanjunajniže energi<strong>je</strong>, ako na n<strong>je</strong>ga ne d<strong>je</strong>lu<strong>je</strong> neka vanjska sila; elektron semože gibati oko <strong>je</strong>zgre samo po kvantiziranim stazama, a pri tomelektron ne emitira energiju.Drugi Bohrov postulat: Atom prima ili odašil<strong>je</strong> energiju samo kadn<strong>je</strong>gov elektron prelazi iz <strong>je</strong>dne u drugu stazu.Ako se elektronu dovede energija, može doći do apsorpci<strong>je</strong> kvantaenergi<strong>je</strong> i elektron prelazi u više, pobuñeno energijsko stan<strong>je</strong> ili na daljukvantiziranu stazu (s obzirom na <strong>je</strong>zgru).
Struktura atoma 6Pri spontanom povratku u niže energijsko stan<strong>je</strong> elektron odašil<strong>je</strong> kvantenergi<strong>je</strong> elektromagnetskog zračenja, hν, ili foton; energija <strong>je</strong> fotona<strong>je</strong>dnaka razlici energija dviju staza, ili dviju energijskih razina, tj.hν = E − Em, n = ci<strong>je</strong>li bro<strong>je</strong>vi; označuju redni broj kvantne staze.mnm > n Emisija kvanta energi<strong>je</strong> E m - E nm < n Apsorpcija kvanta energi<strong>je</strong> E m - E n Frekvencija emitiranog svi<strong>je</strong>tla iz atoma odreñena <strong>je</strong> razlikomenergijskih razina pripadnog "skoka" elektrona; emitirane frekvenci<strong>je</strong>imaju diskretan spektar.
Struktura atoma 7Treći Bohrov postulat (govori o kvantiziranju staza) = Elektroni moguboraviti samo u onim energijskim stanjima ili stazama (orbitama) ukojima <strong>je</strong> njihov zakretni impuls (kutna količina gibanja, L) <strong>je</strong>dnakumnošku tzv. reducirane Planckove konstante (h/2π) i neke c<strong>je</strong>lobrojnevri<strong>je</strong>dnosti (n = 1, 2, 3,): hmvr = n = nħ2πPrim<strong>je</strong>na Bohrovih postulata: Opravdan<strong>je</strong> za diskretnu strukturuatomskih linijskih spektara. Mogu se izračunati frekvenci<strong>je</strong> ili valneduljine po<strong>je</strong>dinih serija za atom vodika.
Polum<strong>je</strong>ri staza elektrona?2e m ⎛ nh24πε0 ⎝ 2π⎞= ⎜ ⎟r r mr ⎠2Struktura atoma 7e4πεr2 202=mvrv=nmvr =h2π mrhn2 π2 2 2e m n h=4πεr r 4πm r02 2 2 2eε2 2 20=1rn hπ mrn=ε n h0me2 22πn = indeks s oznakom rednog broja stazen = 1 i pripadne vri<strong>je</strong>dnosti konstanti, gornja <strong>je</strong>dnadžba da<strong>je</strong> vri<strong>je</strong>dnostradijusa prve staze vodikovog atoma (tzv. Bohrov radijus atoma) :r 1 = 5,3⋅10 -11 m.
Struktura atoma 8rn2 2ε0n h=2me πRadijusi viših staza su takoñer kvantizirani! r n = n 2 r 1 ; tako <strong>je</strong> r 2 = 4 r 1 , r 3 = 9 r 1 , itd.Brzina elektrona u atomu?hKoristimo: mvr = n2 π2 2ε0n hmv2me π=nh2πvn=2e2nhε0 Brzina elektrona na prvoj stazi odnosno u osnovnom stanju atomavodika iznosi: v 1 = 2⋅10 6 m/s.Ukupna energija elektrona u atomu?Jednaka <strong>je</strong> zbroju kinetičke i potencijalne energi<strong>je</strong>, tj. E = K + U :K =mv22U2e= −4πεr0U se dobi<strong>je</strong> integriran<strong>je</strong>m električne sile,na putu dr i u granicama od r do besk.
nU = −K =4me4εn h2 2 204me8εn h2 2 20Struktura atoma 92 22ε0n he=U = −2me π4πεrK =Ukupna energija elektrona u atomu na n-toj stazi:0mv22En= −vn=4me8εn h2e2nhε2 2 200 Energijske razine u atomu su kvantizirane; ukupna energija elektronau atomu <strong>je</strong> negativna (elektron <strong>je</strong> vezan za atom) i poprima vri<strong>je</strong>dnostništice za n = ∞. Elektron izvan atoma ima pozitivnu kinetičku energiju, koju on možekontinuirano (bilo kako) mi<strong>je</strong>njati.Grafički prikaz:
Grafički prikaz:Struktura atoma 10Energijski spektar za vodikov atom;L označu<strong>je</strong> skokove elektrona za Lymanovu seriju,B za Balmerovu seriju, itd.
Struktura atoma 11Postupak odvajanja elektrona od atoma nazivamo ionizacijom, a do n<strong>je</strong>dolazi kad se elektronu u atomu dovede izvana energija, koja <strong>je</strong> <strong>je</strong>dnakaili veća od apsolutnog iznosa energi<strong>je</strong> elektrona u atomu.Energija ionizaci<strong>je</strong> odgovara po iznosu upravo energiji elektrona ustabilnom stanju atoma.
Struktura atoma 11rn2 2ε0n h=2me πa 0za n=1a 0= 0.05 nmEnergija prve staze u atomu vodika, ili prva energijska razina stabilnogstanja vodika: E 1 = -13,6 eV (1 eV = 1,6⋅10 -19 J).Druga razina ima po apsolutnom iznosu 4 (= 2 2 ) puta manju vri<strong>je</strong>dnostenergi<strong>je</strong>, tj. E 2 = -3,4 eV (što <strong>je</strong> zapravo prva viša ili pobuñenaenergijska razina s obzirom na osnovnu razinu).E 3 = E 1 /9 = -1,5 eV, itd
Struktura atoma 12Kolika <strong>je</strong> energija emitiranog fotona, npr. za skok elektrona s treće nadrugu stazu ?44meme ⎛ 1 1 ⎞En= −2 2 2 hυ = E3 − Ehυ=22 2 ⎜ −2 2 ⎟8εn h8εh ⎝ 2 3 ⎠υ =0c / λme ⎛= ⎜ −λ 8εh c 2 341 1 12 2 2 20 ⎝Usporedimo izraz s Balmerovom formulom za valni broj lini<strong>je</strong> H αvodikovog atoma:1 ⎛ 1 1 ⎞= R −Rydbergova konstanta⎜ 2 2 ⎟λ ⎝ 2 3 ⎠⎞⎟⎠0Rme47 -1=2 2R = 1,097 ⋅10m8ε0h c
Struktura atoma 13Zaključak: Lymanova serija nasta<strong>je</strong> uz emisiju fotona, i to nakonpobude atoma vodika i povratka elektrona s druge na prvu stazu, zatims treće na prvu stazu, pa s četvrte na prvu stazu, itd.;Balmerova serija nasta<strong>je</strong> skokom, tj. povratkom pobuñenog elektrona streće na drugu stazu (što da<strong>je</strong> liniju), zatim s četvrte na drugu stazu (štoda<strong>je</strong> liniju), pa s pete na drugu, itd.Kod Pashenove seri<strong>je</strong> promatramo skokove elektrona s viših na trećustazu, te slično za druge seri<strong>je</strong>.
Struktura atoma 14Kvantizirani Bohrov atom <strong>je</strong> usp<strong>je</strong>šno protumačio diskretnu strukturulinijskih atomskih spektara.Eksperimentalna potvrda pri m<strong>je</strong>renju ionizacijskih energija, npr. zaatome živinih para, i dr.; eksperimentalni rezultati se razlikuju prim<strong>je</strong>riceza 0,2 % pri proračunu Rydbergove konstante.Da li Bohrova teorija vri<strong>je</strong>di i za atomske strukture ko<strong>je</strong> su složeni<strong>je</strong> odvodikovog atoma?Vri<strong>je</strong>di samo približno ili <strong>je</strong> nezadovoljavajuća!Za složeni<strong>je</strong> atome treba uzeti u obzir i odbojne sile meñu istovrsnimnabojima, te neizb<strong>je</strong>žne pogr<strong>je</strong>ške u m<strong>je</strong>renju položaja ili brzine čestice,a u skladu s tzv. relacijom neodreñenosti (putanja elektrona ne može bititočno odreñena).Točniju sliku da<strong>je</strong> kvantna mehanika koja govori o v<strong>je</strong>rojatnostinalaženja elektrona na nekom m<strong>je</strong>stu u atomu, i dr.
Struktura atoma 15Kvantna mehanika može doći do svih relacija ko<strong>je</strong> su sli<strong>je</strong>dile izBohrovog modela atoma(i još puno više), prim<strong>je</strong>rice kvantiziraneenergijske razine u atomu, možemo izvesti i bez Bohrovih postulata.Kolegij kvantna mehanika da<strong>je</strong> potpun prikaz grañe atoma.Ukratko:L. de Broglie Predložio da se svakoj čestici može pripisati valnikarakter, po uzoru na foton. Objasnio Bohrov zaht<strong>je</strong>v za kvantizacijomorbitalnog momenta L (kutne količine gibanja, zakretnog impulsa):orbita elektrona bit će stabilna ako sadrži ci<strong>je</strong>li broj valnih duljina, tj. akoformira stojni val.
Uv<strong>je</strong>t da de Brogliev val bude stojni val:= Bohrova kvantizacija LE. Schroedinger (1926. god.) <strong>je</strong> izveo valnu <strong>je</strong>dnadžbu koja opisu<strong>je</strong>giban<strong>je</strong> čestice mase m, ukupne energi<strong>je</strong> E i potencijalne energi<strong>je</strong> U:28πm∆Ψ ( x, y, z) +2[ E −U ( x, y, z) ] Ψ ( x, y, z) = 0hΨ= Valna funkcija (zavisi samo o prostornim koordinatama)∆ = Laplaceov operator
Struktura atoma 1528πm∆Ψ ( x, y, z) + [ E −U ( x, y, z) ] Ψ ( x, y, z) = 02hOd valne funkci<strong>je</strong> Ψ, kao r<strong>je</strong>šenja diferencijalne <strong>je</strong>dnadžbe drugog reda,traži se da bude <strong>je</strong>dnoznačna i konačna u ci<strong>je</strong>lom prostoru te da <strong>je</strong>kontinuirana i ima neprekinutu derivaciju.Takvo r<strong>je</strong>šen<strong>je</strong> valne <strong>je</strong>dnadžbe postoji samo za neke vri<strong>je</strong>dnostiparametara (ili odreñene vri<strong>je</strong>dnosti energi<strong>je</strong>), ko<strong>je</strong> nazivamo vlastitimvri<strong>je</strong>dnostima (E 1 , E 2 , …, E n ), a r<strong>je</strong>šenja nazivamo vlastitim funkcijama:Ψ1, Ψ2,..., ΨnZa valno giban<strong>je</strong> čestice u ograničenom prostoru, kao što <strong>je</strong> elektron uatomu, energijski spektar <strong>je</strong> diskretan; slobodnom gibanju česticeodgovara kontinuirani spektar energija (npr. za elektron izvan atoma).Statistička interpretacija valne funkci<strong>je</strong> kaže kako svakoj točki prostorapripada odreñena v<strong>je</strong>rojatnost nalaženja čestice na tom položaju;pripadna v<strong>je</strong>rojatnost odgovara kvadratu apsolutne vri<strong>je</strong>dnosti valnefunkci<strong>je</strong> Ψ.
Kvantni bro<strong>je</strong>viSvi kvantni bro<strong>je</strong>vi uvedeni su da bi se objasnili eksperimentalnirezultati spektralnih linija kemijskih elemenata.1. Glavni kvantni broj n- uveden Bohrovom kvantizacijom kutne količine gibanja (angularnogmomenta)- odreñu<strong>je</strong> ukupnu energiju dozvol<strong>je</strong>nog stanja atoma vodika- sva stanja s istim n nazivaju se ljuske i označavaju se velikim slovima K, L,M, N,... što odgovara stanju s n = 1, 2, 3, 4, ...2. Orbitalni kvantni broj l-Arnold Sommerfeld (1868.-1951.) proširio Bohrov model atoma uzevši u obzir ieliptične putan<strong>je</strong> – uveo l s dozvol<strong>je</strong>nim c<strong>je</strong>lobrojnim vri<strong>je</strong>dnostima l= 0 do n -1.-odreñu<strong>je</strong> orbitu elektrona; za dani n, ima n dozvol<strong>je</strong>nih orbita;-stanja s istim l nazivaju se podljuske i označavaju se malim slovima s, p, d, f,...što odgovara l = 0, 1, 2, 3, ...
3. Orbitalni magnetski kvantni broj m l-uveden nakon Zeemanovog efekta: ci<strong>je</strong>pan<strong>je</strong> spektralne lini<strong>je</strong>plina, kada se plin stavi u jako magnetsko pol<strong>je</strong>; linija seci<strong>je</strong>pala na 3 nove bliske lini<strong>je</strong> (mala prom<strong>je</strong>na valne duljine) →energija elektrona se promi<strong>je</strong>ni kada se nalazi u magnetskompolju-dozvol<strong>je</strong>ne vri<strong>je</strong>dnosti su od –l do l = 2l +1 vri<strong>je</strong>dnost4. Kvantni broj spina (spinski magnetski kvantni broj), m s-uveden da bi se objasnilo ci<strong>je</strong>pan<strong>je</strong> spektralne lini<strong>je</strong> kad se gleda spektar uvisokoj rezoluciji – čak i bez prim<strong>je</strong>ne magnetskog polja; ovo ci<strong>je</strong>pan<strong>je</strong> nazivase fina struktura;-1925. Samuel Goudsmit i George Uhlenbeck uveli su ideju vrtn<strong>je</strong> elektronaoko osi da bi objasnili podri<strong>je</strong>tlo fine strukture; time <strong>je</strong> uveden još <strong>je</strong>dan kvantnibroj: kvantni broj spina m s
Kvantna teorija takoñer uvodi kvantne bro<strong>je</strong>ve, ali oni su rezultat r<strong>je</strong>šavanjaSchredingerove valne <strong>je</strong>dnadžbe uz zadane rubne uv<strong>je</strong>te, a ne uvode se da biobjasnili eksperimentalne rezulate.Kvantni broj spina uvodi se u Diracovoj relativističkoj kvantnoj teoriji i nemaveze ni sa kakvom vrtnjom elektrona oko osi. Spin <strong>je</strong> <strong>je</strong>dno intrinsično svojstvoelektrona (poput naboja ili mase elektrona) ko<strong>je</strong> se može opisati pomoćuspinskog kvantnog broja.Pojam orbite takoñer nema značen<strong>je</strong> u kvantnoj teoriji već se iz kvadrata valne funkci<strong>je</strong>odreñu<strong>je</strong> v<strong>je</strong>rojatnost nalaženja elektrona u odreñenoj točki prostora. Ta v<strong>je</strong>rojatnost zaosnovno stan<strong>je</strong> atoma vodika najveća <strong>je</strong> za radijus a 0prve Bohrove orbite, ali postoji iv<strong>je</strong>rojatnost za neke druge radijuse.Sferni elektronskioblak za osnovnostan<strong>je</strong> atoma vodika –gušći dio oblakapredstavlja područ<strong>je</strong>veće v<strong>je</strong>rojatnostinalaženja elektrona.
Pauli<strong>je</strong>v princip isključenja i periodni sustav elemenataPauli 1925.Koliko elektrona u atomu može imati iste kvantne bro<strong>je</strong>ve?Ne posto<strong>je</strong> 2 elektrona u atomu koja imaju iste kvantne bro<strong>je</strong>ve.Na istom energetskom stanju mogu biti dva elektrona (spin gore i dol<strong>je</strong>), ali ne mogubiti dva elektrona u istom kvantnom stanju.Korišten<strong>je</strong>m Pauli<strong>je</strong>vog principa, počevšiod atoma vodika i dodavajući po <strong>je</strong>danelektron, možemo izgraditi ci<strong>je</strong>li periodnisustav elemenata. Prvo se popunjavajunajniže ljuske i podljuske, a onda one navišim energijama, <strong>je</strong>r svaki sustav uprirodi teži energetskom minimumu.Podljuska <strong>je</strong> popun<strong>je</strong>na kada sadrži2(2l+1) elektrona.
1871. Dmitrij Ivanovič Mendel<strong>je</strong><strong>je</strong>v (1834.-1907.) ruski kemičar – poredao <strong>je</strong>elemente po atomskoj masi i kemijskim svojstvima → prazna m<strong>je</strong>sta u tablici→ popun<strong>je</strong>na novim kasni<strong>je</strong> otkrivenim elementima čija <strong>je</strong> svojstva predvidioMendel<strong>je</strong><strong>je</strong>v
LaseriPočetkom druge polovice 20. stol<strong>je</strong>ća otkriven <strong>je</strong> maser (akronim, engl.– Microwave Amplification by Stimulated Emission of Radiation).Vrlo brzo i prvi laser (akronim – Light Amplification by StimulatedEmission of Radiation) s rubinskim štapićem kao aktivnim materijalomza pojačan<strong>je</strong> vidljivog zračenja.Pri upadu elektromagnetskog zračenja u tvar nasta<strong>je</strong> interakcija atoma(molekula), ili električnih dipola, s električnim pol<strong>je</strong>m, ko<strong>je</strong> kao upadnasv<strong>je</strong>tlost potiče titran<strong>je</strong> dipola tj. elektronskog oblaka u atomu.Zavisno o razlici faza titranja dipola i vala električnog polja, dipol može:a) Apsorbirati energiju polja normalna ili pozitivna apsorpcijab) Pojačati <strong>je</strong> u obliku stimulirane emisi<strong>je</strong> zračenja. negativnaapsorpcija sv<strong>je</strong>tlosti
Laseri 2Normalna apsorpcija sv<strong>je</strong>tlosti u tvari zadovoljava eksponencijalnizakon: I = I 0 e -αxI = prolazni intenzitet sv<strong>je</strong>tlosti kroz apsorber debljine xI 0 = upadni intenzitet sv<strong>je</strong>tlostiα = pozitivni koefici<strong>je</strong>nt apsorpci<strong>je</strong>Za α< 0 (slučaj negativnog koefici<strong>je</strong>nta apsorpci<strong>je</strong>). Pri prolazusv<strong>je</strong>tlosti kroz tvar intenzitet sv<strong>je</strong>tlosti se pojačava s povećan<strong>je</strong>m puta x.U takvom mediju (nazivamo ih aktivnim), broj fotona se povećava kaolavina zbog stimulirane emisi<strong>je</strong>, koja prevladava u procesima interakci<strong>je</strong>.Einstein - Predvidio <strong>je</strong> stimuliranu emisiju zračenja. (Pokazao <strong>je</strong> kakoatom u elektromagnetskom polju sv<strong>je</strong>tlosnih valova ima svojstvaelektričnog dipola, pa u prisustvu električnog polja on može pojačatienergiju polja putem stimulirane emisi<strong>je</strong>.)
Laseri 3Kvantno - mehanički prikaz - Atom koji boravi u pobuñenom stanjuenergi<strong>je</strong> E n , pod d<strong>je</strong>lovan<strong>je</strong>m polja može pri<strong>je</strong>ći u niže energijsko stan<strong>je</strong>,E m , uz odreñenu v<strong>je</strong>rojatnost.Kažemo da primi<strong>je</strong>n<strong>je</strong>no elektromagnetsko pol<strong>je</strong> "izbacu<strong>je</strong>" atom izekscitiranog stanja, tj.Iz višeg energijskog stanja atom može pri<strong>je</strong>ći u niže stan<strong>je</strong> pod ut<strong>je</strong>ca<strong>je</strong>mpolja ili spontano, a pri tome zrači kvant energi<strong>je</strong> hν.Takva teorijska predviñanja posli<strong>je</strong> su eksperimentalno zapažena, pa <strong>je</strong>,prim<strong>je</strong>rice, ustanovl<strong>je</strong>na negativna apsorpcija (tj. pojačan<strong>je</strong>) vidljivesv<strong>je</strong>tlosti u živinim parama pri električnom izboju.
Laseri 4Pri stimuliranoj emisiji upadno zračen<strong>je</strong> mora imati ista svojstva kaoekscitirano zračen<strong>je</strong>.Svaki novi foton (koji nasta<strong>je</strong> u atomu kad elektron skoči iz višeg u nižeenergijsko stan<strong>je</strong> pod d<strong>je</strong>lovan<strong>je</strong>m upadne sv<strong>je</strong>tlosti) ima istu energiju iisti sm<strong>je</strong>r gibanja kao i upadni foton.Stimuliranom emisijom sv<strong>je</strong>tlost se pojačava u aktivnom mediju: od<strong>je</strong>dnog upadnog fotona nastaju dva fotona, ta dva fotona proizvode četiri,a) apsorpcija upadnog kvanta energi<strong>je</strong> u atomu;b) stimulirana emisija;c) sm<strong>je</strong>r skoka elektrona pri apsorpciji (1),spontanoj emisiji (2) i stimuliranoj emisijikvanta energi<strong>je</strong> (fotona).
Laseri 5Simbolima valne teori<strong>je</strong> Stimulirana se emisija sastoji u povećanjuamplitude ulaznog (prolaznog) vala bez prom<strong>je</strong>ne u frekvenciji, sm<strong>je</strong>rugibanja, fazi i polarizaciji elektromagnetskog vala.Kod normalnih uv<strong>je</strong>ta (termička ravnoteža) Broj atoma N 2 upobuñenom stanju (E 2 ) <strong>je</strong> manji od N 1 , tj. N 2 /N 1 < 1; tada <strong>je</strong> α > 0.Da bi se dobio medij s negativnom apsorpcijom (α < 0), valja ga izbacitiiz ravnoteže, tj. napraviti odnos N 2 /N 1 > 1, tzv. populacijska inverzija.Populacijska inverzija se može dobiti pomoću takozvane optičke pumpe.
Laseri 6Rubinski laser - Prvi izgrañeni laser. Koristio aktivni medij u čvrstomstanju s tri energijske razine (po<strong>je</strong>dnostavl<strong>je</strong>no); laserski štap (10x1 cm)bio <strong>je</strong> izgrañen od rubinskog kristala, koji se može sintetizirati kaoaluminij oksid (Al 2 O 3 ), s dodatcima oko 0,4 % krom oksida (Cr 2 O 3 ),gd<strong>je</strong> ioni Cr 3+ zam<strong>je</strong>njuju ponegd<strong>je</strong> atom aluminija u kristalnoj rešetki.U rešetki takvog rubina inducirani se pri<strong>je</strong>lazi dogañaju u ionima kromakoji uz osnovno stan<strong>je</strong> C imaju dvi<strong>je</strong> više energijske vrpce A i nižudvostruku razinu B:Pri<strong>je</strong>lazi iz B u C odgovaraju emisijicrvenog svi<strong>je</strong>tla s valnim duljinamaλ 1 = 692,7 nm i λ 2 = 694,3 nm.
Laseri 7Princip rada: Rubin osvi<strong>je</strong>tlimo jakom zelenom sv<strong>je</strong>tlošću iz bl<strong>je</strong>skalice(pun<strong>je</strong>ne s neonom i kriptonom), što predstavlja optičku pumpu. Ionikroma prelaze iz osnovnog stanja C na razinu A, iz ko<strong>je</strong> bez zračenja(energija se prenosi na rešetku kao toplina) prelazi s najvećomv<strong>je</strong>rojatnosti u stan<strong>je</strong> B. U B veća populacija nego u stanju C. Populacijska inverzija.Spontani pri<strong>je</strong>laz iz B u C ima malu v<strong>je</strong>rojatnost.
Laseri 8Plinski laseri: U pravilu, populacijska inverzija može biti rezultatneelastičnih sudara izmeñu elektrona i atoma pri električnom izboju.Ipak, tu <strong>je</strong> pobuñeno stan<strong>je</strong> obično vrlo kratkotrajno i atomi se spontanovraćaju u stabilno, normalno stan<strong>je</strong>. To se može izb<strong>je</strong>ći, di<strong>je</strong>lom, ako seplinu dodaju pogodne molekule kao onečišćen<strong>je</strong>, pa više energijskerazine imaju veću populaciju elektrona.Plinski laser He – Ne Populacijska se inverzija postiže pri električnomizboju u sm<strong>je</strong>si helija i neona (u odnosu 10:1, kod tlaka od oko 100 Pa).
Laseri 9Plinski laser He – Ne Populacijska se inverzija postiže pri električnomizboju u sm<strong>je</strong>si helija i neona (u odnosu 10:1, kod tlaka od oko 100 Pa).Atomi helija (He) se pobuñuju u sudaru s elektronima (e) i dolaze umetastabilno stan<strong>je</strong> E 3 (Energijske su vrpce po<strong>je</strong>dnostavl<strong>je</strong>no prikazane<strong>je</strong>dnom razinom.).U neelastičnom srazu s ekscitiranim atomima helija (He*), atomi neona(Ne) takoñer prelaze u pobuñeno stan<strong>je</strong> (Ne*) s energijskom razinom E 3 '(gd<strong>je</strong> <strong>je</strong> dostignuta populacijska inverzija), koja <strong>je</strong> blizu razinipobuñenog helija (E 3 ' E 3 ).Matematički:e + He = He* + eHe* + Ne = Ne* + He
Laseri 10Pri<strong>je</strong>laz atoma neona iz razine E 3 ' u E 2 ima značen<strong>je</strong> stimulirane emisi<strong>je</strong>sv<strong>je</strong>tlosti valne duljine λ = 632,8 nm, (crvenu laserska sv<strong>je</strong>tlost).Pri<strong>je</strong>laz atoma iz E 2 u osnovno stan<strong>je</strong> E 1 odvija se obliku difuznogpredavanja energi<strong>je</strong> st<strong>je</strong>nkama posude.Pripadne energijske razine imaju približne vri<strong>je</strong>dnosti:E 1 = 0;E 3 ≅20 eV;E 3 ' – E 2 = 1,96 eV.U ci<strong>je</strong>vi lasera He – Ne električni izboj se postiže pod naponom od 1-2kV, sa snagom električnog napajanja od 5 -10 W; snaga izlaznog snopalaserske sv<strong>je</strong>tlosti <strong>je</strong> od 1 do 50 mW
Laseri 11Pojačan<strong>je</strong> sv<strong>je</strong>tlosti pri stimuliranoj emisiji može biti dal<strong>je</strong> povećanoprolaskom sv<strong>je</strong>tlosti kroz aktivni element više puta pri<strong>je</strong> nego laserskisnop bude izbačen iz medija.Snop sv<strong>je</strong>tlosti se nalazi u optičkoj šupljini, što <strong>je</strong> tzv. rezonantnašupljina, koja se sastoji od dva ravna ili konkavna zrcala, izmeñu kojih <strong>je</strong>sm<strong>je</strong>šten laserski štap ili plinska ci<strong>je</strong>v.Svaki foton optičke pumpe u laserskom štapiću može služiti kao "starter"za lasersko d<strong>je</strong>lovan<strong>je</strong>. Dio lavine prolazi kroz polupropusno zrcalo, adio se reflektira i pojačava u aktivnom mediju, itd., što se ponavlja.
Laseri 11Granica pojačanja snopa odreñena <strong>je</strong> tzv. laserskim zasićen<strong>je</strong>m, ko<strong>je</strong>zavisi o broju atoma laserskog elementa u pobuñenom stanju.
Laseri 12Pojačan<strong>je</strong> laserskog snopa, odnosno vremenske prom<strong>je</strong>ne intenzitetalaserske sv<strong>je</strong>tlosti, dobro opisu<strong>je</strong> tzv. logistička ili populacijska<strong>je</strong>dnadžba, sl<strong>je</strong>dećeg oblika:x = n+ 1rxn ( 1- xn)x n = Intenzitet snopa nakon n-tog prolaza kroz optičku šupljinu.r = tzv. kontrolni parametar. Ima značen<strong>je</strong> brzine porasta laserskog snopai odreñen <strong>je</strong> svojstvima aktivnog medija. Općenito, 0 < r < 4.Kada <strong>je</strong> varijabla x normalizirana i pokazu<strong>je</strong> relativne vri<strong>je</strong>dnosti sobzirom na najveću vri<strong>je</strong>dnost promatrane veličine (ovd<strong>je</strong>, intenzitetasnopa sv<strong>je</strong>tlosti), te <strong>je</strong> 0 < x n < 1.Kod većih brzina porasta laserskog snopa, ili za r > 3,5 r<strong>je</strong>šenjalogističke <strong>je</strong>dnadžbe postaju sasvim nepredvidiva i intenziteti izlaznoglaserskog snopa pokazuju u vremenu niz nepravilnih i nepretkazivihvri<strong>je</strong>dnosti; to <strong>je</strong> pojava tzv. determinističkog kaosa (vezan uz nelinearnedinamičke i disipativne sustave).
Laseri 13Jezik valne teori<strong>je</strong>: Lasersko zračen<strong>je</strong> <strong>je</strong> koherentno s ekscitirajućimzračen<strong>je</strong>m.Pojačan<strong>je</strong> sv<strong>je</strong>tlosti u laseru predstavlja povećan<strong>je</strong> valne amplitude.Stoga <strong>je</strong> važno da val koji se vraća u neku točku aktivnog elementa imaistu fazu kao izvorni val za bilo koji broj refleksija na zrcalu.To znači da odnos izmeñu valne duljine sv<strong>je</strong>tlosti (λ) i dužine laserskogelementa (L) mora biti ci<strong>je</strong>li broj, tj. treba uspostaviti odnos: 2L = nλ L = nλ /2 ; n = 1, 2,… ; oznaka 2L odnosi se na put vala izmeñu dvi<strong>je</strong>uzastopne refleksi<strong>je</strong>. Primarni i sekundarni valovi interferiraju konstruktivno (pojačavaju se),a tako raste i rezultantna amplituda. Sv<strong>je</strong>tlost koja izlazi iz lasera proizvedena <strong>je</strong> konstruktivnominterferencijom od mnogo koherentnih valova koji se razlikuju u fazi zavišekratnik od 2π. Laser ima vrlo veliku amplitudu i izvanredno veliki intenzitet.
Laseri 14Optička šupljina se promatra kao rezonantna šupljina, ili rezonator,duljine L na kojoj <strong>je</strong> sm<strong>je</strong>šteno n stojnih valova. L = nλ /2 Pripadna rezonantna frekvencija:υn= nc / 2LLaseri daju snop monokromatske sv<strong>je</strong>tlosti velike snage i male angularnedivergenci<strong>je</strong>, što <strong>je</strong> pogodno u mnogim prim<strong>je</strong>nama.Laserska sv<strong>je</strong>tlost se prim<strong>je</strong>nju<strong>je</strong> u komunikaciji, za detekciju mete, zam<strong>je</strong>ren<strong>je</strong> udal<strong>je</strong>nosti i za oslobañan<strong>je</strong> velike topline u sićušnomvolumenu pa laserski snop prodire s malom rupom u tvrde materijale ilimikroskopske di<strong>je</strong>love tkiva (npr. li<strong>je</strong>čen<strong>je</strong> retine oka).Rubinski laser dostiže snagu snopa od 10 kW na 1 cm 2 .Laser s ugljik-dioksidom da<strong>je</strong> snažni impulsni snop s energijom od 1 kJu 1ns, tj. snop postiže vršnu snagu od 10 12 W.
Laseri 15Poluvodički laseri - Populacijska inverzija postiže se pomoću stalnogelektričnog polja, ko<strong>je</strong> usm<strong>je</strong>ru<strong>je</strong> elektrone i šupljine kroz poluvodički n-p-n spoj.Laseri prim<strong>je</strong>ne: Od navoñenja oružja do proizvoda široke potrošn<strong>je</strong>(npr. laserskim snopom se buše uske rupice na d<strong>je</strong>čjim bočicama)Laseri su postali nezam<strong>je</strong>njivi u prim<strong>je</strong>ni holografi<strong>je</strong> i stvaranju 3D slika.Proizvodnja kompaktnih ploča (CD) ili audio i video diskova, i dr.;laserskim snopom se postiže separacija u prirodnoj sm<strong>je</strong>si urana ( 235 U i238U) i obogaću<strong>je</strong> prirodni uran izotopom 235 U (laserom se pobuñujuatomi u plinovitom uran-fluoridu; odreñena frekvencija lasera ionizira<strong>je</strong>dnu vrstu atoma nuklida urana koji se onda električnim pol<strong>je</strong>motklanjaju iz sm<strong>je</strong>se).Izvanredno jakim impulsnim laserskim snopom (npr. CO 2 laser, vršnesnage 10 14 W, u impulsu od 1s) zagrijava se sm<strong>je</strong>sa deuterija i tricija, štoomoguću<strong>je</strong> ostvaren<strong>je</strong> nuklearne fuzi<strong>je</strong> u reaktoru (kratkotrajna fuzija seponavlja desetak puta u sekundi).