Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
• 7. SKUPINA<br />
• Mn Tc Re Bd<br />
• ns 2 (n-1) d 5 (bohrij)<br />
• Mangan<br />
• MnO 2<br />
piroluzit<br />
• Mn 3<br />
O 4<br />
hasmanit<br />
• Mn 3<br />
O 4<br />
+ Fe 2<br />
O 3<br />
+ 7 C → (2 Fe + 3 Mn) + 7 CO<br />
•
• w (Mn)<br />
• 80%<br />
• 65 - 70 %<br />
• 5 - 20 %<br />
feromangan<br />
silikomangan (15-20 % Si)<br />
zrcalno željezo<br />
• Legure:manganski čelik: w (Mn) = 13%,w(C)=1.25%<br />
• nemagnetičan<br />
• Manganin: w ( Cu) = 84 %, w(Mn) =12 %,w(Ni) = 4 %<br />
•<br />
• 3 Mn 3<br />
O 4<br />
+ 8 Al → 9 Mn + 4 Al 2<br />
O 3
• II<br />
• Mn + 2 H + ⇔ Mn 2+ + H 2<br />
• ↓<br />
• [ Mn(H 2<br />
O) 6<br />
] 2+<br />
E 0 (Mn 2+ /Mn) = - 1.05 V<br />
•<br />
2 Mn 2+ + 5 PbO 2<br />
+ 4 H + → 2 MnO 4-<br />
+ 5 Pb 2+ + 2 H 2<br />
O<br />
• Mn 2+ + 2 OH - → Mn(OH) 2<br />
• 2+ +4 +4<br />
• Mn(OH) 2<br />
+ ½ O 2<br />
→ MnO(OH) 2<br />
→ MnO 2<br />
+ H 2<br />
O
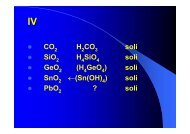
• IV<br />
• MnO 2<br />
+ 2 KOH → K 2<br />
MnO 3<br />
+ H 2<br />
O<br />
• +4 +2<br />
• MnO 2<br />
+ 4 HCl → MnCl 2<br />
+ Cl 2<br />
+ 2 H 2<br />
O<br />
• VI<br />
• MnO 2<br />
+ 2 KOH → K 2<br />
MnO 3<br />
+ H 2<br />
O<br />
• +4 +6<br />
• MnO 2<br />
+ 2 KOH + ½ O 2<br />
→ K 2<br />
MnO 4
• VII<br />
•<br />
+6 +7<br />
• 3 MnO 4<br />
2-<br />
+ 4 H + → 2 MnO 4-<br />
+ MnO 2<br />
+ 2 H 2<br />
O<br />
• A: MnO 4<br />
2-<br />
→ MnO 4-<br />
+ e -<br />
•<br />
+7 hν +4<br />
• 4 MnO 4<br />
-<br />
+ 4 H + → 4 MnO 2<br />
+ 3 O 2<br />
+ 2 H 2<br />
O<br />
• MnO 4-<br />
+ 8 H + + 5 e - → Mn 2+ + 4 H 2<br />
O, E 0 = 1.51 V
• TRIJADA ŽELJEZA<br />
• Fe Co Ni<br />
• VI V IV max.moguć oks.<br />
• broj<br />
• 4s 2 3 d 6 3 d 7 3 d 8<br />
Fe, Co Ni<br />
II III II<br />
Najvažniji Spojevi
• Željezo:<br />
• Fe 2<br />
O 3<br />
hematit<br />
• Fe 3<br />
O 4<br />
magnetit<br />
• FeCO 3<br />
siderit<br />
• FeOOH limonit<br />
• Dob:<br />
• Fe 2<br />
O 3<br />
+ 3 C → 2 Fe + 3 CO<br />
• Fe 2<br />
O 3<br />
+ 3 CO → 2 Fe + 3 CO 2<br />
• CO 2<br />
+ C ⇔ 2 CO<br />
• 3 Fe + C → Fe 3<br />
C<br />
• ili 3 Fe + 2 CO → Fe 3<br />
C + CO2<br />
• CaCO 3<br />
→ CaO + CO 2<br />
• ↓<br />
• + SiO 2<br />
, Al 2<br />
O 3<br />
• ↓<br />
• Troska
• Sirovo željezo<br />
• Čelik<br />
do 4.5 % C<br />
< 1.7 % C<br />
• Thomasov postupak Ca 3<br />
(PO 4<br />
) 2<br />
• Bessemerov postupak<br />
• C+ O 2<br />
→ CO 2<br />
• Si + O 2<br />
→ SiO 2<br />
SiO 2<br />
+ CaO → CaSiO 3<br />
• Mn + ½ O 2<br />
→ MnO MnO + SiO 2<br />
→ MnSiO 3<br />
• 2 P + ½ O 2<br />
→ P 2<br />
O 5<br />
P 2<br />
O 5<br />
+ 3 CaO → Ca 3<br />
(PO 4<br />
) 2<br />
• troska<br />
• DEZOKSIDACIJA:<br />
FeO + Mn → Fe + MnO
• KOROZIJA Fe<br />
• A: 2 Fe → 2 Fe 2+ + 4 e -<br />
E 0 = - 0.44 V<br />
• K: 2H 2<br />
O + O 2<br />
+ 4 e - → 4 OH - E 0 = 1.23 V<br />
• Fe 2+ + 2 OH - → Fe(OH) 2<br />
• 4 Fe(OH) 2<br />
+ O 2<br />
+ 2 H 2<br />
O → 4 Fe(OH) 3<br />
• ↓<br />
• Fe 2<br />
O 3<br />
⋅ n H 2<br />
O
• Spojevi II III<br />
• ↓ ↓<br />
• pretežno ionski kovalentni karakter<br />
• FeCl 2<br />
⋅ 4 H 2<br />
O FeCl 3<br />
⋅ 6 H 2<br />
O<br />
• FeSO 4<br />
⋅ 7 H 2<br />
O Fe 2<br />
(SO 4<br />
) 3<br />
• (NH 4<br />
) 2<br />
FeSO 4<br />
⋅ 6 H 2<br />
O (NH 4<br />
) 2<br />
Fe(SO 4<br />
) 2<br />
⋅12 H 2<br />
O<br />
• Fe 3+ + H 2<br />
O → Fe(OH) 2+ + H +
• Kompleksni spojevi<br />
• Fe 3+ + 6 Cl - →[FeCl 6<br />
] 3-<br />
•<br />
Fe 2+ + 6 CN - →[Fe(CN) 6<br />
] 4-<br />
• II III II<br />
• K + + [ Fe(CN) 6<br />
] 4- + Fe 3+ → K Fe [Fe(CN) 6<br />
]<br />
• berlinat ion<br />
• [ Fe(CN) 6<br />
] 4- + X - ⇔[Fe(CN) 5<br />
X] 3- + CN -<br />
• prusiati<br />
• H 2<br />
O<br />
• NH 3<br />
• CO<br />
• NO + [ Fe(CN) 5<br />
NO] 2- nitroprusid ion
• Kobalt<br />
•<br />
kobaltit<br />
CoAs 2<br />
⋅ CoS 2<br />
• Dobivanje uz Cu<br />
• Spojevi: II III<br />
• CoO + SiO 2<br />
→ CaSiO 3<br />
staklo<br />
• CoO + Al 2<br />
O 3<br />
→ Co(AlO 2<br />
) 2<br />
keramika<br />
• Thĕnardovo modrilo
• Nikal<br />
• (Ni, Fe) 9<br />
S 8<br />
pentlandit<br />
•<br />
oksid<br />
• (Ni, Fe) 9<br />
S 8<br />
→Ni 3<br />
S 2<br />
+ FeS + Fe 2<br />
O 3<br />
•<br />
prženje<br />
↓ ↓<br />
• O 2<br />
C<br />
• SiO 2<br />
SiO 2<br />
• FeSiO 3<br />
• Ni 3<br />
S 2<br />
+ 7/2 O 2<br />
→ 3 NiO + 2 SO 2<br />
•<br />
400°C<br />
• 2 NiO + (CO+H 2<br />
) → 2 Ni + CO 2<br />
+ H 2<br />
O<br />
•<br />
80° C<br />
• Ni + 4 CO ⇔ Ni(CO) 4<br />
•<br />
180°<br />
• Mondov postupak
• Spojevi : II III<br />
• Edisonov akumulator<br />
• + 2 NiOOH + 2 e - + 2 H 2<br />
O ⇔ 2 Ni(OH) 2<br />
+ 2 OH -<br />
• - Fe + 2 OH - ⇔ Fe(OH) 2<br />
+ 2 e -<br />
• • → pražnjenje
• Kompleksni spojevi nikla (II)<br />
• oktaedarski sp 3 d 2 [ Ni(H 2<br />
O) 6<br />
] 2+<br />
• [ Ni(NH 3<br />
) 6<br />
] 2+<br />
• tetraedarski sp 3 [ Ni(Cl) 4<br />
] 2-<br />
• kvadratni dsp 2 [ Ni(CN) 4<br />
] 2-<br />
• Ni 2+ + 2 CN - ⇔ Ni(CN) 2<br />
• Ni (CN) 2<br />
+ 2 CN - ⇔[Ni(CN) 4<br />
] 2-
• Platinski metali<br />
• Ru Rh Pd<br />
• 4d 7 5 s 1 4 d 8 5 s 1 4 d 10<br />
• Os Ir Pt<br />
• 5 d 6 4 s 2 5 d 7 6 s 2 5 d 9 6 s 1<br />
• Dob:<br />
3 Pd + 16 H + + 4 NO 3-<br />
+ 18 Cl - → 3 PdCl<br />
2-<br />
6<br />
+ 4 NO + 8 H 2<br />
O<br />
3 Pt + 16 H + + 4 NO 3-<br />
+ 18 Cl - → 3 Pt Cl<br />
2-<br />
6<br />
+ 4 NO + 8 H 2<br />
O<br />
• Au Cl 4<br />
-+ 3 Fe 2+ ⇔ Au + 3 Fe 3+ + 4 Cl -<br />
• PdCl 6<br />
2-<br />
+ 2 Fe 2+ ⇔ PdCl 4<br />
2-<br />
+ 2 Fe 3+ + 2 Cl -
• PtCl 6<br />
2-<br />
+ 2 NH 4<br />
+<br />
→ (NH 4<br />
) 2<br />
[ PtCl 6<br />
]<br />
• (NH 4<br />
) 2<br />
[ PtCl 6<br />
]→Pt + 2 NH 3<br />
+ 2 HCl + 2 Cl 2<br />
• Legure Pt s : B, Si, Pb, P, As,Sb,Bi<br />
• PdH 0.5<br />
• Pd (II)<br />
• Pd + Cl 2<br />
→ PdCl 2<br />
• 2 Pd + O 2<br />
→ 2 PdO<br />
• PdCl 2<br />
+ 2 Cl - → PdCl 4<br />
2-
• Wackerov process<br />
• PdCl 2<br />
• CuCl 2<br />
• C 2<br />
H 4<br />
+ ½ O 2<br />
→ CH 3<br />
CHO<br />
• O 2<br />
• C 2<br />
H 4<br />
+ PdCl 2<br />
+ H 2<br />
O → CH 3<br />
CHO + Pd + 2 HCl<br />
• Pd + CuCl 2<br />
→ PdCl 2<br />
+ CuCl<br />
• 2 CuCl + 2 HCl + ½ O 2<br />
→ 2 CuCl 2<br />
+ H 2<br />
O
• Cu Ag Au<br />
III<br />
Uuu<br />
• (n-1) d 10 n s 1<br />
• χ 1.9 1,9 2.4<br />
• E 0 (M + /M)/V + 0.52 + 0.8 + 1.69<br />
• E i II<br />
/eV 20.3 21.5 20.5<br />
• Cu + + e - → Cu<br />
E 0 = 0.52 V<br />
• Cu 2+ + 2 e - → Cu E 0 = 0.34V<br />
• Au + + e - → Au E 0 = 1.69 V<br />
Au 3+ + 3 e - → Au E 0 = 1.5 V
• 2 Cu + ⇔ Cu 2+ + Cu<br />
• 3 Au + ⇔ Au (III) + 2 Au<br />
• kompleksi<br />
• Cu 2+ + e - ⇔ Cu +<br />
E 0 = 0.16 V<br />
•
• Dob: Cu<br />
• CuFeS 2<br />
halkopirit<br />
• Cu 2<br />
S halkozin<br />
• CuS kovelin<br />
• 4 CuFeS 2<br />
+ 11/2 O 2<br />
→ 2 (Cu 2<br />
S + FeS) +<br />
Fe 2<br />
O 3<br />
+ 4 SO 2<br />
• Fe 2<br />
O 3<br />
+ C + SiO 2<br />
→ 2 FeSiO 3<br />
+ CO<br />
• 2 FeS + 3 O 2<br />
+ 2 SiO 2<br />
→ 2 FeSiO 3<br />
+ 2 SO 2<br />
• bakreni kamen<br />
• 2 Cu 2<br />
S + 3 O 2<br />
→ 2 Cu 2<br />
O + 2 SO 2<br />
• Cu 2<br />
S + 2 Cu 2<br />
O→ 6 Cu + SO 2
• Ag<br />
4 Ag + O 2<br />
+ 8 CN - + 2 H 2<br />
O→ 4 Ag (CN) 2-<br />
+ 4 OH -<br />
• Ag + + e - → Ag E 0 = 0.8 V<br />
• Ag(CN) -<br />
2<br />
+ e - → Ag + 2 CN - E 0 = -0.31 V<br />
• 2 Ag (CN) 2-<br />
+ Zn + 3 OH - → 2 Ag + 4 CN - + Zn(OH) 3<br />
–<br />
• (Zn(CN) 4<br />
2-<br />
)<br />
• Au kao i Ag<br />
•
• Spojevi<br />
• Cu<br />
• Stabilni u vodenim otopinama<br />
• Cu 2<br />
O , CuCl<br />
• CuCN Cu 2+ + 2 CN- → CuCN (s) + ½ (CN) 2<br />
• CuCN + 3 CN - → Cu(CN) 4<br />
3-<br />
• neobično stabilan<br />
kompleks<br />
• [Cu (H 2<br />
O) 6<br />
] 2+<br />
• CuSO 4<br />
⋅5 H 2<br />
O<br />
• Cu + 3 H + + HSO 4-<br />
+ ½ O 2<br />
→ Cu 2+ + SO 4<br />
2-<br />
+ H 2<br />
O
• Ag<br />
• Ag Hal → Ag + Hal<br />
• Ag + + 2 CN - → Ag (CN) 2-<br />
• k ≈ 10 20 dm 6 mol -2<br />
• AgNO 3<br />
•
• Zn Cd Hg<br />
III<br />
Uub<br />
• (n-1) d 10 n s<br />
• χ 1.6 1.7 1.9<br />
• E 0 (M 2+ /M) /V- 0.76 - 0.4 + 0.854<br />
• E i<br />
(I+II) / eV 27.3 25.8 29.1
• Dob: Zn<br />
• ZnS sfalerit<br />
• ZnCO 3<br />
smitsonit<br />
• 2 ZnS + 3 O 2<br />
→ 2 ZnO + 2 SO 2<br />
(g)<br />
• ZnO + C → Zn(g) + CO (g)<br />
• Elektrolitski<br />
• ZnO + H + + HSO -<br />
4<br />
→ Zn 2+ + SO<br />
2-<br />
4<br />
+ H 2<br />
O
• E 0 (Zn 2+ / Zn) = - 0.76 V<br />
• E 0 (Fe 2+ / Fe) = - 0.44 V<br />
• E 0 (Sn 2+ / Sn) = - 0.14 V<br />
• K: Zn 2+ + 2 e - → Zn<br />
• A: H 2<br />
O→ ½ O 2<br />
+ 2 H + + 2 e -<br />
• Upotreba: Zaštita od korozije (Fe)
• Cink i spojevi vrlo otrovni<br />
• Cd dobivanje uz Zn<br />
• Cd i spojevi vrlo otrovni (CdO) (g)<br />
•<br />
• Hg HgS cinobarit 0.1<br />
mg/ m 3 dozvoljeno<br />
• HgS + O 2<br />
→ Hg(g) + SO 2<br />
(g)<br />
• Živine pare i topljivi spojevi vrlo otrovni
• SPOJEVI<br />
• ZnO<br />
2 Zn (g) + O 2<br />
→ 2 ZnO<br />
• Svojstva : amfoteran<br />
• Upotreba: pigment , punilo<br />
• ZnCl 2<br />
+ ZnO + H 2<br />
O→ 2 ZnOHCl(s)<br />
• zubarstvo<br />
• ZnS<br />
• ZnCl 2<br />
⋅ 2 H 2<br />
O<br />
• ZnSO 4<br />
⋅ 7 H 2<br />
O<br />
• CdO bazičan karakter<br />
• CdS kadmijevo žutilo<br />
• CdSO 4<br />
⋅ 8/3 H 2<br />
O
• 2 Hg 2+ + 2 e - → 2 Hg<br />
E 0 = 0.79 V<br />
• Hg 2+ + 2 e - → Hg E 0 = 0.85<br />
• 2 HgCl 2<br />
+ SnCl<br />
2-<br />
4<br />
→ Hg 2<br />
Cl 2<br />
+ SnCl<br />
2-<br />
6<br />
• Hg 2<br />
Cl 2<br />
+ SnCl<br />
2-<br />
4<br />
→ 2 Hg + SnCl<br />
2-<br />
6<br />
• Hg 2+ + S 2- → HgS K s<br />
= 6⋅ 10 –52 mol 2 L -2<br />
• Kiselo<br />
• HgS (s) + H 2<br />
S ⇔ [Hg(SH 2<br />
)] pk =6.2<br />
• Lužnato: HgS (s) + S 2- ⇔ [HgS 2<br />
] 2- (ag) pk = 1.5<br />
•
THE END