Predavanje 04 (doc. dr. sc. S. MilardoviÄ) - ZOAK FKIT
Predavanje 04 (doc. dr. sc. S. MilardoviÄ) - ZOAK FKIT
Predavanje 04 (doc. dr. sc. S. MilardoviÄ) - ZOAK FKIT
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
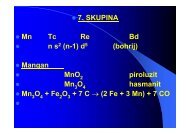
17. SKUPINA ns 2 np 5<br />
• F Cl Br I At<br />
• E i<br />
/ eV 17,4 13 11,9 10,4 x →x + +e -<br />
• -E a<br />
/eV 3,45 3,61 3,36 3,07 x +e - →x -<br />
• E(veze)<br />
• kJmol -1 159 242 190 151 x 2<br />
→ 2x<br />
• -E(hi<strong>dr</strong>.)<br />
• kJmol -1 506 376 343 297 x - (g)→x - (aq.)<br />
• E o / V 2,9 1,4 1,1 0,5 x 2<br />
+2e - ↔2x - (aq.)<br />
• Χ 4 3 2,8 2,5
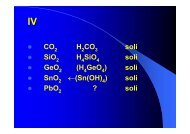
ELEMENTARNE TVARI<br />
• F 2<br />
Cl 2<br />
Br 2<br />
I 2<br />
• t t<br />
/ o C -218,6 -101 -7,25 113,6<br />
• t v<br />
/ o C -188,1 -34 59,5 185,2<br />
• ρ /gcm -3 1,51 1,66 3,19 3,96<br />
• l ( x - x)s 149 198 227 272 pm
• DOBIVANJE: A: 2X - -2e - → X 2<br />
• LAB.<br />
• 10Cl - + 2 MnO 4-<br />
+ 16 H + → 5 Cl 2<br />
+ 2Mn 2+ + 8 H 2<br />
O<br />
• FLUOR CaF 2<br />
, Na 3<br />
AlF 6<br />
• OTROVAN<br />
• REAKTIVAN<br />
• DOB. ELEKTROLIZA HF ⋅KF, 3 HF ⋅KF<br />
• (Cu, Ni )<br />
• HF + F - → HF<br />
-<br />
2<br />
• (KF)
• A: 2HF 2-<br />
→ 2HF + F 2<br />
+ 2e -<br />
• K: 2HF + 2e - → H 2<br />
+ 2F -
• BROM u moru w(Br) = 0,007 %<br />
DOB: Cl 2<br />
+ 2 Br - → 2 Cl - + Br 2<br />
3 Br 2<br />
+ 6 OH - → BrO 3-<br />
+ 5 Br - + 3 H 2<br />
O<br />
←<br />
H +<br />
• JOD NaIO 3<br />
u prirodi<br />
• 2 IO 3-<br />
+ 5 HSO 3-<br />
+ 2 H + → I 2<br />
+ 5 HSO 4-<br />
+ H 2<br />
O
Pregled reakcija halogena<br />
• nX 2<br />
+ 2 M → 2MX n<br />
⎩ praktički svi<br />
• X 2<br />
+ H 2<br />
→ 2HX ⎧ metali + P, As, Sb<br />
• X 2<br />
+ H 2<br />
O → 2H + + 2X - + Y 2<br />
O 2<br />
F 2<br />
, (Cl 2<br />
)<br />
• X 2<br />
+ H 2<br />
O ⇒ H + + X - + HOX osim F 2<br />
• X 2<br />
+ H 2<br />
S ⇒ S + 2 HX<br />
H 2<br />
O<br />
Cl 2<br />
, Br 2<br />
, I 2<br />
• 3 X 2<br />
+ 8 NH 3<br />
→ 6 NH 4<br />
X + N 2<br />
F 2<br />
, Cl 2<br />
, Br 2<br />
• 3 I 2<br />
+ NH 3<br />
→ NI 3<br />
+ 3 HI<br />
• y X 2<br />
+ 2 MO z<br />
+ 2 zC → 2 MX y<br />
+ 2 z<br />
CO
SPOJEVI<br />
• STABILNI SPOJEVI<br />
• oksidacijski broj:<br />
-I<br />
• -I I III V VII F<br />
• HX HXO HXO 2<br />
HXO 3<br />
HXO 4
OKSIDACIJSKI BROJ: -I<br />
• KISELINE:<br />
• HF, HCl, HBr, HI<br />
• ⎯⎯→<br />
• JAKOST<br />
• DOB:-DIREKTNA SINTEZA<br />
• H 2<br />
+ Cl 2<br />
→ 2HCl<br />
•<br />
Pt<br />
• H 2<br />
+ Br 2<br />
→ 2 HBr<br />
•<br />
200°C
-IZ SOLI<br />
CaF 2<br />
+ H 2<br />
SO 4<br />
→ 2 HF (g) + CaSO 4<br />
(s)<br />
2 NaCl + H 2<br />
SO 4<br />
→ 2 HCl + Na 2<br />
SO 4
• IONSKI MF x<br />
MCl x<br />
MBr x<br />
Mi x<br />
• TOPLJIVOST<br />
• ⎯⎯⎯⎯⎯⎯→<br />
• TALIŠTE<br />
• ←⎯⎯⎯⎯⎯⎯<br />
• ←⎯⎯⎯⎯⎯⎯<br />
• Energ. krist. reš.<br />
• Energ. hi<strong>dr</strong>at.<br />
•<br />
• KOVALENTNI TALIŠTE<br />
• ⎯⎯⎯⎯⎯⎯→<br />
• ⎯⎯⎯⎯⎯⎯→<br />
Polarizibilnost
SPOJEVI S POZITIVNIM STUPNJEVIMA<br />
OKSIDACIJE<br />
F Cl Br I<br />
+1<br />
HXO<br />
⎯<br />
+<br />
⎯<br />
⎯<br />
+3<br />
HXO 2<br />
⎯<br />
+<br />
⎯<br />
⎯<br />
+5<br />
HXO 3<br />
⎯<br />
+<br />
+<br />
(H 2<br />
I 2<br />
O 6<br />
)<br />
+7<br />
HXO 4<br />
+1<br />
XO -<br />
⎯<br />
⎯<br />
+<br />
+<br />
+<br />
+<br />
H 5<br />
IO 6<br />
+<br />
+3<br />
XO 2<br />
-<br />
⎯<br />
+<br />
⎯<br />
⎯<br />
+5<br />
XO 3<br />
-<br />
⎯<br />
+<br />
+<br />
+<br />
+7<br />
XO 4<br />
-<br />
⎯<br />
+<br />
+<br />
10 6<br />
5-
Imena kiselina i soli elemenata 17.<br />
skupine<br />
• Formula Tradicijsko ime soli<br />
• HCl klorovodična klorid<br />
• HClO hipoklorasta hipoklorit<br />
• HClO 2<br />
klorasta klorit<br />
• HClO 3<br />
klorna klorat<br />
• HClO 4<br />
perklorna perklorat
kiselinska nomenklatura<br />
• HCl klorovodična kiselina<br />
• HClO monooksoklorna kiselina<br />
• HClO 2<br />
dioksoklorna kiselina<br />
• HClO 3<br />
trioksoklorna kiselina<br />
• HClO 4<br />
tetraoksoklorna kiselina
vodikova nomenklatura<br />
• HCl<br />
• HClO<br />
• HClO 2<br />
• HClO 3<br />
• HClO 4<br />
vodikov klorid<br />
vodikov monooksoklorat<br />
vodikov dioksoklorat<br />
vodikov trioksoklorat<br />
vodikov tetraoksoklorat
Jakost okso kiselina<br />
• HClO < HClO 2<br />
< HClO 3<br />
<<br />
3 ⋅ 10 -8 10 -2 10<br />
HClO 4<br />
10 10 K A<br />
molL -1<br />
I III V<br />
HPH 2<br />
O 2<br />
∼ H 2<br />
PHO 3<br />
∼ H 3<br />
PO 4<br />
10 -2 1.6 ⋅ 10 -2 1,1 ⋅ 10 -2 K A<br />
molL -1
STUPANJ OKSIDACIJE<br />
I<br />
• HXO, X = Cl, Br, I<br />
←⎯⎯⎯⎯<br />
JAKOST I STABILNOST RASTE<br />
•<br />
o I -I<br />
• X 2<br />
+ 2 OH - ↔ XO - + X - + H 2<br />
O<br />
X 2<br />
+ H 2<br />
O ↔ H + + X - + HXO
STUPANJ OKSIDACIJE<br />
V<br />
• HBrO 3<br />
, HClO 3<br />
, HIO → H 3 2 I 2 O 6<br />
•<br />
• RASTE OKSID DJELOVANJA<br />
• RELATIVNO STABILNE<br />
Dobivanje soli:<br />
•<br />
• 3 X 2<br />
+ 6 OH - → 3 XO - + 3 X - + 3 H 2<br />
O<br />
• 3 XO - → XO 3-<br />
+ 2X -<br />
•<br />
• Odnos brzina ClO - 1<br />
• disproporc. BrO - 100<br />
• IO - 30000
STUPANJ OKSIDACIJE<br />
VII<br />
• HClO 4<br />
HBrO 4<br />
HIO 4<br />
H 5<br />
IO 6<br />
• INDUSTRIJSKI POSTUPAK:<br />
• A: ClO 3-<br />
+ H 2<br />
O → ClO 4-<br />
+ 2H + + 2e -<br />
• NaClO 4<br />
•<br />
↓
• SLABE KISELINE<br />
SOLI HIDROLIZIRAJU<br />
• XO - + H 2<br />
O → HXO + OH -<br />
SNAŽAN OKSIDANS<br />
OKSIDIRA VLASTITU SOL<br />
• HIPOKLORITI:<br />
• NaClO, Ca(OCl) 2<br />
, CaCl(OCl)<br />
• ClO - + H + → HClO<br />
• HClO + Cl - + H + → Cl 2<br />
+ H 2<br />
O<br />
•
PLEMENITI PLINOVI<br />
• 1s 2 He<br />
• ns 2 np 6 Ne, Ar, Kr, Xe, Ra<br />
• t 1/2<br />
= 4 d<br />
• U ZRAKU:<br />
• Ar Ne HeKr Xe<br />
• ϕ 0,99 ∼ 10 -3 5 x 10 -4 10 -4 ∼ 10 -7 %
SPOJEVI<br />
• He Ne Ar Kr Xe Ra<br />
• E i<br />
/eV 24,6 21,6 15,8 14 12,1 10,8<br />
• O 2<br />
+ PtF 6<br />
(g) → O 2+<br />
[PtF 6<br />
] - (s) (1962)<br />
• O 2<br />
→ O 2<br />
+<br />
+ e - E i<br />
= 12,2 eV<br />
• Xe + PtF 6<br />
(g) → Xe + [PtF 6<br />
] - (s)<br />
• žut
XeF 2<br />
, XeF 4<br />
, XeF 6<br />
, XeO 6<br />
4-<br />
5s 5p 5d<br />
F - F -<br />
-<br />
F -<br />
F -<br />
F - F -<br />
-<br />
F - F - spd<br />
F - F - F -<br />
F -<br />
3 2