hidroliza soli, puferske otopine - ZOAK FKIT - Fakultet kemijskog ...
hidroliza soli, puferske otopine - ZOAK FKIT - Fakultet kemijskog ...
hidroliza soli, puferske otopine - ZOAK FKIT - Fakultet kemijskog ...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Fakultet</strong> <strong>kemijskog</strong> inženjerstva i tehnologije<br />
Sveučilišta u Zagrebu<br />
Seminar 09<br />
KEMIJSKA RAVNOTEŽA II<br />
Ravnoteže u otopinama elektrolita 2<br />
dr. sc. Biserka Tkalčec<br />
dr. sc. Lidija Furač
KEMIJSKA RAVNOTEŽA II<br />
KONJUGIRANE KISELINE I BAZE U VODENOJ OTOPINI<br />
2.1. B + H 2 O BH + + OH -<br />
baza kiselina kiselina baza<br />
NH 3 + H 2 O NH<br />
+<br />
4 + OH -<br />
baza kiselina kiselina baza<br />
općenito<br />
primjer<br />
BH + = konjugirana kiselina baze B<br />
NH 4+ = konjugirana kiselina baze NH 3<br />
2.2. BH + + H 2 O H 3 O + + B<br />
kis. baza kiselina baza<br />
općenito<br />
NH 4<br />
+<br />
+ H 2 O H 3 O + + NH 3<br />
kis. baza kiselina baza<br />
primjer<br />
B = konjugirana baza kiseline BH +<br />
NH 3 = konjugirana baza kiseline NH 4<br />
+
KEMIJSKA RAVNOTEŽA II<br />
a) konstanta ravnoteže 2.1. = konstanta ionizacije konjugirane baze B<br />
K<br />
B<br />
=<br />
[ ][ ]<br />
+ −<br />
BH OH<br />
[ B]<br />
=<br />
[ ]<br />
+<br />
BH K<br />
[ ][ ]<br />
+<br />
B H<br />
W<br />
b) konstanta ravnoteže 2.2 = konstanta ionizacije konjugirane kiseline BH +<br />
K K<br />
[ ][ ]<br />
+ −<br />
H<br />
[ ]<br />
+<br />
= BH<br />
B<br />
K =<br />
B<br />
K<br />
K<br />
w<br />
K<br />
K =<br />
K<br />
K<br />
K<br />
w<br />
B<br />
Konstanta konjugirane baze<br />
Konstanta konjugirane kiseline
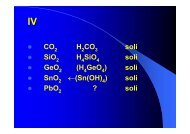
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
1. Vodene <strong>otopine</strong> <strong>soli</strong>, dobivene neutralizacijom jakih baza i slabih<br />
kiselina<br />
(1) MeA → Me + (aq) + A - (aq) …...........potpuna disocijacija, jer je sol (ionski spoj)<br />
- A - = konjugirana baza slabe kiseline i jača baza od vode<br />
voda se ponaša kao kiselina, tj. protondonor<br />
(2) A - + H 2 O HA + OH - ......................HIDROLIZA<br />
baza kiselina kiselina baza<br />
Iz (1)........c (A - ) = c ( MeA)<br />
Iz (2)........ [OH - ] = [HA]......jer je omjer stehiometrijskih koeficijenata = 1 : 1
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
- konstanta hidrolize, K h (ravnoteža (2)) :<br />
K<br />
h<br />
=<br />
K<br />
B<br />
=<br />
K<br />
K<br />
w<br />
HA<br />
=<br />
[ ][ ]<br />
−<br />
HA OH<br />
[ ]<br />
−<br />
A<br />
=<br />
c(A<br />
[ ]<br />
− 2<br />
OH<br />
− [<br />
−<br />
) − OH ]<br />
pH<br />
− 2<br />
−<br />
1.) bez aproksimacije: [ OH ] + K ⋅[ OH ]<br />
h<br />
− K<br />
h<br />
-<br />
⋅c<br />
(A )<br />
= 0<br />
[OH - ] pOH pH<br />
2.) aproksimativno:<br />
[OH - ] = [HA] 3 % račun bez aproksimacije<br />
2. stupanj hidrolize, α h ≤ 3 % aproksimativni račun
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
- stupanj hidrolize, α:<br />
α<br />
h<br />
=<br />
c<br />
−<br />
(A<br />
hidrolizirano<br />
−<br />
)<br />
c (A<br />
)<br />
=<br />
[ OH ]<br />
−<br />
c (MeA)<br />
-napomena: Pri računu obratiti pažnju na dvovalentne <strong>soli</strong>, MeA 2 , u<br />
kojima je c (A - ) = 2 c (MeA 2 ), npr. Ca(CH 3 COO) 2 !!
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
2. Vodene <strong>otopine</strong> <strong>soli</strong>, dobivene neutralizacijom jakih kiselina i slabih<br />
baza<br />
(1) BA → B + (aq) + A - (aq) …...........potpuna disocijacija, jer je sol (ionski spoj)<br />
B + = konjugirana kiselina slabe baze i jača kiselina od vode<br />
voda se ponaša kao baza, tj. protonakceptor<br />
(2) B + + H 2 O B + H 3 O + ......................HIDROLIZA<br />
kiselina baza baza kiselina<br />
Iz (1)........c (B + ) = c ( BA)<br />
Iz (2)........ [H 3 O + ] = [H + ] = [B]...jer je omjer stehiometrijskih koeficijenata = 1 : 1
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
- konstanta hidrolize, K h (ravnoteža (2)) :<br />
K<br />
h<br />
=<br />
K<br />
K<br />
=<br />
K<br />
K<br />
w<br />
B<br />
=<br />
[ ][ ]<br />
+<br />
B H<br />
[ ]<br />
+<br />
B<br />
=<br />
c(B<br />
[ ]<br />
+ 2<br />
H<br />
+ [<br />
+<br />
) − H ]<br />
pH<br />
+ 2<br />
+<br />
1.) bez aproksimacije: [ H ] + K ⋅[ H ]<br />
h<br />
− K<br />
h<br />
⋅c<br />
(B<br />
+<br />
)<br />
= 0<br />
[H + ] pH<br />
2.) aproksimativno:<br />
[H + ] = [B] 3 % račun bez aproksimacije<br />
2. stupanj hidrolize, α h ≤ 3 % aproksimativni račun
KEMIJSKA RAVNOTEŽA II – <strong>hidroliza</strong> <strong>soli</strong><br />
- stupanj hidrolize, α:<br />
α<br />
h<br />
=<br />
c<br />
(B<br />
hidrolizirano<br />
+<br />
+<br />
)<br />
c (B<br />
)<br />
=<br />
[ H ]<br />
+<br />
c (BA)<br />
-napomena: Pri računu obratiti pažnju na dvovalentne <strong>soli</strong>, B 2 A, u<br />
kojima je c (B + ) = 2 c (B 2 A), npr. (NH 4 ) 2 SO 4 !!
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
OTOPINE PUFERA:<br />
1.) Smjesa slabe kiseline i njezine <strong>soli</strong> s jakom bazom, npr. smjesa HAc i NaAc<br />
2.) Smjesa slabe baze i njezine <strong>soli</strong> s jakom kiselinom, npr. smjesa NH 3 i NH 4 Cl<br />
TEMELJNO SVOJSTVO: Dodatkom jake kiseline ili baze (najveća moguća količina<br />
ovisi o kapacitetu pufera) u otopinu pufera, pH <strong>otopine</strong> se značajno ne mijenja.<br />
PRIPREMA:<br />
a) izravno miješanje komponenata smjese<br />
b) djelomična neutralizacija:<br />
- slabe kiseline jakom bazom jaka baza je mjerodavni reaktant<br />
ili<br />
- slabe baze jakom kiselinom jaka kiselina je mjerodavni reaktant<br />
c) izravno miješanje dviju <strong>soli</strong> poliprotonske kiseline (npr. NaH 2 PO 4 i Na 2 HPO 4 ) i<br />
različite druge kombinacije nije sadržaj kolegija
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
1.) primjer: smjesa HAc i NaAc<br />
reakcije u otopini:<br />
1) HAc H + + Ac - ..... djelomična ionizacija slabe kiseline RAVNOTEŽNA<br />
Le Chatélier<br />
REAKCIJA<br />
2) NaAc Na + + Ac - ..... sol, ionski spoj potpuna disocijacija<br />
c (Ac - ) 2) = c (NaAc)<br />
K<br />
K<br />
=<br />
+ −<br />
[ H ][ Ac ]<br />
[ HAc]<br />
- [Ac - ] = [Ac - ] 1) + c (Ac - ) 2)<br />
[Ac - ] 1) « c (Ac - ) 2)<br />
[Ac - ] ≈ c (Ac - ) 2) = c (NaAc)<br />
- [HAc] = c ( HAc) - [H + ] ≈ c (HAc)<br />
Za razliku od <strong>otopine</strong> čiste kiseline, [H + ] ≠ [Ac - ]
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
K<br />
K<br />
=<br />
[ H ][ Ac ]<br />
+ −<br />
[ HAc ]<br />
≈<br />
[ ]<br />
+<br />
(<br />
−<br />
H c Ac )<br />
c<br />
( HAc )<br />
[ ]<br />
+ c ( HAc)<br />
H =<br />
K<br />
⋅<br />
c (<br />
−<br />
Ac )<br />
=<br />
[ ]<br />
+<br />
H c ( NaAc)<br />
c<br />
( HAc)<br />
( HAc )<br />
( NaAc )<br />
c<br />
K ≈ =<br />
c<br />
n<br />
n<br />
=<br />
( HAc )<br />
( NaAc )<br />
[ ]<br />
+<br />
H n ( NaAc )<br />
n<br />
( HAc )<br />
Omjer koncentracija slabe kiseline i njezine <strong>soli</strong> određuje pH <strong>puferske</strong> <strong>otopine</strong>.<br />
- povećanje koncentracije <strong>soli</strong> u kiseloj puferskoj otopini:<br />
c (Ac - ) c (HAc) [H + ] pH kiselost <strong>otopine</strong> se<br />
−<br />
c (Ac )<br />
proporcionalno smanji<br />
- povećanje koncentracije slabe kiseline u kiseloj puferskoj otopini:<br />
c (HAc) c (HAc) [H + ] pH kiselost <strong>otopine</strong> se<br />
−<br />
c (Ac )<br />
proporcionalno poveća
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
a) Dodatak jake baze u kiselu pufersku otopinu:<br />
jaku bazu neutralizira slaba kiselina u puferskoj otopini:<br />
CH 3 COOH + NaOH CH 3 COONa + H 2 O<br />
kiselina baza sol<br />
( )<br />
c (CH 3 COOH) ; c (CH 3 COO - ) c HAc [H + ] pH kiselost <strong>otopine</strong><br />
−<br />
c Ac<br />
( )<br />
se malo smanji<br />
b) Dodatak jake kiseline u kiselu pufersku otopinu:<br />
jaku kiselinu neutralizira konjugirana baza slabe kiseline (anion slabe kiseline) u<br />
otopini, prisutna u značajnoj količini zbog potpuno disocirane <strong>soli</strong> (jedn.2)):<br />
CH 3 COO - + HCl CH 3 COOH + Cl -<br />
baza kiselina kiselina baza<br />
CH 3 COONa + HCl<br />
CH 3 COOH + NaCl<br />
( )<br />
ili u molekulskom obliku<br />
c (CH 3 COO - ) ; c (CH 3 COOH) c HAc [H + ] pH kiselost <strong>otopine</strong><br />
−<br />
c Ac<br />
( )<br />
se malo poveća
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
2.) primjer: smjesa NH 3 i NH 4 Cl<br />
reakcije u otopini:<br />
1) NH 3 + H 2 O NH 4 + + OH - ... djelomična ionizacija slabe RAVNOTEŽNA<br />
Le Chatélier baze REAKCIJA<br />
2) NH 4 Cl NH 4 + + Cl - ..... sol, ionski spoj potpuna disocijacija<br />
K<br />
c (NH 4 + ) 2) = c (NH 4 Cl)<br />
B<br />
=<br />
[<br />
+ −<br />
NH ][ Cl ]<br />
4<br />
[ NH ]<br />
3<br />
- [NH 4 + ] = [NH 4 + ] 1) + c (NH 4 + ) 2)<br />
[NH 4 + ] 1) « c (NH 4 + ) 2)<br />
[NH 4 + ] ≈ c (NH 4 + ) 2) = c (NH 4 Cl)<br />
- [NH 3 ] = c ( NH 3 ) - [OH - ] ≈ c (NH 3 )<br />
Za razliku od <strong>otopine</strong> čiste baze, [OH - ] ≠ [NH 4+ ]
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
K<br />
B<br />
=<br />
[<br />
+<br />
NH ][ OH ]<br />
−<br />
4<br />
[ NH ]<br />
3<br />
≈<br />
c<br />
( NH )[ OH ]<br />
+ −<br />
c<br />
4<br />
( NH )<br />
3<br />
=<br />
[ OH ] c ( NH )<br />
−<br />
+<br />
c<br />
( NH )<br />
3<br />
4<br />
=<br />
[ OH ] n ( NH )<br />
−<br />
+<br />
n<br />
( NH )<br />
3<br />
4<br />
− c<br />
[ ]<br />
( NH<br />
3<br />
)<br />
OH ⋅<br />
=<br />
B<br />
+<br />
c<br />
4<br />
( NH )<br />
c ( NH<br />
3<br />
)<br />
( NH Cl )<br />
K ≈ =<br />
c<br />
4<br />
n<br />
n<br />
( NH<br />
3<br />
)<br />
( NH Cl )<br />
4<br />
Omjer koncentracija slabe baze i njezine <strong>soli</strong> određuje pH <strong>puferske</strong> <strong>otopine</strong>.<br />
- povećanje koncentracije <strong>soli</strong> u lužnatoj puferskoj otopini:<br />
c (NH + 4 ) c (NH [OH - 3)<br />
] [H + ] pH kiselost <strong>otopine</strong> se<br />
+<br />
c (NH )<br />
4<br />
proporcionalno poveća<br />
- povećanje koncentracije slabe baze u lužnatoj puferskoj otopini:<br />
c (NH 3 ) c (NH<br />
3)<br />
[OH-] [H + ] pH kiselost <strong>otopine</strong> se<br />
+<br />
c (NH )<br />
proporcionalno smanji<br />
4
KEMIJSKA RAVNOTEŽA II – <strong>otopine</strong> pufera<br />
a) Dodatak jake kiseline u lužnatu pufersku otopinu:<br />
jaku kiselinu neutralizira slaba baza u puferskoj otopini:<br />
NH 3 + HCl NH 4 Cl<br />
baza kiselina sol<br />
( )<br />
c (NH 3 ) ; c (NH + 4 ) c NH [OH - ] [H + 3<br />
] pH kiselost <strong>otopine</strong><br />
+<br />
c NH<br />
( )<br />
4<br />
se malo poveća<br />
b) Dodatak jake baze u lužnatu pufersku otopinu:<br />
jaku bazu neutralizira konjugirana kiselina slabe baze (kation slabe baze) u<br />
otopini, prisutna u značajnoj količini zbog potpuno disocirane <strong>soli</strong> (jedn.2)):<br />
NH + 4 + OH - NH 3 + H 2 O<br />
kiselina<br />
baza<br />
ili u molekulskom obliku<br />
NH 4 Cl + NaOH<br />
NH 4 Cl + NH 3 + H 2 O<br />
( )<br />
c (NH 4+ ) ; c (NH 3 ) c NH [OH - 3<br />
] [H + ] pH kiselost <strong>otopine</strong><br />
+<br />
c NH<br />
( )<br />
4<br />
se malo smanji
1 . M. Sikirica, Stehiometrija:<br />
Domaća zadaća<br />
zadatci: 10.22.; 10.22.; 10.35.; 10.36.; 10.41.; 10.43.; 10.44.; 10.45.<br />
Napomena za 10.35. i 10.36.: Kiseline (baze) su monoprotonske (jednovalentne), a u točki ekvivalencija<br />
je kiselina (baza) potpuno neutralizirana.<br />
2. I. Filipović, Opća i anorganska kemija I:<br />
zadatci: 9.3.17.; 9.3.19.; 9.3.20.<br />
3. Izračunajte pH <strong>otopine</strong> natrijeva hipoklorita (NaClO), ako je maseni udio NaClO u<br />
otopini, w = 10 %, a gustoća <strong>otopine</strong> je 1,2 kg/L. Konstanta hipokloritne kiseline<br />
je, K (HClO) = 3,2 ∙ 10-8 M. R: pH = 10,85.<br />
4. Izračunajte masu amonijevog perklorata u 250 mL <strong>otopine</strong>, ako je pH te <strong>otopine</strong>,<br />
pH = 5,11. Konstanta ionizacije amonijaka je, K (NH 3 ) = 1,7 ∙ 10 -5 M; R: m = 3 g.<br />
5. U otopini kalijevog cijanida koncentracije c = 0,2 M izmjeren je pH = 11,2.<br />
Izračunajte konstantu ionizacije slabe cijanovodične kiseline HCN.<br />
R: K (HCN) = 7.96 ∙ 10 -10 M.<br />
6. Izračunajte: a) volumen sumporne kiseline, c (H 2 SO 4 ) = 0,25 M, potreban za<br />
potpunu neutralizaciju 1,0 L <strong>otopine</strong> amonijaka, c (NH 3 ) = 1 M i b) pH <strong>otopine</strong><br />
nakon neutralizacije. K (NH 3 ) = 1,7 ∙ 10 -5 M.<br />
R: a) V (H 2 SO 4 ) = 2,0 L; b) pH = 4,85.
Domaća zadaća - nastavak<br />
7. Izračunajte pH <strong>otopine</strong> koja se dobije miješanjem 400 cm 3 octene kiseline,<br />
c (CH 3 COOH) = 0,5 M i 200 cm 3 <strong>otopine</strong> natrijeva acetata, c (CH 3 COONa) = 1 M.<br />
K (CH 3 COOH) = 1,75 ∙ 10 -5 M. R: pH = 4,76.<br />
8. Izračunajte masu amonijeva klorida koju treba dodati u 250 cm 3 <strong>otopine</strong><br />
amonijaka, w (NH 3 ) = 5 %, ρ (NH3) otopina = 0,98 g cm -3 , da bi se dobila<br />
puferska otopina čiji pH = 9,8. K (NH 3 ) = 1,7 ∙ 10-5 M. R: m (NH 4 Cl) = 10,36 g.<br />
9. Izračunajte pH <strong>otopine</strong> koja je pripremljena otapanjem 17,28 g čvrstog kalijeva<br />
hidroksida u 3 litre <strong>otopine</strong> octene kiseline, c (CH 3 COOH) = 0,25 M.<br />
K (CH 3 COOH) = 1,75 ∙ 10 -5 M. R: pH = 4,6.<br />
10. Izračunajte za koliko će se promijeniti pH <strong>otopine</strong> koja sadrži amonijak, c (NH 3 )<br />
= 0,1 M i amonijev sulfat c ((NH 4 ) 2 SO 4 ) = 0,05 M, ako se u 100 cm 3 te <strong>otopine</strong><br />
doda a) 10 cm 3 <strong>otopine</strong> NaOH, c (NaOH) = 0,2 M, b) 10 cm 3 <strong>otopine</strong> H 2 SO 4 ,<br />
c (H 2 SO 4 ) = 0,1 M. K (NH 3 ) = 1,7 ∙ 10 -5 M. R: a) ΔpH = 0,18; b) ΔpH = 0,18.<br />
11. Izračunajte volumen <strong>otopine</strong> klorovodične kiseline, c (HCl) = 0,5 M, koji treba<br />
dodati u 200 mL <strong>otopine</strong> koja sadrži octenu kiselinu i natrijev acetat jednakih<br />
koncentracija, c (CH 3 COOH) = c (CH 3 COONa) = 1M, da bi se pH <strong>otopine</strong><br />
promijenio za 0,02 pH jedinice. K (CH 3 COOH) = 1,75 ∙ 10 -5 M.<br />
R: V (HCl) = 10 cm 3 .
Zadatci za vježbu - nastavak<br />
1. Izračunajte pH <strong>otopine</strong> amonijevog sulfata, ako je maseni udio te <strong>soli</strong> u otopini,<br />
w = 0,04, a gustoća <strong>otopine</strong> je 1,02 g/mL. Konstanta baze amonijaka je,<br />
K (NH 3 ) = 1,7 ∙ 10 -5 M. R: pH = 4,71.<br />
2. U otopini amonijevog nitrata izmjeren je pH = 5,1. Izračunajte masenu<br />
koncentraciju <strong>soli</strong> u otopini. K (NH 3 ) = 1,7 ∙ 10 -5 M. R: γ = 8,56 g/L.<br />
3. Izračunajte pH <strong>otopine</strong> koja sadrži barijev acetat masene koncentracije 120 g/L.<br />
Konstanta ionizacija octene kiseline je, K (CH 3 COOH) = 1,75 ∙ 10 -5 M.<br />
R: pH = 9,4.<br />
4. Izračunajte pH <strong>otopine</strong> koja sadrži 10 g natrijevog nitrita u 150 mL <strong>otopine</strong>.<br />
Konstanta ionizacije dušikaste kiseline je, K (HNO 2 ) = 4 ∙ 10 -4 M.<br />
R: pH = 8,7.<br />
5. Izračunajte pH <strong>otopine</strong> anilin hidrogenklorida (C6H5NH3Cl) množinske<br />
koncentracije, c = 0,5 M. Anilin, C 6 H 5 NH 2 , je slaba baza, a anilin hidroklorid je sol<br />
te baze. K (C 6 H 5 NH 2 ) = 3,8 ∙ 10 -10 M. R: pH = 2,44.<br />
Uputa: anilin se ponaša u vodi kao amonijak:<br />
C 6 H 5 NH 2 + H 2 O C 6 H 5 NH 3+ + OH – K (C 6 H 5 NH 2 ) = 3,8 ∙ 10 -10 M<br />
Sol disocira prema sljedećoj jednadžbi: C 6 H 5 NH 3 Cl → C 6 H 5 NH 3+ + Cl -
Zadatci za vježbu - nastavak<br />
6. Izračunajte konstantu ionizacije anilina (C 6 H 5 NH 2 ), ako pH <strong>otopine</strong> anilin<br />
hidrogenklorida množinske koncentracije, c (C 6 H 5 NH 3 Cl) = 0,5, iznosi pH =<br />
2,44. (Uputa kao za zadatak 5.). R: K (C 6 H 5 NH 2 ) = 3,8 ∙ 10-10 M.<br />
7. Izračunajte: a) volumen <strong>otopine</strong> natrijeva hidroksida množinske koncentracije,<br />
c (NaOH) = 0,2 M, potreban za potpunu neutralizaciju 20 mL <strong>otopine</strong> octene<br />
kiseline, c (CH 3 COOH) = 0,05 M i b) pH <strong>otopine</strong> nakon neutralizacije.<br />
K (CH 3 COOH)= 1,75 ∙ 10 -5 M. R: a) V (NaOH) = 5,0 mL; b) pH = 8,68.<br />
8. Izračunajte za koliko se promijeni pH <strong>otopine</strong> amonijaka, c (NH 3 ) = 1,5 M, ako se<br />
u 200 mL <strong>otopine</strong> doda 5 g amonijeva klorida. K (NH 3 ) = 1,7 ∙ 10-5 M.<br />
R: ΔpH = 1,96.<br />
9. Izračunajte množinu klorovodične kiseline koju je potrebno dodati u otopinu koja<br />
sadrži 1,2 mol amonijaka, da bi se dobila puferska otopina čiji pH = 9,7.<br />
K (NH 3 ) = 1,7 ∙ 10 -5 M. R: n (HCl) = 0,304 mol.<br />
10. Izračunajte masu natrijeva hidroksida koju je potrebno dodati u 250 cm 3 <strong>otopine</strong><br />
koja sadrži amonijak, c (NH 3 ) = 0,5 M i amonijev klorid, c (NH 4 Cl) = 1,0 M, da bi<br />
se pH <strong>otopine</strong> promijenio za 0,6 pH jedinice. K (NH 3 ) = 1,7 ∙ 10 -5 M<br />
R: m (NaOH) = 5 g.
Zadatci za vježbu - nastavak<br />
11. Izračunajte za koliko će se promijeniti pH <strong>otopine</strong> koja sadrži octenu kiselinu,<br />
c (CH 3 COOH) = 0,020 M i natrijev acetat c (CH 3 COONa) = 0,015 M, ako se u<br />
10 cm 3 te <strong>otopine</strong> doda a) 10 µmol HCl, b) 10 = µmol NaOH.<br />
K (CH 3 COOH) = 1,75 ∙ 10 -5 M. R: a) ΔpH = 0,05; b) ΔpH = 0,05.