maj - jazmp
maj - jazmp
maj - jazmp
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
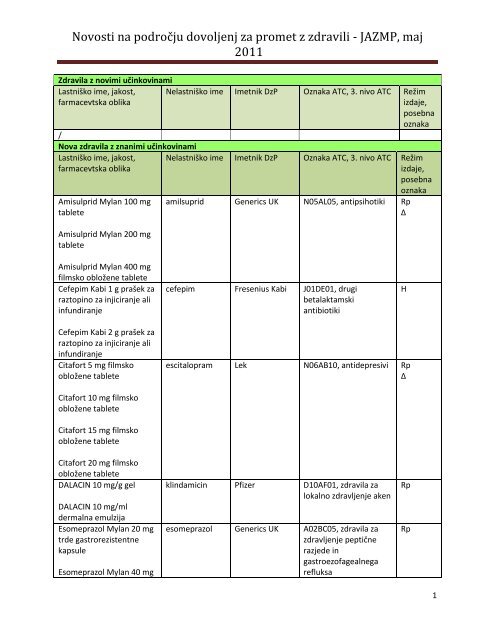
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
Zdravila z novimi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
/<br />
Nova zdravila z znanimi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Amisulprid Mylan 100 mg<br />
tablete<br />
Amisulprid Mylan 200 mg<br />
tablete<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
amilsuprid Generics UK N05AL05, antipsihotiki Rp<br />
∆<br />
Amisulprid Mylan 400 mg<br />
filmsko obložene tablete<br />
Cefepim Kabi 1 g prašek za<br />
raztopino za injiciranje ali<br />
infundiranje<br />
cefepim Fresenius Kabi J01DE01, drugi<br />
betalaktamski<br />
antibiotiki<br />
H<br />
Cefepim Kabi 2 g prašek za<br />
raztopino za injiciranje ali<br />
infundiranje<br />
Citafort 5 mg filmsko<br />
obložene tablete<br />
escitalopram Lek N06AB10, antidepresivi Rp<br />
∆<br />
Citafort 10 mg filmsko<br />
obložene tablete<br />
Citafort 15 mg filmsko<br />
obložene tablete<br />
Citafort 20 mg filmsko<br />
obložene tablete<br />
DALACIN 10 mg/g gel<br />
DALACIN 10 mg/ml<br />
dermalna emulzija<br />
Esomeprazol Mylan 20 mg<br />
trde gastrorezistentne<br />
kapsule<br />
Esomeprazol Mylan 40 mg<br />
klindamicin Pfizer D10AF01, zdravila za<br />
lokalno zdravljenje aken<br />
esomeprazol Generics UK A02BC05, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
Rp<br />
Rp<br />
1
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
trde gastrorezistentne<br />
kapsule<br />
Klopidogrel Vale<br />
Pharmaceuticals 75 mg<br />
filmsko obložene tablete<br />
Lopacut 2 mg filmsko<br />
obložene tablete<br />
Meropenem Kabi 500 mg<br />
prašek za raztopino za<br />
injiciranje ali infundiranje<br />
klopidogrel<br />
Vale<br />
Pharmaceuticals<br />
B01AC04,<br />
antitrombotiki<br />
loperamid Vitabalans Oy A07DA03,<br />
antiperistaltiki<br />
meropenem Fresenius Kabi J01DH02, drugi<br />
betalaktamski<br />
antibiotiki<br />
Rp<br />
Rp<br />
∆<br />
H<br />
Meropenem Kabi 1g<br />
prašek za raztopino za<br />
injiciranje ali infundiranje<br />
Nutriflex Omega<br />
G120/N5,4/E emulzija za<br />
infundiranje<br />
parenteralna<br />
prehrana<br />
B. Braun<br />
Melsungen<br />
B05BA10,raztopine za<br />
intravensko uporabo<br />
H<br />
Nutriflex Omega<br />
G144/N8/E emulzija za<br />
infundiranje<br />
Pramipeksol Arrow<br />
0,088 mg tablete<br />
Pramipeksol Arrow<br />
0,18 mg tablete<br />
Pramipeksol Arrow<br />
0,35 mg tablete<br />
pramipeksol Arrow N04BC05,<br />
dopaminergiki<br />
Rp<br />
∆<br />
Pramipeksol Arrow<br />
0,7 mg tablete<br />
Propofol Claris 10 mg/ml<br />
emulzija za injiciranje ali<br />
infundiranje<br />
propofol<br />
Claris<br />
Lifescience UK<br />
N01AX10, splošni<br />
anestetiki<br />
ZZ<br />
Propofol Claris 20 mg/ml<br />
emulzija za injiciranje ali<br />
infundiranje<br />
Propoven 20 mg/ml<br />
emulzija za injiciranje ali<br />
infundiranje<br />
Sevofluran Baxter 250 ml<br />
para za inhaliranje,<br />
propofol<br />
Medias<br />
International<br />
N01AX10, splošni<br />
anestetiki<br />
sevofluran Baxter N01AB08, splošni<br />
anestetiki<br />
ZZ<br />
ZZ<br />
2
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
tekočina<br />
Trimeluzine 35 mg tablete<br />
s podaljšanim sproščanjem<br />
Zdravila v novih farmacevtskih oblikah<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
/<br />
Zdravila z novimi jakostmi<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
trimetazidin Lupin (Europe) C01EB15, druga zdravila<br />
za bolezni srca<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
/<br />
Nove indikacije in druge pomembnejše spremembe<br />
Lastniško ime, jakost, farmacevtska oblika/nelastniško ime/oznaka ATC<br />
CARBAGLU 200 mg disperzibilne tablete, kargluminska kislina, A16AA05<br />
Dopolnitev poglavij<br />
4.1 Terapevtske indikacije<br />
Zdravilo Carbaglu je indicirano za zdravljenje<br />
hiperamoniemije, ki je posledica primarnega pomanjkanja N-acetilglutamat-sintaze;<br />
hiperamoniemije zaradi izovalerične acidemije;<br />
hiperamoniemije zaradi metilmalonične acidemije;<br />
hiperamoniemije zaradi propionske acidemije.<br />
4.2 Odmerjanje in način uporabe<br />
Pri izovalerični acidaemiji, metilmalonične acidaemiji in propionske acidaemiji:<br />
Zdravljenje je treba uvesti po hiperamoniemiji pri bolnikih z organsko acidemijo. Začetni dnevni<br />
odmerek naj bo 100 mg/kg pa do 250 mg/kg, če je potrebno.<br />
Nato ga je treba individualno prilagoditi tako, da se vzdržujejo normalne ravni amonijaka v plazmi (glejte<br />
poglavje 4.4).<br />
4.8 Neželeni učinki<br />
Neželeni učinki pri organski acidaemiji<br />
Srčne bolezni: občasni: bradikardija<br />
Bolezni prebavil: občasni: diareja, bruhanje<br />
Splošne težave in spremembe na mestu aplikacije: občasni: pireksija<br />
5.1 Farmakodinamične lastnosti<br />
Klinična učinkovitost in varnost<br />
Pri bolnikih z organsko acidemijo (novorojenčki in ne-novorojenčki) je zdravljenje s kargluminsko kislino<br />
povzročilo hitro zmanjšanje ravni amonijaka v plazmi ter zmanjšalo tveganje za nevrološke zaplete.<br />
3
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
HUMIRA 40 mg/0,8 ml raztopina za injiciranje za pediatrično uporabo, adalimumab, L04AB04<br />
Razširitev dovoljenja za promet-farmacevtska oblika za pediatrično uporabo<br />
4.1 Terapevtske indikacije<br />
Poliartikularni juvenilni idiopatski artritis<br />
Zdravilo Humira je v kombinaciji z metotreksatom indicirano za zdravljenje aktivnega<br />
poliartikularnega juvenilnega idiopatskega artritisa pri otrocih in mladostnikih, starih od 4 do 17 let, ki<br />
se ne odzovejo ustrezno na eno ali več imunomodulirajočih antirevmatičnih zdravil. Zdravilo Humira<br />
je mogoče uporabiti kot monoterapijo v primeru intolerance za metotreksat ali kadar nadaljne<br />
zdravljenje z metotreksatom ni primerno (za učinkovitost monoterapije glejte poglavje 5.1). Študije z<br />
zdravilom Humira pri otrocih, starih manj kot 4 leta, niso bile izvedene.<br />
LUCENTIS 10 mg/ml raztopina za injiciranje, ranibizumab, S01LA04<br />
Dopolnitev poglavij<br />
4.1 Terapevtske indikacije<br />
za zdravljenje okvare vida zaradi makularnega edema, ki nastane kot posledica zapore<br />
mrežnične vene (pri zapori centralne mrežnične vene ali njene veje) (glejte poglavje 5.1).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
V 60 minutah po injiciranju zdravila Lucentis so opažali prehodno zvišan intraokularni tlak (IOT).<br />
Ugotavljali so tudi vztrajno zvišan intraokularni tlak (glejte poglavje 4.8). Tako intraokularni tlak kot tudi<br />
perfuzijo glave očesnega živca je treba spremljati in ustrezno obravnavati.<br />
Obseg izkušenj z zdravljenjem bolnikov, pri katerih je že kdaj prej prišlo do zapore mrežnične vene, in<br />
bolnikov z ishemično zaporo veje centralne mrežnične vene ali z zaporo centralne mrežnične vene, je<br />
omejen. Pri bolnikih, ki i<strong>maj</strong>o zaporo mrežnične vene s kliničnimi znaki ireverzibilne ishemične okvare<br />
vidne funkcije, zdravljenje ni priporočeno.<br />
4.8 Neželeni učinki<br />
Populacija z zaporo mrežnične vene<br />
Varnost zdravila Lucentis so proučevali v dveh 12-mesečnih preskušanjih (BRAVO in CRUISE). V<br />
preskušanje je bilo vključenih 264 oziroma 261 bolnikov, ki so prejemali ranibizumab in imeli okvaro vida<br />
zaradi makularnega edema, nastalega kot posledica zapore veje centralne mrežnične vene oziroma<br />
zapore centralne mrežnične vene (glejte poglavje 5.1). V preskušanjih BRAVO in CRUISE so o drugih<br />
očesnih neželenih dogodkih in o tistih, ki niso bili vezani na oči, poročali s podobnima pogostnostjo in<br />
izraženostjo, kot so jih opažali v preskušanjih na bolnikih z vlažno obliko SDM.<br />
Posodobljeno tudi poglavje 5.1. Farmakodinamične lastnosti.<br />
NILLAR gastrorezistentne tablete 20 mg in 40 mg, esomeprazol, A02BC05<br />
Dopolnitev poglavij<br />
4.1 Terapevtske indikacije<br />
Preprečevanje ponovne krvavitve peptične razjede, kot nadaljevanje parenteralnega zdravljenja.<br />
4.2 Odmerjanje in način uporabe<br />
4
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
Preprečevanje ponovne krvavitve peptične razjede, kot nadaljevanje parenteralnega zdravljenja:<br />
40 mg enkrat na dan 4 tedne za preprečevanje ponovne krvavitve iz peptičnih razjed, kot nadaljevanje<br />
parenteralnega zdravljenja.<br />
4.3 kontraindikacije<br />
Esomeprazola se, tako kot ostalih zaviralcev protonske črpalke, ne sme jemati sočasno z nelfinavirom.<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Zdravljenje z zaviralci protonske črpalke lahko rahlo poveča tveganje za pojav gastrointestinalnih okužb,<br />
npr. z bakterijama Salmonella in Campylobacter (glejte poglavje 5.1).<br />
Sočasno jemanje esomeprazola z atazanavirjem ni priporočljivo (glej poglavje 4.5). Če se oceni, da je<br />
kombinacija atazanavirja in zaviralca protonske črpalke neizogibna, je priporočljivo skrbno klinično<br />
spremljanje bolnika v kombinaciji z zvišanjem odmerka atazanavirja na 400 mg s 100 mg ritonavirja; pri<br />
čemer naj ne bi presegli odmerka esomeprazola 20 mg.<br />
Esomeprazol je zaviralec encima CYP2C19. Ob uvedbi ali ukinitvi zdravljenja z esomeprazolom je treba<br />
upoštevati možnost medsebojnega delovanja z zdravili, ki jih presnavlja CYP2C19. Opazili so medsebojno<br />
delovanje med klopidogrelom in omeprazolom (glejte poglavje 4.5). Klinični pomen te interakcije ni<br />
znan. Iz varnostnih razlogov sočasno zdravljenje z esomeprazolom in klopidogrelom ni priporočljivo.<br />
4.5 Medsebojno delovanje z drugimi zdravili in druge oblike interakcij<br />
Poročali so o interakciji omeprazola z nekaterimi zaviralci proteaze. Klinični pomen in mehanizmi teh<br />
interakcij niso vedno znani. Povečan želodčni pH med zdravljenjem z omeprazolom lahko spremeni<br />
absorpcijo zaviralcev proteaz. Drugi možni mehanizmi interakcije potekajo preko zaviranja encima<br />
CYP2C19. Za atazanavir in nelfinavir so pri sočasni uporabi z omeprazolom poročali o njuni manjši<br />
serumski koncentraciji, zato sočasna uporaba teh zdravil ni priporočljiva. Sočasno jemanje omeprazola<br />
(40 mg enkrat na dan) in 300 mg atazanavirja /100 mg ritonavirja je pri zdravih prostovoljcih povzročilo<br />
znatno zmanjšanje izpostavljenosti atazanavirju (približno 75-odstotno zmanjšanje vrednosti AUC, Cmax<br />
and Cmin). Povečanje odmerka atazanavirja na 400 mg ni kompenziralo vpliva omeprazola na<br />
izpostavljenost atazanavirju. Sočasno dajanje omeprazola (20 mg enkrat na dan) 400 mg atazanavirja<br />
/100 mg ritonavirja zdravim prostovoljcem je povzročilo približno 30-odstotno zmanjšanje<br />
izpostavljenosti atazanavirju v primerjavi z izpostavljenostjo, ki so jo opazili pri 300 mg atazanavirja /100<br />
mg ritonavirja enkrat na dan brez omeprazola 20 mg enkrat na dan. Sočasna uporaba omeprazola (40<br />
mg enkrat na dan) je zmanjšala srednjo vrednost AUC, Cmax in Cmin nelfinavirja za 36–39 % in srednjo<br />
vrednost AUC, Cmax in Cmin farmakološko aktivnega presnovka M8 za 75-92 %. Za sakvinavir (sočasno z<br />
ritonavirjem) so poročali o zvišanih koncentracijah v serumu (80-100 %) pri sočasnem zdravljenju z<br />
omeprazolom (40 mg enkrat na dan). Zdravljenje z omeprazolom 20 mg enkrat na dan ni vplivalo na<br />
izpostavljenost darunavirju (sočasno z ritonavirjem) in amprenavirju (sočasno z ritonavirjem). Zdravljenje<br />
z esomeprazolom 20 mg enkrat na dan ni vplivalo na izpostavljenost amprenavirju (ob sočasnem<br />
5
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
zdravljenju z ritonaviremm in samostojno). Zdravljenje z omeprazolom 40 mg enkrat na dan ni vplivalo<br />
na izpostavljenost lopinavirju (ob sočasnem zdravljenju z ritonavirjem). Zaradi podobnih<br />
farmakodinamičnih učinkov in farmakokinetičnih lastnosti omeprazola in esomeprazola sočasna uporaba<br />
esomeprazola in atazanavirja ni priporočljiva, sočasna uporaba esomeprazola in nelfinavirja pa je<br />
kontraindicirana.<br />
V navzkrižni klinični študiji so 5 dni uporabljali bodisi klopidogrel sam (polnilni odmerek 300 mg in nato<br />
odmerek 75 mg/dan) bodisi v kombinaciji z omeprazolom (80 mg hkrati s klopidogrelom). Če sta bila<br />
klopidogrel in omeprazol uporabljena skupaj, se je izpostavljenost aktivnemu presnovku klopidogrela<br />
zmanjšala za 46 % (1. dan) oz. 42 % (5. dan). Če sta bila klopidogrel in omeprazol uporabljena skupaj, se<br />
je povprečno zavrtje agregacije trombocitov (IPA) zmanjšalo za 47 % (24 ur) oz. 30 % (5. dan). Druga<br />
študija je pokazala, da uporaba klopidogrela in omeprazola s časovnim presledkom ne prepreči njunega<br />
medsebojnega delovanja, ki je verjetno posledica zavrtja CYP2C19 z omeprazolom. Opazovalne in<br />
klinične študije so dale razhajajoče podatke o kliničnih posledicah tega farmakokinetičnega/<br />
farmakodinam- skega medsebojnega delovanja, kar zadeva večje srčno-žilne dogodke.<br />
4.8 Neželeni učinki<br />
Zelo redko: hipomagneziemija<br />
Dopolnjeno je tudi poglavje 5.1 Farmakodinamične lastnosti.<br />
NutropinAq 10 mg/2 ml (30 i.e.) raztopina za injiciranje, somatropin, H01AC01<br />
Dopolnitev poglavja<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Bolnike s predhodno ugotovljenim tumorjem ali s pomanjkanjem rastnega hormona, ki je posledica<br />
intrakranialne lezije, je treba rutinsko nadzirati glede napredovanja ali ponovitve osnovnega<br />
bolezenskega procesa. Pri osebah, ki so v otroštvu prebolele raka, in so se nato zdravile s somatropinom,<br />
so poročali o večjem tveganju, da zbolijo za drugim tumorjem. Pri bolnikih, ki so se pri prvem tumorju<br />
zdravili z obsevanjem glave, je bil intrakranialni tumor, še posebej meningiom, najpogostejša druga<br />
novotvorba.<br />
Pri sladkornih bolnikih z aktivno proliferativno ali s hudo neproliferativno retinopatijo zdravljenje s<br />
somatropinom ni indicirano.<br />
Pri manjšem številu bolnikov s pomanjkanjem rastnega hormona, ki so se zdravili z rastnim hormonom,<br />
so poročali o pojavu levkemije. Vzročne povezave z zdravljenjem s somatropinom niso ugotovili.<br />
Vnetje trebušne slinavke pri otrocih<br />
Zdravljenje s somatropinom je pri otrocih povezano z večjim tveganjem za razvoj pankreatitisa kot pri<br />
odraslih. Primeri so sicer redki, vendar pa je pri otroku, ki se zdravi s somatropinom, v primeru pojava<br />
bolečine v trebuhu treba pomisliti na vnetje trebušne slinavke.<br />
Tudi dopolnitev poglavja 4.8 Neželeni učinki.<br />
KALETRA (125 mg/50 mg filmsko obložene tablete, 200 mg/50 mg filmsko obložene tablete,<br />
6
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
133,3 mg/33,3 mg mehke kapsule, (80 mg + 20 mg) / ml peroralna raztopina), lopinavir in<br />
ritonavir, J05AE06<br />
Dopolnitev poglavja<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Poročali so o povečanih koncentracijah transaminaz z ali brez povečanja koncentracije bilirubina v<br />
plazmi pri bolnikih, okuženih s HIV, in pri posameznikih, zdravljenih za profilakso, že 7 dni po začetku<br />
terapije z lopinavirjem/ritonavirjem v kombinaciji z drugimi protivirusnimi učinkovinami. V nekaterih<br />
primerih je prišlo do resne disfunkcije jeter.<br />
Pred začetkom terapije z lopinavirjem/ritonavirjem je potrebno ustrezno laboratorijsko testiranje, med<br />
zdravljenjem pa strogo nadzorovanje.<br />
ONDANSETRON Claris 2 mg/ml raztopina za injiciranje ali infundiranje, ondansetron,<br />
A04AA01<br />
Dopolnitev poglavij<br />
4.1 Terapevtske indikacije<br />
Pediatrična populacija:<br />
Ondansetron je indiciran za obvladovanje s kemoterapijo povzročene navzee in bruhanja pri otrocih,<br />
starejših od 6 mesecev ter za preprečevanje in zdravljenje pooperativne navzee in bruhanja pri otrocih,<br />
starejših od 1 meseca.<br />
4.2 Odmerjanje in način uporabe<br />
Močno emetogena kemoterapija:<br />
Bolnikom, ki preje<strong>maj</strong>o močno emetogeno kemoterapijo (na primer velike odmerke cisplatina), se<br />
ondansetron aplicira ali rektalno ali intravensko ali intramuskularno.<br />
Pediatrična populacija:<br />
Navzea in bruhanje zaradi kemoterapije pri otrocih, starejših od 6 mesecev, in mladostnikih<br />
Odmerek za zdravljenje s kemoterapijo povzročene navzee in bruhanja se lahko izračuna na podlagi<br />
telesne površine (TP) ali telesne mase –glejte spodaj. Odmerjanje na podlagi telesne mase dosega višje<br />
dnevne odmerke v primerjavi z odmerjanjem na podlagi TP (glejte poglavji 4. 4 in 5.1).<br />
Zdravilo Ondansetron Claris se lahko razredči v 5% raztopini dekstroze ali 0,9% raztopini natrijevega<br />
klorida oz. v ostalih kompatibilnih infuzijskih raztopinah (glejte poglavje 6.6) ter aplicira z intravensko<br />
infuzijo v trajanju najmanj 15 minut.<br />
Na voljo ni podatkov iz nadzorovanih kliničnih raziskav o uporabi ondansetrona pri preprečevanju<br />
navzee in bruhanja, povzročenih ali podaljšanih zaradi kemoterapije. Na voljo ni podatkov iz kliničnih<br />
raziskav o uporabi ondansetrona pri z radioterapijo povzročeni navzei in bruhanju pri otrocih.<br />
Odmerjanje glede na TP:<br />
Ondansetron je treba aplicirati neposredno pred kemoterapijo v obliki enkratnega intravenskega<br />
odmerka 5 mg/m2 . Intravenski odmerek ne sme preseči 8 mg.<br />
S peroralnim odmerjanjem se lahko prične po dvanajstih urah in se lahko nadaljuje do 5 dni (Preglednica<br />
1)<br />
Preglednica 1: Odmerjanje na podlagi TP pri kemoterapiji – otroci, starejši od 6 mesecev, in mladostniki<br />
Telesna površina 1. dan (a,b) 2. – 6. dan (b)<br />
7
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
10 kg največ 3 odmerki<br />
0,15 mg/kg v 4-urnih<br />
razmikih<br />
2 mg sirupa vsakih 12<br />
ur<br />
4 mg sirupa ali tablete<br />
vsakih 12 ur<br />
a Intravenski odmerek ne sme preseči 8mg.<br />
b Skupni odmerek ne sme preseči odmerka za odrasle 32 mg.<br />
Pediatrična populacija:<br />
Pooperativna slabost in bruhanje pri otrocih, starejših od 1 meseca, in mladostnikih:<br />
Za preprečevanje pooperativne navzee in bruhanja pri otrocih s kirurškim posegom v splošni anesteziji<br />
se enkratni odmerek ondansetrona lahko aplicira v obliki počasne intravenske injekcije (najmanj 30<br />
sekund) v odmerku od 0,1 mg/kg do največ 4 mg pred, ob ali po uvedbi anestezije.<br />
Za zdravljenje pooperativne navzee in bruhanja pri otrocih s kirurškim posegom v splošni anesteziji se<br />
8
Novosti na področju dovoljenj za promet z zdravili - JAZMP, <strong>maj</strong><br />
2011<br />
enkratni odmerek ondansetrona lahko aplicira v obliki počasne intravenske injekcije (najmanj 30 sekund)<br />
v odmerku 0,1 mg/kg do največ 4 mg.<br />
Na voljo ni podatkov o uporabi ondansetrona pri zdravljenju pooperativne navzee in bruhanja pri<br />
otrocih, mlajših od 2 let.<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Pediatrična populacija<br />
Pediatrične bolnike, ki preje<strong>maj</strong>o ondansetron skupaj s hepatotoksičnimi kemoterapevtiki, je potrebno<br />
skrbno spremljati glede motenega delovanja jeter.<br />
Navzea in bruhanje zaradi kemoterapije<br />
Če se odmerki računajo na podlagi telesne mase (mg/kg) in se 3 odmerki aplicirajo v 4-urnih razmikih,<br />
skupni dnevni odmerek presega enkratni odmerek 5 mg/m2 , ki mu sledi en peroralni odmerek. V<br />
kliničnih raziskavah primerjave učinkovitosti teh dveh različnih režimov odmerjanja niso raziskali.<br />
Navzkrižna primerjava raziskav kaže podobno učinkovitost obeh režimov (poglavje 5.1).<br />
4.5 Medsebojno delovanje z drugimi zdravili in druge oblike interakcij<br />
Uporaba ondansetrona sočasno z zdravili, ki podaljšajo interval QT, lahko povzroči dodatno podaljšanje<br />
intervala QT. Sočasna uporaba ondansetrona in kardiotoksičnih zdravil (npr. antraciklinov) lahko poveča<br />
tveganje za aritmije (poglavje 4.4).<br />
4.8 Neželeni učinki<br />
Pediatrična populacija<br />
Profil neželenih učinkov pri otrocih in mladostnikih je primerljiv s profilom pri odraslih.<br />
Tudi dopolnitev poglavij 5.1 Farmakodinamične lastnosti in 5.2 farmakokinetične lastnosti s<br />
podatki za pediatrično populacijo.<br />
9