nov - jazmp
nov - jazmp nov - jazmp
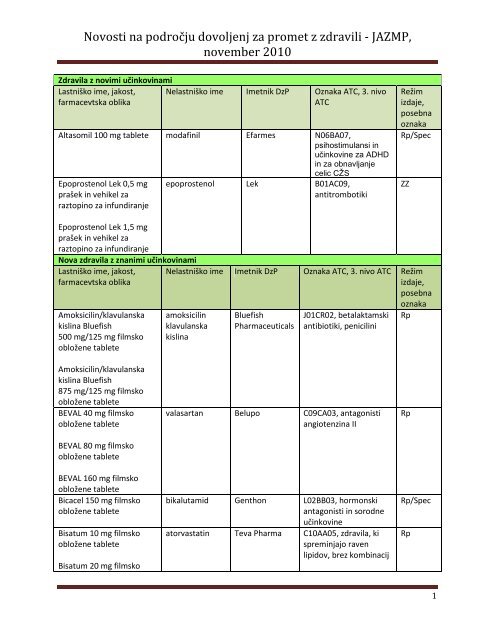
Novosti na področju dovoljenj za promet z zdravili - JAZMP, november 2010 Zdravila z novimi učinkovinami Lastniško ime, jakost, farmacevtska oblika Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Altasomil 100 mg tablete modafinil Efarmes N06BA07, psihostimulansi in učinkovine za ADHD in za obnavljanje celic CŽS Epoprostenol Lek 0,5 mg prašek in vehikel za raztopino za infundiranje epoprostenol Lek B01AC09, antitrombotiki Režim izdaje, posebna oznaka Rp/Spec ZZ Epoprostenol Lek 1,5 mg prašek in vehikel za raztopino za infundiranje Nova zdravila z znanimi učinkovinami Lastniško ime, jakost, farmacevtska oblika Amoksicilin/klavulanska kislina Bluefish 500 mg/125 mg filmsko obložene tablete Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim izdaje, posebna oznaka amoksicilin klavulanska kislina Bluefish Pharmaceuticals J01CR02, betalaktamski antibiotiki, penicilini Rp Amoksicilin/klavulanska kislina Bluefish 875 mg/125 mg filmsko obložene tablete BEVAL 40 mg filmsko obložene tablete BEVAL 80 mg filmsko obložene tablete BEVAL 160 mg filmsko obložene tablete Bicacel 150 mg filmsko obložene tablete Bisatum 10 mg filmsko obložene tablete Bisatum 20 mg filmsko valasartan Belupo C09CA03, antagonisti angiotenzina II bikalutamid Genthon L02BB03, hormonski antagonisti in sorodne učinkovine atorvastatin Teva Pharma C10AA05, zdravila, ki spreminjajo raven lipidov, brez kombinacij Rp Rp/Spec Rp 1
- Page 2 and 3: Novosti na področju dovoljenj za p
- Page 4 and 5: Novosti na področju dovoljenj za p
- Page 6 and 7: Novosti na področju dovoljenj za p
- Page 8 and 9: Novosti na področju dovoljenj za p
- Page 10 and 11: Novosti na področju dovoljenj za p
- Page 12 and 13: Novosti na področju dovoljenj za p
- Page 14 and 15: Novosti na področju dovoljenj za p
- Page 16 and 17: Novosti na področju dovoljenj za p
- Page 18 and 19: Novosti na področju dovoljenj za p
- Page 20 and 21: Novosti na področju dovoljenj za p
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Zdravila z <strong>nov</strong>imi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo<br />
ATC<br />
Altasomil 100 mg tablete modafinil Efarmes N06BA07,<br />
psihostimulansi in<br />
učinkovine za ADHD<br />
in za obnavljanje<br />
celic CŽS<br />
Epoprostenol Lek 0,5 mg<br />
prašek in vehikel za<br />
raztopino za infundiranje<br />
epoprostenol Lek B01AC09,<br />
antitrombotiki<br />
Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
Rp/Spec<br />
ZZ<br />
Epoprostenol Lek 1,5 mg<br />
prašek in vehikel za<br />
raztopino za infundiranje<br />
Nova zdravila z znanimi učinkovinami<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Amoksicilin/klavulanska<br />
kislina Bluefish<br />
500 mg/125 mg filmsko<br />
obložene tablete<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
amoksicilin<br />
klavulanska<br />
kislina<br />
Bluefish<br />
Pharmaceuticals<br />
J01CR02, betalaktamski<br />
antibiotiki, penicilini<br />
Rp<br />
Amoksicilin/klavulanska<br />
kislina Bluefish<br />
875 mg/125 mg filmsko<br />
obložene tablete<br />
BEVAL 40 mg filmsko<br />
obložene tablete<br />
BEVAL 80 mg filmsko<br />
obložene tablete<br />
BEVAL 160 mg filmsko<br />
obložene tablete<br />
Bicacel 150 mg filmsko<br />
obložene tablete<br />
Bisatum 10 mg filmsko<br />
obložene tablete<br />
Bisatum 20 mg filmsko<br />
valasartan Belupo C09CA03, antagonisti<br />
angiotenzina II<br />
bikalutamid Genthon L02BB03, hormonski<br />
antagonisti in sorodne<br />
učinkovine<br />
atorvastatin Teva Pharma C10AA05, zdravila, ki<br />
spreminjajo raven<br />
lipidov, brez kombinacij<br />
Rp<br />
Rp/Spec<br />
Rp<br />
1
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
obložene tablete<br />
Bisatum 40 mg filmsko<br />
obložene tablete<br />
Bisatum 80 mg filmsko<br />
obložene tablete<br />
Bisoprololijev fumarat Lek<br />
1,25 mg filmsko obložene<br />
tablete<br />
Bisoprololijev fumarat Lek<br />
2,5 mg filmsko obložene<br />
tablete<br />
Bisoprololijev fumarat Lek<br />
5 mg filmsko obložene<br />
tablete<br />
Bisoprololijev fumarat Lek<br />
10 mg filmsko obložene<br />
tablete<br />
Donepezilijev klorid Lek<br />
5 mg filmsko obložene<br />
tablete<br />
Donepezilijev klorid Lek<br />
10 mg filmsko obložene<br />
tablete<br />
Espumisan 100 mg/ml<br />
peroralne kapljice,<br />
emulzija<br />
Fluvastatin Pharmathen<br />
80 mg tablete s<br />
podaljšanim sproščanjem<br />
Gemcitabin Kabi 38 mg/ml<br />
prašek za raztopino za<br />
infundiranje<br />
Glukoza Baxter 100 mg/ml<br />
raztopina za infundiranje<br />
Klopidogrel Pentafarma<br />
75 mg filmsko obložene<br />
tablete<br />
Linezolid Teva 600 mg<br />
filmsko obložene tablete<br />
bisoprolol Lek C07AB07, zaviralci<br />
adrenergičnih<br />
receptorjev beta<br />
donepezil Lek N06DA02, zdravila za<br />
zdravljenje demence<br />
silikoni<br />
Berlin-Chemie<br />
(Menarini<br />
Group)<br />
A03AX13, zdravila za<br />
zdravljenje črevesnih<br />
funkcionalnih motenj<br />
fluvastatin Pharmathen C10AA04, zdravila, ki<br />
spreminjajo raven<br />
lipidov, brez kombinacij<br />
gemcitabin<br />
Fresenius Kabi<br />
Oncology<br />
L01BC05, zaviralci<br />
celične pres<strong>nov</strong>e<br />
(antimetaboliti)<br />
ogljikovi hidrati Baxter<br />
(glukoza)<br />
klopidogrel Pentafarma -<br />
Soc. Tecnico-<br />
Medicinal<br />
linezolid Teva Pharma J01XX08, druge<br />
protimikrobne<br />
učinkovine<br />
B05BA03, raztopine za<br />
intravensko uporabo<br />
B01AC04,<br />
antitrombotiki<br />
Rp<br />
Rp<br />
∆<br />
BRp v<br />
lekarnah<br />
Rp<br />
H<br />
ZZ<br />
Rp<br />
H/Rp<br />
2
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Medicinski kisik Messer<br />
100% medicinski plin,<br />
kriogenski<br />
Meroximer 0,088 mg<br />
tablete<br />
Meroximer 0,18 mg<br />
tablete<br />
Meroximer 0,35 mg<br />
tablete<br />
Meroximer 0,7 mg tablete<br />
Meroximer 1,1 mg tablete<br />
Mofetilmikofenolat Arrow<br />
500 mg filmsko obložene<br />
tablete<br />
Montelukast Mylan 10 mg<br />
filmsko obložene tablete<br />
Natrijev risedronat Actavis<br />
5 mg filmsko obložene<br />
tablete<br />
Natrijev risedronat Actavis<br />
30 mg filmsko obložene<br />
tablete<br />
kisik<br />
Messer<br />
Slovenija<br />
V03AN01, druga<br />
nerazvrščena zdravila<br />
(medicinski plini)<br />
pramipeksol Actavis Group N04BC05,<br />
dopaminergiki<br />
mikofenolna<br />
kislina<br />
Arrow<br />
L04AA06,<br />
imunosupresivi<br />
(zaviralci imunske<br />
odzivnosti)<br />
montelukast Generics UK R03DC03, druga<br />
sistemska zdravila za<br />
obstruktivne pljučne<br />
bolezni<br />
risedronska<br />
kislina<br />
Actavis Group<br />
M05BA07, zdravila z<br />
učinkom na strukturo in<br />
mineralizacijo kosti<br />
ZZ<br />
Rp<br />
∆<br />
H/Rp<br />
Rp<br />
Rp<br />
Natrijev risedronat Actavis<br />
35 mg filmsko obložene<br />
tablete<br />
Olanzapin Arrow 5 mg<br />
filmsko obložene tablete<br />
olanzapin Arrow N05AH03, antipsihotiki Rp<br />
∆<br />
Olanzapin Arrow 5 mg<br />
orodisperzibilne tablete<br />
Olanzapin Arrow 10 mg<br />
filmsko obložene tablete<br />
Olanzapin Arrow 10 mg<br />
orodisperzibilne tablete<br />
3
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Olanzapin Arrow 15 mg<br />
filmsko obložene tablete<br />
Olanzapin Arrow 15 mg<br />
orodisperzibilne tablete<br />
Olanzapin Arrow 20 mg<br />
filmsko obložene tablete<br />
Olanzapin Arrow 20 mg<br />
orodisperzibilne tablete<br />
Rabeprazol Lek 10 mg<br />
gastrorezistentne tablete<br />
Rabeprazol Lek 20 mg<br />
gastrorezistentne tablete<br />
Remifentanil Teva 1 mg<br />
prašek za koncentrat za<br />
raztopino za injiciranje ali<br />
infundiranje<br />
rabeprazol Lek A02BC04, zdravila za<br />
zdravljenje peptične<br />
razjede in<br />
gastroezofagealnega<br />
refluksa<br />
remifentanil Teva Pharma N01AH06, splošni<br />
anestetiki<br />
Rp<br />
ZZ<br />
§<br />
Remifentanil Teva 5 mg<br />
prašek za koncentrat za<br />
raztopino za injiciranje ali<br />
infundiranje<br />
Ziprazidon Actavis 20 mg<br />
trde kapsule<br />
ziprazidon Actavis Group N05AE04, antipsihotiki Rp/Spec<br />
∆<br />
Ziprazidon Actavis 40 mg<br />
trde kapsule<br />
Ziprazidon Actavis 60 mg<br />
trde kapsule<br />
Ziprazidon Actavis 80 mg<br />
trde kapsule<br />
Zolmitriptan Actavis<br />
2,5 mg filmsko obložene<br />
tablete<br />
Zolmitriptan Actavis 5 mg<br />
filmsko obložene tablete<br />
Zolpidemijev tartrat Teva<br />
5 mg filmsko obložene<br />
tablete<br />
zolmitriptan Actavis Group N02CC03, zdravila proti<br />
migreni<br />
zolpidem Teva Pharma N05CF02, hipnotiki in<br />
sedativi<br />
Rp<br />
Rp<br />
∆<br />
4
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Zolpidemijev tartrat Teva<br />
10 mg filmsko obložene<br />
tablete<br />
Zdravila v <strong>nov</strong>ih farmacevtskih oblikah<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
CIKLOSPORIN ALKALOID<br />
100 mg/ml peroralna<br />
raztopina<br />
Glypressin 1 mg<br />
raztopina za injiciranje<br />
Nurofen Immedia<br />
200 mg mehke kapsule<br />
Nurofen za otroke z<br />
okusom jagode 40 mg/ml<br />
peroralna suspenzija<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo ATC Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
ciklosporin Alkaloid L04AD01,<br />
imunosupresivi<br />
(zaviralci imunske<br />
odzivnosti)<br />
terlipresin<br />
ibuprofen<br />
Ferring<br />
Arzneimittel<br />
Reckitt<br />
Benckiser<br />
Healthcare<br />
International<br />
H01BA04, hormoni<br />
zadnjega režnja hipofize<br />
M01AE01, nesteroidna<br />
protivnetna in<br />
protirevmatična zdravila<br />
H/Rp<br />
ZZ<br />
BRp v<br />
lekarnah<br />
Nurofen za otroke z<br />
okusom pomaranče<br />
40 mg/ml peroralna<br />
suspenzija<br />
Ospamox 125 mg/5 ml<br />
prašek za peroralno<br />
suspenzijo<br />
Ospamox 250 mg/5 ml<br />
prašek za peroralno<br />
suspenzijo<br />
Ospamox 500 mg/5 ml<br />
prašek za peroralno<br />
suspenzijo<br />
Ospamox 500 mg filmsko<br />
obložene tablete<br />
Ospamox 750 mg filmsko<br />
obložene tablete<br />
Ospamox 1000 mg<br />
filmsko obložene tablete<br />
Zdravila z <strong>nov</strong>imi jakostmi<br />
amoksicilin Lek J01CA04, betalaktamski<br />
antibiotiki, penicilini<br />
Rp<br />
5
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Lastniško ime, jakost,<br />
farmacevtska oblika<br />
Nelastniško ime Imetnik DzP Oznaka ATC, 3. nivo<br />
ATC<br />
/<br />
Nove indikacije in druge pomembnejše spremembe<br />
Lastniško ime, jakost, farmacevtska oblika/nelastniško ime/oznaka ATC<br />
Režim<br />
izdaje,<br />
posebna<br />
oznaka<br />
Menadex 12,5 mg filmsko obložene tablete (samo pakiranje z 10 tabletami), deksketoprofen,<br />
M01AE17<br />
Sprememba režima izdaje iz Rp v BRp v lekarnah.<br />
Sprememba imena zdravila<br />
Perindopril Lek 2 mg (4 mg, 8 mg) tablete v Voxin 2 mg (4 mg, 8 mg) tablete, perindopril, C09AA04<br />
Propicomb 2 mg/0,625 mg tablete in Propicomb 4 mg/1,25 mg tablete v Voxin Combo 2 mg/0,625 mg<br />
tablete in Voxin Combo 4 mg/1,25 mg tablete, perindopril, C09AA04<br />
Sprememba imena zdravila<br />
Picturlop 75 mg filmsko obložene tablete v Klopidogrel IWA 75 mg filmsko obložene tablete,<br />
klopidogrel, B01AC04<br />
Sprememba imena zdravila<br />
Enalatil 5 mg (10 mg, 20 mg) tablete v Enalapril Vitabalans 5 mg tablete, enalapril, C09AA02<br />
Sprememba imena zdravila<br />
Cipralex 10 mg (20 mg) orodisperzibilne tablete v Cipralex MELTZ 10 mg (20 mg) orodisperzibilne<br />
tablete, escitalopram, N06AB10<br />
Sprememba imena zdravila<br />
Actylise 2 mg prašek in vehikel za raztopino za injiciranje ali infundiranje v Actylise CATHFLO 2 mg<br />
prašek in vehikel za raztopino za injiciranje ali infundiranje, alteplaza, B01AD02<br />
Spremembe SmPC kontrastnih sredstev, ki vsebujejo gadolinij<br />
Evropska komisija je v napotitvenem postopku v skladu z 31. členom Direktive 2001/83/ES oz 20.<br />
Členom Uredbe (ES) 726/2004 izdala sklep o spremembi SmPC za kontrastna sredstva, ki vsebujejo<br />
gadolinij. Kontrastna sredstva so glede na stopnjo tveganja za razvoj nefrogene sistemske fibroze (NSF)<br />
razvrščena v tri skupine, SmPC za posamezne skupine so glede na stopnjo tveganja ustrezno<br />
posodobljeni:<br />
• Kontrastna sredstva, ki so povezana z velikim tveganjem (gadoversetamid (Optimark),<br />
gadodiamid (Omniscan), gadopentetna kislina (Magnevist, Magnegita);<br />
• Kontrastna sredstva s srednje velikim tveganjem (gadofosveset (Vasovist), gadoksetna kislina<br />
(Primovist), gadobenska kislina (MultiHance);<br />
• Kontrastna sredstva z majhnim tveganjem (gadoterna kislina (Dotarem), gadoteridol<br />
(ProHance), gadobutrol (Gadovist).<br />
Zaradi boljše preglednosti so dopolnitve SmPC predstavljene za vsako kontrastno sredstvo posebej.<br />
Omniscan 0,5 mmol/ml raztopina za injiciranje, gadodiamid, V08CA03<br />
6
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
4.2 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Novorojenčki do četrtega tedna starosti in dojenčki do enega leta starosti<br />
Zdravilo Omniscan je kontraindicirano pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte poglavje 4.3).<br />
Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se zdravilo Omniscan lahko<br />
uporablja pri teh bolnikih le po skrbni presoji v odmerkih, ki ne presegajo 0,1 mmol/kg telesne mase.<br />
Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih premalo, se<br />
zdravila Omniscan ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
Okvara ledvic<br />
Zdravilo Omniscan je kontraindicirano pri bolnikih s hudo okvaro ledvic (glomerulna filtracija (GFR)<br />
< 30 ml/min/1,73 m 2 ) in pri bolnikih v perioperativnem obdobju presaditve jeter (glejte poglavje 4.3).<br />
Zdravilo Omniscan se lahko uporablja le po skrbni presoji koristi in tveganj pri bolnikih z zmerno okvaro<br />
ledvic (GFR 30 - 59 ml/min/1,73 m 2 ) v odmerkih, ki ne presegajo 0,1 mmol/kg telesne mase (glejte<br />
poglavje 4.4). Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih<br />
premalo, se zdravila Omniscan ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
Starejši (stari 65 in več let)<br />
Prilagajanje odmerkov ni potrebno. Pri starejših bolnikih je potrebna previdnost (glejte poglavje 4.4).<br />
4.3 Kontraindikacije<br />
Preobčutljivost za zdravilno učinkovino gagodiamid ali katerokoli pomožno s<strong>nov</strong> zdravila.<br />
Zdravilo Omniscan je kontraindicirano pri bolnikih s hudo okvaro ledvic (glomerularna filtracija<br />
GFR < 30ml/min/1,73m 2 ), pri bolnikih v perioperativnem obdobju presaditve jeter in pri <strong>nov</strong>orojenčkih<br />
do 4. tedna starosti (glejte poglavje 4.4).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Motnje delovanja ledvic<br />
Pred uporabo zdravila Omniscan je treba pri vseh bolnikih na podlagi laboratorijskih preiskav oceniti<br />
delovanje ledvic.<br />
Poročali so o nefrogeni sistemski fibrozi (NSF), povezani z uporabo zdravila Omniscan in nekaterih drugih<br />
kontrastnih sredstev, ki vsebujejo gadolinij pri bolnikih z akutno ali kronično hudo okvaro ledvic (GFR<br />
< 30 ml/min/1,73 m 2 ). Ker je akutna ledvična odpoved pogosta pri bolnikih po presaditvi jeter, pri teh<br />
bolnikih obstaja določeno tveganje. Zdravila Omniscan se ne sme uporabljati pri bolnikih s hudo okvaro<br />
ledvic, pri bolnikih v perioperativnem obdobju presaditve jeter in pri <strong>nov</strong>orojenčkih (glejte poglavje 4.3).<br />
Tveganje za razvoj NSF pri bolnikih z zmerno okvaro ledvic (GFR 30 – 59 ml/min/1,73 m 2 ) ni znano, zato<br />
je treba pri bolnikih z zmerno okvaro ledvic zdravilo Omniscan uporabljati le po skrbni presoji koristi in<br />
tveganj.<br />
Hemodializa takoj po uporabi zdravila Omniscan je morda koristna pri odstranitvi zdravila Omniscan iz<br />
telesa. Ni dokazov, ki bi podprli uvedbo hemodialize za preprečevanje ali zdravljenje NSF pri bolnikih, ki<br />
se ne zdravijo s hemodializo.<br />
Dojenčki<br />
Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se zdravilo Omniscan lahko<br />
uporablja pri bolnikih v starosti od 6 do 12 mesecev le po skrbni presoji.<br />
Starejši bolniki<br />
Ker je lahko ledvični očistek gadodiamida pri starejših bolnikih slabši, je ocena delovanja ledvic še zlasti<br />
7
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
pomembna pri bolnikih, starih 65 let in več.<br />
4.6 Nosečnost in dojenje<br />
Nosečnost Ni zadostnih podatkov o uporabi gadodiamida pri nosečnicah. Izsledki študij na živalih kažejo<br />
vpliv na sposobnost razmnoževanja pri uporabi ponavljajočih velikih odmerkov (glejte poglavje 5.3).<br />
Zdravila Omniscan se ne sme uporabljati med nosečnostjo, razen če je uporaba {zdravilne učinkovine}<br />
potrebna zaradi kliničnega stanja ženske.<br />
Dojenje<br />
Ni znano, ali se gadodiamid izloča v materino mleko. Razpoložljivi podatki pri živalih kažejo na izločanje<br />
gadodiamida v mleko (za podrobnosti glejte poglavje 5.3). Tveganja za dojenega otroka ne moremo<br />
izključiti. Po aplikaciji zdravila Omniscan je treba dojenje prekiniti za najmanj 24 ur.<br />
4.8 Neželeni učinki<br />
Pri uporabi zdravila Omniscan so poročali o primerih nefrogene sistemske fibroze (NSF) (glejte poglavje<br />
4.4).<br />
4.9 Preveliko odmerjanje<br />
Zdravilo Omniscan se lahko odstrani s hemodializo, vendar pa ni dokazov, da je hemodializa primerna za<br />
preprečevanje nefrogene sistemske fibroze (NSF).<br />
6.6 Posebni varnostni ukrepi za odstranjevanje in ravnanje z zdravilom<br />
Nalepko z viale prilepite na bolnikov karton, da je uporabljeno zdravilo, ki vsebuje gadolinij natančno<br />
zabeleženo. Zabeležiti je treba tudi uporabljeni odmerek zdravila.<br />
Optimark 500 mikromolov/ml raztopina za injiciranje, gadoversetamid, V08CA06<br />
4.2 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Okvarjeno delovanje ledvic<br />
Zdravilo Optimark je kontraindicirano pri bolnikih s hudo ledvično okvaro (stopnja glumeralne filtracije<br />
(GFR) < 30 ml/min/1,73 m2) in pri bolnikih, pri katerih so opravili presaditev jeter ali so v perioperativen<br />
obdobju presaditve jeter (glejte poglavje 4.3). Pri bolnikih z zmerno ledvično okvaro (GFR 30-59<br />
ml/min/1,73 m2) je uporaba zdravila Optimark dovoljena le po skrbni oceni razmerja med tveganjem in<br />
koristmi pri odmerku, ki ne preseže 100 mikromolov/kg telesne mase (glejte poglavje 4.4). Med<br />
slikanjem se ne sme uporabiti več kot en odmerek. Zaradi pomanjkanja podatkov o ponavljajočem<br />
odmerjanju je po<strong>nov</strong>no injiciranje zdravila Optimark dovoljeno šele po poteku časovnega presledka 7<br />
dni.<br />
Novorojenčki, stari manj kot 4 tedne, dojenčki, stari manj kot 1 leto, in otroci<br />
Zdravilo Optimark je kontraindicirano pri <strong>nov</strong>orojenčkih, starih manj kot 4 tedne (glejte poglavje 4.3).<br />
Uporaba zdravila Optimark ni priporočena pri otrocih, mlajših od dveh let, saj varnosti, učinkovitosti in<br />
vpliva na delovanje nerazvitih ledvic pri tej starostni skupini niso raziskovali. Zdravilo Optimark so<br />
preučevali pri otrocih, starih dve leti ali več. Pri tem je bil varnostni profil podoben kot pri odraslih.<br />
Starejši (stari 65 in več let)<br />
Prilagoditev odmerka ni potrebna. Pri starejših bolnikih je potrebna previdnost (glejte poglavje 4.4).<br />
4.3 Kontraindikacije<br />
Zdravilo Optimark je kontraindicirano pri bolnikih s hudo ledvično okvaro (GFR < 30 ml/min/1,73m 2 ), pri<br />
8
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
bolnikih, pri katerih so opravili presaditev jeter ali so v perioperativen obdobju presaditve jeter ter pri<br />
<strong>nov</strong>orojenčkih, starih do 4 tedne (glejte poglavje 4.4).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Okvarjeno delovanje ledvic<br />
Pred apliciranjem zdravila Optimark je treba pri vseh bolnikih z laboratorijskimi preiskavami ugotoviti<br />
morebitno ledvično disfunkcijo. Pri bolnikih s hudo akutno ali kronično ledvično okvaro (GFR < 30<br />
ml/min/1,73m2) so poročali o nefrogeni sistemski fibrozi (NSF), povezani z uporabo zdravila Optimark in<br />
nekaterih kontrastnih sredstev, ki vsebujejo gadolinij. Pri bolnikih, pri katerih so opravili ali opravljajo<br />
presaditev jeter je tveganje še zlasti veliko, saj je v tej skupini incidenca akutne ledvične odpovedi visoka.<br />
Zato se zdravilo Optimark pri bolnikih, pri katerih so opravili ali opravljajo presaditev jeter in pri<br />
<strong>nov</strong>orojenčkih ne sme uporabljati (glejte poglavje 4.3).<br />
Tveganje za nastanek NSF pri bolnikih z zmerno okvaro ledvic (GFR 30-59 ml/min/1,73 m2) ni znano,zato<br />
je treba zdravilo Optimark pri bolnikih z zmerno okvaro ledvic uporabljati le po skrbni analizi koristi in<br />
tveganj.<br />
Gadoversetamid se lahko dializira. Hemodializa kmalu po uporabi zdravila Optimark pri bolnikih, ki so<br />
trenutno na hemodializi, je lahko uporabna pri odstranjevanju zdravila Optimark iz telesa. Ni dokazov, ki<br />
podpirajo uporabo hemodialize za preprečevanje ali zdravljenje NSF pri bolnikih, ki niso na hemodializi.<br />
Otroci<br />
Zdravilo Optimark se ne sme dajati z avtoinjektorjem. Otrokom je treba potrebni odmerek injicirati<br />
ročno, da se tako prepreči nenamerno preveliko odmerjanje.<br />
Novorojenčki in dojenčki<br />
Zdravilo Optimark se ne sme uporabljati pri otrocih, mlajših od dveh let. Varnosti in učinkovitosti v tej<br />
starostni skupini niso raziskovali.<br />
Starejši bolniki<br />
Ker je ledvični očistek gadofosveseta pri starejših lahko slabši, je pregled za ugotavljanje ledvične<br />
disfunkcije še zlasti pomemben pri bolnikih, starih več kot 65 let.<br />
4.6 Nosečnost in dojenje:<br />
Nosečnost<br />
Podatkov o uporabi gadoversetamida pri nosečnicah ni. Študije na živalih ne kažejo na neposredne ali<br />
posredne škodljive vplive na sposobnost razmnoževanja (glejte poglavje 5.3). Zdravila Optimark ne<br />
smete uporabljati med nosečnostjo, razen če klinično stanje nosečnice zahteva uporabo<br />
gadoversetamida.<br />
Dojenje<br />
Ni znano, ali se gadoversetamide izloča v materino mleko. Ni dovolj podatkov o izločanju<br />
gadoversetamida v živalsko mleko. Tveganja za dojenega otroka ne moremo izključiti. Po uporabi<br />
zdravila Optimark je treba prenehati z dojenjem za vsaj 24 ur.<br />
4.8 Neželeni učinki<br />
Z uporabo zdravila Optimark so poročali o primerih nefrogene sistemske fibroze (NSF) (glejte poglavje<br />
4.4).<br />
4.9 Preveliko odmerjanje<br />
Zdravilo Optimark je mogoče odstraniti iz krvi z dializo. Vendar pa ni dokazov, da je hemodializa<br />
primerna za preprečevanje nefrogene sistemske fibroze (NSF).<br />
9
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
6.6 Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko na napolnjenih injekcijskih brizgah/vialah nalepite na kartoteko bolnika, da zagotovite natančno<br />
evidentiranje uporabljenega kontrastnega sredstva z gadolinijem. Zabeležite tudi uporabljeni odmerek.<br />
Magnegita 500 mikromolov/ml raztopina za injiciranje, gadopentetna kislina, V08CA01<br />
Dopolnitev SmPC<br />
4.9 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Novorojenčki do četrtega tedna starosti in dojenčki do enega leta starosti<br />
Zdravilo Magnegita je kontraindicirano pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte poglavje 4.3).<br />
Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se zdravilo Magnegita lahko<br />
uporablja pri teh bolnikih le po skrbni presoji v odmerkih, ki ne presegajo 0,2 ml/kg telesne mase. Med<br />
slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih premalo, se<br />
zdravila Magnegita ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
Otroci v starosti 1-2 let<br />
Pri otrocih, mlajših od 2 let, znaša priporočeni odmerek 0,2 ml/kg telesne mase in ustreza najvišjemu<br />
odmerku.<br />
Da se izognemo nenačrtnemu prevelikemu odmerjanju, ustrezen odmerek kontrastnega sredstva<br />
Magnegita apliciramo ročno in ne apliciramo z avtoinjektorjem.<br />
Prosimo, glejte tudi poglavje 4.4 – Posebna opozorila in previdnostni ukrepi (<strong>nov</strong>orojenčki in otroci).<br />
Starejši (stari 65 in več let) Prilagajanje odmerkov ni potrebno. Pri starejših bolnikih je potrebna<br />
previdnost.<br />
Okvara ledvic<br />
Zdravilo Magnegita je kontraindicirano pri bolnikih s hudo okvaro ledvic (glomerulna filtracija (GFR)<br />
< 30 ml/min/1,73 m 2 ) in pri bolnikih v perioperativnem obdobju presaditve jeter (glejte poglavje 4.3).<br />
Zdravilo Magnegita se lahko uporablja le po skrbni presoji koristi in tveganj pri bolnikih z zmerno okvaro<br />
ledvic (GFR 30 - 59 ml/min/1,73 m 2 ) v odmerkih, ki ne presegajo 0,2 ml/kg telesne mase (glejte poglavje<br />
4.4). Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih premalo,<br />
se zdravila Magnegita ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
4.3 Kontraindikacije<br />
Zdravilo Magnegita je kontraindicirano pri bolnikih s hudo okvaro ledvic (glomerulna filtracija (GFR) < 30<br />
ml/min/1,73 m 2 ), pri bolnikih v perioperativnem obdobju presaditve jeter in pri <strong>nov</strong>orojenčkih do<br />
četrtega tedna starosti (glejte poglavje 4.4).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Okvarjeno delovanje ledvic<br />
Pred uporabo zdravila Magnegita je treba pri vseh bolnikih na podlagi laboratorijskih preiskav<br />
oceniti delovanje ledvic.<br />
Poročali so o nefrogeni sistemski fibrozi (NSF), povezani z uporabo zdravila Magnegita in nekaterih<br />
drugih kontrastnih sredstev, ki vsebujejo gadolinij pri bolnikih z akutno ali kronično hudo okvaro ledvic<br />
10
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
(GFR < 30 ml/min/1,73 m 2 ). Ker je akutna ledvična odpoved pogosta pri bolnikih po presaditvi jeter, pri<br />
teh bolnikih obstaja določeno tveganje. Zdravila Magnegita se ne sme uporabljati pri bolnikih s hudo<br />
okvaro ledvic, pri bolnikih v perioperativnem obdobju presaditve jeter in pri <strong>nov</strong>orojenčkih (glejte<br />
poglavje 4.3).<br />
Tveganje za razvoj NSF pri bolnikih z zmerno okvaro ledvic (GFR 30 – 59 ml/min/1,73 m 2 ) ni znano, zato<br />
je treba pri bolnikih z zmerno okvaro ledvic zdravilo Magnegita uporabljati le po skrbni presoji koristi in<br />
tveganj.<br />
Hemodializa takoj po uporabi zdravila Magnegita je morda koristna pri odstranitvi zdravila Magnegita iz<br />
telesa. Ni dokazov, ki bi podprli uvedbo hemodialize za preprečevanje ali zdravljenje NSF pri bolnikih, ki<br />
se ne zdravijo s hemodializo.<br />
Novorojenčki in otroci<br />
Zdravilo Magnegita je kontraindicirano pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte poglavje<br />
4.3). Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se zdravilo Magnegita<br />
lahko uporablja pri teh bolnikih le po skrbni presoji.<br />
Starejši bolniki<br />
Ker je lahko ledvični očistek dimegluminijevega gadopentetata pri starejših bolnikih slabši, je ocena<br />
delovanja ledvic še zlasti pomembna pri bolnikih, starih 65 let in več.<br />
4.6 Nosečnost in dojenje:<br />
Nosečnost<br />
Ni podatkov o uporabi dimegluminijevega gadopentetata pri nosečnicah.<br />
Izsledki študij na živalih kažejo vpliv na sposobnost razmnoževanja pri uporabi ponavljajočih velikih<br />
odmerkov (glejte poglavje 5.3). Zdravila Magnegita se ne sme uporabljati med nosečnostjo, razen če je<br />
uporaba dimegluminijevega gadopentetata potrebna zaradi kliničnega stanja ženske.<br />
Dojenje<br />
Ni znano, ali se dimegluminijev gadopentetat izloča v materino mleko. Razpoložljivi podatki pri živalih<br />
kažejo na izločanje dimegluminijevega gadopentetata v mleko (za podrobnosti glejte poglavje 5.3).<br />
Tveganja za dojenega otroka ne moremo izključiti. Po aplikaciji zdravila Magnegita je treba dojenje<br />
prekiniti za najmanj 24 ur.<br />
4.8. Neželeni učinki<br />
Pri uporabi zdravila Magnegita so poročali o primerih nefrogene sistemske fibroze (NSF) (glejte poglavje<br />
4.4).<br />
4.9 Preveliko odmerjanje<br />
Zdravilo Magnegita se lahko odstrani s hemodializo.<br />
V primeru zastrupitve zaradi prevelikega odmerka je mogoče kontrastno sredstvo Magnegita odstraniti s<br />
hemodializo, vendar pa ni dokazov, da je hemodializa primerna za preprečevanje nefrogene sistemske<br />
fibroze (NSF).<br />
6.6 Posebni varnostni ukrepi za odstranjevanje<br />
Nalepko, ki je na viali, prilepite na bolnikov karton, da je uporabljeno zdravilo, ki vsebuje gadolinij,<br />
natančno zabeleženo. Zabeležiti je treba tudi uporabljeni odmerek zdravila.<br />
Magnevist 0,5 mmol/ml raztopina za injiciranje, gadopentetna kislina, V08CA01<br />
11
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
4.2 Odmerjanje in način uporabe<br />
Kranialno in spinalno MRS<br />
Novorojenčki, dojenčki in otroci do drugega leta starosti<br />
Praviloma za dobro povečanje kontrasta in kot odgovor na klinična vprašanja zadostuje 0,2 ml<br />
kontrastnega sredstva Magnevist na kg telesne mase.<br />
Kontrastno sredstvo Magnevist je kontraindicirano pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte<br />
poglavje 4.3).<br />
Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se kontrastno sredstvo Magnevist<br />
lahko uporablja pri teh bolnikih le po skrbni presoji v odmerkih, ki ne presegajo 0,2 ml/kg telesne mase.<br />
Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih premalo, se<br />
kontrastnega sredstva Magnevist ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
MRS celega telesa<br />
Novorojenčki, dojenčki in otroci do drugega leta starosti<br />
Kontrastno sredstvo Magnevist je kontraindicirano pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte<br />
poglavje 4.3).<br />
Uporaba kontrastnega sredstva pri otrocih mlajših od dveh let se ne priporoča, ker pri tej skupini<br />
bolnikov ni dovolj izkušenj z MRS celega telesa.<br />
Zaradi nezrelega delovanja ledvic pri dojenčkih do enega leta starosti, se kontrastno sredstvo Magnevist<br />
lahko uporablja pri teh bolnikih le po skrbni presoji v odmerkih, ki ne presegajo 0,2 ml/kg telesne mase.<br />
Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o ponavljajočih odmerkih premalo, se<br />
kontrastnega sredstva Magnevist ne sme po<strong>nov</strong>no aplicirati prej kot po 7 dneh.<br />
Posebne skupine bolnikov<br />
Bolniki z okvaro ledvic<br />
Kontrastno sredstvo Magnevist je kontraindicirano pri bolnikih s hudo okvaro ledvic (glomerulna<br />
filtracija (GFR) < 30 ml/min/1,73 m 2 ) in pri bolnikih v perioperativnem obdobju presaditve jeter (glejte<br />
poglavje 4.3). Kontrastno sredstvo Magnevist se lahko uporablja le po skrbni presoji koristi in tveganj pri<br />
bolnikih z zmerno okvaro ledvic (GFR 30 – 59 ml/min/1,73 m 2 ) v odmerkih, ki ne presegajo 0,2 ml/kg<br />
telesne mase (glejte poglavje 4.4). Med slikanjem se lahko uporabi le en odmerek. Ker je podatkov o<br />
ponavljajočih odmerkih premalo, se kontrastnega sredstva Magnevist ne sme po<strong>nov</strong>no aplicirati prej kot<br />
po 7 dneh.<br />
Starejši (stari 65 let ali več)<br />
Prilagajanje odmerkov ni potrebno. Pri starejših bolnikih je potrebna previdnost (glejte poglavje 4.4).<br />
4.3. Kontraindikacije<br />
Uporaba kontrastnega sredstva Magnevist je kontraindicirana pri bolnikih s hudo okvaro ledvic<br />
(glomerulna filtracija (GFR) < 30 ml/min/1,73 m 2 ), pri bolnikih v perioperativnem obdobju presaditve<br />
jeter in pri <strong>nov</strong>orojenčkih do četrtega tedna starosti (glejte poglavje 4.4).<br />
4.4. Posebna opozorila in previdnostbi ukrepi<br />
Motnje delovanja ledvic<br />
Pred uporabo kontrastnega sredstva Magnevist je treba pri vseh bolnikih na podlagi laboratorijskih<br />
preiskav oceniti delovanje ledvic.<br />
Poročali so o nefrogeni sistemski fibrozi (NSF), povezani z uporabo kontrastnega sredstva Magnevist in<br />
nekaterih drugih kontrastnih sredstev, ki vsebujejo gadolinij pri bolnikih z akutno ali kronično hudo<br />
okvaro ledvic (GFR < 30 ml/min/1,73 m 2 ). Ker je akutna ledvična odpoved pogosta pri bolnikih po<br />
12
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
presaditvi jeter, pri teh bolnikih obstaja določeno tveganje. Kontrastno sredstvo Magnevist se ne sme<br />
uporabljati pri bolnikih s hudo okvaro ledvic, pri bolnikih v perioperativnem obdobju presaditve jeter in<br />
pri <strong>nov</strong>orojenčkih (glejte poglavje 4.3).<br />
Tveganje za razvoj NSF pri bolnikih z zmerno okvaro ledvic (GFR 30 – 59 ml/min/1,73 m 2 ) ni znano, zato<br />
je treba pri bolnikih z zmerno okvaro ledvic kontrastno sredstvo Magnevist uporabljati le po skrbni<br />
presoji koristi in tveganj.<br />
Hemodializa takoj po uporabi kontrastnega sredstva Magnevist je morda koristna pri odstranitvi<br />
kontrastnega sredstva Magnevist iz telesa. Ni dokazov, ki bi podprli uvedbo hemodialize za<br />
preprečevanje ali zdravljenje NSF pri bolnikih, ki se ne zdravijo s hemodializo.<br />
Starejši bolniki<br />
Ker je lahko ledvični očistek gadopentetne kisline pri starejših bolnikih slabši, je ocena delovanja ledvic<br />
še zlasti pomembna pri bolnikih, starih 65 let in več.<br />
4.6. Nosečnost in dojenje<br />
Nosečnost<br />
Ni zadostnih podatkov o uporabi gadopentetne kisline pri nosečnicah. Izsledki študij na živalih kažejo<br />
vpliv na sposobnost razmnoževanja pri uporabi ponavljajočih velikih odmerkov (glejte poglavje 5.3).<br />
Kontrastno sredstvo Magnevist se ne sme uporabljati med nosečnostjo, razen če je uporaba<br />
gadopentetne kisline potrebna zaradi kliničnega stanja ženske.<br />
Dojenje<br />
V materino mleko se izloči majhna količina dimeglumi<strong>nov</strong>e soli gadopentetne kisline (največ 0,04 %<br />
apliciranega odmerka). Tveganja za dojenega otroka ne moremo izključiti. Po aplikaciji kontrastnega<br />
sredstva Magnevist je treba dojenje prekiniti za najmanj 24 ur.<br />
4.8. Neželeni učinki<br />
Po uporabi kontrastnega sredstva Magnevist so poročali o primerih nefrogene sistemske fibroze (NSF)<br />
(glejte poglavje 4.4).<br />
4.9 Preveliko odmerjanje<br />
Kontrastno sredstvo Magnevist se lahko odstrani s hemodializo, vendar pa ni dokazov, da je hemodializa<br />
primerna za preprečevanje nefrogene sistemske fibroze (NSF).<br />
6.6. Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko za sledljivost, ki je na vialah/brizgah/steklenicah, prilepite v bolnikovo kartoteko, da je uporaba<br />
kontrastnega sredstva z gadolinijem natančno zabeležena. Zabeležiti je treba tudi uporabljen odmerek.<br />
Vasovist 0,25 mmol/ml raztopina za injiciranje, gadofosveset, V08CA11<br />
4.2 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Okvara ledvic<br />
Uporabi kontrastnega sredstva Vasovist se je treba izogniti pri bolnikih s hudo ledvično okvaro (hitrost<br />
glomerularne filtracije - GFR < 30 ml/min/1,73m2) in pri bolnikih v obdobju pred presaditvijo jeter, razen<br />
če je diagnostična informacija bistvenega pomena in je ni mogoče pridobiti z nekontrastnim<br />
13
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
magnetnoresonančnim slikanjem (MRI) (glejte poglavje 4.4). Če se uporabi kontrastnega sredstva<br />
Vasovist ni mogoče izogniti, odmerek ne sme preseči 0,03 mmol/kg telesne mase. Med slikanjem se ne<br />
sme uporabiti več kot en odmerek. Zaradi pomanjkanja podatkov o ponavljajočem odmerjanju je<br />
po<strong>nov</strong>no dajanje injekcij kontrastnega sredstva Vasovist dovoljeno šele po poteku časovnega presledka<br />
7 dni.<br />
Pediatrični bolniki<br />
Novorojenčki, dojenčki, otroci in mladostniki:<br />
Uporaba ni priporočena pri <strong>nov</strong>orojenčkih, dojenčkih, otrocih in mladostnikih. Za bolnike, mlajše od 18<br />
let, še ni kliničnih izkušenj.<br />
Starejši bolniki (stari 65 in več let)<br />
Prilagoditev odmerka ni potrebna. Pri starejših bolnikih je potrebna previdnost (glejte poglavje 4.4).<br />
4.4. Posebna opozorila in previdnostni ukrepi<br />
Okvara ledvic<br />
Gadofosveset se iz telesa izloči predvsem v urinu, zato je treba biti pri bolnikih z okvarjenim delovanjem<br />
ledvic previden (glejte poglavji 4.2 in 5.2).<br />
Pred apliciranjem kontrastnega sredstva Vasovist je priporočljivo, da se pri vseh bolnikih<br />
opravijo laboratorijski testi, da se ugotovi delovanje ledvic.<br />
Poročali so o nefrogeni sistemski fibrozi (NSF), povezani z uporabo nekaterih kontrastnih sredstev, ki<br />
vsebujejo gadolinij, pri bolnikih z akutno ali kronično hudo ledvično okvaro (hitrost glomerulne filtracije<br />
(GRF < 30 ml/min/1,73m). Pri bolnikih, pri katerih opravljajo presaditev jeter, je tveganje še posebej<br />
visoko, saj je v tej skupini incidenca akutne ledvične odpovedi visoka. Ker obstaja možnost, da se NSF<br />
pojavi pri uporabi kontrastnega sredstva Vasovist, se mu je treba izogniti pri bolnikih s hudo ledvično<br />
okvaro in pri bolnikih v obdobju pred presaditvijo jeter, razen če je diagnostična informacija bistvenega<br />
pomena in je ni mogoče pridobiti z nekontrastnim magnetnoresonančnim slikanjem.<br />
Hemodializa takoj po uporabi kontrastnega sredstva Vasovist je morda koristna pri odstranitvi<br />
kontrastnega sredstva Vasovist iz telesa. Ni znakov, ki bi podprli uvedbo hemodialize za preprečevanje<br />
ali zdravljenje NSF pri bolnikih, ki še niso na hemodializi.<br />
Starejši bolniki<br />
Ker je lahko pri starejših bolnikih ledvični očistek gadofosveseta slabši, še treba še zlasti pri starejših od<br />
65 let opraviti presejalni test za okvarjeno delovanje ledvic.<br />
Pri bolnikih zdravljenih s hemodializo je lahko hemodializa izvedena kmalu po uporabi kontrastnega<br />
sredstva Vasovist koristna za njegovo odstranitev iz telesa. V kliničnih preskušanjih so pokazali, da se<br />
lahko gadofosveset učinkovito odstrani iz telesa z dializo, pri kateri se uporabijo visokopretočni filtri. Ni<br />
dokazov, ki bi podpirali uvedbo hemodialize za preprečevanje ali zdravljenje NSF pri bolnikih, ki se še ne<br />
zdravijo s hemodializo.<br />
4.6 Plodnost, nosečnost in dojenje<br />
Nosečnost<br />
Ni zadostnih podatkov o uporabi kontrastnega sredstva Vasovist pri nosečnicah. Študije na živalih so<br />
pokazale vpliv na sposobnost razmnoževanja pri ponavljajočih se visokih odmerkih (glejte poglavje 5.3).<br />
Kontrastnega sredstva Vasovist ne smete uporabljati pri nosečnicah, razen če klinično stanje nosečnice<br />
zahteva uporabo kontrastnega sredstva.<br />
Dojenje<br />
Gadolinij vsebuje kontrastno sredstvo, ki se v mleko izloča v zelo majhnih količinah (glejte poglavje 5.3).<br />
14
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Pri kliničnih odmerkih se učinek na dojenčka ne pričakuje zaradi majhne količine, ki se izloča v mleko, in<br />
slabe absorpcije iz črevesja. Nadaljevanje dojenja ali prekinitev uporabe kontrastnega sredstva Vasovist<br />
za obdobje 24 ur po uporabi je v presoji zdravnika in doječe matere.<br />
4.8 Neželeni učinki<br />
Pri uporabi drugih kontrastnih sredstev, ki vsebujejo gadolinij, so poročali o primerih nefrogene<br />
sistemske fibroze (NSF) (glejte poglavje 4.4).<br />
4.9 Preveliko odmerjanje<br />
Kontrastno sredstvo Vasovist se lahko odstrani s hemodializo. Vendar pa ni dokazov, da je hemodializa<br />
primerna za preprečevanje nefrogene sistemske fibroze (NSF).<br />
6.6 Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko nalepite na kartoteko bolnika, da zagotovite natančno evidentiranje uporabljenega<br />
kontrastnega sredstva z gadolinijem. Zabeležiti je treba tudi uporabljeni odmerek zdravila.<br />
MultiHance 0,5 mmol/ml raztopina za injiciranje, gadobenska kislina, V08CA08<br />
4.2 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Zdravila MultiHance se ne sme uporabiti pri bolnikih s hudo okvarjenim delovanjem ledvic<br />
(GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Hemodializa, neposredno po dajanju zdravila MultiHance, je morda koristna za odstranjevanje zdravila<br />
MultiHance iz telesa. Ni dokazov, ki bi podprli uporabo hemodialize za preprečitev ali zdravljenje NSF pri<br />
bolnikih, ki se ne zdravijo s hemodializo.<br />
Starostniki<br />
Ker je lahko pri starostnikih ledvični očistek dimegluminijevega gadobenata zmanjšan, je še posebej<br />
pomembno, da se pri bolnikih, starejših od 65 let, preveri delovanje ledvic.<br />
4.6 Nosečnost in dojenje<br />
Nosečnost<br />
Podatkov o uporabi dimegluminijevega gadobenata pri nosečnicah ni. Študije na živalih so pokazale<br />
toksične učinke na sposobnost razmnoževanja pri večkratnih velikih odmerkih (glejte poglavje 5.3).<br />
Zdravila MultiHance se ne sme uporabljati med nosečnostjo, razen če je zaradi kliničnega stanja<br />
nosečnice uporaba dimegluminijevega gadobenata potrebna.<br />
Dojenje<br />
Kontrastna sredstva, ki vsebujejo gadolinij, se izločajo v materino mleko v zelo majhnih količinah (glejte<br />
poglavje 5.3). V kliničnih odmerkih se ne pričakuje učinkov na dojenčka zaradi majhne količine, ki se<br />
izloči v mleku ter majhne absorpcije iz prebavil. Zdravnik in mati, ki doji, se odločita o nadaljevanju ali<br />
prekinitvi dojenja za 24 ur po uporabi zdravila Multihance.<br />
4.8 Neželeni učinki<br />
Po uporabi zdravila MultiHance so poročali o posameznih primerih nefrogene sistemske fibroze (NSF) pri<br />
bolnikih, ki so sočasno prejeli druga kontrastna sredstva, ki vsebujejo gadolinij (glejte poglavje 4.4).<br />
4.9 Preveliko odmerjanje<br />
Zdravilo MultiHance se lahko odstrani s hemodializo. Vendar ni dokazov, da je hemodializa primerna za<br />
preprečevanje nefrogene sistemske fibroze (NSF).<br />
6.6 Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko za sledljivost, ki je na viali, prilepite v bolnikovo kartoteko, da je uporaba kontrastnega sredstva<br />
z gadolinijem natančno zabeležena. Zabeležiti je treba tudi uporabljen odmerek.<br />
Primovist 0,25 mmol/ml raztopina za injiciranje, gadoksetna kislina, V08CA10<br />
4.2 Odmerjanje in način uporabe<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Kontrastno sredstvo Primovist se ne sme uporabiti pri bolnikih s hudo okvarjenim delovanjem ledvic<br />
(GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
4.4. Posebna opozorila in previdnostni ukrepi<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Pred uporabo kontrastnega sredstva Primovist je priporočljivo pri vseh bolnikih preveriti delovanje<br />
ledvic z laboratorijskimi preiskavami.<br />
Pri bolnikih z akutno ali hudo kronično okvaro delovanja ledvic (GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
Gadovist 1,0 mmol/ml raztopina za injiciranje, gadobutrol, V08CA09<br />
4.2 Odmerjanje in način uporabe<br />
Posebne skupine bolnikov<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Kontrastno sredstvo Gadovist se lahko uporablja pri bolnikih s hudo okvarjenim delovanjem<br />
(GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
sposobnost razmnoževanja pri večkratnih velikih odmerkih (glejte poglavje 5.3). Kontrastno sredstvo<br />
Gadovist se ne sme uporabljati med nosečnostjo, razen če je zaradi kliničnega stanja nosečnice uporaba<br />
gadobutrola potrebna.<br />
Dojenje<br />
Kontrastna sredstva, ki vsebujejo gadolinij, se izločajo v materino mleko v zelo majhnih količinah (glejte<br />
poglavje 5.3). V kliničnih odmerkih se ne pričakuje učinkov na dojenčka zaradi majhne količine, ki se<br />
izloči v mleku ter majhne absorpcije iz prebavil. Zdravnik in mati, ki doji, se odločita o nadaljevanju ali<br />
prekinitvi dojenja za 24 ur po uporabi kontrastnega sredstva Gadovist.<br />
4.8 Neželeni učinki<br />
Po uporabi kontrastnega sredstva Gadovist so poročali o posameznih primerih nefrogene sistemske<br />
fibroze (NSF) večinoma pri bolnikih, ki so sočasno prejeli druga kontrastna sredstva, ki vsebujejo<br />
gadolinij (glejte poglavje 4.4).<br />
4.9 Preveliko odmerjanje<br />
Pri prevelikem odmerjanju pri bolnikih z motnjami delovanja ledvic, se lahko kontrastno sredstvo<br />
Gadovist odstrani iz telesa hemodializo. Po treh hemodializah se iz telesa odstrani približno 98 %<br />
učinkovine. Vendar ni dokazov, da je hemodializa primerna za preprečevanje nefrogene sistemske<br />
fibroze (NSF).<br />
6.6. Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko za sledljivost, ki je na brizgah, prilepite v bolnikovo kartoteko, da je uporaba kontrastnega<br />
sredstva z gadolinijem natančno zabeležena. Zabeležiti je treba tudi uporabljen odmerek.<br />
Dotarem 0,5 mmol/ml raztopina za injiciranje, gadoterna kislina, V08CA02<br />
4.2 Odmerjanje in način uporabe<br />
Priporočeni odmerek je 0,1 mmol/kg, to je 0,2 ml/kg telesne mase, pri odraslih, otrocih in dojenčkih.<br />
Pri angiografiji lahko v odvisnosti od izvida opravljene preiskave bolniku date tudi drugo injekcijo<br />
0,1 mmol/kg, to je 0,2 ml/kg telesne mase, v času iste preiskave, če je potrebno.V izjemnih okoliščinah,<br />
kot je potrditev solitarne narave metastaze ali ugotavljanje leptomeningealnih tumorjev, lahko date tudi<br />
drugo injekcijo 0,2 mmol/kg, to je 0,4 ml/kg telesne mase.<br />
Posebne skupine bolnikov<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Kontrastno sredstvo Dotarem se lahko uporablja pri bolnikih s hudo okvarjenim delovanjem<br />
(GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
podatkov o večkratni uporabi se odmerjanja kontrastnega sredstva Dotarem ne sme ponavljati, razen če<br />
je presledek med odmerkoma vsaj 7 dni.<br />
Kontrastno sredstvo Dotarem ni priporočljivo za angiografijo pri otrocih starih manj kot 18 let zaradi<br />
nezadostnih podatkov o učinkovitosti in varnosti pri tej indikaciji.<br />
Starostniki (stari 65 let ali več)<br />
Prilagajanje odmerka ni potrebno. Pri starostnikih je potrebna previdnost (glejte poglavje 4.4).<br />
4.4 Posebna opozorila in previdnostni ukrepi<br />
Bolniki z okvarjenim delovanjem ledvic<br />
Pred uporabo kontrastnega sredstva Dotarem je priporočljivo pri vseh bolnikih preveriti delovanje<br />
ledvic z laboratorijskimi preiskavami.<br />
Pri bolnikih s hudo akutno ali hudo kronično okvaro delovanja ledvic (GFR
Novosti na področju dovoljenj za promet z zdravili - JAZMP,<br />
<strong>nov</strong>ember 2010<br />
fibroze (NSF) večinoma pri bolnikih, ki so sočasno prejeli druga kontrastna sredstva, ki vsebujejo<br />
gadolinij (glejte poglavje 4.4).<br />
4.9 Preveliko odmerjanje<br />
Kontrastno sredstvo Dotarem se lahko odstrani s hemodializo. Vendar ni dokazov, da je hemodializa<br />
primerna za preprečevanje nefrogene sistemske fibroze (NSF).<br />
6.6. Posebni varnostni ukrepi za odstanjevanje in ravnanje s kontrastnim sredstvom<br />
Nalepko za sledljivost, ki je na vialah, prilepite v bolnikovo kartoteko, da je uporaba kontrastnega<br />
sredstva z gadolinijem natančno zabeležena. Zabeležiti je treba tudi uporabljen odmerek.<br />
21