â¹Ã§indekiler - Anadolu Ãniversitesi
â¹Ã§indekiler - Anadolu Ãniversitesi â¹Ã§indekiler - Anadolu Ãniversitesi
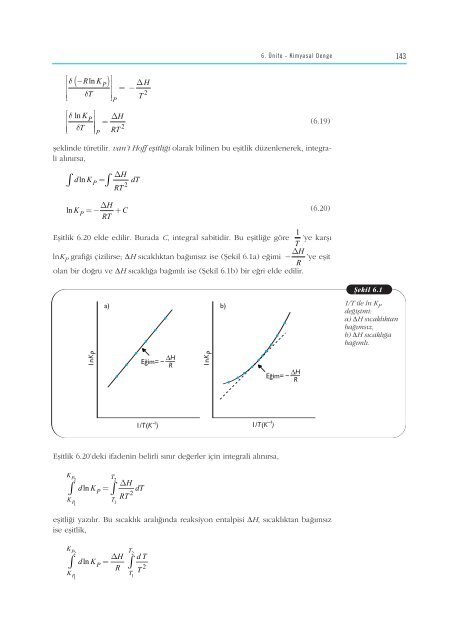
6. Ünite - Kimyasal Denge 143 ( ) ⎡ δ −Rln K ⎤ P ∆H =− δ ⎣⎢ T 2 ⎦⎥ T P ⎡ δ ln K ⎤ P ∆H ⎣⎢ δT = 2 ⎥⎦ P RT (6.19) fleklinde türetilir. van’t Hoff eflitli¤i olarak bilinen bu eflitlik düzenlenerek, integrali al›n›rsa, ∫ H dln KP = ∫ ∆ 2 RT dT ∆H ln KP =− + C RT (6.20) Eflitlik 6.20 elde edilir. Burada C, integral sabitidir. Bu eflitli¤e göre ’ye karfl› lnK P grafi¤i çizilirse; ∆H s›cakl›ktan ba¤›ms›z ise (fiekil 6.1a) e¤imi − ∆H ’ye eflit R olan bir do¤ru ve ∆H s›cakl›¤a ba¤›ml› ise (fiekil 6.1b) bir e¤ri elde edilir. 1 T fiekil 6.1 1/T ile ln K P de¤iflimi: a) ∆H s›cakl›ktan ba¤›ms›z, b) ∆H s›cakl›¤a ba¤›ml›. ı ı Eflitlik 6.20’deki ifadenin belirli s›n›r de¤erler için integrali al›n›rsa, KP 2 ∫ K P 1 eflitli¤i yaz›l›r. Bu s›cakl›k aral›¤›nda reaksiyon entalpisi ∆H, s›cakl›ktan ba¤›ms›z ise eflitlik, KP 2 ∫ K P1 T2 ∆H dln KP = ∫ dT 2 T RT T2 ∆ H dT dln KP = R ∫ 2 T 1 T1
144 Fizikokimya fleklinde yaz›l›p integrali al›n›rsa, KP ln KP 2 1 = ∆H R ⎛T2− T ⎞ ⎜ 1 ⎝⎜ T1 T2 ⎠⎟ (6.21) eflitli¤i elde edilir. Böylece farkl› iki s›cakl›ktaki denge sabitlerinden reaksiyon entalpisi hesaplanabilir. Benzer flekilde reaktantlar›n ve ürünlerin toplam mol say›lar›n›n ayn›, yani ∆n=0 oldu¤u durumda mol kesirlerine ba¤l› denge sabiti için de Eflitlik 6.19, ⎡ dln K ⎤ x ⎣⎢ dT ⎦⎥ P H = ∆ 2 RT (6.22) fleklinde yaz›labilir. ÖRNEK 6.10: Br 2 (g) ⇋ 2Br(g) reaksiyonun 2500 K ve 3000 K için denge sabiti de¤erleri s›ras›yla 57,9 ve 300 ise, bu reaksiyonun 2700 K’deki denge sabitini, serbest enerji de¤iflimini, entalpi de¤iflimini (s›cakl›ktan ba¤›ms›z oldu¤unu varsayarak) ve entropi de¤iflimini hesaplay›n›z. Çözüm: Entalpi de¤ifliminin s›cakl›ktan ba¤›ms›z oldu¤unu varsayarak bilinenler, KP ln KP 2 1 = ∆H R ⎛T2− T ⎞ 1 ⎝⎜ T1 T2 ⎠⎟ ifadesinde yerine yaz›l›rsa, 300 ∆H ⎛3000 K − 2500 K⎞ ln = 57, 9 − − 8314 , J K 1 mol 1 ⎝⎜ 2500 K × 3000 K ⎠⎟ ∆H = 205156 J mol −1 bulunur. 2700 K’deki denge sabiti, K ln 2 57, 9 = 205156 J ⎛2700 K − 2500 K ⎞ −1 −1 8,314 J K mol ⎝⎜ 2500 K× 2700 K ⎠⎟ ⇒ K 2700 = 120, 3 olarak hesaplan›r. ∆G° ve ∆S°, ∆G =−RTln K −1 −1 − ∆G =− 8, 314 J K mol × 2700 K× ln 120, 3⇒ ∆G 1 =−107524, 7 J mol
- Page 100 and 101: 94 Fizikokimya olarak yaz›l›r.
- Page 102 and 103: 96 Fizikokimya Çizelgelerde verile
- Page 104 and 105: 98 Fizikokimya ÖRNEK 4.8: C 10 H 1
- Page 106 and 107: 100 Fizikokimya s›ras›ndaki sta
- Page 108 and 109: 102 Fizikokimya ÖRNEK 4.11: CaCl 2
- Page 110 and 111: 4. Ünite - Termokimya 103 iyonlar
- Page 112 and 113: 4. Ünite - Termokimya 105 Kendimiz
- Page 114 and 115: 4. Ünite - Termokimya 107 Yararlan
- Page 116 and 117: Serbest Enerji G‹R‹fi Ünite 2
- Page 118 and 119: 5. Ünite - Serbest Enerji Sabit ba
- Page 120 and 121: 5. Ünite - Serbest Enerji 113 PV
- Page 122 and 123: 5. Ünite - Serbest Enerji 115 Efli
- Page 124 and 125: 5. Ünite - Serbest Enerji 117 ⎛
- Page 126 and 127: 5. Ünite - Serbest Enerji 119 ‹d
- Page 128 and 129: 1 mol gerçek gaz için, ( Gm ) 2 P
- Page 130 and 131: 5. Ünite - Serbest Enerji 123 273
- Page 132 and 133: 5. Ünite - Serbest Enerji 125 Öze
- Page 134 and 135: 5. Ünite - Serbest Enerji 127 Kend
- Page 137 and 138: 6F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 139 and 140: 132 Fizikokimya ÖRNEK 6.1: H 2 (g)
- Page 141 and 142: 134 Fizikokimya Dengedeki bir siste
- Page 143 and 144: 136 Fizikokimya Çözüm: Verilenle
- Page 145 and 146: 138 Fizikokimya Deriflime ba¤l›
- Page 147 and 148: 140 Fizikokimya ÖRNEK 6.8: F 2 (g)
- Page 149: 142 Fizikokimya x N2 + x H2 = 1 - x
- Page 153 and 154: 146 Fizikokimya ∆H = nC p dT efli
- Page 155 and 156: 148 Fizikokimya eflitli¤i elde edi
- Page 157 and 158: 150 Fizikokimya Özet Dengedeki bir
- Page 159 and 160: 152 Fizikokimya Kendimizi S›nayal
- Page 161 and 162: 154 Fizikokimya S›ra Sizde 5 K p
- Page 163 and 164: 7F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 165 and 166: 158 Fizikokimya Gazlar kar›flt›
- Page 167 and 168: 160 Fizikokimya ⎛ ∆G Karışma
- Page 169 and 170: 162 Fizikokimya fiekil 7.2 ‹deal
- Page 171 and 172: 164 Fizikokimya G m,A (s) = G m,A (
- Page 173 and 174: 166 Fizikokimya fiekil 7.4 ‹deal
- Page 175 and 176: 168 Fizikokimya x N 2 xO 2 PN 0, 78
- Page 177 and 178: 170 Fizikokimya V = nAVA + nBVB for
- Page 179 and 180: 172 Fizikokimya fleklinde yaz›lab
- Page 181 and 182: 174 Fizikokimya fiekil 7.8 Saf s›
- Page 183 and 184: 176 Fizikokimya olur. x B =0 için
- Page 185 and 186: 178 Fizikokimya SIRA S‹ZDE DÜfi
- Page 187 and 188: 180 Fizikokimya ÖRNEK 7.12: Bir ar
- Page 189 and 190: 182 Fizikokimya Kendimizi S›nayal
- Page 191 and 192: 184 Fizikokimya S›ra Sizde 2 ‹d
- Page 193 and 194: 8F‹Z‹KOK‹MYA Amaçlar›m›z
- Page 195 and 196: 188 Fizikokimya n a A (P,T ) = nb A
- Page 197 and 198: 190 Fizikokimya fiekil 8.1 Suyun fa
- Page 199 and 200: 192 Fizikokimya fiimdi birbiriyle a
6. Ünite - Kimyasal Denge<br />
143<br />
( )<br />
⎡<br />
δ −Rln<br />
K ⎤<br />
P<br />
∆H<br />
=−<br />
δ<br />
⎣⎢<br />
T<br />
2<br />
⎦⎥<br />
T<br />
P<br />
⎡<br />
δ ln K ⎤<br />
P<br />
∆H<br />
⎣⎢<br />
δT<br />
=<br />
2<br />
⎥⎦<br />
P RT<br />
(6.19)<br />
fleklinde türetilir. van’t Hoff eflitli¤i olarak bilinen bu eflitlik düzenlenerek, integrali<br />
al›n›rsa,<br />
∫<br />
H<br />
dln<br />
KP<br />
= ∫ ∆<br />
2<br />
RT<br />
dT<br />
∆H<br />
ln KP<br />
=− + C<br />
RT<br />
(6.20)<br />
Eflitlik 6.20 elde edilir. Burada C, integral sabitidir. Bu eflitli¤e göre<br />
’ye karfl›<br />
lnK P grafi¤i çizilirse; ∆H s›cakl›ktan ba¤›ms›z ise (fiekil 6.1a) e¤imi − ∆H ’ye eflit<br />
R<br />
olan bir do¤ru ve ∆H s›cakl›¤a ba¤›ml› ise (fiekil 6.1b) bir e¤ri elde edilir.<br />
1<br />
T<br />
fiekil 6.1<br />
1/T ile ln K P<br />
de¤iflimi:<br />
a) ∆H s›cakl›ktan<br />
ba¤›ms›z,<br />
b) ∆H s›cakl›¤a<br />
ba¤›ml›.<br />
ı<br />
ı<br />
Eflitlik 6.20’deki ifadenin belirli s›n›r de¤erler için integrali al›n›rsa,<br />
KP<br />
2<br />
∫<br />
K P<br />
1<br />
eflitli¤i yaz›l›r. Bu s›cakl›k aral›¤›nda reaksiyon entalpisi ∆H, s›cakl›ktan ba¤›ms›z<br />
ise eflitlik,<br />
KP<br />
2<br />
∫<br />
K P1<br />
T2<br />
∆H<br />
dln<br />
KP<br />
= ∫ dT<br />
2<br />
T RT<br />
T2<br />
∆ H dT<br />
dln KP<br />
=<br />
R<br />
∫ 2<br />
T<br />
1<br />
T1