Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Sluttenta</strong>men <strong>Bke2</strong> 26:e oktober <strong>2000</strong> 09 00 - 16 00 .<br />
Max poäng =78p. Gräns för godkänd = 42p (54%).<br />
Svara på varje fråga på separat papper!<br />
Ange tydligt frågans nummer längst upp på sidan!<br />
Glöm inte att ange din skrivningskod på varje papper!<br />
Glöm inte att skriva ner och spara din kod!<br />
Kod<br />
Fråga nr<br />
Lycka till!<br />
1. a) Markera polära och icke-polära delar i nedanstående molekyl. Vilken typ av ämne<br />
är det, och vad heter molekylen (2p)<br />
COO-<br />
+H 3 N C H<br />
CH 2<br />
CH 2<br />
CH 2<br />
NH<br />
C NH 2 +<br />
NH 2<br />
CH 3<br />
b) Arrangera molekylerna nedan så att de vätebinder med maximalt antal<br />
vätebindningar. Ange också avståndet mellan donor och acceptoratom i en typisk<br />
vätebinding. Vätebinding mellan bl.a. de här två molekylerna är grundläggande för<br />
hur en mycket viktig biomolekyl fungerar. Vilken molekyl, och varför (2p)<br />
HN<br />
N<br />
R<br />
R<br />
Svar:<br />
a) Amino, karboxyl och guanidiniumgrupperna är polära, kolkedjan är apolär (1p).<br />
Aminosyra (0.5p), arginin (0.5p).<br />
b) -NH 2 …O=, N…HN- (0.5p). Ca 3.1 Å (2.7 - 3.2Å) (0.5p). DNA (0.5p); håller ihop<br />
dubbelspiralens komplementära strängar genom basparning (här A - T) (0.5p).
2. Utan biologiska membran skulle inget liv kunna existera. Beskriv med en enkel skiss<br />
den kemiska strukturen av membranlipider, och uppbyggnaden av ett biologiskt<br />
membran. På vilket sätt fungerar biologiska membran annorlunda än icke-biologiska<br />
(t.ex. dialysmembran) Ge två exempel på energialstrande processer där biologiska<br />
membran är av central betydelse. (2p)<br />
Svar:<br />
Enkel figur glycerol-(R1,R2,polär grupp) där R = fettsyra (0.5p). Membranfigur,<br />
dubbellager, hydrofobt in, hydrofilt ut, proteiner (0.5p). Biologiska membran<br />
innehåller proteiner som sköter om aktiv transport av olika substanser över<br />
membranet (0.5p). Oxidativ fosforylering, fotosyntesens ljusreaktioner (0.5p).<br />
3. Aminosyrorna G och P är vanliga i beta-böjar.<br />
a) skriv de fullständiga namnen på G och P (0.5p)<br />
b) förklara vilka egenskaper var och en av dessa två aminosyror har som gör att de<br />
ofta förekommer i sådana böjar (1p)<br />
c) En av ovanstående aminosyror återfinns endast sällan i alfahelixstruktur. Vilken<br />
Beskriv alfahelixstrukturen och förklara varför. (1.5p)<br />
d) Rita tripeptiden G-P-X där X är en valfri (men ej G eller P!) aminosyra, vid pH 7.<br />
Markera peptidbindningar och bindingar i huvudkedjan som kan roteras fritt. Ange<br />
peptidens laddning vid pH 7 (3p). (6p totalt frågan)<br />
Svar:<br />
a) Glycin (0.25p), Prolin (0.25p).<br />
b) Glycin saknar sidokedja och phi & psi-vinklarna kan därför anta i stort sett vilka<br />
värden som helst è huvudkedjan kan böjas kraftigt (0.5p). Hos prolin binder<br />
sidokedjan tillbaks till huvudkedjan och gör därmed en ”knix” på denna (0.5p).<br />
c) Prolin (0.25p). Alfahelix är en högervriden spiral med 3.6 aminosyror/varv (0.25).<br />
Stabiliseras av vätebindingar mellan C=O på aminosyra n och NH på aminosyra n+4<br />
(0.5). Prolin saknar väte på peptidkvävet som därför inte kan delta i vätebinding.<br />
(0.5p)<br />
d) Figuren bör innehålla korrekt laddade terminaler (0.25p), sidokedjor (3 x 0.5p),<br />
huvudkedja (0.25p), peptidbinding (0.25p), och phi-, psi- vinklar (2 x 0.25p),<br />
laddning (0.25p) för full poäng.<br />
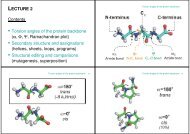
4. Om vi har ett enzym som har subenhets-kompositionen α 4 β 4 γ 2 δ, och varje α-subenhet<br />
har två domäner, och δ−subenheten har tre domäner, hur många N- respektive C-<br />
terminaler finns det (1p)<br />
Svar:<br />
11 st av varje (en N- och C-terminal per subenhet). (1p)
5. I figuren nedan visas resultatet av ett försök att separarera en blandning av fyra<br />
proteiner, A-D, på DEAE-Sepharose vilken har en positivt laddad ligand. Varje topp<br />
anses motsvara ett protein. Protein A eluerar direkt efter tillsats av bara buffert d.v.s.<br />
25 mM Tris-HCl pH 7.5. Protein B eluerar vid 0.1 M NaCl och protein C vid 0.3 M<br />
NaCl. Du vet att de fyra proteinerna har följande isoelektriska punkter (pI): 5.2, 6.0,<br />
6.9 samt 9.0.<br />
Jonbyteskromatografi på DEAE-Sepharose<br />
1<br />
Abs280<br />
0.8<br />
0.6<br />
0.4<br />
A<br />
B<br />
C<br />
0.2<br />
0<br />
0 10 20 30 40<br />
Fraktionsnummer<br />
a) Beskriv korfattat principen för jonbyteskromatografi (2p)<br />
b) Para ihop respektive protein med troligt pI-värde (2p)<br />
c) Protein D har tydligen inte lossnat från kolonnen. Hur kan man få ut det (1p)<br />
Svar:<br />
a) Jonbyteskromatografi bygger på principen att molekyler kan binda reversibelt till<br />
laddade grupper vilka immobiliserats på en bärarsubstans (1p). De molekyler, i vårt<br />
fall proteiner, som binder kan fås att lossna från liganden igen genom att jonstyrkan<br />
höjs antingen i steg eller kontinuerligt med en s.k. gradient. (1p)<br />
b) A- pI 9.0<br />
B- pI 6.9<br />
C- pI 6.0<br />
D- pI 5.2<br />
(0.5p för varje rätt svar)<br />
c) Protein D kan troligen fås att eluera genom att jonstyrkan höjs ytterligare t.ex. till<br />
0.5 M. (1p)<br />
6. Jämför interaktionerna (vätebindingar, van der Waals o.s.v.) mellan en oveckad<br />
polypeptid och vatten å ena sidan, och inom ett korrekt veckat globulärt protein å
andra sidan. Vilken faktor är viktigast för veckning och stabilisering av 3Dstrukturen<br />
(5p)<br />
Svar:<br />
Interaktion Oveckad polypeptid<br />
(0.5p/svar)<br />
Veckat protein<br />
(0.5p/svar)<br />
Vätebindingar polära grupper - vatten sekundärstruktur; mellan polära<br />
sidokedjor; polära sidokedjor-vatten<br />
van der Waalsinteraktioner<br />
relativt få & svaga många<br />
Elektrostatiska<br />
interaktioner<br />
få,<br />
skärmas av vatten<br />
mellan motsatt laddade sidokedjor nära<br />
varandra<br />
Hydrofoba Hydrofoba grupper<br />
minskar vattnets entropi<br />
Hydrofoba grupper tätt packade i<br />
kärnan è många vdW-interaktioner<br />
Den hydrofoba effekten är viktigast för veckning och stabilisering av 3D-strukturen.<br />
(1p)<br />
7. a) Varför används heme-bindande proteiner för transport och lagring av syre i stället<br />
för att syre transporteras löst i blodet, eller bundet till en fri heme-grupp (1p)<br />
b) Syretransport och lagring av syre i musklerna ställer olika krav på syrebindningsegenskaperna<br />
hos de inblandade proteinerna. Beskriv hur syrebindningsegenskaperna<br />
hos myoglobin och hemoglobin skiljer sig åt och ange den strukturella<br />
bakgrunden till skillnaderna! Vad kallas den egenskap som gör att hemoglobin kan<br />
fungera som syretransportör (3p)<br />
c) Beskriv kortfattat en heterotrop alloster effekt hos hemoglobin. (1p)<br />
(5p totalt)<br />
Svar:<br />
a) Syre löser sig dåligt i blod och måste bindas till något (t.ex. heme) för att ge<br />
tillräcklig löslighet (0.25p).<br />
Järnet i en fri heme-grupp i lösning oxideras till Fe 3+ och kan inte släppa bundet syre<br />
(0.25p).<br />
Den hydrofoba miljön runt hemegruppen i hemoglobin och myoglobin gör att järnet<br />
förblir reducerat och kan då både binda och avge syre under de syretryck som råder i<br />
lunga respektive muskelvävnad (0.5p).<br />
b) Transportproteinet hemoglobin måste binda syre vid höga syrgastryck (lunga) och<br />
släppa det infrån sig vid låga syretryck (muskel) (0.25p).
Lagringsproteinet myoglobin måste kunna binda syre vid låga syretryck (muskel)<br />
(0.25p).<br />
Hemoglobin består av fyra Mb-liknande subenheter (0.25p) och kan existera i två<br />
olika former (0.25p): R och T. R och T står i jämvikt med varandra (0.25p). T<br />
(deoxyHb) binder syre svagt (0.25p); R (oxyHb) binder syre starkt (0.25p).<br />
Binding av syre förskjuter jämvikten mot R-formen så att mer R-Hb finns i lungorna;<br />
vid låga syretryck förskjuts jämvikten mot T-formen och mer syre kan avges (0.5p).<br />
Detta beror på att olika Hb-subenheter kommunicerar med varandra genom<br />
konformations-förändringar orsakade av syrebinding (0.5p) och kallas för kooperativ<br />
binding eller (homotrop) allosteri (0.25p).<br />
c) Bohreffekten = sur miljö (H + ) och CO 2 "sköljer ut" O 2 från Hb genom at stabilisera<br />
deoxyHb (heteroptrop alloster effekt). BPG stabiliserar deoxyHb så att mer syre kan<br />
avges till muklerna. I syrefattig miljö ökas produktionen av BPG. (1p för ett korrekt<br />
exempel).<br />
8. a) Att enzymer är så effektiva katalysatorer beror främst på att de är utformade för att<br />
binda reagerande ämnen på ett speciellt sätt. Aktiva ytan är formad för att<br />
åstadkomma två viktiga effekter som snabbar upp kemiska reaktioner. Vilka är dessa<br />
effekter Hur mycket påskyndar de reaktionshastigheten (2p)<br />
b) Serinproteaser som trypsin, chymotrypsin, och elastas har likartade aktiva ytor och<br />
använder samma mekanism för att klyva polypeptidkedjor. Vilka tre sidokedjor<br />
förekommer alltid hos serinproteaser Reaktiva grupper i aktiva ytan hos enzymer<br />
kan delta direkt i kemisk reaktion med substratet vilket kallas kemisk katalys.Ge ett<br />
exempel på två olika typer av kemisk katalys hos serinproteaser. (3p)<br />
c) Då man undersöker aktiviteten hos serinproteaset chymotrypsin som funktion av<br />
pH finner man att aktiviteten har ett optimum kring pH 7.8, och att aktivitet i stort sett<br />
saknas vid pH under 4.0. Varför (1p)<br />
(6p totalt)<br />
Svar:<br />
a) Närhetseffekten gör att reaktiva grupper kommer nära varandra, och i rätt<br />
orientering, vilket ökar sannolikheten för reaktion (0.75p). Ökningen uppskattas till<br />
10 4 -10 5 gånger (0.25p).<br />
Enzymet stabiliserar övergångstillståndet ("transition state") och minskar därigenom<br />
aktiveringsenergin (0.75p). Ökningen uppskattas till minst 10 4 -10 5 gånger (0.25p).<br />
b) Alla serinproteaser har en s.k. katalytisk triad bestående av Asp - His - Ser (1p).
Syra-bas-katalys innebär att protoner ges till eller tas från substratet (0.5p). His tar<br />
upp en proton från serin så att den blir en negativt laddad nukleofil (0.5p).<br />
Kovalent katalys innebär att en reaktiv grupp på enzymet reagerar direkt med<br />
substratet och bildar en kovalent binding till en del av eller hela substratet (0.5p), ett<br />
s.k. kovalent reaktionsintermediat där en del av eller hela substratet sedan överförs till<br />
ett annat substrat.<br />
Den aktiverade serinen attakerar karbonylkolet i peptidbindingen som skall klyvas<br />
och bildar ett tetraediskt intermediat (0.5p).<br />
c) Vid pH 7.8 är Asp negativt laddad och kan stabilisera His+; His kan lätt protoneras<br />
och deprotoneras eftersom pH är nära pKa för His (0.5p). Vid pH 4 är Asp<br />
företrädesvis protonerad och neutral; His fungerar inte som bas och enzymet är "dött"<br />
(0.5p).<br />
9. a) Hur påverkar ett enzyms Km respektive kcat förhållandet mellan koncentration av<br />
substrat och produkt vid jämvikt (1p)<br />
b) Ange i reaktionsschemat E+S ES --> E+P de hastighetskonstanter som styr<br />
reaktionen. I Km ingår samtliga dessa hastighetskonstanter. Skriv uttrycket. (1p)<br />
c) Km kan ha samma värde som dissociationskonstanten (Ks) för sönderfall av ESkomplexet,<br />
och är då ett mått på hur hårt substratet binds, men bara under en viss<br />
förutsättning. Vilken (1p)<br />
(3p totalt)<br />
Svar:<br />
a) Inte alls (1p). Jämvikten beror på den termodynamiska skillnaden i fri energi,<br />
medan Km och kcat är uttryck för förhållanden mellan hastighetskonstanter.<br />
b) Om<br />
så är Km = (k -1 +k cat )/k 1 (1p)<br />
k 1 k cat<br />
E + S < -- > ES -- > E + P<br />
k -1<br />
c) Gäller när k -1 är mycket större än k cat ( då blir Km = k -1 /k 1 = Ks (1p)<br />
10. Rita Lineweaver-Burke-plotten för<br />
a) ett enzym i frånvaro och i närvaro av en kompetitiv inhibitor och<br />
b) ett enzym i frånvaro och i närvaro av en icke-kompetitiv (non-competitive)<br />
inhibitor, och förklara kortfattat hur dessa två typer av inhibitorer fungerar, och hur<br />
Vmax och Km påverkas av inhibitorerna.
Ange i figurerna hur man får ut Vmax och Km, och glöm inte att namnge axlarna!<br />
(3p)<br />
Svar:<br />
a) korrekt figur (samma skärningspunkt 1/V-axeln; samma Vmax) (1p); konkurerar<br />
om aktiva ytan (0.5p)<br />
b) korrekt figur (samma skärningspunkt 1/[S]-axeln; samma Km) (1p); binder till<br />
regulatorisk yta och påverkar aktiva ytan genom konformations-förändringar<br />
(=heterotrop alloster effekt) (0.5p)<br />
11. Enzymatiska processer är reglerade för att de ska ske vid rätt tid och på rätt plats.<br />
Regleringen sker i allmänhet genom att på olika sätt påverka aktiviteten för enzym<br />
som katalyserar metaboliskt irreversibla steg. Ibland regleras ett enzym av en produkt<br />
längre fram i en metabolisk reaktionskedja (feedback); ibland kan produkten av ett<br />
tidigare steg fungera som regulator (feed forward). Förutom att det reglerande ämnet<br />
kan fungera som en kompetitiv inhibitor finns också andra sätt att påverka ett enzyms<br />
aktivitet. Beskriv kortfattat tre sådana mekanismer för att reglera ett enzym, och ange<br />
om mekanismen är reversibel eller ej. (3p)<br />
Svar:<br />
Alloster reglering: den reglerande molekylen binder på särskild regulatorisk plats i<br />
enzymet och påverkar aktiviteten genom konformationsförändringar i aktiva ytan.<br />
Oftast oligomera proteiner. Reversibel. (1p)<br />
Fosforylering: genom att reversibelt sätta på (kinaser) och plocka bort (fosfataser)<br />
fosfatgrupper kan enzymets aktivitet påverkas. (1p)<br />
Proteolytisk aktivering: en propeptid klyvs bort för aktivera enzymet. Irreversibel.<br />
(1p)<br />
12. Serinproteaser utsöndras som zymogener från bukspottkörteln. Efter aktivering i<br />
tarmen klyver de peptidkedjor med en gemensam katalytisk process, men varje<br />
serinproteas har olika specificitet och klyver peptidbindingar efter olika aminosyror.<br />
T. ex. klyver chymotrypsin peptidkedjor efter aminosyrarester med aromatiska eller<br />
andra stora sidokedjor, medan trypsin klyver efter positivt laddade sidokedjor.<br />
Förklara med en figur hur denna substratspecifictet uppkommer. (2p)<br />
Svar:<br />
2p för figur enl s 171 i boken eller liknande (olika fickor för binding av olika typer av<br />
sidokedjor).
13. Idisslare som har drabbats av akut acetonemi behandlas ibland genom att veterinären<br />
injicerar kortisol. Kortisol är ett kataboliskt hormon som stimulerar nedbrytningen av<br />
proteiner. Förklara kortfattat hur en sådan behandling kan resultera i att akut<br />
acetonemi hos idisslare kan hävas. (2p)<br />
Svar:<br />
Kortisol bryter ner proteiner vilket leder till att levern kan utnyttja dessa till<br />
glukoneogenes och därmed höja blodglukos-nivån. (2p)<br />
14. Vid en partiell svält tillförs ingen näring utifrån. Beskriv kortfattat vad som händer i<br />
levern (i biokemiska termer) efter flera timmars frånvaro av föda och ange varifrån<br />
respektive metabolit härstammar (max 1 sida). (6p)<br />
Svar:<br />
Glukos bildas från Leverglykogen. (1p)<br />
Glukos bildas från laktat, från skelettmuskler. (1p)<br />
Glukos bildas från glycerol, från lipolys i fettväven där glycerol och fria fettsyror<br />
bildas triacylglycerol. (1p)<br />
Glukos bildas från glukogena aminosyror som kommer huvudsakligen från<br />
musklerna. (1p)<br />
Fettsyra förbränningen (β-oxidationen) ökar, fettsyror från fettväven. (1p)<br />
Brist på glukos leder till brist på oxalacetat vilket resulterar i en ökad<br />
ketonkroppsproduktion. (1p)<br />
15. Enzymet citratlyas katalyserar spjälkningen av citrat i cytosolen. Nötkreatur har ingen<br />
(eller mycket låg) aktivitet av detta enzym. Vilka är spjälkningprodukterna Vilken<br />
roll i fettsyrasyntesen spelar detta enzym Varför behöver kon inte detta enzym (3p)<br />
Svar:<br />
Citrat som transporterats ut i cytosolen spjälkas till oxalacetat och acetyl-CoA. (1p)<br />
Acetyl-CoA utgör substrat för fettysrasyntesen. (1p)<br />
Idisslarna får stora mängder acetat från förjäsningen av kolhydrater i vommen och<br />
utnyttjar cytosoliskt acetat som kopplas ihop med CoA. (1p)<br />
16. Vid hårt muskelarbete ackumuleras huvudsakligen en metabolit från<br />
kolhydratnedbrytningen (glykolysen) i skelettmusklerna. Vilken Hur hanterar<br />
kroppen omhändertagandet av denna metabolit (3p)<br />
Svar:<br />
Laktat (1p). Laktat från musklerna transporteras via blodet till levern, där sker<br />
glukoneogenes, d.v.s. glukos bildas som sedan transporteras tillbaka till muskeln,<br />
Cori-cykeln (2p).
17. Vilket påstående är rätt (1p)<br />
Pentosfosfat-shunten<br />
a) består av en serie reaktioner som inte har något samband med någon annan<br />
metabolisk reaktionsväg.<br />
b) genererar NADH som reducerande ämne i biosyntes-reaktioner.<br />
c) producerar ribos-5-fosfat (1p)<br />
d) kräver arabinos-5-fosfat<br />
18. Vilket påstående är rätt (1p)<br />
Om pyruvat skall oxideras vidare i citronsyracykeln<br />
a) måste pyruvat omvandlas till oxalacetat<br />
b) måste pyruvat omvandlas till acetyl-CoA genom oxidativ dekarboxylering. (1p)<br />
c) måste pyruvat binda kovalent till ett litet enzym som katalyserar reaktionen.<br />
19. Vad är finessen med en signalöverförings-kaskad Ge ett exempel på en sådan! (2p)<br />
Svar:<br />
En signalöverföringskaskad är en kedjereaktion som förstäker en signal i flera olika<br />
steg (1p).<br />
(Initialbindningen av t.ex. ett hormon till en receptor kan t.ex. ge upphov till<br />
• aktivering av ett antal G-proteiner som<br />
• aktiverar t.ex. adenylatcyklas som<br />
• ger många cAMP molekyler som<br />
• aktiverar ännu fler kinaser som<br />
• aktiverar eller stänger av ännu fler enzymer.<br />
Signalen förstärks genom kedjan.)<br />
Ett exempel som behandlats på kursen är hur ett hormon (glucagon, epinefrin)<br />
aktiverar glykogen-nedbrytning. (1p)<br />
20. a) Beskriv huvudkomponenterna i fotosyntesens ljusreaktion. Illustrera gärna med en<br />
enkel skiss. (2.5p)<br />
Besvara sedan följande frågor:<br />
b) Var sker fotosyntesens ljusreaktion (0.5p)<br />
c) Vad heter den vanligaste ljusinfångande komponenten hos växter (0.5p)<br />
d) Vilken allmän fysikalisk egenskap hos molekylerna som ingår i ljusreaktionen<br />
utnyttjas för att transportera elektroner (0.5p)<br />
e) Varifrån tas elektronerna (0.5p)<br />
f) Vilken är den slutliga elektron-mottagaren (0.5p)
Svar:<br />
a)<br />
• Ett (biologiskt) membran (0.25p)<br />
• en elektronkälla (H 2 O) (0.25p)<br />
• ljusinfångande pigment (klorofyll) (0.25p)<br />
• elektrontransporterande kofaktorer (redox-centra) (0.25p)<br />
• protein (reaktionscenter (0.25p), cytokrom bf-komplex (0.25p))<br />
• vattenlösliga elektronbärare (cytokrom c (0.25p), plastocyanin (0.25p))<br />
• elektron-mottagare (NADP + ) (0.25p)<br />
• ljus (0.25p).<br />
See t.ex. Fig 16.7 i Horton.<br />
b) I kloroplasternas tylakoidmembran. (0.5p)<br />
c) Klorofyll (a) (0.5p)<br />
d) Reduktionspotentialen (redox-potentialen). (0.5p)<br />
e) H 2 O (0.5p)<br />
f) NADP + (0.5p)<br />
21. DNA-polymeras I från E. coli består av ett enda protein och är inblandat i både<br />
replikation och lagning av DNA. Beskriv detta enzyms uppgifter i dessa två<br />
processer. (2p)<br />
Svar:<br />
Replikation: degraderar RNA-primern i Okasaki-fragmenten och byter ut dessa mot<br />
DNA. (1p)<br />
Lagning: fyller igen den lucka i DNAt som uppstått då cellens lagningssystem har<br />
identifierat och degraderat ett fel i den ena DNA-strängen. (1p)<br />
22. a) Generna (proteinkodande regioner i DNAt) i E. coli är ofta ordnade i operon. Vad<br />
är fördelen med ett sådant arrangemang (1p)<br />
b) Vad är en exon (1p)<br />
c) Vad är ett "anticodon" och vad har det för uppgift under translationen (1p)<br />
Svar:<br />
a) Alla gener i operonet styrs av en gemensam promotor. (1p)<br />
b) Sekvens (i DNA eller RNA) som finns kvar i det processade (splicade) RNAtranskriptet.<br />
(1p)<br />
c) Den triplett av nukleotider på tRNA-molekyler som basparar mot mRNAt under<br />
translationen. (1p)<br />
23. a) Vad innebär transformering av bakterier Hur utfördes transformeringen på DNAlabben<br />
(2p)
) Varför växte det blåa bakteriekolonier på vissa plattor innehållande ampicillin, X-<br />
gal och IPTG (2p)<br />
c) Varför tillsattes ethidiumbromid till agarosgelen där vi separerade våra DNAfragment<br />
(1p)<br />
Svar:<br />
a) Transformering = Ett sätt att stoppa in en plasmid i en bakterie (1p). På labben<br />
gjordes detta genom elektrotransformering/elchock/1500V av<br />
plasmid/bakterieblandningen.(1p)<br />
b) Blå kolonier därför att bakterier som plockat upp en plasmid med intakt lacZ-gen<br />
uttrycker beta-galaktosidas som kan bryta ned X-gal till ett blått färgämne. (2p) IPTG<br />
förklaring ger inget extra. Namn på gen och enzym bra men inte nödvändigt.<br />
c) Etidiumbromid binder till DNA och fluorescerar i UV-ljus. Annars skulle vi inte<br />
se våra DNA-fragment (1p)