原料药:规范市场仿制药的竞争力基础
原料药:规范市场仿制药的竞争力基础
原料药:规范市场仿制药的竞争力基础
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
国内外原料药市场的发展趋势<br />
以及监管现状<br />
加拿大新科咨询有限公司总裁<br />
上海新科咨询公司执行总裁<br />
美欧GMP高级咨询师/审计师<br />
程毓渡博士<br />
培训内容提要<br />
2. 美欧原料药监管现状:介绍美国<br />
与欧盟原料药/制剂的注册文件与<br />
GMP现场检查之间的关系 GMP现场检查之间的关系,原料 原料<br />
药/制剂注册审批中美国和欧盟<br />
GMP现场检查要求,美国和欧盟<br />
GMP现场检查法规与指南等美欧<br />
原料药监管方面的现状<br />
国内外原料药市场回顾与发展趋势<br />
原料药:规范市场仿<br />
原料药:规范市场仿<br />
制药的竞争力基础<br />
培训内容提要<br />
1. 国内外原料药市场回顾与发展<br />
趋势:介绍包括中国在内的国<br />
际仿制药/原料药市场当前状况<br />
与发展前景,比较中国与印度<br />
市场的优越性与特点,展望仿<br />
制药/原料药市场的互为生存的<br />
发展趋势<br />
培训内容提要<br />
培训内容提要-3<br />
3. 国内外原料药监管现状-2:介<br />
绍美国和欧盟GMP现场检查法<br />
规与指南 规与指南,并解读中国新版<br />
并解读中国新版<br />
GMP附录-2(原料药GMP要<br />
求)。<br />
原料药市场解析<br />
• 全球制药行业趋势<br />
• 美欧制药企业的增长<br />
• 印度和中国药厂的表现<br />
• 仿制药企业的成功因素<br />
• 原料药市场切入点<br />
• 美欧原料药公司的发展与影响<br />
• 回顾与展望<br />
1
全球机会:宏观因素<br />
• 地域与经济增长<br />
• 先进发达国家的人口老龄化<br />
• 发展中国家的经济与人口增长加上老龄化<br />
• 医疗保健经费压缩的政治压力逐渐导致更加有利<br />
的立法和规定来支持仿制药生产和使用<br />
• 名列前几位的仿制药公司整合:现今巨大的全球<br />
公司提升了对仿制药的信心<br />
• 原料药市场在今后5-10年中将会有5-10%数量上的<br />
增长,但是由于日益激烈的竞争只有1-2%价值上的<br />
增长<br />
2006-2008年度不同区域年平均市场增长<br />
• 美国市场增长8-9%(2005年为5-6%),全球市场<br />
年增长43%。<br />
• 欧盟市场增长4 欧盟市场增长4-5%,2005年为4-5%,降低0.5%个<br />
5% 2005年为4 5% 降低05%个<br />
百分点。<br />
• 中国市场增长为17-18%,达到130-140亿美元<br />
• 印度国内市场在数量上每年增长8-9%,印度官方<br />
预测到2010年印度药品市场包括出口在内的增长会<br />
翻番。<br />
IMS:药品市场增长预测<br />
• 专利药品过期而受到仿制药的竞争也是2010年-2013年<br />
的药品市场增长率停留在个位数的一个主要原因,例如<br />
治疗高胆固醇药品立普妥(LIPITOR)或阿托伐他汀钙片<br />
、抗雪凝药品保栓通(PLAVIX)或氯吡格雷、抗支哮<br />
喘药物舒利迭(SERETIDE)或西洛司等<br />
喘药物舒利迭(SERETIDE)或西洛司等。<br />
• 中国市场继续保持每年20%以上的市场增长,现在起<br />
到2103年,中国药品市场将为世界药品市场增长贡献<br />
21%。<br />
• 七个药品市场增长国为:巴西、中国、印度、墨西哥<br />
、韩国语土耳其。药品市场增长七国2010年整体增长率<br />
为12-14%,今后5年为13-16%。<br />
全球制药行业发展特点:循环往复<br />
• 2005年由于独家保护的失去是一个开始向下的市场<br />
• 2006-2008年期间许多销售规模很到的产品在主要市场都失去了<br />
独家保护<br />
• 全球公司与美欧区域性公司及其美国主要客户的整合<br />
• 欧盟客户保持分块特征,绝大部分按照国家划分,通过包装、<br />
销售规则和品名来支持每一国家内的公司,但是这一情况正在改变<br />
• 来自于已建立和正在成长的印度公司将加入分享市场的循环,中<br />
国也正在加入<br />
IMS:药品市场增长预测<br />
• 2010年全球药品市场将增长4-6%,超过8250亿美元。<br />
• 现在起到2013年,全球平均每年的药品销售增长率为<br />
4-7%。市场价值将超出9750亿美元。整体市场增长率处<br />
于 于一个历史上缓慢增长期。<br />
个历史上缓慢增长期<br />
• 美国市场2009年预测为4.5%-5.5%的增长,2010年的增<br />
长为3-5%。<br />
• 受经济危机影响,药品需要自行支出的国家诸如俄罗<br />
斯、墨西哥、韩国等增长速度大幅度下滑,药品主要由<br />
政府支出的国家诸如德国、日本、西班牙的增长速度受<br />
影响较小。<br />
市场表现:仿制药厂超过品牌药厂<br />
持续运行摊薄每股盈利(EPS)<br />
3年复<br />
合年均<br />
增长率<br />
5年复合<br />
年均增<br />
长率<br />
美国仿制药表现 25.5% 39.2%<br />
美国品牌药表现 -12.1% -6.0%<br />
欧洲品牌药表现 6.3% 13.6%<br />
美国仿制药超出美国品牌药 37.7% 45.3%<br />
美国仿制药超出欧洲品牌药 19.3% 25.7%<br />
2
制药行业长期循环增长规律:新药越少,增长越慢<br />
• 美国和全球市场缓慢 Slowing US and global market growth<br />
• 2004-2007期间年美国市场增长率为每年 +6%(1999-<br />
2003期间为每年+10% )<br />
• 2004-2007期间全球市场增长率为每年 +6.5% (1999-<br />
2003期间为每年+10% )<br />
• 原因 原因:新产品上市降低了20%<br />
新产品上市降低了<br />
• 2004-2007期间平均每年上市的新产品为45 个(1999-<br />
2003期间平均每年上市的新产品 为54个)<br />
10 10年以上预测 年以上预测<br />
•更少的产品可供仿制药制造<br />
•大药厂需求更少的原料药产能<br />
•进一步的整合<br />
•持续的原料药产能向仿制药发展<br />
印度制药行业的增长<br />
• RANBAXY(已被日本第一三共收购)为世界第9位印度<br />
第一位全球仿制药公司<br />
• 印度药品产值为75亿美元,占全球生产量的8%和价值的<br />
1.5%(2004年数据)<br />
• 印度制药行业出口创汇30亿美元(2004年数据),复合年<br />
均增长率为22.9%<br />
• 印度原料药业务创汇10亿美元(2005年数据),可生产400<br />
多种原料药<br />
• E&Y(安永)在数量方面把印度列为第四位的市场,但在<br />
国内消费价值方面把印度列为第十三位的市场<br />
大药厂应对仿制药竞争:增加外包和合<br />
同研发与制造<br />
• 印度和中国原料药/中间体生产厂家受益<br />
• 传统的美欧合同制造商遭遇风险<br />
• 对印度基于研发的传统合同制造商有更大的长期影响<br />
• RANBAXY与GSK在新化学实体/新分子实体方面的<br />
研究合作<br />
• DRL 目前重点转向新化学实体/新分子实体的研究<br />
• 致力于新化学实体/新分子实体的印度公司将制造任<br />
何成功的产品<br />
• 注重合同研发与制造的印度公司也许把重点从原<br />
料药转向仿制药<br />
美国市场回顾与展望: 2006-2008年期间价值增长但独家保护减<br />
少,2009-2010年期间市场适度下滑<br />
Source: Lehman PharmaPipelinesTM 2004<br />
向美欧市场供货的竞争<br />
• 印度公司瞄准美欧市场<br />
• 中国经常是印度供应链的一部分<br />
• 为数不多的私营中国公司-落后于印度3-5年<br />
• 越来越多的新印度公司尝试向美国客户销售更低成本的原料药和<br />
制剂产品<br />
• 美国客户利用印度的供货来从他们主要的制剂供应商那里获取更<br />
好价格,而且必须寻找更低成本的原料药以保持竞争力。<br />
结果<br />
•盈利受制于整个供应链<br />
•新进者占有很小的制剂市场份额<br />
•促进制剂外包<br />
仿制药美国市场评价:低价期望但是不<br />
一定赢取业务<br />
•仿制药生产商需要通过产品与供应的持续性、配<br />
售与物流能力以及未来产品开发储备几方面把自<br />
身与药品零售商区别开来<br />
•价格不总是有意义的谈判工具,因为大部分仿制<br />
- Dennis O’Dell, SVP Pharmacy Services, Walgreen,<br />
药都是采取多供应商采购且价格类似<br />
comments on conference call hosted by Rich Silver<br />
and Meredith Alder, Lehman Brothers NY with George Barrett<br />
& Bill Marth of Teva. Dec. 9, 2004<br />
3
美国市场评价: 印度的竞争在增长,但是在占有制剂市场份<br />
额方面没有多少进展<br />
• 除了RANBAXY公司,可以说,在美国制剂市场上,DRL公司<br />
和SUN/CARACO公司都没有占有意义的直销制剂市场份额。<br />
• 加盟产品难以衡量:制剂市场份额属于美国合作伙伴<br />
• 72家印度公司在美国有处于可引用的 DMF文件<br />
• CIPLA, DRL, RANBAXY, MATRIX, SUN,,WOCKHARDT,<br />
LUPIN些公司每家名下有超过25个可引用的DMF文件: 竞争压力<br />
与原料药有关<br />
趋势<br />
Year Y<br />
递交的和ANDA(包括加盟的产品)中引用<br />
的DMF文件大量增加 。<br />
ANDA中引用更多的印度DMF<br />
2005E<br />
2004<br />
2003<br />
2002<br />
2001<br />
2000<br />
0 50 100 150 200<br />
No. of Indian/Chinese DMFs Cited in ANDAs<br />
China<br />
India<br />
• 许多DMF在多个ANDA文件中北引用<br />
• 某些引用印度DMF文件的ANDA支持那些通过合作伙伴上市的产品<br />
欧盟:较低的标准,更少的监管<br />
• COS(原料药证书)不需要现场GMP检查就可以获得<br />
• 2008年以前,欧盟买注册文件很普遍,制剂购买商经常不检查制<br />
剂生产基地,也不检查原料药供应商<br />
• 许多转让注册文件的欧盟当地仿制药公司不具备评价或审计原料<br />
药供应商的能力<br />
• 原料药供应商可以很容易地变更<br />
• 目前欧盟制造药品的原料药大约70%来自于印度和中国,比80年<br />
代提高了10%左右<br />
问题<br />
买注册文件势必缺乏原料药质量监管<br />
FDA FDA收到的 收到的DMF DMF文件中已经审核的<br />
文件中已经审核的45% 45%来自印 来自印<br />
度( 度(2004 2004年数据),而在<br />
年数据),而在1999 1999年还不到 年还不到5% 5%<br />
更多的印度DMF文件被引用,更多的印度原料药<br />
厂被FDA检查<br />
• FDA只检查那些DMF文件被ANDA引用的原料药厂<br />
• 某些引用印度DMF文件的ANDA支持那些通过合作伙伴上市的产品<br />
美国市场仿制药业务成功要素<br />
• 产品储备<br />
• 销售与推广<br />
• 原料药<br />
• 市场或商机<br />
• 速度和低成本<br />
4
仿制药业务成功要素:产品储备<br />
强势的和增长的具备竞争力的产品储备<br />
• 产品选择:建立支持公司发展战略的产品储备,包括大药、新药<br />
、独特药<br />
• 专注研发加业务开发和转让的执行,以建立能及时批准上市的产<br />
品储备<br />
• 仿制药公司可持续的市场领先源于高效运行、内部研发能力和高<br />
度擅长原料药采购<br />
• 吸引人的产品储备可以加强现有产品的销售<br />
• 新进者如果没有吸引人的产品储备将难以销售上市已久的产品,即使价格有<br />
竞争力<br />
印度竞争力: 产品储备<br />
• 高质量印度制药公司在研发和建立产品储备方面具<br />
备竞争力<br />
• 速度与高技能,包括:<br />
• 非侵权工艺的开发<br />
• 难度大的机型<br />
• 低成本研发人员<br />
• 仿制药公司核心竞争力在印度公司中完善建立:<br />
• 快速、非侵权开发与注册申报<br />
• 低成本但是产品同等<br />
• 专利规定的独家保护期后及时上市<br />
仿制药业务成功要素:销售与推广<br />
• 与当地客户健全的关系,对客户的很如了解和满<br />
足客户需求的能力<br />
• 在纯粹的仿制药市场上具备完善的产品上市运行<br />
和进出供应链的管理<br />
• 大的美国销售网络<br />
• 分销商不从小商品供应商那里拿货<br />
• 必备持之以恒服务满足严格的复杂的大客户需求<br />
的经验<br />
• 耽误 耽误/错过 错过/原料药问题都是不可以接受的<br />
原料药问题都是不可以接受的<br />
Teva<br />
Ivax<br />
Ranbaxy<br />
Par<br />
Dr. Reddy’s<br />
Mylan<br />
Watson<br />
Barr<br />
Andrx<br />
Sandoz/Eon<br />
APP<br />
Impax<br />
Alpharma<br />
美国仿制药产品储备<br />
ANDAs<br />
Pending<br />
140*<br />
57*<br />
52<br />
49<br />
47<br />
44<br />
40<br />
35<br />
~30<br />
27+?<br />
18<br />
14<br />
12<br />
Value<br />
$Billion<br />
89+*<br />
29<br />
35<br />
29<br />
10<br />
14+?<br />
3<br />
6<br />
7<br />
Number<br />
FTF<br />
37*<br />
12*<br />
10<br />
Source<br />
R&D<br />
R&D, Cipla, BD&L<br />
R&D<br />
BD&L, R&D-Kali<br />
R&D<br />
R&D<br />
Cipla, BD&L<br />
R&D, BD&L<br />
R&D<br />
Cipla,BD&L,IndiaR&D<br />
R&D, BD&L<br />
R&D, BD&L<br />
BD&L<br />
外包式产品储备方面的问题<br />
• 转让制剂产品的仿制药公司可以向制剂采购商在质<br />
量、 量、cGMP cGMP符合性、原料药供应商已经<br />
符合性、原料药供应商已经FDA FDA检查等 检查等<br />
方面提供保证吗?<br />
• 缺乏产品储备的仿制药公司审计他们的原料药供应<br />
商吗?这些仿制药公司具备这样的技术能力吗?<br />
• 供应链的安全可靠程度如何?<br />
• GMP GMP符合性的保证度如何?<br />
符合性的保证度如何?<br />
• 可以依据原料药供应商来使用费侵权工艺吗?仿制<br />
药购买商实施检查吗?<br />
印度竞争力:销售与推广<br />
• 绝大部分印度公司仍在了解西方仿制药公司和客户的<br />
需求<br />
• 必须具备为美国大供应链供应产品的经验<br />
须具 美 大供 供 产<br />
• 支撑合作关系或具备可靠原料药供应模式<br />
• 合作关系成本高且缺乏与基于研发的公司的竞争力,<br />
如果处理不妥的话,还会加大规范与质量方面的风险<br />
• 对基于欧盟原料药供应商施加进一步压力以促进他们<br />
的仿制药客户竞争<br />
5
仿制药业务成功要素:原料药<br />
• 保持内供原料药或健全的采购合作关系<br />
• 避免对原创药厂和带知识产权的仿制药厂的侵权<br />
• 早做准备,在独家保护到期前<br />
早做准备,在独家保护到期前7-10 10年<br />
• 完善注册申报所需的技术包和支持数据,并回复来自不同市<br />
场药监机构的缺陷性<br />
• 高效运行,内供原料药是克服或挑战专利的一个具备<br />
竞争力的选择,有利于首个申报<br />
竞争力的选择,有利于首个申报/首个上市和解决复杂<br />
首个上市和解决复杂<br />
的技术问题<br />
• 内供原料药可以降低成本<br />
• 比喻:如果你需要牛奶,你不必买一头奶牛。如果你<br />
需要很多牛奶,你可以买一头奶牛,但是需要一个专<br />
业农户而不是一个药剂师来管理它。<br />
中国竞争力:原料药<br />
• 中国在制剂进入规范市场的准备度方面落后印度3-7年<br />
,但是具备快速的原料药增长能力和增长迅速的原料药<br />
销售。<br />
• 印度仿制药公司朝制剂方面的整合促使原料药需求流<br />
向中国<br />
• 中国是向印度提供中间体的供应商,有助于印度降低<br />
成本提高竞争力<br />
• 中国是一个成长中的原料药直销规范市场的力量,特<br />
别是在简单产品、老产品以及发酵产品方面<br />
仿制药业务成功要素::低成本<br />
• 低成本是仿制药业务模式的一个既定部分<br />
• 在竞争方面有一定的重要性但是被过分夸大<br />
• 高成本公司不具备竞争力,但是低成本公司不能仅<br />
依靠低成本参与竞争<br />
印度竞争力:原料药:<br />
• 进入规范市场的印度公司均有内供原料药生产和开发<br />
能力<br />
• 经验丰富的印度公司诸如CIPLA 经验丰富的印度公司诸如CIPLA,RANBAXY,DRL<br />
RANBAXY DRL<br />
都具备原料药采购与供应链管理能力<br />
• 不具备原料药自供能力的美欧仿制药公司需要从印度<br />
和中国采购原料药以保持竞争力<br />
欧盟竞争力:原料药<br />
• 传统的欧盟原料药生产商具有客户关系、规范经验和<br />
市场知识<br />
• 具有保护知识产权的良好记录<br />
• 欧盟原料药公司具备从中国和印度采购中间体和供应<br />
链管理优异能力,因此具备成本优势<br />
• 需要降低成本,包括能够早期迅速开发非侵权工艺,<br />
这方面提供欧盟和印度/中国公司的结合的机会<br />
中国竞争力:低成本<br />
• 中国原料药通常比印度便宜,在有生产能力或规范性不是主<br />
要问题的情况下,中国经常成为第三方的低成本生产商<br />
• 中国具备低成本和高素质的科技人才,但是比印度缺乏规范<br />
符合性和业务与供应链管理方面的经验<br />
• 与中国交流是一个问题,具备一个能说中文的有经验的人员<br />
是很重要的<br />
• 中国正在朝向价值链方向转移,增加诸如基本建设的硬件和<br />
与规范符合性相关的软件方面的投资,势必提高成本<br />
6
速度对仿制药市场是至关重要的<br />
•4周内,GSK丢失65%的PAXIL处方<br />
仿制药价格在前40周是原创药的40-50%<br />
仿制药上市之初,PAXIL销售额是23亿美元<br />
• 即使GSK价格大降,人们还是购买仿制药<br />
仿制药策略提示:首个上市比准备更充分上市更加重要<br />
• 在专利失效时瞄准大药<br />
大量数据文件,易于选择<br />
• 内部研发<br />
原有模式<br />
• 仿制药价格在<br />
仿制药价格在180 180<br />
天后快速下跌<br />
• 可造成快捷采购<br />
以争取首个申报<br />
。在上市前需要<br />
解决问题<br />
品牌药和仿制药竞争模式变化趋势<br />
• 12-24个月期间品牌市场/利润缓<br />
慢侵蚀<br />
• 绝大部分原料药采购自欧洲<br />
西班牙、意大利、匈牙利、德国<br />
• 考虑印度和中国原料药:低成本/<br />
质量低<br />
• 绝大部分仿制药在专利到期时上<br />
市<br />
• 差异式产品策略<br />
现今模式<br />
日益重视市场定位<br />
• 强化业务合作和转让以补充或扩大产<br />
品储备,特别是制剂<br />
• 对品牌市场和利润的快速侵蚀<br />
• 仿制药通过新化学实体/新分子实体开<br />
发和引进向品牌药领域扩张<br />
• 公司整合形成大公司主导<br />
US: Teva, Mylan, Watson, Sandoz<br />
• 原料药市场由印度/中国主导<br />
• 独占期申请大量增加<br />
原料厂家与仿制药公司合作方式<br />
• 与缺乏内供原料药的仿制药公司建立盟约关系<br />
• 成为他们研发产品储备的开发商<br />
• 做好与一个仿制药厂合并的准备<br />
• 选择作为独立合作伙伴<br />
• 仿制药公司在印度和中国选择原料药独立供应商<br />
• 原料药公司作为TEVA和SANDOZ公司的独立后备供应商<br />
• 特殊原料药厂家可以成为那些具备内供原料药但是不<br />
能100%满足需求的仿制药公司的补充供应商<br />
• 与其它具有广泛市场能力的高质量原料药建立盟约关<br />
系<br />
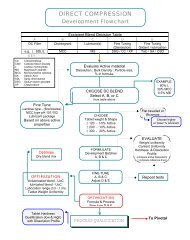
原料药供应的启动具有举足轻重的作用<br />
品牌产品<br />
仿制药开发典型路线:标准操作流程<br />
在专利独家保护到期前5-7年选择原料药<br />
原料药供应商对首个申报/上市独占期至关重要<br />
数量足够支持开发<br />
关键影响<br />
市场评价<br />
专利<br />
评价<br />
外部咨询<br />
原料药供应商<br />
业务开发<br />
寻找<br />
与制剂<br />
开发<br />
制剂<br />
开发与<br />
中试<br />
递交<br />
ANDA ANDA文件 文件<br />
稳定<br />
性与要<br />
药动研<br />
究<br />
原料药供应商<br />
合同研发机构<br />
递交专利证明<br />
递交 递交DMF DMF<br />
验证与<br />
批准制剂<br />
9个月 个月 2 个月 6-12 12 个月 12 个月 5个月 个月 12 12-18 18个月 个月.<br />
原料药供应商<br />
商业模式变更对原料药产生影响<br />
• 品牌药厂家和仿制药厂家正在改变他们的原料药采购策<br />
略<br />
• 增加在印度的采购和转向中国采购,一些新的全球采购<br />
公司可能不具备确保规范符合性和质量的法规与质量能力<br />
• 许多新的原料药生产厂家缺乏cGMP符合性的历史记录<br />
• 越来越多的原料药来自印度和中国。越来越多的制剂出<br />
口,尤其是来自于印度。客户直接与供应商交往。<br />
原料药是规范市场仿制药竞争力的基础<br />
ANDA ANDA得到批 得到批<br />
准<br />
• 具备内部或外部的研发产品储备的原料药合作伙伴的<br />
仿制药公司具有较高的长期增长期望<br />
• 缺乏建立产品储备能力的仿制药公司<br />
• 最可能需要并购,并购对象应该是具备产品储备、较低的科<br />
研资源成本、较强的规范能力和非侵权工艺开发能力的优良<br />
原料药厂家<br />
• 缺乏内供原料药的仿制药公司必须与健全的原料药厂<br />
家结成盟约关系或引进制剂注册申报文件资料<br />
• 盟约关系必须建立在信息共享和相互信任的基础上,并能提<br />
供早期低成本开发资源<br />
• 与印度 与印度/中国原料药厂家不具备紧密合作关系的仿制药<br />
中国原料药厂家不具备紧密合作关系的仿制药<br />
公司不会有兴旺的发展前景<br />
7
国内外原料药监管现状<br />
1、介绍美国与欧盟原料药/制剂的注册文<br />
件与GMP现场检查之间的关系<br />
2、介绍原料药/制剂注册审批中美国和欧<br />
盟GMP现场检查要求<br />
3、介绍美国和欧盟GMP现场检查法规与<br />
指南<br />
原料药 原料药/制剂注册文件与<br />
制剂注册文件与<br />
美国和欧盟<br />
美国和欧盟GMP GMP现场检查要求<br />
现场检查要求<br />
原料药GMP现场检查(美国FDA)<br />
美国FDA对DMF资料尚未被制剂厂家注<br />
册文件引用的原料药厂家不进行评审和<br />
GMP现场检查,但是对DMF资料已被制<br />
剂厂家注册文件引用的原料药厂家则进<br />
行GMP现场检查(批准前检查PAI,即<br />
PRE-APPROVAL INSPECTION)。<br />
原料药 原料药/制剂注册文件与<br />
制剂注册文件与<br />
美国和欧盟<br />
美国和欧盟GMP GMP现场检查要求<br />
现场检查要求<br />
制剂 /药品注册文件<br />
向美国FDA递交的制剂/药品注册文件包括仿<br />
制药ANDA(ANDA注册指南)、新药NDA(新<br />
药注册指南)、临床试验药IND(临床试验药<br />
注册指南)。向欧盟(EMEA)递交的制剂/药<br />
品注册文件包括生物药、确定适应症的新药、<br />
罕见药、儿童用药等(EMEA制剂/药品注册法<br />
规、EMEA制剂/药品注册申请表)。<br />
原料药 原料药/制剂注册文件与<br />
制剂注册文件与<br />
美国和欧盟<br />
美国和欧盟GMP GMP现场检查要求<br />
现场检查要求<br />
原料药(API)注册文件<br />
原料药文件DMF是制剂申请文件的一部<br />
分(FDA/DMF),在美国不能做为独立<br />
文件注册,但是在欧盟国家可以通过申<br />
请欧洲药典局的CEP证书的方式获得正<br />
式注册(EDQM/ASMF/EDMF/CEP)。<br />
原料药 原料药/制剂注册文件与<br />
制剂注册文件与<br />
美国和欧盟<br />
美国和欧盟GMP GMP现场检查要求<br />
现场检查要求<br />
原料药GMP现场检查(欧盟)<br />
欧盟通过欧洲药典局对CEP证书上列出<br />
的原料药生产厂家实施GMP现场检查<br />
(EDQM/INSPECTION)。CEP证书可以<br />
先于GMP现场检查颁发,也可以后于<br />
GMP现场检查颁发,取决于EDQM可以<br />
安排的GMP现场检查日程状况。<br />
原料药 原料药/制剂注册文件与<br />
制剂注册文件与<br />
美国和欧盟<br />
美国和欧盟GMP GMP现场检查要求<br />
现场检查要求<br />
制剂 /药品的GMP现场检查<br />
向美国FDA递交的制剂/药品注册文件(例如<br />
仿制药ANDA、新药NDA、临床试验药IND)<br />
批准前或向欧盟EMEA(中央途径)或欧盟各个<br />
国家(国家途径)递交的制剂/药品注册文件<br />
批准前均需要接受GMP现场检查(即PAI)。<br />
PAI对原料药部分和制剂部分均需进行(美国<br />
PAI指南与欧盟PAI指南)<br />
8
美国和欧盟<br />
美国和欧盟GMP GMP现场检查 现场检查<br />
法规与指南<br />
• 美国与欧盟<br />
美国与欧盟GMP GMP现场检查法规与指南是一个<br />
现场检查法规与指南是一个<br />
复杂的且不断变化的庞大系统。<br />
• 美国 美国FDA FDA的GMP GMP现场检查虽然基于现行的<br />
现场检查虽然基于现行的<br />
cGMP cGMP法规要求,但是许多<br />
GMP GMP法规要求 法规要求 法规要求,但是许多FDA<br />
但是许多 但是许多FDA FDA的GMP GMP现场检 现场检<br />
查指南都是上世纪八十年代以来制定的,在实<br />
践中导致 践中导致GMP GMP现场检查的诸多不确定性。<br />
现场检查的诸多不确定性。<br />
• 欧盟 欧盟GMP GMP现场检查(包括<br />
现场检查(包括EDQM EDQM组织的 组织的GMP GMP<br />
现场检查)是由各成员国派出<br />
现场检查)是由各成员国派出GMP GMP检查官员,<br />
检查官员,<br />
在规范要求与缺陷评价方面具有显著差异。<br />
• 药品<br />
• 临床实验材料<br />
• 原料药 原料药(2005<br />
欧盟检查强制要求<br />
2005年11 11月开始 月开始, , 2004/27/EC, ARTICLE 46 46)<br />
IOM 5.1.2 现场检查方法<br />
现场检查方法<br />
FDA现场检查的目的 ?<br />
“现场检查用于<br />
现场检查用于获取当观 获取当观<br />
“ “一个机构的现场检查<br />
一个机构的现场检查<br />
个机构的现场检查 察到违反规范时的法律<br />
是对药厂仔细、严厉 行动所需的依据<br />
行动所需的依据,或旨 ,或旨<br />
和官方的考察以确定<br />
其与 其与FDA FDA颁布的法律<br />
颁布的法律<br />
的符合性 的符合性”<br />
在获取新技术、良好商<br />
业操守、或建立食品标<br />
准或其它规定的专门信<br />
息”<br />
((IOM IOM WEB / IOM CHAPTER 55))<br />
美国FDA与欧盟EMEA使命<br />
消费者<br />
健康<br />
保护<br />
• 化妆品<br />
• 食品添加剂<br />
• 低酸罐头食品<br />
• 药化饲料<br />
• 医疗器械 医疗器械/设备 设备(低风险 低风险)<br />
• 医疗器械 医疗器械(高风险 高风险)<br />
• 活性药物质<br />
活性药物质(原料药 原料药)<br />
• 医疗器械 医疗器械(无菌 无菌)<br />
• 药品 药品(化学来源 化学来源)<br />
• 血液和血液制品<br />
• 药品 药品(生物技术来源<br />
生物技术来源)<br />
FDA 检查强制要求<br />
严格程度增加<br />
不受FDA现场检查的机构<br />
工程或建筑公司<br />
设备生产与供应商<br />
非生产合同厂商<br />
非生产合同厂商<br />
非检测合同厂商<br />
外部培训机构<br />
咨询公司<br />
9
总统<br />
卫生与民众服务部<br />
公众健康服务<br />
美国政府卫生部机构<br />
食品药品署<br />
下设中心 (负责科学评价):<br />
生物药品评价与研究中心 [CBER]<br />
化学药品评价与研究中心 [CDER]<br />
医疗器械和放射性健康中心 [CDRH]<br />
食品安全与实用营养品中心 [CFSAN]<br />
兽药中心<br />
下设办公机构(负责规范评价):<br />
[CVM]<br />
药政事务办公室<br />
专员办公室<br />
[ORA]<br />
仿制药办公室 [OGD]<br />
FDA FDA现场检查制度<br />
现场检查制度<br />
法律 法律 联邦食品/药品<br />
联邦食品 药品/化妆品法(<br />
化妆品法(21USCode 21USCode)<br />
规范 规范 药品生产良好规范( 21CFR210 21CFR210-211 211)<br />
检查指南 规范解释 - 供检查官参考<br />
行业指南 规范解释 – 供行业参考<br />
指导方针 检查指南+行业指南<br />
检查指南 行业指南<br />
FDA FDA的SOPs SOPs 符合性政策指南 (CPG)<br />
检查官操作手册<br />
检查官操作手册(IOM) (IOM)<br />
参考意见 生物产品指南<br />
现场检查报告 FDA FDA-483 483表 + 机构检查报告<br />
机构检查报告(EIR) (EIR)<br />
法院判决 法院判决 例如对Barr<br />
例如对 Barr公司的判决<br />
公司的判决<br />
FDA FDA面向 面向21 21世纪 世纪GMP GMP<br />
2004 2004年启动: 年启动:FDA FDA面向 面向21 21世纪 世纪GMP GMP最后报告 最后报告(PDF PDF)<br />
• 药品制造中的创新与持续改进 – 面向 面向21 21世纪药品 世纪药品<br />
• PAT PAT(过程分析技术)<br />
(过程分析技术) – 创新药品与生产和质量保证<br />
• 面向 面向21 面向 面向21 21世纪药品 世纪药品GMP GMP中基于风险方法<br />
中基于风险方法<br />
• 行业指南:<br />
行业指南:cGMP cGMP的质量系统方法<br />
的质量系统方法<br />
• 行业指南:用于临床实验中的计算机系统<br />
• 行业指南:植物药<br />
• 药品 药品GMP GMP问题与回答<br />
问题与回答<br />
• 混合药的 混合药的GMP GMP<br />
• 新药办公室新的基于风险的药品质量评价系统<br />
• FDA FDA内部作业的质量系统<br />
内部作业的质量系统<br />
• 药品现场检查培训课程<br />
化学药与生物药现场检查差别<br />
• 化学药现场检查<br />
– 区域 区域GMP GMP检查官 检查官<br />
• 生物药现场检查<br />
– “生物团队 生物团队” ” 方法<br />
• 区域 区域GMP GMP检查官 检查官<br />
• FDA FDA中心( 中心(CBER CBER)产品审计官<br />
)产品审计官<br />
• 药品质控实验室<br />
• 微生物质控实验室<br />
• 清洁过程验证<br />
• 高纯工艺水<br />
• 国外药厂<br />
• 工艺验证基本原则<br />
• 药物主文件<br />
药物主文件(DMF) (DMF)指南 指南<br />
• 超标 超标(OOS) (OOS)检测结果调查<br />
检测结果调查<br />
• 无菌工艺生产的无菌产品<br />
FDA FDA现场检查指南<br />
现场检查指南<br />
• 无菌原料药生产<br />
• 制剂生产<br />
• 口服固体制剂开发与验证批<br />
准前 准前/批准后事项<br />
准前 准前/批准后事项<br />
批准后事项<br />
• 外用药品<br />
• 口服液和悬浮液<br />
• 冻干粉针<br />
• 化妆品生产<br />
FDA FDA现场检查指南网站<br />
现场检查指南网站<br />
行业指南:<br />
行业指南:cGMP cGMP的质量系统方法<br />
的质量系统方法<br />
三大体系融合<br />
• ISO9000( ISO9000(国际标<br />
ISO9000( ISO9000(国际标 国际标<br />
准组织质量标准)<br />
• QSR QSR(医疗器材质<br />
(医疗器材质<br />
量系统规范)<br />
• cGMP cGMP(药品生产<br />
(药品生产<br />
良好管理规范)<br />
cGMP<br />
ISO 9000<br />
QSR<br />
10
行业指南:<br />
行业指南:cGMP cGMP的质量系统方法<br />
的质量系统方法<br />
指南宗旨<br />
质量应该建立在产品之中,不能<br />
质量应该建立在产品之中,不能<br />
仅仅依赖检测来确保产品质量<br />
仅仅依赖检测来确保产品质量<br />
行业指南:<br />
行业指南:cGMP cGMP的质量系统方法<br />
的质量系统方法<br />
现代质量概念<br />
D D. CAPA CAPA ( (整改与预防措施<br />
( (整改与预防措施<br />
整改与预防措施)<br />
E. 变更控制<br />
F. 质量部门<br />
G. 六大系统现场检查模式<br />
美欧现场检查要旨<br />
确保下列符合性<br />
确保下列符合性:<br />
• 与申报文件中承诺的符合性<br />
• 生产与检测的<br />
生产与检测的GMP GMP符合性 符合性<br />
行业指南:<br />
行业指南:cGMP cGMP的质量系统方法<br />
的质量系统方法<br />
现代质量概念:<br />
A. 质量<br />
B. 质量来源于设计与产品开发过程<br />
C. 风险管理 风险管理/风险评价 风险评价<br />
i. FMEA FMEA方法 方法<br />
ii. FTA方法<br />
iii. iii.HACCP HACCP方法 方法<br />
其它 其它FDA FDA指南文件 指南文件<br />
• FDA FDA关于制剂 关于制剂GMP GMP的修改( 的修改(2008 2008年12 12月生效) 月生效)<br />
• FDA FDA关于 关于OOS OOS调查的指南(<br />
调查的指南(2006 2006年10 10月生效) 月生效)<br />
• FDA FDA检查官药品制造检查指南(<br />
检查官药品制造检查指南(2002 2002年2月生效) 月生效)<br />
• FDA FDA关于 关于ICHQ7 ICHQ7作为原料药<br />
作为原料药GMP GMP(2006 2006年3月生效) 月生效)<br />
• FDA FDA关于药品生产与产品质量的其它信息<br />
关于药品生产与产品质量的其它信息<br />
美欧现场检查异同<br />
美国<br />
欧盟<br />
11
美国 美国<br />
美国 美国<br />
– 通过政府聘用考<br />
核<br />
– 参加过 参加过FDA FDA所有 所有<br />
培训课程<br />
– 接受过其它<br />
接受过其它FDA FDA<br />
检查官培训<br />
– 团队方式进行批准前审<br />
计( 计(PAI PAI)和 )和GMP GMP审计 审计<br />
检查人员<br />
欧盟 欧盟<br />
–具有制药行业的广泛管<br />
具有制药行业的广泛管<br />
理专长<br />
–具备相关的教育背景<br />
具备相关的教育背景<br />
–了解最新技术<br />
了解最新技术<br />
检查人员(续)<br />
– 非正式管理 –不鼓励与机<br />
不鼓励与机<br />
构建立关系<br />
– 具备信息自由度 (FOI)<br />
– 对伪劣行为打击严厉<br />
–必须是 必须是ISO ISO-9000 9000主评审 主评审<br />
员 (英国 英国)<br />
欧盟 欧盟<br />
– 单个检查官进行<br />
单个检查官进行GMP GMP审计 审计<br />
(无 (无PAI PAI审计类型)<br />
审计类型)<br />
– 非正式管理 -- --鼓励与官方的<br />
鼓励与官方的<br />
良好关系<br />
– 官方保密法律(英国)<br />
– 对伪劣行为打击严厉<br />
检查风格(续)<br />
美国: 美国:<br />
挑战符合性<br />
挑战符合性<br />
欧盟 欧盟<br />
挑战科学性<br />
挑战科学性<br />
美国 美国<br />
– 无指定专门机构<br />
– 重视或依据<br />
重视或依据FDA FDA历史检 历史检<br />
查结果<br />
– 按照检查清单进行审计<br />
– 检查官趋向年轻<br />
美国 美国<br />
• GMP GMP是规范 是规范<br />
检查人员(续)<br />
欧盟 欧盟<br />
检查风格<br />
• 为法院立案收集证据<br />
• 文字工作量大<br />
• 现场考察时间相对较<br />
少<br />
– 五年内指定国内相同机<br />
构,然后重新指定<br />
– 检查官关系和口头交流<br />
结果<br />
– 审计过程缓慢但是深入<br />
– 检查官趋向年长<br />
欧盟 欧盟<br />
• GMP GMP是法律或指南<br />
是法律或指南<br />
• 注重管理问题<br />
• 文字工作量少<br />
• 注重现场实际考察<br />
美国药品批准时间与现场检查<br />
评审步骤 急需药品 标准药品<br />
报送申请 0 0<br />
FDA30 FDA30天评审<br />
FDA30 FDA30天评审 天评审 30 30<br />
最早现场检查 45 45<br />
最迟现场检查 150 270<br />
新药批准 180 300<br />
现场检查时限 70 – 100 180 - 240<br />
12
FDA FDA药品 药品GMP GMP实施范围 实施范围<br />
• 研究 药物化学研究 [--- ---]<br />
药理学研究 [GLP]<br />
毒理学研究 [GLP]<br />
• 开发 发 制剂 制剂开发 发<br />
[GMP]<br />
分析方法开发 [GMP]<br />
临床批次生产 [GMP]<br />
临床实验 [GCP]<br />
• 生产 采购 [GMP]<br />
生产 [GMP]<br />
检测 [GMP]<br />
仓储 仓储/分发 分发 [GMP]<br />
可追溯性 可追溯性/召回 召回 [GMP]<br />
FDA FDA现场检查原因<br />
现场检查原因<br />
• INDA / ANDA / NDA / BLA / PMA 申请<br />
• 美国军队供应合同<br />
美国军队供应合同(FDA (FDA作为美国国防部药品<br />
作为美国国防部药品<br />
检查机构 检查机构) 检查机构 检查机构)<br />
• 投诉跟进<br />
• GMP GMP违反检查跟进<br />
违反检查跟进<br />
• 常规 常规GMP GMP现场检查 现场检查(大约每 大约每18 18–24 24个月进行一<br />
个月进行一<br />
次)<br />
如何应对欧盟现场检查<br />
情况简介(<br />
情况简介(1小时 小时 – 不要超过)<br />
不要超过)<br />
• 高层管理层<br />
• 设施描述<br />
• 财经稳定性(公司与地域)<br />
• 资本投资计划<br />
• 机构组织<br />
• 员工发展计划<br />
• 讨论本次检查程序<br />
FDA FDA批准前现场检查<br />
批准前现场检查<br />
批准前现场检查涵盖:<br />
批准前现场检查涵盖:<br />
– 临床实验药物申请<br />
临床实验药物申请(化学药 化学药) INDA<br />
– 非专利仿制药申请(化学药) ANDA<br />
– 新药上市许可申请 (化学药 化学药) NDA<br />
– 生物药上市许可申请<br />
生物药上市许可申请(生物药 生物药) BLA<br />
– 批准前上市申请 (医疗器械 医疗器械) PMA<br />
– 原料药生产厂家<br />
– 生物等效性测试机构<br />
– 合同生产厂商 (生产 生产+检测 检测)<br />
DMF<br />
按照注册途径安排:<br />
欧盟:谁进行检查<br />
• 依据集中化途径 (CPMP/EMEA)<br />
-- 由指定审计员负责现场检查<br />
• 依据国家注册途径<br />
-- 由本国药监机构现场检查<br />
• 管理控制<br />
• 管理效率<br />
欧盟检查官的关注点<br />
• 质量放行人员的作用<br />
放 作<br />
• GMP GMP符合性的保障<br />
符合性的保障<br />
• 从供应商选择到分销中心的工艺<br />
从供应商选择到分销中心的工艺/产<br />
品链流程<br />
13
欧盟现场检查典型问题 -1<br />
• 员工变动率如何?<br />
• 员工缺勤率如何?<br />
• 临时员工占总员工比例如何?<br />
• 公司邻居是谁和在生产什么?<br />
• 如何把质量议题向员工交流?<br />
• 当夜晚很迟的时候送货来到仓库情况如何?<br />
• 你对所有的天平衡器每天进行重量核实吗?<br />
G<br />
M<br />
P<br />
成成<br />
本本<br />
欧盟现场检查注重点<br />
• 合理的科学<br />
-- 追溯到 追溯到“基本原理”<br />
基本原理”<br />
• 具备逻辑性和可解释性<br />
• 管理能力与效率<br />
GMP GMP实施程度与成本关系<br />
实施程度与成本关系<br />
GMP GMP实施程度 实施程度<br />
90% 100%<br />
欧盟现场检查典型问题 -2<br />
• 解释供应商审计系统和该系统的依据?<br />
• 当条码读取器出现故障如何处置?<br />
• 该产品的投诉记录如何?<br />
• 如何授权批记录审核与产品放行?<br />
• 当人员在里面处于动态时,如何证明冻<br />
干设施仍可以称为是<br />
干设施仍可以称为是100 100级? 级?<br />
欧盟现场检查关注点<br />
欧盟现场检查关注点:<br />
验证过程中<br />
验证过程中QA QA作用 作用<br />
QA QA在验证任务团队管理中的功能<br />
在验证任务团队管理中的功能<br />
• 验证团队向谁报告?<br />
团 向谁报告<br />
• 谁真正引导<br />
谁真正引导QA QA作为验证团队一部分的方向?<br />
作为验证团队一部分的方向?<br />
• 谁为 谁为QA QA的团队融合作用提供回馈?<br />
的团队融合作用提供回馈?<br />
–大部分英国<br />
大部分英国MRHA MRHA关注 关注<br />
–美国公司由于已知的利益冲突而未能通过审计<br />
美国公司由于已知的利益冲突而未能通过审计<br />
现场检查失败的可能后果<br />
执行现场检查<br />
检查官签发<br />
检查官签发FD FD-483 483 + 编写 编写EIR( EIR( Establishment<br />
警告信<br />
同意裁决 / 海关扣留<br />
临时限制令<br />
罚款 罚款/利润损失 利润损失<br />
Inspection Report)<br />
14
FDA FDA现场检查失败的后果<br />
现场检查失败的后果<br />
• 惭愧 惭愧: : 每个人都知道你没有通过<br />
• 商业影响:丧失销售直到<br />
商业影响:丧失销售直到FDA FDA下一次现场检查,竞争者<br />
下一次现场检查,竞争者<br />
得到更多的获得批准的时间,可能会丧失市场或市场份<br />
额 额,投资者害怕,影响其它向<br />
额,投资者害怕,影响其它向FDA<br />
投资者害怕 影响其它向<br />
影响其它向FDA FDA递交的申请 FDA递交的申请,所在地<br />
递交的申请 递交的申请,所在地/ 所在地 所在地/<br />
国家药监机构立即知情,未来产品责任更大等。<br />
• 个人影响:可能会被辞退工作<br />
• 更多的影响:临床实验需要终结,潜在病人无处可以获<br />
取同样的药物<br />
美国 美国FDA FDA重要信息网站介绍<br />
重要信息网站介绍<br />
FDA FDA规范行业信息<br />
规范行业信息<br />
化学药物评审中心<br />
美国 美国FDA FDA规范事务办公室<br />
规范事务办公室<br />
美国 美国FDA FDA信息自由制度<br />
信息自由制度<br />
美国现场检查信息自由制度<br />
• 信息自由资料对世界上任何地方的任何人开放<br />
• 30 30页以内资料不收任何费用,超过<br />
页以内资料不收任何费用,超过30 30页每页收 页每页收10 10美分 美分<br />
• 资料检索时间收费,取决于检索的复杂程度<br />
• 资料索取要求<br />
资料索取要求10<br />
资料索取要求<br />
资料索取要求10 10日内通知 日内通知<br />
• 回复时间:即刻到<br />
回复时间:即刻到15 15个月之间 个月之间<br />
• 向信息自由部索取<br />
向信息自由部索取FDA FDA资料的联系信息如下:<br />
资料的联系信息如下:<br />
Freedom Of Information Staff [HFI [HFI-35] 35]<br />
Food and Drug Administration<br />
5600 Fishers Lane<br />
Rockville MD 20857 USA<br />
• 通过信件或传真索取,不接受电子邮件或网络索取<br />
美欧 美欧GMP GMP现场检查相关网站介绍<br />
现场检查相关网站介绍<br />
美国现场检查信息自由制度<br />
–视为民主与开放型政府的形式(可以间接视为政<br />
视为民主与开放型政府的形式(可以间接视为政<br />
府资助的工业间谍活动)<br />
–可以获得除被视为是国家机密或商业机密的任何<br />
可以获得除被视为是国家机密或商业机密的任何<br />
信息<br />
–不包括临床实验(<br />
不包括临床实验(INDAs INDAs), , 新药 新药/非专利仿制药<br />
非专利仿制药<br />
(A/NDAs A/NDAs), , 原料药( 原料药(DMFs DMFs), , 生物药( 生物药(BLAs BLAs)<br />
的信息<br />
–包括的信息:现场检查报告、药厂资料、某些会<br />
包括的信息:现场检查报告、药厂资料、某些会<br />
议纪要等<br />
英国( 英国(MHRA MHRA)与欧盟 )与欧盟 (EMEA EMEA)<br />
药监部门信息资源<br />
医疗与健康产品规范署<br />
(MHRA MHRA)<br />
Market Towers<br />
1 Nine Elms Street<br />
London SW1, United<br />
Kingdom<br />
英国信息自由制度<br />
欧洲医疗产品审评署<br />
(EMEA EMEA)<br />
7 Westferry Circus,<br />
Canary Wharf<br />
London E14 4HB,<br />
United Kingdom<br />
15
FDA FDA现场检查方式:系统检查<br />
现场检查方式:系统检查<br />
所有公司都有六大系统:<br />
所有公司都有六大系统:<br />
• 质量系统<br />
• 设施与设备系统<br />
• 物料系统<br />
• 生产系统<br />
• 包装与标签系统<br />
• 实验室控制系统<br />
系统检查 系统检查: : “ “全检” 全检”<br />
–设施的初次检查<br />
设施的初次检查<br />
–符合性历史数据出现问题<br />
符合性历史数据出现问题<br />
–上次检查后发生重大变更<br />
上次检查后发生重大变更<br />
• 新的交叉污染可能性<br />
• 新技术、设备、设施<br />
–警告信跟踪(转化为有因检查)<br />
警告信跟踪(转化为有因检查)<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
德国卫生部下属两个机构(BMGS German Ministry of<br />
Health– “Bundesoberbehörden”)<br />
<br />
BfArM– 普通药品上市许可(Marketing authorisation,<br />
(general))<br />
<br />
PEI– 血液制品、血清和疫苗上市许可(MA for blood,<br />
sera sera, vaccines etc etc.) )<br />
<br />
16个联邦省局 Federal States Ministries (“Laender”) (in<br />
Bavaria StMGUGV, Munich)<br />
1个中心调度机构(with 1 Central Co-ordination Unit<br />
(ZLG)in Bavaria)<br />
<br />
7 个地区政府局Regional Governments (e.g. RvS)<br />
-制造与进口许可(Manufacturing and Import Licenses)<br />
-公司的指导Supervision of companies<br />
-世界卫生组织证书(WHO Certificates)<br />
<br />
实验室( Laboratory -OMCL Oberschleissheim)<br />
with 1 Central Co-ordination Unit (LGL)<br />
系统检查中的选项<br />
– 全检选项<br />
• 质量系统加其它三个系统<br />
– 简化检查<br />
• 质量系统加其它两个系统<br />
避免混淆 避免混淆 ….<br />
– 符合性检查<br />
• 核实以前缺陷的整改<br />
• 包括有因检查<br />
系统检查 系统检查: : “简化检查”<br />
–不使用全检模式<br />
不使用全检模式<br />
–作为进行中的监督检查<br />
作为进行中的监督检查<br />
–足够作为日常检查<br />
足够作为 足够作为日常检查 常检查<br />
–满足两年一次的检查要求<br />
满足两年一次的检查要求<br />
–简化检查中的轮换系统选择(大区决定<br />
简化检查中的轮换系统选择(大区决定<br />
哪些系统受检)<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
德国卫生部下属两个机构(BMGS German Ministry of<br />
Health– “Bundesoberbehörden”)<br />
<br />
BfArM– 普通药品上市许可(Marketing authorisation,<br />
(general))<br />
<br />
PEI– 血液制品、血清和疫苗上市许可(MA for blood,<br />
sera sera, vaccines etc etc.) )<br />
<br />
16个联邦省局 Federal States Ministries (“Laender”) (in<br />
Bavaria StMGUGV, Munich)<br />
1个中心调度机构(with 1 Central Co-ordination Unit<br />
(ZLG)in Bavaria)<br />
<br />
7 个地区政府局Regional Governments (e.g. RvS)<br />
-制造与进口许可(Manufacturing and Import Licenses)<br />
-公司的指导Supervision of companies<br />
-世界卫生组织证书(WHO Certificates)<br />
<br />
实验室( Laboratory -OMCL Oberschleissheim)<br />
with 1 Central Co-ordination Unit (LGL)<br />
16
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
法律 Pharmaceuticals:<br />
2001/83/EC (hum.) & 2001/82/EEC(vet.)<br />
GMP-Directives:<br />
91/356/EEC (hum) & 91/412/EEC(vet)<br />
规范 EMEA, central authorization &<br />
supervision of med. Products 2309/93/EC<br />
transferred<br />
into 15<br />
national<br />
member<br />
state laws<br />
directly<br />
binding<br />
规定 e.g. related to BSE/ TSE directly<br />
binding<br />
指南/指导原 GMP – Guide<br />
则(软法律) Rules governing med. products<br />
Compilation of Community<br />
Procedures<br />
current<br />
standard<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
GMP GMP现场检查类型:<br />
现场检查类型:<br />
• 国内 国内GMP GMP现场检查 现场检查<br />
• 国外 国外GMP GMP现场检查 现场检查<br />
• 根据 根据EMEA EMEA要求,按照(<br />
要求,按照(CPMP/CVMP<br />
CPMP/CVMP)对直 )对直<br />
接在欧盟 接在欧盟EMEA EMEA注册的药品进行<br />
注册的药品进行GMP GMP现场检查 现场检查<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
*GMP *GMP飞行检查模式适应条件:<br />
飞行检查模式适应条件:<br />
• 未能遵守药品生产许可证的规定放行产品<br />
• 药品召回或药品投诉<br />
• 重大人员变更或厂房设施变更但没有通知药监检查机构<br />
• 发现大量 发现大量GMP GMP缺陷后核实整改情况<br />
缺陷后核实整改情况<br />
• 公司隐藏东西<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
• 依据法律 依据法律2003/94/EC(<br />
2003/94/EC(取代 取代91/356/EEC)<br />
91/356/EEC)和2001/83/EC<br />
2001/83/EC<br />
检查人用药制造厂商的<br />
检查人用药制造厂商的GMP GMP符合性 符合性<br />
• 依据 依据91/412/EEC<br />
91/412/EEC 和2001/82/EC<br />
2001/82/EC检查兽用药制造厂商的<br />
检查兽用药制造厂商的<br />
检查兽 药制 商的<br />
GMP GMP符合性 符合性<br />
• GMP GMP现场检查至少每两年一次,大公司可以逐个分厂<br />
现场检查至少每两年一次,大公司可以逐个分厂<br />
部门实施 部门实施GMP GMP现场检查,每<br />
现场检查,每5年必须全部检查完一次<br />
年必须全部检查完一次<br />
• 两次 两次GMP GMP现场检查之间的时间从不超过<br />
现场检查之间的时间从不超过3年<br />
德国 德国GMP GMP检查法规与指南<br />
检查法规与指南<br />
GMP GMP现场检查模式:<br />
现场检查模式:<br />
• 整体 整体GMP GMP现场检查 现场检查<br />
• GMP GMP现场复检 现场复检<br />
• 产品或工艺相关检查<br />
• 突发事件检查(采取飞行检查模式<br />
突发事件检查(采取飞行检查模式*)<br />
英国 英国GMP GMP检查法规与指南<br />
检查法规与指南<br />
英国 英国GMP GMP现场检查的法规与指南涵盖:<br />
现场检查的法规与指南涵盖:<br />
• 合格放行人(<br />
合格放行人(QULIFIED QULIFIED PERSON) PERSON):负责放行用于临<br />
:负责放行用于临<br />
床的药品或者上市销售的人用和兽用药品(<br />
床的药品或者上市销售的人用和兽用药品(QP QP)<br />
• 基于风险的检查(<br />
基于风险的检查(RISK RISK-BASED BASED INSPECTION):<br />
GMP GMP现场检查的范围、频率和深度取决于被规范机构<br />
现场检查的范围、频率和深度取决于被规范机构<br />
执行 执行GMP GMP规范的责任度(<br />
规范的责任度( RISK RISK-BASED BASED INSPECTION)<br />
INSPECTION<br />
• 原料药( 原料药(API API): ): 2005 2005年10 10月欧盟通过立法对欧盟制剂<br />
月欧盟通过立法对欧盟制剂<br />
厂商使用的起始原料药监管必须按照<br />
厂商使用的起始原料药监管必须按照2001/83/EC 2001/83/EC修改后 修改后<br />
的版本 的版本2004/27/EC 2004/27/EC,并将该规范转为每个成员国的法律。<br />
,并将该规范转为每个成员国的法律。<br />
17
英国 英国GMP GMP检查法规与指南<br />
检查法规与指南<br />
原料药( 原料药(API API)<br />
• 英国于 英国于2005 2005年10 10月将欧盟法律<br />
月将欧盟法律2004/27/EC<br />
2004/27/EC制定为本国<br />
制定为本国<br />
的法定文件(<br />
的法定文件(STATUTORY STATUTORY INSTRUMENT) S.I.<br />
2005/2789 2005/2789。<br />
• 英国根据法律<br />
英国根据法律S.I. S.I. 2005/2789 2005/2789,强制执行<br />
,强制执行2004/27/EC<br />
2004/27/EC第<br />
46(f) 46(f)条款 条款 ,要求 ,要求MAH MAH(药品生产许可证持有者)采用<br />
(药品生产许可证持有者)采用<br />
的起始原料药是按照<br />
的起始原料药是按照GMP GMP规范制造的。<br />
规范制造的。<br />
• 英国 英国MHRA MHRA制定了关于在制剂生产厂检查原料药的相应<br />
制定了关于在制剂生产厂检查原料药的相应<br />
文件( 文件(API API FOCUSED MHRA INSPECTIONS<br />
INSPECTIONS)<br />
英国 英国GMP GMP检查法规与指南<br />
检查法规与指南<br />
英国 英国GMP GMP现场检查程序(<br />
现场检查程序(INSPECTION<br />
INSPECTION PROCESS):<br />
通知 预先通知(电话和书面方式),按照基于风险的<br />
基础模式,被检查机构需要填写相关表格。<br />
执行 初始会议、详细现场检查、小结会议<br />
缺陷 重大缺陷(生产有害产品)、主要缺陷(偏离GMP<br />
重大缺陷(生产有害产品)、主要缺陷(偏离 GMP<br />
规范)、一般缺陷(重大和主要缺陷以外的缺陷)<br />
决策 颁发GMP 颁发 GMP证书或信件,或采取法律行动(<br />
证书或信件,或采取法律行动(IAG IAG)<br />
现场检查强度<br />
现场检查强度<br />
各国 各国GMP GMP现场检查强度<br />
现场检查强度<br />
美国 美国 [FDA FDA]<br />
英国 英国 [MHRA MHRA]<br />
澳大利亚 澳大利亚 [TGA TGA]<br />
加拿大 加拿大 [TPD TPD]<br />
欧盟 欧盟/波罗的海 波罗的海 [EMEA EMEA][ ][EDQM EDQM][NATIONS]<br />
][NATIONS]<br />
日本 日本 [PMDA PMDA]<br />
欧盟 欧盟 /地中海 地中海<br />
巴西,沙特阿拉伯<br />
巴西,沙特阿拉伯<br />
英国 英国GMP GMP检查法规与指南<br />
检查法规与指南<br />
英国 英国GMP GMP现场检查适应类型与模式:<br />
现场检查适应类型与模式:<br />
• 药品生产许可证持有者<br />
• 上市许可证申请中列出的国外生产基地<br />
• 英国国内或海外原料药生产厂家<br />
• 血液制品生产地点<br />
• 药品分销商<br />
• 合同质控化验室<br />
• 违规机构<br />
英国 英国GMP GMP现场检查通常<br />
现场检查通常2-3年一次(特殊情况除外)。<br />
年一次(特殊情况除外)。<br />
WHO EU<br />
effective 25 countries, in 104 most countries of Europe<br />
PIC<br />
27 countries, mostly of Europe,<br />
but rapidly expanding … USA?<br />
ASEAN<br />
11 countries, mostly SE Asia<br />
ICH<br />
3 trade blocks – EU/Japan/USA<br />
药品 药品GMP GMP国际组织 国际组织<br />
Plus Bilateral MRAs:<br />
USA - Australia, Canada, Sweden, Switzerland<br />
Australia – NZ / Canada - EU<br />
MERCOSUR [work in progress]<br />
Argentina-Brazil-Paraguay-Uruguay<br />
问题咨询联系信息<br />
程毓渡博士<br />
美欧 美欧GMP GMP咨询专家 咨询专家<br />
上海新科咨询执行总裁<br />
电话: 电话:021 021 6426 2161<br />
传真: 传真:021 021 6426 1927<br />
手机: 手机:13818112430<br />
13818112430<br />
Email: yudu.cheng@shnovoscience.com<br />
网址: 网址:http://www.shnovoscience.com.cn<br />
http://www.shnovoscience.com.cn<br />
18