СÐÐÐ ÐÐÐ ÐÐÐÐЧ РУÐÐ ÐÐÐÐÐÐÐ ÐРХÐÐÐÐ
СÐÐÐ ÐÐÐ ÐÐÐÐЧ РУÐÐ ÐÐÐÐÐÐÐ ÐРХÐÐÐРСÐÐÐ ÐÐÐ ÐÐÐÐЧ РУÐÐ ÐÐÐÐÐÐÐ ÐРХÐÐÐÐ
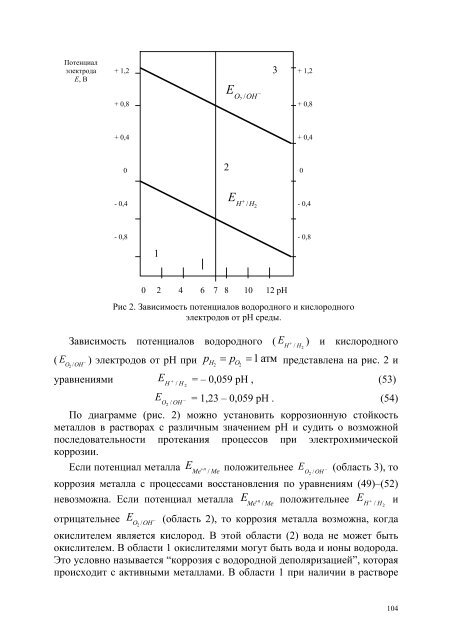
Потенциал электрода Е, В + 1,2 3 + 1,2 + 0,8 E O 2 / OH − + 0,8 + 0,4 + 0,4 0 2 0 - 0,4 E H + / H 2 - 0,4 - 0,8 1 - 0,8 0 2 4 6 7 8 10 12 рН E / Рис 2. Зависимость потенциалов водородного и кислородного электродов от рН среды. Зависимость потенциалов водородного ( ( − O2 OH уравнениями E + H / H 2 ) и кислородного ) электродов от рН при p = p = атм представлена на рис. 2 и H / H 2 H2 O 1 2 E + = – 0,059 рН , (53) E O / OH 2 − = 1,23 – 0,059 рН . (54) По диаграмме (рис. 2) можно установить коррозионную стойкость металлов в растворах с различным значением рН и судить о возможной последовательности протекания процессов при электрохимической коррозии. Если потенциал металла E E Me n / Me O2 / OH − (область 3), то коррозия металла с процессами восстановления по уравнениям (49)–(52) невозможна. Если потенциал металла положительнее E + и E / E Me n / Me отрицательнее − O2 OH (область 2), то коррозия металла возможна, когда окислителем является кислород. В этой области (2) вода не может быть окислителем. В области 1 окислителями могут быть вода и ионы водорода. Это условно называется “коррозия с водородной деполяризацией”, которая происходит с активными металлами. В области 1 при наличии в растворе H / H 2 104
растворенного кислорода окислителем будет и кислород по реакции (52). Это условно называется “коррозия с кислородной деполяризацией”. Таким образом, в области 1 окислителями могут выступать все вышеперечисленные вещества: кислород, ионы водорода, вода (реакции (49)–(52)). Пример 1. Какие металлы могут корродировать с кислородной деполяризацией в растворе с рН = 7,0 и давлением кислорода p O2 = 1,0? Решение. По уравнению (54) рассчитаем потенциал кислородного электрода E O / OH 2 − = 1,23 – 0,059 рН = 0,817 В. Таким образом, в заданных условиях могут корродировать металлы, электродный потенциал которых меньше 0,817 В, например медь, железо, цинк и др. Пример 2. Как происходит коррозия цинка, находящегося в контакте с медью в нейтральном и кислом растворах? Составьте электронные уравнения анодного и катодного процессов. Каков состав продуктов коррозии? Решение. Цинк имеет более отрицательный потенциал (-0,763 В), чем медь (0,34 В), поэтому он является анодом, а медь катодом. Анодный процесс: Zn – 2e = Zn 2+ ; Катодный процесс: в кислой среде 2Н + + 2е = Н 2 , в нейтральной среде 1/2О 2 + Н 2 О + 2е = 2ОН - . Так как ионы цинка Zn 2+ с ОН - -группами образуют нерастворимый гидроксид, то продуктом коррозии будет Zn(ОН) 2 . Пример 3. Составление схемы гальванического элемента, образующегося при коррозии металла. Хром находится в контакте с медью. Какой из металлов будет окисляться при коррозии в среде соляной кислоты? Составьте уравнения реакций и схему образующегося гальванического элемента. Решение. Исходя из положения металлов в ряду стандартных электродных потенциалов находим, что хром – более активный металл (Е 0 = –0,744 В) и в образующейся гальванопаре будет анодом; медь – катодом (Е 0 = 0,34 В). Хромовый анод растворяется: Cr – 3e = Cr 3+ . На медном катоде выделяется водород: 2Н + + 2е = Н 2 . Схема работающего гальванического элемента: (–) 2Cr ⏐ Cr 3+ ⏐ НС1 ⏐ (Сu) 3Н 2 ⏐ 6Н + (+). 105
- Page 53 and 54: ( 124,7 + ) , или ,4 ⋅124,7 =
- Page 55 and 56: 262. Какую массу Na 2 SO
- Page 57 and 58: Коэффициенты раств
- Page 59 and 60: где с - удельная теп
- Page 61 and 62: 291. При растворении
- Page 63 and 64: расчете состава ан
- Page 65 and 66: 310. Раствор сахара (
- Page 67 and 68: равен содержанию 20,
- Page 69 and 70: Таким образом, коли
- Page 71 and 72: K Д = 2 2 αC⋅αC α C α = = (
- Page 73 and 74: молекул кислоты, и
- Page 75 and 76: 364. Вычислите конст
- Page 77 and 78: 366. Насыщенный раст
- Page 79 and 80: Логарифмируя соотн
- Page 81 and 82: 391. Чему равна конст
- Page 83 and 84: Как правило, степен
- Page 85 and 86: 403. Напишите в ионно
- Page 87 and 88: РАЗДЕЛ 7. ЭЛЕКТРОХИ
- Page 89 and 90: n - число ионов желе
- Page 91 and 92: 445. Вычислите потен
- Page 93 and 94: −3 E 2 H + H = 0, 059lg 5, 664⋅
- Page 95 and 96: ΔG 0 обр.(Сu 2+ ) = +66,2 кД
- Page 97 and 98: На практике вследс
- Page 99 and 100: никелировании в те
- Page 101 and 102: электроды нераство
- Page 103: расплава, если терм
- Page 107 and 108: 516. Какое покрытие м
- Page 109 and 110: СПИСОК ЛИТЕРАТУРЫ 1
- Page 111 and 112: 1 2 3 4 MgO(к) -601,24 -569,6 26,9
- Page 113 and 114: периоды 1 ряды I ПЕР
- Page 115 and 116: Таблица 7 Произведе
- Page 117 and 118: 3.4. 146. Реакция 1 и 2; 14
- Page 119 and 120: 295. 11,46 г; 297. -77,7 кДж/м
- Page 121 and 122: 438. 2,46; 3,4⋅10 -2 ; 439. -0,29
Потенциал<br />
электрода<br />
Е, В<br />
+ 1,2<br />
3<br />
+ 1,2<br />
+ 0,8<br />
E O<br />
2 /<br />
OH<br />
−<br />
+ 0,8<br />
+ 0,4<br />
+ 0,4<br />
0<br />
2<br />
0<br />
- 0,4<br />
E H<br />
+ / H 2<br />
- 0,4<br />
- 0,8<br />
1<br />
- 0,8<br />
0 2 4 6 7 8 10 12 рН<br />
E /<br />
Рис 2. Зависимость потенциалов водородного и кислородного<br />
электродов от рН среды.<br />
Зависимость потенциалов водородного (<br />
( −<br />
O2<br />
OH<br />
уравнениями<br />
E +<br />
H<br />
/ H 2<br />
) и кислородного<br />
) электродов от рН при p = p = атм представлена на рис. 2 и<br />
H<br />
/ H 2<br />
H2 O<br />
1<br />
2<br />
E + = – 0,059 рН , (53)<br />
E<br />
O / OH<br />
2<br />
−<br />
= 1,23 – 0,059 рН . (54)<br />
По диаграмме (рис. 2) можно установить коррозионную стойкость<br />
металлов в растворах с различным значением рН и судить о возможной<br />
последовательности протекания процессов при электрохимической<br />
коррозии.<br />
Если потенциал металла E E<br />
Me n / Me<br />
O2<br />
/ OH<br />
− (область 3), то<br />
коррозия металла с процессами восстановления по уравнениям (49)–(52)<br />
невозможна. Если потенциал металла положительнее E + и<br />
E /<br />
E<br />
Me n / Me<br />
отрицательнее<br />
−<br />
O2<br />
OH<br />
(область 2), то коррозия металла возможна, когда<br />
окислителем является кислород. В этой области (2) вода не может быть<br />
окислителем. В области 1 окислителями могут быть вода и ионы водорода.<br />
Это условно называется “коррозия с водородной деполяризацией”, которая<br />
происходит с активными металлами. В области 1 при наличии в растворе<br />
H<br />
/ H 2<br />
104