Totul despre Proteine - GRUPA IV.pdf
Totul despre Proteine - GRUPA IV.pdf
Totul despre Proteine - GRUPA IV.pdf
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
2. Proprietăţile fizico-chimice<br />
2.1. Masă moleculară<br />
Datorită formării aproape în exclusivitate din aminoacizi, putem considera proteinele<br />
ca fiind de fapt nişte polipeptide, cu masă moleculară foarte mare intre 10.000 şi<br />
60.000.000.Masa moleculară se determină prin diferite metode, mai ales în cazul proteinelor<br />
cu masa moleculară foarte mare ca de exemplu proteina C reactivă. Masa moleculară a<br />
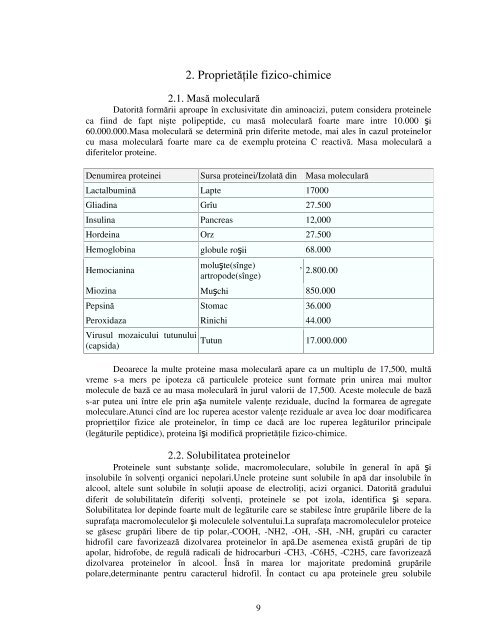
diferitelor proteine.<br />
Denumirea proteinei Sursa proteinei/Izolată din Masa moleculară<br />
Lactalbumină Lapte 17000<br />
Gliadina Grîu 27.500<br />
Insulina Pancreas 12,000<br />
Hordeina Orz 27.500<br />
Hemoglobina globule roşii 68.000<br />
Hemocianina<br />
moluşte(sînge) ,<br />
artropode(sînge)<br />
9<br />
2.800.00<br />
Miozina Muşchi 850.000<br />
Pepsină Stomac 36.000<br />
Peroxidaza Rinichi 44.000<br />
Virusul mozaicului tutunului<br />
(capsida)<br />
Tutun 17.000.000<br />
Deoarece la multe proteine masa moleculară apare ca un multiplu de 17,500, multă<br />
vreme s-a mers pe ipoteza că particulele proteice sunt formate prin unirea mai multor<br />
molecule de bază ce au masa moleculară în jurul valorii de 17,500. Aceste molecule de bază<br />
s-ar putea uni între ele prin aşa numitele valenţe reziduale, ducînd la formarea de agregate<br />
moleculare.Atunci cînd are loc ruperea acestor valenţe reziduale ar avea loc doar modificarea<br />
proprietţilor fizice ale proteinelor, în timp ce dacă are loc ruperea legăturilor principale<br />
(legăturile peptidice), proteina îşi modifică proprietăţile fizico-chimice.<br />
2.2. Solubilitatea proteinelor<br />
<strong>Proteine</strong>le sunt substanţe solide, macromoleculare, solubile în general în apă şi<br />
insolubile în solvenţi organici nepolari.Unele proteine sunt solubile în apă dar insolubile în<br />
alcool, altele sunt solubile în soluţii apoase de electroliţi, acizi organici. Datorită gradului<br />
diferit de solubilitateîn diferiţi solvenţi, proteinele se pot izola, identifica şi separa.<br />
Solubilitatea lor depinde foarte mult de legăturile care se stabilesc între grupările libere de la<br />
suprafaţa macromoleculelor şi moleculele solventului.La suprafaţa macromoleculelor proteice<br />
se găsesc grupări libere de tip polar,-COOH, -NH2, -OH, -SH, -NH, grupări cu caracter<br />
hidrofil care favorizează dizolvarea proteinelor în apă.De asemenea există grupări de tip<br />
apolar, hidrofobe, de regulă radicali de hidrocarburi -CH3, -C6H5, -C2H5, care favorizează<br />
dizolvarea proteinelor în alcool. Însă în marea lor majoritate predomină grupările<br />
polare,determinante pentru caracterul hidrofil. În contact cu apa proteinele greu solubile