- Page 1 and 2:
Martha Reis Qu’mica Manual do Pro
- Page 3 and 4:
Diretoria editorial Lidiane Vivaldi
- Page 5 and 6:
As ilustrações estão fora de esc
- Page 7 and 8:
Sumário Unidade 1: Mudanças clim
- Page 9 and 10:
UNIDADE 1 Mudanças climáticas Mud
- Page 11 and 12:
Fotos: ULTRA.F/Getty Images 1 O que
- Page 13 and 14:
A Química polui? Em geral, há vá
- Page 15 and 16:
2 Grandezas f’sicas Para medir, c
- Page 17 and 18:
Curiosidade Quilograma-padrão O pa
- Page 19 and 20:
Abaixo da camada de gelo formada, a
- Page 21 and 22:
Experimento Densidade e correntes d
- Page 23 and 24:
Temperatura e calor A temperatura
- Page 25 and 26:
Alex Argozino/Arquivo da editora A
- Page 27 and 28:
X d) à diminuição da pressão at
- Page 29 and 30:
1 Propriedades que definem a matŽr
- Page 31 and 32:
A. Parramón/AP Photo B A Água em
- Page 33 and 34:
Chuva Neve acumulada nos galhos da
- Page 35 and 36:
Exercício resolvido 1 (Unicamp-SP)
- Page 37 and 38:
A capacidade de dissolução da sac
- Page 39 and 40:
Exercício resolvido 2 Veja a segui
- Page 41 and 42:
Há vários indícios que evidencia
- Page 43 and 44:
De onde vem... para onde vai? îxid
- Page 45 and 46:
3 Propriedades de grupos A flor de
- Page 47 and 48:
Exercício resolvido 3 (Ufscar-SP)
- Page 49 and 50:
1 Classifica•‹o dos materiais U
- Page 51 and 52:
Kostin/Shutterstock O aço é um ma
- Page 53 and 54:
Exercício resolvido 1 (Unicamp-SP)
- Page 55 and 56:
Veja no quadro a seguir como são c
- Page 57 and 58:
3 Separação de misturas Você rec
- Page 59 and 60:
Há vários fatores que interferem
- Page 61 and 62:
O problema de utilizar a água do m
- Page 63 and 64:
Geralmente as ETAs também fazem o
- Page 65 and 66:
Exercício resolvido 3 (Unicamp-SP)
- Page 67 and 68:
Cotidiano do Químico Destilação
- Page 69 and 70:
Curiosidade Os céticos do aquecime
- Page 71 and 72:
Exercício resolvido 4 (Fuvest-SP)
- Page 73 and 74:
UNIDADE 2 Oxigênio e ozônio Oxig
- Page 75 and 76:
O gás carbônico que liberamos na
- Page 77 and 78:
Sciencephotos/Alamy/Latinstock Rea
- Page 79 and 80:
Curiosidade O jogo de interesses na
- Page 81 and 82:
Exercício resolvido 1 (Vunesp-SP)
- Page 83 and 84:
Beatriz Lefévre/O2 Filmes 4 Lei da
- Page 85 and 86:
Lavoisier também explicou corretam
- Page 87 and 88:
Lembre-se de que na época (século
- Page 89 and 90:
6 Método científico Para evitar o
- Page 91 and 92:
Album/Oronoz/Latinstock É por isso
- Page 93 and 94:
massa de modelar seringas tira de i
- Page 95 and 96:
Contradições entre a hipótese e
- Page 97 and 98:
Observe o raciocínio utilizado por
- Page 99 and 100:
Exercício resolvido 3 (Vunesp-SP)
- Page 101 and 102:
CAPÍTULO 5 Notações químicas FO
- Page 103 and 104:
2 S’mbolos dos elementos karawan/
- Page 105 and 106:
Ilustrações: Banco de imagens/Arq
- Page 107 and 108:
Uma sugestão para iniciar o balanc
- Page 109 and 110:
5 Massa molecular e massa atmica Sh
- Page 111 and 112:
Pelo modelo de Dalton, o átomo é
- Page 113 and 114:
Akg-Images/Latinstock Wilhelm Ostwa
- Page 115 and 116:
Um raciocínio semelhante ao do exp
- Page 117 and 118:
As únicas substâncias que possuem
- Page 119 and 120:
6 Fórmulas químicas Encontrar a f
- Page 121 and 122:
Como exemplo, vamos calcular a part
- Page 123 and 124:
7 Alotropia Os elementos que aprese
- Page 125 and 126:
Retomando a notícia Você leu na p
- Page 127 and 128:
Alótropos do carbono As ilustraç
- Page 129 and 130:
De onde vem... para onde vai? Fósf
- Page 131 and 132:
Exercício resolvido 5 (UEsPI) o el
- Page 133 and 134:
UNIDADE 3 Poluição eletromagnéti
- Page 135 and 136:
1 A imagem do ‡tomo Microscópio
- Page 137 and 138:
2 A eletricidade O modelo atômico
- Page 139 and 140:
As ampolas de Crookes O fenômeno d
- Page 141 and 142:
Experimento Eletrólitos e não ele
- Page 143 and 144:
Exercício resolvido 1 Depois que T
- Page 145 and 146:
Veja mais detalhes a esse respeito
- Page 147 and 148:
Exercício resolvido 2 (IFSudeste-M
- Page 149 and 150:
Rutherford trabalhou junto com outr
- Page 151 and 152:
Alex Argozino/Arquivo da editora el
- Page 153 and 154:
5 Investigação da natureza da luz
- Page 155 and 156:
A teoria de Max Planck A maior comp
- Page 157 and 158:
Vlue/123RF/Easypix 6 Espectros dos
- Page 159 and 160:
• Quando um elétron passa de um
- Page 161 and 162:
CAPÍTULO 7 Modelo básico do átom
- Page 163 and 164:
James Chadwick recebeu o prêmio No
- Page 165 and 166:
O diâmetro do núcleo de um átomo
- Page 167 and 168:
Massa atômica A massa atômica ofi
- Page 169 and 170:
4 A eletrosfera O próton e o elét
- Page 171 and 172:
REtomANdo A NotíCIA A reportagem d
- Page 173 and 174:
5 distribuição eletrônica Para o
- Page 175 and 176:
SP/Latinstock O bromo é líquido
- Page 177 and 178:
Exercício resolvido 3 Se contarmos
- Page 179 and 180:
7 A tabela periódica atual Na tabe
- Page 181 and 182:
A tabela e o diagrama de energia A
- Page 183 and 184:
8 Classifica•‹o dos elementos O
- Page 185 and 186:
De onde vem... para onde vai? Ferro
- Page 187 and 188:
Exercício resolvido 4 A seguir des
- Page 189 and 190:
Variação do raio atômico em um p
- Page 191 and 192:
Energia de ionização Quando retir
- Page 193 and 194:
Eletronegatividade Determinados ele
- Page 195 and 196:
X X 33 Cristais de NaF e MgF 2 diss
- Page 197 and 198:
UNIDADE 4 Poluição de interiores
- Page 199 and 200:
1 Estabilidade e regra do octeto Na
- Page 201 and 202: 3 Ligação covalente e energia Vam
- Page 203 and 204: — — 5 Compostos formados segund
- Page 205 and 206: k 7 Resson‰ncia Como você perceb
- Page 207 and 208: Exercício resolvido 1 (Unicamp-SP)
- Page 209 and 210: Contração do octeto Comumente oco
- Page 211 and 212: Por isso, concluímos que a estrutu
- Page 213 and 214: predominantemente covalente predomi
- Page 215 and 216: Exercício resolvido 2 O dióxido d
- Page 217 and 218: H 11 As ilustrações estão fora d
- Page 219 and 220: Legenda da tabela: carbono oxigêni
- Page 221 and 222: Exercício resolvido 3 (Unicamp-SP)
- Page 223 and 224: Analisando a tabela da página 221,
- Page 225 and 226: Exercício resolvido 4 (Vunesp-SP)
- Page 227 and 228: Friedrich Wöhler SPL/Latinstock 1
- Page 229 and 230: 2 Postulados de KekulŽ Entre 1858
- Page 231 and 232: • Simplificação do ciclobuteno,
- Page 233 and 234: 6 Nomenclatura Os hidrocarbonetos f
- Page 235 and 236: De onde vem... para onde vai? PVC O
- Page 237 and 238: Exercício resolvido 1 (UFMG) Vári
- Page 239 and 240: Exercício resolvido 2 O ácido met
- Page 241 and 242: UNIDADE 5 Chuva ‡cida A chuva ác
- Page 243 and 244: 1 Liga•‹o inica Quando a difere
- Page 245 and 246: Observe: Energias de ionização em
- Page 247 and 248: 3 Propriedades dos compostos iônic
- Page 249 and 250: 4 Compostos inorgânicos Uma caract
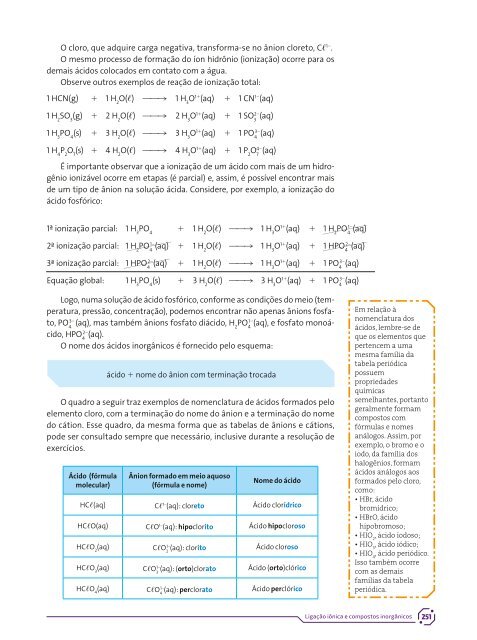
- Page 251: Saiba mais a respeito da classifica
- Page 255 and 256: De onde vem... para onde vai? ácid
- Page 257 and 258: Retomando a notícia O artigo da p
- Page 259 and 260: Saúde e sociedade Eventos naturais
- Page 261 and 262: 6 Bases de Arrhenius As bases são
- Page 263 and 264: Veja o conceito de fórmula unitár
- Page 265 and 266: Michel Borges/Shutterstock Suplemen
- Page 267 and 268: O bicarbonato de sódio é usado co
- Page 269 and 270: Lew Robertson/Photographer's Choice
- Page 271 and 272: Óxidos básicos Os óxidos básico
- Page 273 and 274: Exercício resolvido 5 (Cesgranrio-
- Page 275 and 276: 1 Liga•‹o met‡lica A alta ele
- Page 277 and 278: RETOMANDO A NOTÍCIA O artigo da p
- Page 279 and 280: 3 Reações de oxirredução Torste
- Page 281 and 282: 4 C‡lculo do NOx Alguns elementos
- Page 283 and 284: 5 Deslocamento simples Diminui a el
- Page 285 and 286: Exercício resolvido 2 (Cefet-RJ) Q
- Page 287 and 288: Sugestões de leitura, filmes e sit
- Page 289 and 290: Tabela periódica dos elementos n:
- Page 291 and 292: Sumário 1 Apresentação e objetiv
- Page 293 and 294: Experimento Os experimentos são at
- Page 295 and 296: Dessa forma, é apresentada uma Qu
- Page 297 and 298: As atividades experimentais, as ati
- Page 299 and 300: É muito importante que os estudant
- Page 301 and 302: Do ponto de vista processual observ
- Page 303 and 304:
10 Capítulo a capítulo em sala de
- Page 305 and 306:
6. A Química é essencialmente nat
- Page 307 and 308:
Uma boa estratégia para melhoria d
- Page 309 and 310:
outras linhas da tabela, que esse r
- Page 311 and 312:
A partir da discussão realizada na
- Page 313 and 314:
Conversa com o professor Construç
- Page 315 and 316:
14 A afirmação é incorreta, pois
- Page 317 and 318:
Esse equilíbrio só ocorre quando
- Page 319 and 320:
da época. Seguindo esse mesmo perc
- Page 321 and 322:
Os pratos de alumínio podem ser su
- Page 323 and 324:
preciso de elemento, que ele mesmo
- Page 325 and 326:
Porém, as descobertas de Avogadro
- Page 327 and 328:
Massa de água F: 96 g de oxigênio
- Page 329 and 330:
Ilustrações: Alex Argozino/ Arqui
- Page 331 and 332:
Conversa com o professor Ainda hoje
- Page 333 and 334:
uma lixa (pedaço de papel recobert
- Page 335 and 336:
c) (CH 3 CH 2 CH 2 ) 3 N 23 a) 1 mo
- Page 337 and 338:
33 a) NO + O 3 → NO 2 + O 2 NO 2
- Page 339 and 340:
• Contextualizar e analisar a con
- Page 341 and 342:
Micro-ondas Entre 10 9 Hz e 10 12 H
- Page 343 and 344:
para um nível mais externo (mais e
- Page 345 and 346:
Objetivos • Compreender os concei
- Page 347 and 348:
o crédito pelo trabalho indevidame
- Page 349 and 350:
) massa do núcleo (m n ) e massa d
- Page 351 and 352:
) Configuração eletrônica: 1s 2
- Page 353 and 354:
E por que resolvemos introduzir a Q
- Page 355 and 356:
DD DD DD DD D D D Ligação pi Liga
- Page 357 and 358:
sintetizada como uma sequência lin
- Page 359 and 360:
16 Alternativa b. A água tem suas
- Page 361 and 362:
02. Falso. Aminas terciárias não
- Page 363 and 364:
determinação de forças. Alguns c
- Page 365 and 366:
Item 08: errado, porque o átomo de
- Page 367 and 368:
Solicite aos seus alunos uma pesqui
- Page 369:
12 Referências bibliográficas Teo