#Química - Volume 1 (2016) - Martha Reis
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
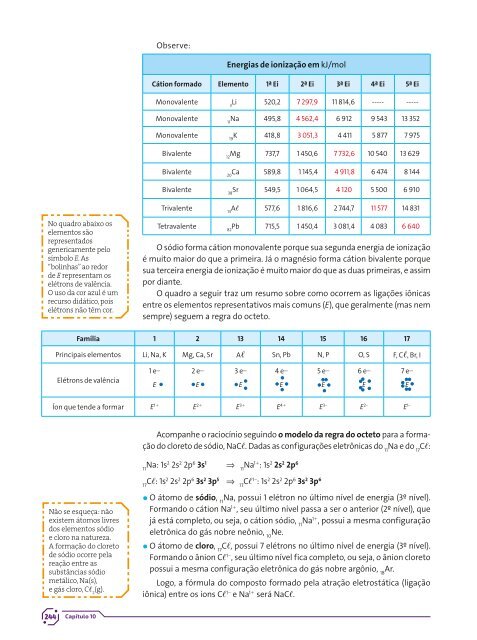
Observe:<br />
Energias de ionização em kJ/mol<br />
Cátion formado Elemento 1ª Ei 2ª Ei 3ª Ei 4ª Ei 5ª Ei<br />
Monovalente Li 520,2 7 297,9 11 814,6 ----- -----<br />
3<br />
Monovalente Na 495,8 4 562,4 6 912 9 543 13 352<br />
11<br />
Monovalente k 418,8 3 051,3 4 411 5 877 7 975<br />
19<br />
Bivalente Mg 737,7 1 450,6 7 732,6 10 540 13 629<br />
12<br />
Bivalente Ca 589,8 1 145,4 4 911,8 6 474 8 144<br />
20<br />
Bivalente Sr 549,5 1 064,5 4 120 5 500 6 910<br />
38<br />
trivalente A, 577,6 1 816,6 2 744,7 11 577 14 831<br />
13<br />
No quadro abaixo os<br />
elementos são<br />
representados<br />
genericamente pelo<br />
símbolo E. As<br />
“bolinhas” ao re dor<br />
de E representam os<br />
elétrons de valência.<br />
O uso da cor azul é um<br />
recurso didático, pois<br />
elétrons não têm cor.<br />
tetravalente Pb 715,5 1 450,4 3 081,4 4 083 6 640<br />
82<br />
O sódio forma cátion monovalente porque sua segunda energia de ionização<br />
é muito maior do que a primeira. Já o magnésio forma cátion bivalente porque<br />
sua terceira energia de ionização é muito maior do que as duas primeiras, e assim<br />
por diante.<br />
O quadro a seguir traz um resumo sobre como ocorrem as ligações iônicas<br />
entre os elementos repre sentativos mais comuns (E), que geralmente (mas nem<br />
sempre) seguem a regra do octeto.<br />
Família 1 2 13 14 15 16 17<br />
Principais elementos Li, Na, k Mg, Ca, Sr A, Sn, Pb N, P O, S F, C,, Br, i<br />
Elétrons de valência<br />
1 e–<br />
E<br />
2 e–<br />
E<br />
3 e–<br />
E<br />
4 e–<br />
E<br />
5 e–<br />
E<br />
6 e–<br />
E<br />
7 e–<br />
E<br />
Íon que tende a formar E 1+ E 2+ E 3+ E 4+ E 3– E 2– E 1–<br />
Acompanhe o raciocínio seguindo o modelo da regra do octeto para a formação<br />
do cloreto de sódio, NaC,. Dadas as configurações eletrônicas do 11<br />
Na e do 17<br />
C,:<br />
Não se esqueça: não<br />
existem átomos livres<br />
dos elementos sódio<br />
e cloro na natureza.<br />
A formação do cloreto<br />
de sódio ocorre pela<br />
reação entre as<br />
substâncias sódio<br />
metálico, Na(s),<br />
e gás cloro, C, 2<br />
(g).<br />
11 Na: 1s2 2s 2 2p 6 3s 1 V 11<br />
Na 1+ : 1s 2 2s 2 2p 6<br />
17 C,: 1s2 2s 2 2p 6 3s 2 3p 5 V 17<br />
C, 1– : 1s 2 2s 2 2p 6 3s 2 3p 6<br />
• O átomo de sódio, 11<br />
Na, possui 1 elétron no último nível de energia (3º nível).<br />
Formando o cátion Na 1+ , seu último nível passa a ser o anterior (2º nível), que<br />
já está completo, ou seja, o cátion sódio, 11<br />
Na 1+ , possui a mesma configuração<br />
eletrônica do gás nobre neônio, 10<br />
Ne.<br />
• O átomo de cloro, 17<br />
C,, possui 7 elétrons no último nível de energia (3º nível).<br />
Formando o ânion C, 1– , seu último nível fica completo, ou seja, o ânion cloreto<br />
possui a mesma configuração eletrônica do gás nobre argônio, 18<br />
Ar.<br />
Logo, a fórmula do composto formado pela atração eletrostática (ligação<br />
iônica) entre os íons C, 1– e Na 1+ será NaC,.<br />
244<br />
Capítulo 10