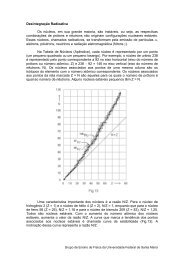
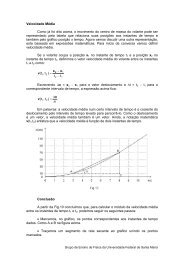
O Ponto de Vista EstatÃstico - UFSM
O Ponto de Vista EstatÃstico - UFSM
O Ponto de Vista EstatÃstico - UFSM
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
alcança o estado <strong>de</strong> equilíbrio, para o qual Ω tem o valor máximo. Desta forma, aevolução do sistema é no sentido do aumento <strong>de</strong> sua entropia.Um sistema qualquer po<strong>de</strong> ser imaginado como composto <strong>de</strong> dois subsistemasarbitrários. Assim, o número <strong>de</strong> microestados associados a qualquer estadomacroscópico do sistema po<strong>de</strong> ser escrito:Ω = Ω 1 Ω 2em que Ω 1 e Ω 2 representam os números <strong>de</strong> microestados associados aos estadosmacroscópicos do subsistema 1 e do subsistema 2, respectivamente. Então:S = k B ln [ Ω 1 Ω 2 ] = k B ln Ω 1 + k B ln Ω 2 = S 1 + S 2Assim, a entropia <strong>de</strong> um sistema é a soma das entropias <strong>de</strong> suas partes. Paraque esta proprieda<strong>de</strong> seja realizada é que <strong>de</strong>finimos a entropia com o logaritmo <strong>de</strong> Ω.Por outro lado, se um sistema passa <strong>de</strong> um estado para outro muito próximo,absorvendo ou per<strong>de</strong>ndo uma pequena quantida<strong>de</strong> <strong>de</strong> energia ∆Q por calor, <strong>de</strong> modoque sua entropia tenha uma pequena variação ∆S, temos:∆ S ≥∆QTNesta expressão, vale a igualda<strong>de</strong> se a mudança <strong>de</strong> estado do sistema éreversível e vale a <strong>de</strong>sigualda<strong>de</strong> se a mudança é irreversível. Po<strong>de</strong>mos justificarfisicamente essa expressão, vamos pensar que a quantida<strong>de</strong> <strong>de</strong> energia ∆Q éabsorvida pelo sistema.A energia absorvida por calor vai se somar à energia interna que já estádistribuída nos movimentos microscópicos dos átomos do sistema e nas interaçõesentre eles. Desta forma, aumenta o número <strong>de</strong> modos microscópicos pelos quais aenergia po<strong>de</strong> estar distribuída e aumenta o número <strong>de</strong> microestados associados aonovo estado do sistema. Por isso, a variação da entropia do sistema é proporcional àquantida<strong>de</strong> <strong>de</strong> energia absorvida por calor: ∆S ~ ∆Q.Além disso, para certa quantida<strong>de</strong> <strong>de</strong> energia ∆Q absorvida por calor, oaumento no número <strong>de</strong> modos microscópicos pelos quais a energia po<strong>de</strong> estardistribuída nos movimentos microscópicos dos átomos do sistema e nas interaçõesentre eles <strong>de</strong>ve ser tanto menor quanto maior for a energia interna que o sistema jápossui. Como a temperatura do sistema é proporcional à sua energia interna, oaumento do número <strong>de</strong> microestados associados ao novo estado do sistema, isto é, oaumento da entropia do sistema, <strong>de</strong>ve ser tanto menor quanto maior for a suatemperatura: ∆S ~ T −1 .A relação dada acima po<strong>de</strong> ser consi<strong>de</strong>rada como a expressão matemática dasegunda lei da Termodinâmica em termos da entropia. Assim, po<strong>de</strong>mos enunciar asegunda lei dizendo que a entropia <strong>de</strong> um sistema isolado não se altera nos processosreversíveis e aumenta nos processos irreversíveis pelos quais passa o sistema.Irreversibilida<strong>de</strong>Consi<strong>de</strong>remos um sistema isolado que passa <strong>de</strong> um estado <strong>de</strong> não equilíbrio aum estado <strong>de</strong> equilíbrio por um processo espontâneo. Uma vez atingido o estado <strong>de</strong>Grupo <strong>de</strong> Ensino <strong>de</strong> Física da Universida<strong>de</strong> Fe<strong>de</strong>ral <strong>de</strong> Santa Maria