O Ponto de Vista EstatÃstico - UFSM
O Ponto de Vista EstatÃstico - UFSM
O Ponto de Vista EstatÃstico - UFSM
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
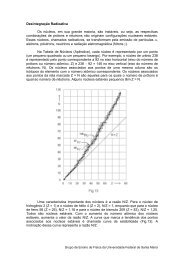
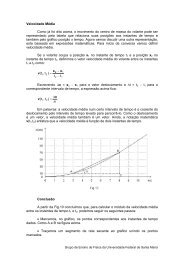
O <strong>Ponto</strong> <strong>de</strong> <strong>Vista</strong> EstatísticoSob o ponto <strong>de</strong> vista da Termodinâmica, <strong>de</strong>finimos os estados do sistema emestudo por variáveis macroscópicas como pressão, temperatura e volume e a partir<strong>de</strong>las, procuramos <strong>de</strong>screver, fenomenologicamente, o comportamento do sistema nosprocessos pelos quais troca energia com a vizinhança por trabalho e por calor. Sob oponto <strong>de</strong> vista da Mecânica Estatística, <strong>de</strong>finimos os estados <strong>de</strong> um sistema porvariáveis microscópicas e por cálculos estatísticos envolvendo gran<strong>de</strong>s números,procuramos relacionar as proprieda<strong>de</strong>s dos átomos ou moléculas às proprieda<strong>de</strong>smacroscópicas do sistema.Estado Macroscópico e MicroestadosVamos consi<strong>de</strong>rar um sistema macroscópico isolado do resto do universo, comenergia interna E. A energia interna do sistema é a soma das energias cinéticas dosmovimentos <strong>de</strong>sor<strong>de</strong>nados, microscópicos, dos seus átomos e das energias potenciaisassociadas às interações mútuas entre esses mesmos átomos. Essa energia E está,portanto, distribuída entre os átomos do sistema. O número <strong>de</strong> átomos <strong>de</strong> um sistemamacroscópico é extremamente gran<strong>de</strong> e cada átomo po<strong>de</strong> ter, em princípio, qualquerfração da energia interna. Desse modo, a energia E po<strong>de</strong> estar distribuída <strong>de</strong> umimenso número <strong>de</strong> modos microscópicos entre os átomos do sistema.Cada configuração do sistema associada a um modo <strong>de</strong> distribuição da energiaE entre seus átomos é um microestado do sistema. Se o sistema está isolado e emequilíbrio, todos os microestados têm igual probabilida<strong>de</strong> <strong>de</strong> ocorrência. Pelasinterações dos átomos do sistema uns com os outros, o modo <strong>de</strong> distribuição daenergia E muda continuamente e o microestado em que se encontra o sistema mudacontinuamente.Cada estado macroscópico do sistema, <strong>de</strong>finido pelos valores <strong>de</strong> suasproprieda<strong>de</strong>s termodinâmicas, po<strong>de</strong> ser realizado por um número muito gran<strong>de</strong> <strong>de</strong>microestados. Em outras palavras, existe um número muito gran<strong>de</strong> <strong>de</strong> microestadospara os quais as medidas das proprieda<strong>de</strong>s termodinâmicas do sistema resultam osmesmos valores. O estado macroscópico ao qual está associado o número máximo <strong>de</strong>microestados é o estado mais provável do sistema e também o seu estado <strong>de</strong>equilíbrio.Quando mudamos as condições às quais o sistema está submetido, mudamos,indiretamente, os modos como a energia interna po<strong>de</strong> estar distribuída entre osátomos do sistema. Desta forma, o estado macroscópico ao qual está associado onúmero máximo <strong>de</strong> microestados passa a ser outro e outro passa a ser o estado <strong>de</strong>equilíbrio do sistema.EntropiaVamos representar por Ω o número <strong>de</strong> microestados associados a um mesmoestado macroscópico. A entropia do sistema, quando ele se encontra nesse estadomacroscópico, é <strong>de</strong>finida pela expressão:S = k B ln Ωem que k B é a constante <strong>de</strong> Boltzmann.Um sistema, abandonado a si próprio num estado qualquer, evolui para outroestado, para o qual Ω é maior. Isso se repete <strong>de</strong> estado para estado até que o sistemaGrupo <strong>de</strong> Ensino <strong>de</strong> Física da Universida<strong>de</strong> Fe<strong>de</strong>ral <strong>de</strong> Santa Maria
alcança o estado <strong>de</strong> equilíbrio, para o qual Ω tem o valor máximo. Desta forma, aevolução do sistema é no sentido do aumento <strong>de</strong> sua entropia.Um sistema qualquer po<strong>de</strong> ser imaginado como composto <strong>de</strong> dois subsistemasarbitrários. Assim, o número <strong>de</strong> microestados associados a qualquer estadomacroscópico do sistema po<strong>de</strong> ser escrito:Ω = Ω 1 Ω 2em que Ω 1 e Ω 2 representam os números <strong>de</strong> microestados associados aos estadosmacroscópicos do subsistema 1 e do subsistema 2, respectivamente. Então:S = k B ln [ Ω 1 Ω 2 ] = k B ln Ω 1 + k B ln Ω 2 = S 1 + S 2Assim, a entropia <strong>de</strong> um sistema é a soma das entropias <strong>de</strong> suas partes. Paraque esta proprieda<strong>de</strong> seja realizada é que <strong>de</strong>finimos a entropia com o logaritmo <strong>de</strong> Ω.Por outro lado, se um sistema passa <strong>de</strong> um estado para outro muito próximo,absorvendo ou per<strong>de</strong>ndo uma pequena quantida<strong>de</strong> <strong>de</strong> energia ∆Q por calor, <strong>de</strong> modoque sua entropia tenha uma pequena variação ∆S, temos:∆ S ≥∆QTNesta expressão, vale a igualda<strong>de</strong> se a mudança <strong>de</strong> estado do sistema éreversível e vale a <strong>de</strong>sigualda<strong>de</strong> se a mudança é irreversível. Po<strong>de</strong>mos justificarfisicamente essa expressão, vamos pensar que a quantida<strong>de</strong> <strong>de</strong> energia ∆Q éabsorvida pelo sistema.A energia absorvida por calor vai se somar à energia interna que já estádistribuída nos movimentos microscópicos dos átomos do sistema e nas interaçõesentre eles. Desta forma, aumenta o número <strong>de</strong> modos microscópicos pelos quais aenergia po<strong>de</strong> estar distribuída e aumenta o número <strong>de</strong> microestados associados aonovo estado do sistema. Por isso, a variação da entropia do sistema é proporcional àquantida<strong>de</strong> <strong>de</strong> energia absorvida por calor: ∆S ~ ∆Q.Além disso, para certa quantida<strong>de</strong> <strong>de</strong> energia ∆Q absorvida por calor, oaumento no número <strong>de</strong> modos microscópicos pelos quais a energia po<strong>de</strong> estardistribuída nos movimentos microscópicos dos átomos do sistema e nas interaçõesentre eles <strong>de</strong>ve ser tanto menor quanto maior for a energia interna que o sistema jápossui. Como a temperatura do sistema é proporcional à sua energia interna, oaumento do número <strong>de</strong> microestados associados ao novo estado do sistema, isto é, oaumento da entropia do sistema, <strong>de</strong>ve ser tanto menor quanto maior for a suatemperatura: ∆S ~ T −1 .A relação dada acima po<strong>de</strong> ser consi<strong>de</strong>rada como a expressão matemática dasegunda lei da Termodinâmica em termos da entropia. Assim, po<strong>de</strong>mos enunciar asegunda lei dizendo que a entropia <strong>de</strong> um sistema isolado não se altera nos processosreversíveis e aumenta nos processos irreversíveis pelos quais passa o sistema.Irreversibilida<strong>de</strong>Consi<strong>de</strong>remos um sistema isolado que passa <strong>de</strong> um estado <strong>de</strong> não equilíbrio aum estado <strong>de</strong> equilíbrio por um processo espontâneo. Uma vez atingido o estado <strong>de</strong>Grupo <strong>de</strong> Ensino <strong>de</strong> Física da Universida<strong>de</strong> Fe<strong>de</strong>ral <strong>de</strong> Santa Maria
equilíbrio, o sistema permanece nele e não retorna espontaneamente ao estado <strong>de</strong>não equilíbrio original. O processo espontâneo, não sendo quase-estático, éirreversível. A irreversibilida<strong>de</strong> do processo espontâneo é <strong>de</strong> caráter probabilístico, istoé, o retorno ao estado original <strong>de</strong> não equilíbrio, estritamente falando, não éimpossível, mas é tanto mais improvável quanto maior o número <strong>de</strong> partículas queconstituem o sistema.Para discutir essa última afirmação, vamos consi<strong>de</strong>rar um recipiente divididopela meta<strong>de</strong> por uma pare<strong>de</strong>. Uma das meta<strong>de</strong>s contém certa quantida<strong>de</strong> <strong>de</strong> gás e aoutra meta<strong>de</strong> está vazia. Então, removemos a pare<strong>de</strong> <strong>de</strong> separação. O gás passa aocupar as duas meta<strong>de</strong>s igualmente. A probabilida<strong>de</strong> do processo inverso, isto é, doesvaziamento espontâneo <strong>de</strong> uma das meta<strong>de</strong>s, po<strong>de</strong> ser calculada como segue.Cada molécula do gás permanece, em média, o mesmo intervalo <strong>de</strong> tempo emcada uma das duas meta<strong>de</strong>s do recipiente e, por isso, a probabilida<strong>de</strong> <strong>de</strong> encontrarqualquer molécula numa <strong>de</strong>stas meta<strong>de</strong> é p(1) = 1/2. Se o gás em questão temcomportamento i<strong>de</strong>al, cada molécula se move in<strong>de</strong>pen<strong>de</strong>ntemente das <strong>de</strong>mais e aprobabilida<strong>de</strong> <strong>de</strong> encontrar N moléculas na mesma meta<strong>de</strong> do recipiente é:p(N) = 2 −NSe existem, por exemplo, 10 moléculas no recipiente, a probabilida<strong>de</strong> <strong>de</strong>encontrar todas elas na mesma meta<strong>de</strong>, é:p(10) = 2 −10 ≈ 9,77 x 10 −4Caso fosse possível medir a posição <strong>de</strong>ssas 10 moléculas uma vez a cadasegundo, existe uma chance a cada (1/2) −10 segundos <strong>de</strong> encontrar todas elas namesma meta<strong>de</strong> do recipiente, ou seja, uma chance a cada 2 10 segundos. Isto significauma chance a cada 17 minutos.Se existem 100 moléculas no recipiente, a probabilida<strong>de</strong> <strong>de</strong> encontrar todaselas na mesma meta<strong>de</strong>, é:p(100) = 2 −100 ≈ 7,89 x 10 −31Caso também fosse possível medir a posição <strong>de</strong>ssas 100 moléculas uma vez acada segundo, existe uma chance a cada (1/2) −100 segundos <strong>de</strong> encontrar todas elasna mesma meta<strong>de</strong> do recipiente, ou seja, uma chance a cada 1,27 x 10 30 segundos.Isto significa uma chance a cada 4,03 x 10 22 anos.Para 10 partículas, o tempo que <strong>de</strong>vemos esperar para que todas elas fiquemna mesma meta<strong>de</strong> do recipiente é pequeno. Já para 100 partículas, o tempo <strong>de</strong> esperaestá muito além da própria ida<strong>de</strong> do Universo.O número <strong>de</strong> partículas <strong>de</strong> qualquer sistema macroscópico é da or<strong>de</strong>m donúmero <strong>de</strong> Avogadro, ou seja, da or<strong>de</strong>m <strong>de</strong> 10 23 . Portanto, a afirmativa <strong>de</strong> que não éimpossível a passagem espontânea do sistema <strong>de</strong> um estado <strong>de</strong> equilíbrio a umestado <strong>de</strong> não equilíbrio, embora verda<strong>de</strong>ira, é apenas formal.Grupo <strong>de</strong> Ensino <strong>de</strong> Física da Universida<strong>de</strong> Fe<strong>de</strong>ral <strong>de</strong> Santa Maria