?cmd=upload&act=open&pageid=232&file=2010_組成式の書き方(PDF用)
?cmd=upload&act=open&pageid=232&file=2010_組成式の書き方(PDF用) ?cmd=upload&act=open&pageid=232&file=2010_組成式の書き方(PDF用)
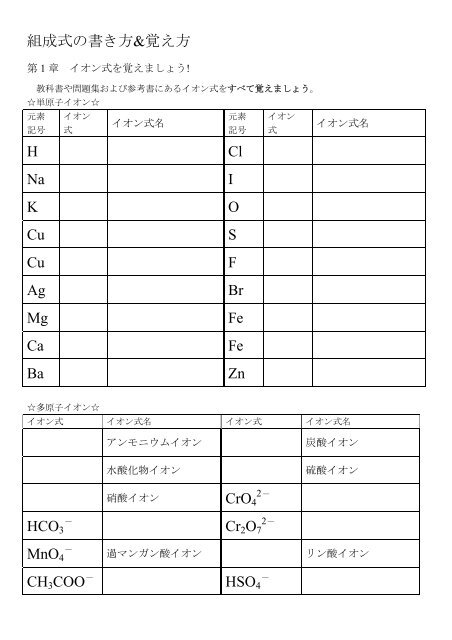
組 成 式 の 書 き 方 & 覚 え 方第 1 章 イオン 式 を 覚 えましょう!教 科 書 や 問 題 集 および 参 考 書 にあるイオン 式 をすべて 覚 えましょう。☆ 単 原 子 イオン☆元 素 イオン元 素 イオンイオン 式 名イオン 式 名記 号 式記 号 式HClNaKCuCuAgMgCaBaIOSFBrFeFeZn☆ 多 原 子 イオン☆イオン 式 イオン 式 名 イオン 式 イオン 式 名アンモニウムイオン水 酸 化 物 イオン炭 酸 イオン硫 酸 イオン硝 酸 イオン CrO 42-HCO 3-Cr 2 O 72-MnO 4-過 マンガン 酸 イオン リン 酸 イオンCH 3 COO -HSO 4-
- Page 3 and 4: 第 3 章 組 成 式 の 組 合
- Page 6 and 7: 第 7 章 組 成 式 の 組 合
- Page 8 and 9: 第 2 章 組 成 式 の 組 合
- Page 12: 第 7 章 組 成 式 の 組 合
組 成 式 の 書 き 方 & 覚 え 方第 1 章 イオン 式 を 覚 えましょう!教 科 書 や 問 題 集 および 参 考 書 にあるイオン 式 をすべて 覚 えましょう。☆ 単 原 子 イオン☆元 素 イオン元 素 イオンイオン 式 名イオン 式 名記 号 式記 号 式HClNaKCuCuAgMgCaBaIOSFBrFeFeZn☆ 多 原 子 イオン☆イオン 式 イオン 式 名 イオン 式 イオン 式 名アンモニウムイオン水 酸 化 物 イオン炭 酸 イオン硫 酸 イオン硝 酸 イオン CrO 42-HCO 3-Cr 2 O 72-MnO 4-過 マンガン 酸 イオン リン 酸 イオンCH 3 COO -HSO 4-
第 3 章 組 成 式 の 組 合 せ 方 ( 単 原 子 イオン 2)例 2 Mg 2+ と Cl - の 場 合1. 陽 イオンと 陰 イオンの 価 数 が 足 してゼロになるような 比 を 考 える。Mg 2+ の 価 数 は『2+』なので 2 価 、Cl - の 価 数 は『-』なので 1 価 である。このままくっつけると、+2+(-1)=+1 になり、ゼロにならない。陰 イオンの 価 数 が 1 不 足 するので、 陰 イオンを 2 倍 して 合 わせる。よって、この Mg 2+ と Cl - の 比 は、1:2 となる。2. 比 が 1:2 のときは、Cl が 2 つ 分 あるという 意 味 を Cl 2 として 右 下 に 添 え 字 をつける。そうすると、 『 MgCl 2 』となる。3.また、Mg(Cl) 2 と 書 かないようにする。( )は 原 子 が 複 数 個 ついているときにのみ 使 用 する。Cl は 文 字 が 2 つ( 複 数 )であるが、『 塩 素 』という 1 つの 原 子 なので( )はつけない。4. 組 成 式 の 読 み 方読 み 方 は、 同 じ。練 習 2 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Mg 2 +Cl - 1:2 MgCl 2 塩 化 マグネシウム1 Ca 2 +Cl - :2 Zn 2 +Cl - :3 Ba 2 +Cl - :4 Na + O 2 -:5 K + O 2 -:6 Ag + S 2 -:7 Ag + O 2 -:8 Al 3 +Cl - :
第 4 章 組 成 式 の 組 合 せ 方 ( 単 原 子 イオン 3)例 3 Cu 2+ と Cl - の 場 合1. 銅 や 鉄 など 一 部 の 金 属 イオンは 複 数 の 価 数 をもつ。( 他 に Sn スズ , Pb 鉛 などがある)化 学 式 上 では、 添 え 字 から 判 別 ができるが、 名 称 の 場 合 、 何 価 の 価 数 と 結 合 しているか不 明 になるため、 必 ず 名 称 に 明 記 する。『 CuCl 2 』は『 塩 化 銅 (Ⅱ) 』と 書 く。これで、2 価 の 銅 イオンと 結 合 していることが 分 かる。練 習 3 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Cu 2 +Cl - 1:2 CuCl 2 塩 化 銅 (Ⅱ)1 Cu 2 +S 2 -:2 Cu 2 +O 2 -:3 Cu + O 2 -:4 Fe 2 +Cl - :5 Fe 3 +Cl - :第 5 章 組 成 式 の 組 合 せ 方 ( 多 原 子 イオン 1)例 4 Na + と OH - の 場 合1.この 場 合 、Na + と OH - の 比 は、1:1 となる。 そのままくっつけて 組 成 式 をつくる。2.また、Na(OH)と 書 かないようにする。原 子 が 複 数 個 ついているときであるが、 比 が 1 の 場 合 のみ( )は 省 く。練 習 4 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Na + OH - 1:1 NaOH 水 酸 化 ナトリウム1 K + OH - :2 Na + -NO 3 :3+NH 4 Cl - :
第 7 章 組 成 式 の 組 合 せ 方 ( 応 用 1)例 6 Al 3+ と O 2- の 場 合1.この 場 合 、Al 3+ と O 2- のように 片 方 を 2 倍 すると、もう 片 方 が 合 わない。このようなときは、 最 小 公 倍 数 を 使 う。そうすると、±6 になるように 合 わせればよいので 比 は、Al 3+ :O 2- =2:3 となる。よって、『 Al 2 O 3 』となる。練 習 6 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Al 3 +O 2 -2:3 Al 2 O 3 酸 化 アルミニウム1 Fe 3 +O 2 -:2 Al 3 + 2-SO 4 :3 Ca 2 + 3-PO 4 :4 Fe 2 + 3-PO 4 :第 8 章 まとめ練 習 7 表 の 空 欄 を 埋 めなさい。陰 イオンCl -O 2-OH -SO 42-陽 イオン塩 化 物 イオン酸 化 物 イオン水 酸 化 物 イオン硫 酸 イオンNa +NaClナトリウムイオン塩 化 ナトリウムCa 2+カルシウムイオンAl 3+アルミニウムイオンFe 3+鉄 (Ⅲ)イオンNH 4+アンモニウムイオン
解 答 組 成 式 の 書 き 方 & 覚 え 方第 1 章 イオン 式 を 覚 えましょう!教 科 書 や 問 題 集 および 参 考 書 にあるイオン 式 をすべて 覚 えましょう。単 原 子 イオン元 素記 号イオン 式イオン 式 名元 素記 号イオン式イオン 式 名H H + 水 素 イオン Cl Cl - 塩 化 物 イオンNa Na + ナトリウムイオン I I - ヨウ 化 物 イオンK K + カリウムイオン O O 2 -酸 化 物 イオンCu Cu + 銅 (Ⅰ)イオン S S 2 -硫 化 物 イオンCu Cu 2 +銅 (Ⅱ)イオン F F - フッ 化 物 イオンAg Ag + 銀 イオン Br Br - 臭 化 物 イオンMg Mg 2 +マグネシウムイオン Fe Fe 2 +鉄 (Ⅱ)イオンCa Ca 2 +カルシウムイオン Fe Fe 3 +鉄 (Ⅲ)イオンBa Ba 2 +バリウムイオン Zn Zn 2 +亜 鉛 イオン多 原 子 イオンイオン 式 イオン 式 名 イオン 式 イオン 式 名+NH 4 アンモニウムイオン2-CO 3 炭 酸 イオンOH - 水 酸 化 物 イオン2-SO 4 硫 酸 イオン-NO 3 硝 酸 イオン2-CrO 4 クロム 酸 イオン-HCO 3 炭 酸 水 素 イオン2-Cr 2 O 7 ニクロム 酸 イオン-MnO 4 過 マンガン 酸 イオン3-PO 4 リン 酸 イオンCH 3 COO - 酢 酸 イオン-HSO 4 硫 酸 水 素 イオン
第 2 章 組 成 式 の 組 合 せ 方 ( 単 原 子 イオン 1)例 1 Ca 2+ と O 2- の 場 合1. 陽 イオンと 陰 イオンの 価 数 が 足 してゼロになるような 比 を 考 える。Ca 2+ の 価 数 は『2+』なので 2 価 、O 2- の 価 数 は『2-』なので 2 価 である。このCa 2+ と O 2- の 比 は、2:2=1:1 である。2. 比 が 1:1 のときは、そのままくっつけて 組 成 式 をつくる。ただし、くっつけるとき、 必 ず 陽 イオンが 左 側 ( 前 方 )、 陰 イオンが 右 側 ( 後 方 )になるように合 わせる。 そうすると、 『 CaO 』となる。3. 組 成 式 の 読 み 方読 み 方 は、 陰 イオン( 後 方 )から 読 んで、 続 けて 陽 イオン( 前 方 )を 読 む。『 酸 化 物 イオンカルシウムイオン 』となるが、『イオン』や『 物 イオン』は 外 して 読 むようにする。『 酸 化 物 イオンカルシウムイオン 』となるので、『 酸 化 カルシウム 』となる。練 習 1 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Ca 2 +O 2 -1:1 CaO 酸 化 カルシウム1 Na + Cl - 1:1 NaCl 塩 化 ナトリウム2 K + I - 1:1 KI ヨウ 化 カリウム3 K + Br - 1:1 KBr 臭 化 カリウム4 Mg 2 +O 2 -1:1 MgO 酸 化 マグネシウム5 Zn 2 +O 2 -1:1 ZnO 酸 化 亜 鉛6 Zn 2 +S 2 -1:1 ZnS 硫 化 亜 鉛7 K + Cl - 1:1 KCl 塩 化 カリウム8 Ag + Cl - 1:1 AgCl 塩 化 銀9 H + Cl - 1:1 HCl 塩 化 水 素10 H + F - 1:1 HF フッ 化 水 素※ 9~10 は 組 成 式 ではありませんが、この 方 法 で 名 称 がつけられる 分 子 式 になります。
第 3 章 組 成 式 の 組 合 せ 方 ( 単 原 子 イオン 2)例 2 Mg 2+ と Cl - の 場 合1. 陽 イオンと 陰 イオンの 価 数 が 足 してゼロになるような 比 を 考 える。Mg 2+ の 価 数 は『2+』なので 2 価 、Cl - の 価 数 は『-』なので 1 価 である。このままくっつけると、+2+(-1)=+1 になり、ゼロにならない。陰 イオンの 価 数 が 1 不 足 するので、 陰 イオンを 2 倍 して 合 わせる。よって、この Mg 2+ と Cl - の 比 は、1:2 となる。2. 比 が 1:2 のときは、Cl が 2 つ 分 あるという 意 味 を Cl 2 として 右 下 に 添 え 字 をつける。そうすると、 『 MgCl 2 』となる。3.また、Mg(Cl) 2 と 書 かないようにする。( )は 原 子 が 複 数 個 ついているときにのみ 使 用 する。Cl は 文 字 が 2 つ( 複 数 )であるが、『 塩 素 』という 1 つの 原 子 なので( )はつけない。4. 組 成 式 の 読 み 方読 み 方 は、 同 じ。練 習 2 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Mg 2 +Cl - 1:2 MgCl 2 塩 化 マグネシウム1 Ca 2 +Cl - 1:2 CaCl 2 塩 化 カルシウム2 Zn 2 +Cl - 1:2 ZnCl 2 塩 化 亜 鉛3 Ba 2 +Cl - 1:2 BaCl 2 塩 化 バリウム4 Na + O 2 -2:1 Na 2 O 酸 化 ナトリウム5 K + O 2 -2:1 K 2 O 酸 化 カリウム6 Ag + S 2 -2:1 Ag 2 S 硫 化 銀7 Ag + O 2 -2:1 Ag 2 O 酸 化 銀8 Al 3 +Cl - 1:3 AlCl 3 塩 化 アルミニウム
第 7 章 組 成 式 の 組 合 せ 方 ( 応 用 1)例 6 Al 3+ と O 2- の 場 合1.この 場 合 、Al 3+ と O 2- のように 片 方 を 2 倍 すると、もう 片 方 が 合 わない。このようなときは、 最 小 公 倍 数 を 使 う。そうすると、±6 になるように 合 わせればよいので 比 は、Al 3+ :O 2- =2:3 となる。よって、『 Al 2 O 3 』となる。練 習 6 次 の 各 イオンから 組 成 式 をつくりなさい。No 陽 イオン 陰 イオン 比 ( 陽 : 陰 ) 組 成 式 組 成 式 名例 Al 3 +O 2 -2:3 Al 2 O 3 酸 化 アルミニウム1 Fe 3 +O 2 -2:3 Fe 2 O 3 酸 化 鉄 (Ⅲ)2 Al 3 + 2-SO 4 2:3 Al 2 (SO 4 ) 3 硫 酸 アルミニウム3 Ca 2 + 3-PO 4 3:2 Ca 3 (PO 4 ) 2 リン 酸 カルシウム4 Fe 2 + 3-PO 4 1:2 Fe(OH) 2 水 酸 化 鉄 (Ⅱ)第 8 章 まとめ練 習 7 表 の 空 欄 を 埋 めなさい。陰 イオン陽 イオンNa +ナトリウムイオンCl -塩 化 物 イオンO 2-OH -SO 42-酸 化 物 イオン 水 酸 化 物 イオン 硫 酸 イオンNaCl Na 2 O NaOH Na 2 SO 4塩 化 ナトリウム 酸 化 ナトリウム 水 酸 化 ナトリウム 硫 酸 ナトリウムCa 2+カルシウムイオンAl 3+アルミニウムイオンFe 3+鉄 (Ⅲ)イオン+NH 4アンモニウムイオンCaCl 2 CaO Ca(OH) 2 CaSO 4塩 化 カルシウム 酸 化 カルシウム 水 酸 化 カルシウム 硫 酸 カルシウムAlCl 3 Al 2 O 3 Al(OH) 3 Al 2 (SO 4 ) 3塩 化 アルミニウム 酸 化 アルミニウム 水 酸 化 アルミニウム 硫 酸 アルミニウムFeCl 3 Fe 2 O 3 Fe(OH) 3 Fe 2 (SO 4 ) 3塩 化 鉄 (Ⅲ) 酸 化 鉄 (Ⅲ) 水 酸 化 鉄 (Ⅲ) 硫 酸 鉄 (Ⅲ)NH 4 Cl (NH 4 ) 2 O NH 4 OH (NH 4 ) 2 SO 4塩 化 アンモニウム 酸 化 アンモニウム 水 酸 化 アンモニウム 硫 酸 アンモニウム