1 Aminoácidos 1. Os aminoácidos são "blocos de construção" das ...
1 Aminoácidos 1. Os aminoácidos são "blocos de construção" das ...
1 Aminoácidos 1. Os aminoácidos são "blocos de construção" das ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Aminoácidos</strong><br />
<strong>1.</strong> <strong>Os</strong> <strong>aminoácidos</strong> <strong>são</strong> "<strong>blocos</strong> <strong>de</strong> construção" <strong>das</strong> proteínas.<br />
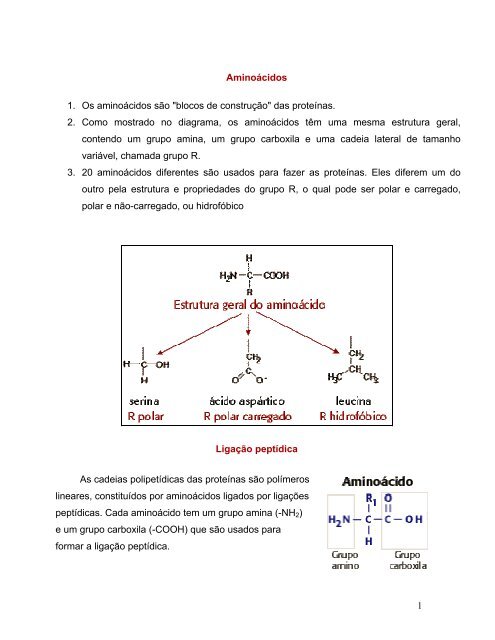
2. Como mostrado no diagrama, os <strong>aminoácidos</strong> têm uma mesma estrutura geral,<br />
contendo um grupo amina, um grupo carboxila e uma ca<strong>de</strong>ia lateral <strong>de</strong> tamanho<br />
variável, chamada grupo R.<br />
3. 20 <strong>aminoácidos</strong> diferentes <strong>são</strong> usados para fazer as proteínas. Eles diferem um do<br />
outro pela estrutura e proprieda<strong>de</strong>s do grupo R, o qual po<strong>de</strong> ser polar e carregado,<br />
polar e não-carregado, ou hidrofóbico<br />
Ligação peptídica<br />
As ca<strong>de</strong>ias polipetídicas <strong>das</strong> proteínas <strong>são</strong> polímeros<br />
lineares, constituídos por <strong>aminoácidos</strong> ligados por ligações<br />
peptídicas. Cada aminoácido tem um grupo amina (-NH2)<br />
e um grupo carboxila (-COOH) que <strong>são</strong> usados para<br />
formar a ligação peptídica.<br />
1
Como mostrado no diagrama, a ligação peptídica se forma entre o átomo <strong>de</strong> carbono<br />
(C) do grupo carboxila e o átomo <strong>de</strong> nitrogênio (N) do grupo amina. <strong>Os</strong> elementos que<br />
compõem a água <strong>são</strong> removidos como um co-produto da reação. A água (H2O) se forma a<br />
partir do -OH do grupo carboxila <strong>de</strong> um dos <strong>aminoácidos</strong> e <strong>de</strong> um átomo <strong>de</strong> hidrogênio do<br />
grupo -NH2 do outro aminoácido.<br />
Ca<strong>de</strong>ias polipeptídicas<br />
No diagrama abaixo, é possível separar visualmente os <strong>aminoácidos</strong> nos pontos em que<br />
há ligações peptídicas. Note que o esqueleto do peptí<strong>de</strong>o é formado por um padrão repetitivo<br />
<strong>de</strong> átomos N-C-C, que correspon<strong>de</strong>m, respectivamente, aos átomos N-amino, C-alfa e<br />
C-carbonílico dos <strong>aminoácidos</strong> individuais. <strong>Os</strong> grupos mostrados como R1, R2, R3, etc.,<br />
representam as ca<strong>de</strong>ias laterais dos diferentes <strong>aminoácidos</strong>.<br />
2
Fórmulas estruturais <strong>de</strong> amino ácidos<br />
alanina<br />
serina<br />
asparagina<br />
ácido aspártico<br />
cisteína<br />
glicina<br />
histidina<br />
homocisteína<br />
glutamina<br />
ácido amino butírico<br />
arginina<br />
fenilalanina<br />
ácido glutâmico<br />
leucina<br />
lisina<br />
serina<br />
3
valina<br />
metionina<br />
norvalina<br />
tirosina<br />
triptofano<br />
As proteínas também <strong>são</strong> chama<strong>das</strong> <strong>de</strong> polipeptí<strong>de</strong>os, porque os <strong>aminoácidos</strong><br />
que as compõe <strong>são</strong> unidos por ligações peptídicas (uma ligação peptídica é a união do<br />
grupo amino (-NH2) <strong>de</strong> um amino ácido com o grupo carboxila (-COOH) <strong>de</strong> outro amino<br />
ácido, através da formação <strong>de</strong> uma amida. A ligação C-N, em um peptí<strong>de</strong>o, é especial:<br />
é 10% mais "curta" do que uma ligação C-N normal, e o ângulo <strong>de</strong> ligação também é<br />
diferente do esperado para um carbono sp 2 . Isto porque a ligação peptídica, na<br />
verda<strong>de</strong>, apresenta uma estrutura <strong>de</strong> ressonância, tendo um forte caráter <strong>de</strong> dupla<br />
ligação - explicando, também, a rigi<strong>de</strong>z <strong>de</strong>sta ligação e sua planarida<strong>de</strong>. Através <strong>de</strong>stas<br />
ligações, os amino ácidos formam ca<strong>de</strong>ias longas; a maioria <strong>das</strong> proteínas tem mais <strong>de</strong><br />
200 amino ácidos. Todos os amino ácidos tem, em comum, um carbono (chamado <strong>de</strong><br />
carbono alfa) ligado a um grupo amino e a um grupo carboxila. Este carbono alfa é um<br />
centro estereogênico e, com exces<strong>são</strong> da glicina (porque não é assimétrica), todos os<br />
amino ácidos, em todos os<br />
organismos vivos terrestres, só aparecem<br />
sob a forma L .<br />
4
Ca<strong>de</strong>ias Laterais dos <strong>Aminoácidos</strong> (grupos R)<br />
Vinte tipos diferentes <strong>de</strong> <strong>aminoácidos</strong> <strong>são</strong> encontrados nas proteínas. As<br />
ca<strong>de</strong>ias laterais (grupos R) diferem nas proprieda<strong>de</strong>s químicas. Algumas <strong>de</strong>las<br />
<strong>são</strong> polares, mas não têm carga elétrica. Outras <strong>são</strong> polares e têm uma carga<br />
elétrica positiva ou negativa em solução aquosa.<br />
<strong>Os</strong> <strong>aminoácidos</strong> com ca<strong>de</strong>ias laterais polares <strong>são</strong> ditos hidrofílicos (têm<br />
afinida<strong>de</strong> pela água), porque estabelecem interações fracas com as moléculas<br />
da água. <strong>Os</strong> grupos R dos <strong>aminoácidos</strong> hidrofílicos contêm átomos<br />
eletronegativos como O e N. Alguns <strong>aminoácidos</strong> <strong>são</strong> apolares (hidrofóbicos)<br />
porque suas ca<strong>de</strong>ias laterais <strong>são</strong> constituí<strong>das</strong> principalmente por ca<strong>de</strong>ias <strong>de</strong><br />
hidrocarbonetos.<br />
Exemplos <strong>de</strong> diferentes classes <strong>de</strong> <strong>aminoácidos</strong>:<br />
5
Proteínas diferentes têm estruturas e proprieda<strong>de</strong>s<br />
diferentes <strong>de</strong>vido à localização específica <strong>de</strong> <strong>aminoácidos</strong><br />
hidrofílicos ou hidrofóbicos.<br />
I<strong>de</strong>ntificação <strong>de</strong> um aminoácido hidrofóbico<br />
Qual dos <strong>aminoácidos</strong> abaixo tem uma ca<strong>de</strong>ia lateral hidrofóbica?<br />
<strong>Aminoácidos</strong> hidrofóbicos<br />
Há 20 <strong>aminoácidos</strong> diferentes nas proteínas. Suas ca<strong>de</strong>ias laterais (grupos R) diferem<br />
em suas proprieda<strong>de</strong>s químicas. Algumas <strong>são</strong> polares, mas sem carga. Outras <strong>são</strong> polares, e<br />
possuem normalmente uma carga positiva ou negativa quando em solução aquosa. <strong>Os</strong> oito<br />
<strong>aminoácidos</strong> mostrados abaixo têm ca<strong>de</strong>ias laterais que <strong>são</strong> claramente hidrofóbicas. Note<br />
que essas ca<strong>de</strong>ias laterais <strong>são</strong> compostas quase que exclusivamente por ligações C-C e C-<br />
H, constituindo ou um hidrocarboneto puro ou um hidrocarboneto contendo um único átomo<br />
polar.<br />
6
Proteínas<br />
Somos seres protéicos: a vida está intimamente ligada às proteínas. Estas moléculas<br />
especiais realizam as mais varia<strong>das</strong> funções no nosso organismo, <strong>de</strong>s<strong>de</strong> o transporte <strong>de</strong><br />
nutrientes e metabólitos à catálise <strong>de</strong> reações biológicas. Apesar da complexida<strong>de</strong> <strong>de</strong> suas<br />
funções, as proteínas <strong>são</strong> relativamente simples: repetições <strong>de</strong> 20 unida<strong>de</strong>s básicas, os amino<br />
ácidos.<br />
As proteínas <strong>são</strong> macromoléculas complexas, compostas <strong>de</strong> <strong>aminoácidos</strong>, e<br />
necessárias para os processos químicos que ocorrem nos organismos vivos.<br />
São os constituintes básicos da vida: tanto que seu nome <strong>de</strong>riva da palavra<br />
grega "proteios", que significa "em primeiro lugar". Nos animais, as proteínas<br />
7
correspon<strong>de</strong>m a cerca <strong>de</strong> 80% do peso dos músculos <strong>de</strong>sidratados, cerca <strong>de</strong><br />
70% da pele e 90% do sangue seco. Mesmo nos vegetais as proteínas estão<br />
presentes.<br />
É conveniente <strong>de</strong>screver a estrutura <strong>de</strong> uma proteína segundo 4 aspectos<br />
relacionados à estrutura covalente e às formas <strong>de</strong> enovelamento da ca<strong>de</strong>ia.<br />
Esses diferentes níveis <strong>de</strong> <strong>de</strong>scrição da estrutura protéica <strong>são</strong> conhecidos<br />
como estruturas primária, secundária, terciária e quaternária.<br />
Embora sejam quase inúmeras, to<strong>das</strong> as proteínas <strong>são</strong> forma<strong>das</strong><br />
exclusivamente por apenas 20 amino ácidos, que se repetem numa<br />
seqüência característica para cada proteína. Esta seqüência, conhecida como<br />
estrutura primária, é que, <strong>de</strong> fato, <strong>de</strong>termina a forma e a função da proteína. A<br />
estrutura primária é somente a seqüência dos amino ácidos, sem se preocupar<br />
com a orientação espacial da molécula. As interações intermoleculares entre<br />
os amino ácidos <strong>das</strong> proteínas fazem com que a ca<strong>de</strong>ia protéica assuma uma<br />
estrutura secundária e, algumas vezes, uma estrutura terciária.<br />
Estrutura Primária <strong>das</strong> Proteínas<br />
A estrutura primária é a seqüência <strong>de</strong> <strong>aminoácidos</strong> que compõem a ca<strong>de</strong>ia<br />
polipeptídica. 20 <strong>aminoácidos</strong> diferentes <strong>são</strong> encontrados nas proteínas. A or<strong>de</strong>m<br />
exata dos <strong>aminoácidos</strong> em uma proteína específica é a estrutura primária <strong>de</strong>ssa<br />
proteína.<br />
8
A estrutura secundária é uma função dos ângulos formados pelas<br />
ligações peptídicas que ligam os amino ácidos. Segundo a IUPAC, "The<br />
secondary structure of a segment of polypepti<strong>de</strong> chain is the local spatial<br />
arrangement of its main-chain atoms without regard to the conformation of its<br />
si<strong>de</strong> chains or to its relationship with other segments". A conformação espacial é<br />
mantida graças as interações intermoleculares (ligação hidrogênio) entre os<br />
hidrogênios dos grupos amino e os átomos <strong>de</strong> oxigênio dos outros amino ácidos.<br />
Estrutura Secundária <strong>das</strong> Proteínas<br />
A estrutura secundária diz respeito aos padrões regulares e repetitivos que<br />
ocorrem localmente no enovelamento do esqueleto da proteína. <strong>Os</strong> dois arranjos<br />
locais mais comuns nas proteínas <strong>são</strong> a alfa-hélice e a folha-beta.<br />
Alfa-Hélice<br />
Numa alfa-hélice, o esqueleto polipeptídico se enrola em torno do eixo <strong>de</strong><br />
uma hélice imaginária, no sentido horário.<br />
Nesta ilustração, estão mostrados apenas os átomos do esqueleto N-C-<br />
CO. Observe o enrolamento em espiral do esqueleto em torno <strong>de</strong> um eixo<br />
imaginário que passa pelo centro da hélice.<br />
9
Em geral, estas ligações forçam a proteína a assumir uma forma<br />
helicoidal, como uma corda enrolada em torno <strong>de</strong> um tubo imaginário. Esta<br />
forma, a mais comum, é chamado <strong>de</strong> alfa hélice.<br />
Outras duas formas na estrutura secundária <strong>são</strong> as beta-sheets e turns.<br />
Nas beta-sheets, um segmento da ca<strong>de</strong>ia interage com outro, paralelamente.<br />
Folha-beta<br />
Na estrutura secundária <strong>de</strong>nominada folha-beta, o esqueleto polipeptídico<br />
está quase completamente estendido. <strong>Os</strong> grupos R (não exibidos na figura) se<br />
alternam para cima e para baixo ao longo do esqueleto estendido.<br />
10
Turns" <strong>são</strong> o terceiro tipo <strong>das</strong> estruturas secundárias clássicas, e <strong>são</strong><br />
responsáveis pela rever<strong>são</strong> da direção da ca<strong>de</strong>ia polipeptídica. Eles <strong>são</strong><br />
localizados na superfície polar da proteína, e contém resíduos com carga. <strong>Os</strong><br />
sítios <strong>de</strong> reconhecimento dos anticorpos, da fosforilação, glicosilação e da<br />
hidroxilação <strong>são</strong> encontrados, freqüentemente, nos ou próximos dos turns.<br />
Estrutura Terciária <strong>das</strong> Proteínas<br />
A estrutura terciária diz respeito à<br />
forma tridimensional específica assumida<br />
pela proteína como resultado do<br />
enovelamento global <strong>de</strong> toda a ca<strong>de</strong>ia<br />
polipeptídica. A estrutura terciária <strong>das</strong><br />
enzimas toma geralmente uma forma<br />
globular compacta.<br />
Estrutura terciária da molécula <strong>de</strong> triose fosfato isomerase (TPI).<br />
11
A estrutura terciária relaciona-se com os loopings e dobraduras da<br />
ca<strong>de</strong>ia protéica sobre ela mesma. É a conformação espacial da proteína, como<br />
um todo, e não <strong>de</strong> <strong>de</strong>terminados segmentos particulares da ca<strong>de</strong>ia protéica. A<br />
forma <strong>das</strong> proteínas está relacionada com sua estrutura terciária. Existem, por<br />
exemplo, proteínas globulares (que tem forma esférica). O que <strong>de</strong>termina a<br />
estrutura terciária <strong>são</strong> as ca<strong>de</strong>ias laterais dos amino ácidos; algumas ca<strong>de</strong>ias<br />
<strong>são</strong> tão longas e hidrofóbicas que perturbam a estrutura secundária helicoidal,<br />
provocando a dobra ou looping da proteína. Muitas vezes, as partes hidrofóbicas<br />
da proteína agrupam-se no interior da proteína dobrada, longe da água e dos<br />
íons do ambiente on<strong>de</strong> a proteína se encontra, <strong>de</strong>ixando as partes hidrofílicas<br />
expostas na superfície da estrutura da proteína. Regiões como "sítio ativos",<br />
"sítios regulatórios" e módulos <strong>são</strong> proprieda<strong>de</strong>s da estrutura terciária.<br />
Estrutura Quaternária <strong>das</strong> Proteínas<br />
Existe, finalmente, a estrutura quaternária: certas<br />
12
proteínas, tal como a hemoglobina, <strong>são</strong> compostas por mais <strong>de</strong> uma unida<strong>de</strong><br />
polipeptídica (ca<strong>de</strong>ia protéica). A conformação espacial <strong>de</strong>stas ca<strong>de</strong>ias, juntas, é<br />
que <strong>de</strong>termina a estrutura quaternária. Esta estrutura é mantida pelas mesmas<br />
forças que <strong>de</strong>terminam as estruturas secundárias e terciárias. A figura ao lado<br />
mostra uma imunoglobulina que é, na verda<strong>de</strong>, um tetrâmero, isto é, constituída<br />
por 4 ca<strong>de</strong>ias protéicas (polipeptí<strong>de</strong>os).<br />
Muitas proteínas <strong>são</strong> constituí<strong>das</strong> por mais <strong>de</strong> uma ca<strong>de</strong>ia polipeptídica. A<br />
estrutura quaternária <strong>de</strong>screve a forma com que as diferentes subunida<strong>de</strong>s se<br />
agrupam e se ajustam para formar a estrutura total da proteína. Por exemplo, a<br />
molécula da hemoglobina humana, mostrada abaixo, é composta por quatro<br />
subunida<strong>de</strong>s.<br />
As proteínas po<strong>de</strong>m ser simples (constituí<strong>das</strong> somente por amino ácidos)<br />
ou conjuga<strong>das</strong> (que contém grupos prostéticos, isto é, grupos não amino<br />
ácidos, tais como carboidratos, íons, pigmentos, etc., como na figura ao lado). A<br />
hemoglobina é um exemplo <strong>de</strong> proteína conjugada: contém 4 grupos<br />
prostéticos, cada um consistindo <strong>de</strong> um íon <strong>de</strong> ferro e a porfirina. São<br />
justamente estes grupos que habilitam a hemoglobina a carregar o oxigênio<br />
13
através da corrente sanguínea. As liproproteínas, tal como LDL e HDL, <strong>são</strong><br />
também exemplos <strong>de</strong> proteínas conjuga<strong>das</strong> - neste caso, com lipí<strong>de</strong>os.<br />
Uma outra forma <strong>de</strong> classificar as proteínas é baseado na sua função.<br />
Sobre este prisma, elas po<strong>de</strong>m ser dividi<strong>das</strong> em dois grupos: proteínas<br />
estruturais e proteínas biologicamente ativas. Algumas proteínas, entretanto,<br />
po<strong>de</strong>m pertencer aos dois grupos. A maioria <strong>das</strong> proteínas estruturais <strong>são</strong><br />
fibrosas - compostas por ca<strong>de</strong>ias alonga<strong>das</strong>. Dois bons exemplos, nos animais,<br />
<strong>são</strong> o colágeno (ossos, tendões, pele e ligamentos) e a queratina (unhas,<br />
cabelos, penas e bicos).<br />
A gran<strong>de</strong> maioria <strong>das</strong> proteínas biologicamente ativas <strong>são</strong> globulares,<br />
e sua ativida<strong>de</strong> funcional é intrínseca a sua organização espacial. Exemplos <strong>são</strong><br />
as enzimas, hormônios protéicos (que atuam como mensageiros químicos),<br />
proteínas <strong>de</strong> transporte (como as lipo-proteínas, que po<strong>de</strong>m carregar o<br />
colesterol) e imunoglobulinas (ou anticorpos), que protegem o corpo <strong>de</strong><br />
microorganismos invasores. Muitas proteínas biologicamente ativas ficam na<br />
região da membrana celular, e atuam <strong>de</strong> diversas maneiras. A figura abaixo<br />
uma proteína trans-membrana, que atua como um canal iônico em bactérias.<br />
Existe um "buraco" na estrutura protéica, <strong>de</strong> cerca <strong>de</strong> 11 angstrons <strong>de</strong> diâmetro,<br />
on<strong>de</strong> os íons passam, seletivamente.<br />
As enzimas <strong>são</strong> uma classe muito importante <strong>de</strong> proteínas biologicamente<br />
ativas. Elas <strong>são</strong> responsáveis pela catálise <strong>de</strong> diversas reações em nosso<br />
organismo. Reações que, sem o auxílio <strong>das</strong> enzimas, jamais aconteceriam ou,<br />
ainda, gerariam in<strong>de</strong>sejados produtos colaterais.<br />
Em uma proteína enzimática, existe um certo domínio chamado <strong>de</strong> "sítio<br />
ativo", que liga-se ao substrato - a molécula reagente - e diminui a energia do<br />
estado <strong>de</strong> transição que leva ao produto <strong>de</strong>sejado. A ligação entre o sítio ativo<br />
e o substrato é extremamente específica: a molécula precisa ter certas<br />
características eletrônicas e espaciais que permitam o seu "encaixe" com a<br />
proteína. Por isso esta relação tem sido chamada <strong>de</strong> lock'n'key, ou seja, chave-<br />
14
fechadura. No exemplo da figura ao lado, uma <strong>de</strong>terminada região da proteína -<br />
o módulo SH2 - liga-se à tirosina fosfatada, que se adapta ao sítio ativo da<br />
enzima tal como uma chave faz a sua fechadura.<br />
A ativida<strong>de</strong> <strong>de</strong> uma enzima po<strong>de</strong> ser bloqueada pela ação <strong>de</strong> outra<br />
molécula, um inibidor. Quando um inibidor interage com uma <strong>de</strong>terminada região<br />
da enzima, chamado <strong>de</strong> sítio regulatório, provoca uma alteração na sua<br />
conformação e uma <strong>de</strong>sativação do sítio catalítico. A ativida<strong>de</strong> enzimática,<br />
portanto, po<strong>de</strong> ser controlada, pelo organismo, através da liberação ou captação<br />
<strong>de</strong> inibidores.<br />
15
Cozinhando proteínas<br />
A Reação <strong>de</strong> Maillard<br />
Como saber quando uma pizza está pronta, o bolo está no ponto ou o frango<br />
está assado? Basta, talvez, olhar: aquele aspecto corado, dourado, é um forte indício<br />
<strong>de</strong> que a comida está cozida. Sabe <strong>de</strong> on<strong>de</strong> vem esta cor?! É da reação <strong>de</strong> Maillard.<br />
São várias as reações químicas que <strong>de</strong>ixam o alimento marrom, ou escurecido.<br />
Pirólise, por exemplo, é um dos mais comuns: quando <strong>de</strong>ixamos o pão por muito<br />
tempo na torra<strong>de</strong>ira, ele volta preto, queimado; ocorre uma <strong>de</strong>sidratação<br />
termicamente induzida do amido, resultando carbono (carvão) e água. O açúcar, a<br />
200 o C, carameliza, através <strong>de</strong> uma <strong>de</strong>sidratação, uma con<strong>de</strong>nsação e uma<br />
polimerização. Entretanto, nem a pirólise ou caramelização inclui o que acontece com<br />
o constituinte alimentar mais importante, as proteínas. Em altas temperaturas, os<br />
<strong>aminoácidos</strong> <strong>das</strong> proteínas interagem com açúcares redutores, produzindo as cores,<br />
aromas e sabores característicos do alimento cozido. Esta reação entre proteínas e<br />
carbohidratos foi primeiramente <strong>de</strong>scrita em 1912, por Louis-Camille Maillard - daí o<br />
nome da reação. Durante o cozimento, a reação <strong>de</strong> Maillard (que envolve uma série<br />
<strong>de</strong> etapas) inicia com uma con<strong>de</strong>nsação entre amino ácidos e açúcares. Estes<br />
compostos, incolores, se rearranjam e <strong>de</strong>sidratam para formar intermediários<br />
amarelados que, finalmente, <strong>são</strong> convertidos para polímeros vermelhos e marrons.<br />
Um dos efeitos positivos da reação <strong>de</strong> Maillard é o aspecto visual <strong>de</strong> bolos, pizzas e<br />
lasanhas quando cozi<strong>das</strong>; um negativo é o escurecimento do leite, quando aquecido<br />
por muito tempo (tal como no doce <strong>de</strong> leite). A cor <strong>de</strong>riva <strong>das</strong> melanoidinas forma<strong>das</strong><br />
pela reação <strong>de</strong> Maillard. A reação <strong>de</strong> Maillard também é responsável pelo<br />
envelhecimento <strong>de</strong> nosso organismo. Muitos químicos vêm pesquisando drogas que<br />
interrompam as reações <strong>de</strong> Maillard numa tentativa <strong>de</strong> minimizar os efeitos do<br />
envelhecimento em nosso corpo.<br />
16
Biomoléculas: Introdução<br />
Há quatro classes principais <strong>de</strong> pequenas moléculas biológicas nas<br />
células. São os carboidratos, os lipí<strong>de</strong>os, os <strong>aminoácidos</strong> e os<br />
nucleotí<strong>de</strong>os. <strong>Os</strong> compostos pertencentes às diferentes classes po<strong>de</strong>m ser<br />
i<strong>de</strong>ntificados por suas características estruturais particulares.<br />
Carboidratos<br />
<strong>1.</strong> <strong>Os</strong> carboidratos po<strong>de</strong>m ser açúcares simples (monossacarí<strong>de</strong>os) como a<br />
glicose, dissacarí<strong>de</strong>os como a sacarose, ou então uma série <strong>de</strong><br />
monossacarí<strong>de</strong>os unidos por ligações glicosídicas.<br />
2. <strong>Os</strong> monossacarí<strong>de</strong>os mais comuns nas células têm 4, 5, ou 6 átomos <strong>de</strong><br />
carbono e vários grupos OH polares.<br />
3. Nos açúcares comuns, a proporção entre C, H e O é <strong>de</strong> 1 : 2 : <strong>1.</strong><br />
4. <strong>Os</strong> açúcares <strong>de</strong> 5 e 6 carbonos normalmente existem nas células como<br />
estruturas contendo um anel <strong>de</strong> 5 ou 6 átomos, com um átomo <strong>de</strong><br />
oxigênio no anel.<br />
5. A abundância <strong>de</strong> grupos OH, a razão C : H : O <strong>de</strong> 1 : 2 : 1 e a estrutura<br />
com um O no anel <strong>são</strong> características-chave para a i<strong>de</strong>ntificação dos<br />
carboidratos.<br />
17
Carboidratos<br />
O açúcar que utilizamos em casa contém a sacarose: um dos vários<br />
compostos orgânicos <strong>de</strong> sabor doce, incolores, solúveis em água, encontrados<br />
na seiva <strong>de</strong> várias plantas (como a cana-<strong>de</strong>-açúcar) e no leite <strong>de</strong> mamíferos. O<br />
açúcar mais comum é justamente a sacarose, que, puro, é utilizado na indústria<br />
<strong>de</strong> alimentos e bebi<strong>das</strong>.<br />
<strong>Os</strong> açúcares pertencem a uma classe <strong>de</strong> compostos orgânicos<br />
chamada carbohidratos*, ou hidratos <strong>de</strong> carbono. O nome <strong>de</strong>riva da reação<br />
<strong>de</strong> fotossíntese que ocorre nas plantas, com a ação catalítica da clorofila: o<br />
dióxido <strong>de</strong> carbono se combina com a água e formam a glucose. As<br />
moléculas <strong>de</strong> glucose po<strong>de</strong>m se combinar e formar outros dois componentes<br />
característicos <strong>das</strong> plantas: a sacarose, a celulose e o amido. As moléculas <strong>de</strong><br />
celulose garantem a sustentação da planta, e as <strong>de</strong> amido servem como um<br />
armazenamento <strong>de</strong> alimento para servir à nova planta, durante o crescimento<br />
inicial.<br />
Tanto a sacarose, amido ou celulose <strong>são</strong> vitais para as necessida<strong>de</strong>s<br />
básicas do homem. Todos os livros, jornais e revistas que lemos <strong>são</strong> impressas<br />
em papel - feito <strong>de</strong> celulose. O pão nosso <strong>de</strong> cada dia é feito com amido e<br />
adoçado com sacarose. Mesmo a cervejinha gelada <strong>de</strong>ve a sua existência à<br />
sacarose: é a fermentação <strong>de</strong>sta que produz o álcool e o CO2.<br />
18
glucose<br />
frutose<br />
<strong>Os</strong> carbohidratos <strong>são</strong>, provavelmente, os compostos orgânicos mais<br />
abundantes nos organismos vivos. Estruturalmente, po<strong>de</strong>m ser vistos como<br />
al<strong>de</strong>ídos poli-hidroxilados ou cetonas polihidroxila<strong>das</strong>; ou, ainda, compostos que,<br />
pela hidrólise, po<strong>de</strong>m se transformar nestes. Eles po<strong>de</strong>m sem divididos em<br />
quatro gran<strong>de</strong>s grupos: monossacarí<strong>de</strong>os, dissacarí<strong>de</strong>os, oligossacarí<strong>de</strong>os e<br />
polissacarí<strong>de</strong>os. <strong>Os</strong> monossacarí<strong>de</strong>os <strong>são</strong> os mais simples: apenas uma<br />
unida<strong>de</strong> <strong>de</strong> açúcar em cada molécula. A glucose, a frutose e a galactose <strong>são</strong> os<br />
monossacarí<strong>de</strong>os mais comuns, e possuem a mesma fórmula molecular:<br />
C6H12O6. A frutose e a glucose <strong>são</strong> encontra<strong>das</strong> em frutas e no mel e a<br />
galactose no leite dos mamíferos. Embora tenham a mesma fórmula molecular,<br />
estes compostos tem estruturas químicas diferentes, isto é, <strong>são</strong> isômeros. O<br />
sabor <strong>de</strong> cada um também é diferente. Sabe-se que o doce do açúcar <strong>de</strong>pen<strong>de</strong><br />
gran<strong>de</strong>mente da posição dos grupos -OH que compõe a estrutura molecular.<br />
Quando duas moléculas <strong>de</strong> um açúcar simples se unem elas formam um<br />
dissacarí<strong>de</strong>o. A sacarose, por exemplo, é um dissacarí<strong>de</strong>o formado por uma<br />
unida<strong>de</strong> <strong>de</strong> frutose e outra unida<strong>de</strong> <strong>de</strong> glucose. A energia contida nas ligações<br />
químicas na frutose, glucose ou sacarose é a resposável por suprir, na maioria<br />
dos seres vivos, a energia necessária para suas ativida<strong>de</strong>s.<br />
<strong>Os</strong> monossacarí<strong>de</strong>os po<strong>de</strong>m, também, se combinar e formar macromoléculas,<br />
19
com longas ca<strong>de</strong>ias <strong>de</strong> unida<strong>de</strong>s <strong>de</strong> frutose, glucose ou galactose repeti<strong>das</strong>.<br />
Estes <strong>são</strong> os polissacarí<strong>de</strong>os: moléculas com mais <strong>de</strong> 10.000 unida<strong>de</strong>s <strong>de</strong><br />
açúcares. Mais <strong>de</strong> uma centena <strong>de</strong> espécies foram i<strong>de</strong>ntifica<strong>das</strong>, mas as mais<br />
comuns <strong>são</strong> a celulose e o amido.<br />
<strong>Os</strong> carbohidratos <strong>são</strong> muito importantes para os seres vivos. O<br />
mecanismo <strong>de</strong> armazenamento <strong>de</strong> energia, para quase todos os seres vivos <strong>de</strong><br />
nosso planeta, baseia-se em carboidratos ou lipí<strong>de</strong>os - os carboidratos <strong>são</strong> uma<br />
fonte <strong>de</strong> energia imediata, enquanto que os lipí<strong>de</strong>os queimam em uma<br />
velocida<strong>de</strong> menor, servindo para longo prazo. O ciclo metabólico da glucose, por<br />
exemplo, é vital para os organismos vivos, tal como o homem: falhas neste ciclo<br />
acarretam vários males, tal como os <strong>de</strong>senca<strong>de</strong>ados pelo diabetes. <strong>Os</strong> seres<br />
ruminantes, tal como o boi, <strong>são</strong> capazes <strong>de</strong> converter os polissacarí<strong>de</strong>os como<br />
a celulose (indigesto para o homem) em açúcares menores e proteínas; e <strong>são</strong><br />
justamente estes seres a maior fonte protéica para a humanida<strong>de</strong>. Vários<br />
antibióticos, tal como a streptomicina, <strong>são</strong> <strong>de</strong>rivados <strong>de</strong> carbohidratos. O<br />
iogurte também <strong>de</strong>ve sua existência aos carbohidratos: os lactobacilos<br />
(bactérias que habitam o leite) convertem o açúcar em ácido lático, gerando o<br />
iogurte.<br />
A quantida<strong>de</strong> total <strong>de</strong> energia (ou, como a mídia normalmente chama,<br />
"caloria") requerida para um indivíduo <strong>de</strong>pen<strong>de</strong> da ida<strong>de</strong>, ocupação e outros<br />
fatores, mas geralmente gira em torno <strong>de</strong> 2.000 a 4.000 calorias (uma caloria,<br />
por <strong>de</strong>finição, é a quantida<strong>de</strong> <strong>de</strong> calor necessária para aumentar a temperatura<br />
20
<strong>de</strong> 1,000 grama <strong>de</strong> água <strong>de</strong> 15 o para 16 o C). Um grama <strong>de</strong> carboidrato produz<br />
cerca <strong>de</strong> 4 calorias, quando metabolizado, no homem. Para efeito <strong>de</strong><br />
comparação, um grama <strong>de</strong> gordura produz cerca <strong>de</strong> 9 calorias e 1 grama <strong>de</strong><br />
proteína produz também 4 calorias. Como <strong>são</strong> rapidamente metabolizados e<br />
altamente energéticos, os carboidrato <strong>são</strong>, geralmente, os pratos principais dos<br />
atletas antes <strong>das</strong> competições.<br />
Esta alta capacida<strong>de</strong> calórica po<strong>de</strong> ser, para alguns, um problema: muitas<br />
pessoas, por motivo <strong>de</strong> saú<strong>de</strong> ou estética, precisam evitar o consumo <strong>de</strong> açúcar.<br />
Lipí<strong>de</strong>os - as biomoléculas hidrofóbicas.<br />
Embora difama<strong>das</strong> pela mídia, estas biomoléculas <strong>são</strong> essenciais para a<br />
manutenção <strong>de</strong> várias estruturas dos seres vivos e atuam e diversos processos<br />
metabólicos.<br />
Mais um caso <strong>de</strong> termo químico que se incorpora ao senso comum:<br />
os lipídios, há tempos, extrapolaram os livros <strong>de</strong> química. Definem um conjunto<br />
<strong>de</strong> substâncias químicas que, ao contrário <strong>das</strong> outras classes <strong>de</strong> compostos<br />
orgânicos, não <strong>são</strong> caracteriza<strong>das</strong> por algum grupo funcional comum, e sim<br />
pela sua alta solubilida<strong>de</strong> em solventes orgânicos e baixa solubilida<strong>de</strong> em água.<br />
Juntamente com as proteínas, ácidos nucléicos e carboidratos, os lipídios <strong>são</strong><br />
componentes essenciais <strong>das</strong> estruturas biológicas, e fazem parte <strong>de</strong> um grupo<br />
conhecido como biomoléculas. <strong>Os</strong> lipídios se encontram distribuidos em todos<br />
os tecidos, principalmente nas membranas celulares e nas células <strong>de</strong> gordura.<br />
21
Triglicerí<strong>de</strong>os<br />
O traço mais facilmente reconhecível <strong>de</strong>stas moléculas é a presença <strong>de</strong> três<br />
ácidos graxos com suas longas cau<strong>das</strong> hidrofóbicas constituí<strong>das</strong> principalmente<br />
por grupos -CH2. <strong>Os</strong> três ácidos graxos estão covalentemente ligados a uma<br />
molécula <strong>de</strong> glicerol. Este composto é uma gordura neutra, do tipo que é<br />
utilizado para armazenar reservas <strong>de</strong> energia no nosso tecido adiposo.<br />
<strong>1.</strong> <strong>Os</strong> lipí<strong>de</strong>os ou gorduras caracterizam-se por sua insolubilida<strong>de</strong> em<br />
água e sua solubilida<strong>de</strong> em solventes orgânicos ou em <strong>de</strong>tergentes.<br />
2. <strong>Os</strong> lipí<strong>de</strong>os <strong>são</strong> as moléculas mais eficientes como reserva energética<br />
<strong>das</strong> células.<br />
3. Boa parte da estrutura dos lipí<strong>de</strong>os é muito apolar, sendo formada<br />
quase exclusivamente por átomos <strong>de</strong> carbono e hidrogênio.<br />
4. <strong>Os</strong> triglicerí<strong>de</strong>os, usados como reserva energética no tecido adiposo,<br />
<strong>são</strong> compostos por uma molécula <strong>de</strong> glicerol con<strong>de</strong>nsada com três<br />
ácidos graxos. <strong>Os</strong> ácidos graxos têm longas cau<strong>das</strong> hidrofóbicas que<br />
consistem essencialmente em repetições <strong>de</strong> grupos -CH2..<br />
22
5. <strong>Os</strong> diglicerí<strong>de</strong>os, que ocorrem principalmente nas membranas<br />
celulares, <strong>são</strong> compostos <strong>de</strong> um glicerol, dois ácidos graxos <strong>de</strong> ca<strong>de</strong>ia<br />
longa e uma "cabeça" contendo um grupo mais hidrofílico.<br />
6. A presença <strong>de</strong> longas ca<strong>de</strong>ias <strong>de</strong> ácidos graxos é uma característicachave<br />
para a i<strong>de</strong>ntificação <strong>de</strong> muitos lipí<strong>de</strong>os importantes.<br />
23
A estrutura mostrada no diagrama é um exemplo <strong>de</strong> lipí<strong>de</strong>o.<br />
Existem diversos tipos <strong>de</strong> moléculas diferentes que pertencem à classe<br />
dos lipídios. Embora não apresentem nenhuma característica estrutural<br />
comumm to<strong>das</strong> elas possuem muito mais ligações carbono-hidrogênio do que as<br />
outras biomoléculas, e a gran<strong>de</strong> maioria possui poucos heteroátomos. Isto faz<br />
com que estas moléculas sejam pobres em dipolos localizados (carbono e<br />
hidrogênio possuem eletronegativida<strong>de</strong> semelhante). Uma <strong>das</strong> leis clássicas da<br />
química diz que "o semelhante dissolve o semelhante": daí a razão para estas<br />
moléculas serem fracamente solúveis em água ou etanol (solventes polares) e<br />
altamente solúveis em solventes orgânicos (geralmente apolares).<br />
Ao contrário <strong>das</strong> <strong>de</strong>mais biomoléculas, os lipídios não <strong>são</strong> polímeros,<br />
isto é, não <strong>são</strong> repetições <strong>de</strong> uma unida<strong>de</strong> básica. Embora possam apresentar<br />
uma estrutura química relativamente simples, as funções dos lipídios <strong>são</strong><br />
complexas e diversas, atuando em muitas etapas cruciais do metabolismo e na<br />
<strong>de</strong>finição <strong>das</strong> estruturas celulares.<br />
<strong>Os</strong> químicos po<strong>de</strong>m separar os lipídios <strong>de</strong> uma amostra biológica através<br />
<strong>de</strong> uma técnica conhecida como extração; um solvente orgânico é adicionado a<br />
uma solução aquosa da amostra e, com um auxílio <strong>de</strong> um funil <strong>de</strong> separação,<br />
obtém-se a fase orgânica rica em lipídios. Com a evaporação do solvente<br />
orgânico obtém-se o lipídio. É <strong>de</strong>sta maneira que, em escala industrial, se obtém<br />
o óleo vegetal.<br />
Como veremos a seguir, alguns lipídios têm a habilida<strong>de</strong> <strong>de</strong> formar filmes<br />
sobre a superfície da água, ou mesmo <strong>de</strong> formar agregados organizados na<br />
solução; estes lipídios possuem uma região, na molécula, polar ou iônica, que é<br />
facilmente hidratada. Este comportamento é característico dos lipídios que<br />
compõe a membrana celular. <strong>Os</strong> lipossomos <strong>são</strong> "microenvelopes" capazes <strong>de</strong><br />
envolverem moléculas orgânicas e entregarem-nas ao "en<strong>de</strong>reço biológico"<br />
correto.<br />
24
Não existe grupos funcionais: em comum, apenas a hidrofobicida<strong>de</strong>!<br />
25
Classificação dos lipídios<br />
Ácidos Graxos<br />
A hidrólise ácida dos triacilglicerídios leva aos correspon<strong>de</strong>ntes ácidos<br />
carboxílicos - conhecidos como ácidos graxos. Este é o grupo mais abundante<br />
<strong>de</strong> lipídios nos seres vivos, e <strong>são</strong> compostos <strong>de</strong>rivados dos ácidos<br />
carboxílicos. Este grupo é geralmente chamado <strong>de</strong> lipídios saponificáveis,<br />
porque a reação <strong>de</strong>stes com uma solução quente <strong>de</strong> hidróxido <strong>de</strong> sódio produz o<br />
correspon<strong>de</strong>nte sal sódico do ácido carboxílico, isto é, o sabão.<br />
<strong>Os</strong> ácidos graxos possuem um pKa da or<strong>de</strong>m <strong>de</strong> 4,8. Isto significa que,<br />
em uma solução on<strong>de</strong> o pH é 4,8, meta<strong>de</strong> da concentração o ácido está<br />
ionizada; a um pH maior (7, por exemplo) praticamente todo o ácido encontra-se<br />
ionizado, formando um sal com o seu contra-íon; num pH menor (3, e.g.) todo o<br />
ácido encontra-se protonado.<br />
26
A natureza do cátion (contra-íon) <strong>de</strong>termina as proprieda<strong>de</strong>s do sal<br />
carboxílico formado. Em geral, sais com cátions divalentes (Ca 2+ ou Mg 2+ ) não<br />
<strong>são</strong> bem solúveis em água, ao contrário do formado com metais alcalinos (Na + ,<br />
K + , etc.), que <strong>são</strong> bastante solúveis em água e em óleo - <strong>são</strong> conhecidos como<br />
sabão. É por este motivo que, em regiões on<strong>de</strong> a água é rica em metais<br />
alcalinos terrosos, é necessário se utilizar formulações especiais <strong>de</strong> sabão na<br />
hora <strong>de</strong> lavar a roupa. Na água, em altas concentrações <strong>de</strong>stes sais, ocorre a<br />
formação <strong>de</strong> micelas - glóbulos microscópicos formados pela agregação <strong>de</strong>stas<br />
moléculas. Nas micelas, as regiões polares <strong>das</strong> moléculas <strong>de</strong> sabão encontramse<br />
em contato com as moléculas <strong>de</strong> água, enquanto que as regiões hidrofóbicas<br />
ficam no interior do glóbulo, em uma pseudofase orgânica, sem contato com a<br />
água.<br />
A adição <strong>de</strong> HCl a uma solução aquosa <strong>de</strong> sabão provoca a precipitação<br />
do ácido graxo, que é pouco solúvel em água e, em solução aquosa, ten<strong>de</strong> a<br />
formar dímeros através <strong>de</strong> fortes ligações hidrogênio.<br />
27
<strong>Os</strong> ácidos graxos também po<strong>de</strong>m ser classificados como saturados ou<br />
insaturados, <strong>de</strong>pen<strong>de</strong>ndo da ausência ou presença <strong>de</strong> ligações duplas<br />
carbono-carbono. <strong>Os</strong> insaturados (que contém tais ligações) <strong>são</strong> facilmente<br />
convertidos em saturados através da hidrogenação catalítica (este processo é<br />
chamado <strong>de</strong> redução). A presença <strong>de</strong> insaturação nas ca<strong>de</strong>ias <strong>de</strong> ácido<br />
carboxílico dificulta a interação intermolecular, fazendo com que, em geral,<br />
estes se apresentem, à temperatura ambiente, no estado líquido; já os<br />
saturados, com uma maior facilida<strong>de</strong> <strong>de</strong> empacotamente intermolecular, <strong>são</strong><br />
sólidos. A margarina, por exemplo, é obtida através da hidrogenação <strong>de</strong> um<br />
líquido - o óleo <strong>de</strong> soja ou <strong>de</strong> milho, que é rico em ácidos graxos insaturados.<br />
Triacilglicerídios<br />
Conhecidos como gorduras neutras, esta gran<strong>de</strong> classe <strong>de</strong> lipídios não<br />
contém grupos carregados. São ésteres do glicerol - 1,2,3-propanotriol. Estes<br />
ésteres possuem longas ca<strong>de</strong>ias carbônicas atacha<strong>das</strong> ao glicerol, e a hidrólise<br />
ácida promove a formação<br />
28
Nos animais, os TAGs <strong>são</strong> lipídios que servem, principalmente, para a<br />
estocagem <strong>de</strong> energia; as células lipidinosas <strong>são</strong> ricas em TAGs. É uma <strong>das</strong><br />
mais eficientes formas <strong>de</strong> estocagem <strong>de</strong> energia, principalmente com TAGs<br />
saturados; cada ligação C-H é um sítio potencial para a reação <strong>de</strong> oxidação, um<br />
processo que libera muita energia.<br />
<strong>Os</strong> TAGs provindo <strong>de</strong> animais terrestres contém uma maior<br />
quantida<strong>de</strong> <strong>de</strong> ca<strong>de</strong>ias satura<strong>das</strong> se comparados aos TAGs <strong>de</strong> animais<br />
aquáticos. Embora menos eficientes no armazenamento <strong>de</strong> energia, as TAGs<br />
insatura<strong>das</strong> oferecem uma vantagem para os animais aquáticos, principalmente<br />
para os que vivem em água fria: elas têm uma menor temperatura <strong>de</strong> fu<strong>são</strong>,<br />
permanecendo no estado líquido mesmo em baixas temperaturas. Se fossem<br />
satura<strong>das</strong>, ficariam no estado sólido e teriam maior dificulda<strong>de</strong> <strong>de</strong> mobilida<strong>de</strong> no<br />
organismo do animal.<br />
29
<strong>Os</strong> TAGs po<strong>de</strong>m ser chamados <strong>de</strong> gorduras ou óleos, <strong>de</strong>pen<strong>de</strong>ndo do<br />
estado físico na temperatura ambiente: se forem sólidos, <strong>são</strong> gorduras, e<br />
líquidos <strong>são</strong> óleos. No organismo, tanto os óleos como as gorduras po<strong>de</strong>m ser<br />
hidrolisados pelo auxílio <strong>de</strong> enzimas específicas, as lipases (tal como a<br />
fosfolipase A ou a lipase pancreática), que permitem a digestão <strong>de</strong>stas<br />
substâncias.<br />
________________________<br />
Fosfolipídios<br />
30
<strong>Os</strong> fosfolípi<strong>de</strong>os <strong>são</strong> ésteres do glicerofosfato - um <strong>de</strong>rivado fosfórico do<br />
glicerol. O fosfato é um diéster fosfórico, e o grupo polar do fosfolipídio. A<br />
um dos oxigênios do fostato po<strong>de</strong>m estar ligados grupos neutros ou carregados,<br />
como a colina, a etanoamina, o inositol, glicerol ou outros. As fostatidilcolinas,<br />
por exemplo, <strong>são</strong> chama<strong>das</strong> <strong>de</strong> lecitinas.<br />
31
<strong>Os</strong> fosfolipídios ocorrem em praticamente todos os seres vivos. Como <strong>são</strong><br />
anfifílicos, também <strong>são</strong> capazes <strong>de</strong> formar pseudomicrofases em solução<br />
aquosa; a organização, entrentanto, difere <strong>das</strong> micelas. <strong>Os</strong> fosfolipídios se<br />
or<strong>de</strong>nam em bicama<strong>das</strong>, formando vesículas. Estas estruturas <strong>são</strong> importantes<br />
para conter substâncias hidrossolúveis em um sistema aquoso - como no caso<br />
<strong>das</strong> membranas celulares ou vesículas sinápticas. Mais <strong>de</strong> 40% <strong>das</strong> membranas<br />
<strong>das</strong> células do fígado, por exemplo, é composto por fosfolipídios. Envolvidos<br />
nestas bicama<strong>das</strong> encontram-<br />
As membranas celulares <strong>são</strong> elásticas e resitentes graças às fortes<br />
interações hidrofóbicas entre os grupos apolares dos fosfolipídios. Estas<br />
membranas formam vesículas que separam os componentes celulares do meio<br />
intercelular - dois sistemas aquosos!<br />
32
Esfingolipídios<br />
rol, eles <strong>são</strong> <strong>de</strong>rivados <strong>de</strong> um amino álcool. Estes lipídios contém 3<br />
componentes fundamentais: um grupo polar, um ácido graxo, e uma estrutra<br />
chamada base esfingói<strong>de</strong> - uma longa ca<strong>de</strong>ia hidrocarbônica <strong>de</strong>rivada do <strong>de</strong>ritro-2-amino-1,3-diol.<br />
É chamado <strong>de</strong> base <strong>de</strong>vido a presença do grupo amino<br />
que, em solução aquosa, po<strong>de</strong> ser convertido para o respectivo íon amônio. A<br />
esfingosina foi o primeiro membro <strong>de</strong>sta classe a ser <strong>de</strong>scoberto e, juntamente<br />
com a di-hidroesfingosina, <strong>são</strong> os grupos mais abundantes <strong>de</strong>sta classe nos<br />
mamíferos. No di-hidro, a ligação dupla é reduzida. O grupo esfingói<strong>de</strong> é<br />
conectado ao ácido graxo graças a uma ligação amídica. A esfingomielina,<br />
encontrada em muitos animais, é um exemplo <strong>de</strong> esfingolipídio.<br />
<strong>Os</strong> vários tipos <strong>de</strong> esfingolipídios <strong>são</strong> classificados <strong>de</strong> acordo com o grupo que<br />
está conectado à base esfingói<strong>de</strong>. Se o grupo hidroxila estiver conectado a um<br />
açúcar, o composto é chamado <strong>de</strong> glicosfincolipídio. O grupo po<strong>de</strong> ser, também,<br />
um éster fosfófico, como a fosfocolina, na esfingomielina. Gangliosídios <strong>são</strong><br />
glicosfingolipídios que contém o ácido N-acetilneurâmico (ácido siálico) ligado à<br />
ca<strong>de</strong>ia oligossacarídica. Estas espécies <strong>são</strong> muito comuns no tecido cerebral.<br />
33
________________________<br />
Esterói<strong>de</strong>s<br />
<strong>Os</strong> esterói<strong>de</strong>s <strong>são</strong> lipídios <strong>de</strong>rivados do colesterol. Eles atuam, nos<br />
organismos, como hormônios e, nos humanos, <strong>são</strong> secretados pelas gôna<strong>das</strong>,<br />
córtex adrenal e pela placenta. A testosterona é o hormônio sexual masculino,<br />
enquanto que o estradiol é o hormônio responsável por muitas <strong>das</strong><br />
características femininas.<br />
O colesterol, além da ativida<strong>de</strong> hormonal, também <strong>de</strong>sempenha um papel<br />
estrutural - habita a pseudofase orgânica nas membranas celulares. Muitas<br />
vezes chamado <strong>de</strong> vilão pela mídia, o colesterol é um composto vital para a<br />
maioria dos seres vivos.<br />
34
________________________<br />
Prostaglandinas<br />
Estes lipídios não <strong>de</strong>sempenham funções estruturais, mas <strong>são</strong><br />
importantes componentes em vários processos metabólicos e <strong>de</strong> comunicação<br />
intercelular. Segundo o químico Michael W. Davidson, da Florida State<br />
University, "prostaglandins act in a manner similar to that of hormones, by<br />
stimulating target cells into action. However, they differ from hormones in that<br />
they act locally, near their site of synthesis, and they are metabolized very<br />
rapidly. Another unusual feature is that the same prostaglandins act differently in<br />
different tissues". Um dos processos mais importantes controlados pelas<br />
prostaglandinas é a inflamação.<br />
35
Nucleotí<strong>de</strong>os<br />
<strong>1.</strong> <strong>Os</strong> nucleotí<strong>de</strong>os <strong>são</strong> os "<strong>blocos</strong> <strong>de</strong> construção" do RNA e do DNA.<br />
2. Eles <strong>são</strong> constituídos por um açúcar <strong>de</strong> 5 carbonos (ribose ou<br />
<strong>de</strong>soxirribose, um grupo fosfato e uma base nitrogenada púrica ou<br />
pirimidínica. As pirimidinas têm anéis <strong>de</strong> 6 átomos com dois átomos <strong>de</strong><br />
nitrogênio no anel. As purinas contêm anéis <strong>de</strong> 4 e <strong>de</strong> 6 membros<br />
reunidos, com 3 átomos <strong>de</strong> nitrogênio nos anel.<br />
3. Para i<strong>de</strong>ntificar um nucleotí<strong>de</strong>o, procure pela porção açúcar-fosfato,<br />
ligada a um anel complexo contendo átomos <strong>de</strong> nitrogênio.<br />
<strong>Os</strong> nucleotí<strong>de</strong>os <strong>são</strong> as unida<strong>de</strong>s monoméricas do RNA e do DNA. Eles<br />
<strong>são</strong> constituídos por uma pentose (ribose no caso do RNA e <strong>de</strong>soxirribose no<br />
caso do DNA), um grupo fosfato e uma base nitrogenada.<br />
Como o nome indica, uma pentose é açúcar que possui um anel com 5<br />
átomos. Ligado ao anel há um grupo fosfato, composto <strong>de</strong> um átomo <strong>de</strong> fósforo<br />
ligado covalentemente a 4 átomos <strong>de</strong> oxigênio. <strong>Os</strong> nucleotí<strong>de</strong>os também têm<br />
uma base nitrogenada ligada à pentose.<br />
36
Bases nitrogena<strong>das</strong>: purinas e pirimidinas<br />
Pirimidinas <strong>são</strong> anéis planos com 5 átomos <strong>de</strong> carbono e 1 átomo <strong>de</strong> nitrogênio.<br />
As purinas <strong>são</strong> anéis planos fusionados, contendo átomos <strong>de</strong> nitrogênio. As bases<br />
púricas e pirimidínicas do RNA e do DNA estão mostra<strong>das</strong> abaixo.<br />
37
DNA e RNA<br />
O RNA e o DNA <strong>são</strong> polímeros <strong>de</strong> nucleotí<strong>de</strong>os. O esqueleto do polímero é<br />
uma seqüência repetitiva <strong>de</strong> açúcar-fosfato-açúcar-fosfato- etc. Esses polímeros<br />
têm "polarida<strong>de</strong>", no sentido <strong>de</strong> que possuem uma direção <strong>de</strong>finida: o fosfato da<br />
posição 5' <strong>de</strong> um nucleotí<strong>de</strong>o liga-se à posição 3' do próximo nucleotí<strong>de</strong>o. No<br />
mo<strong>de</strong>lo do DNA (à esquerda), a fita da esquerda tem a direção 5'-3' (<strong>de</strong> cima para<br />
baixo), e a outra fita tem a polarida<strong>de</strong> inversa. Diz-se que as duas fitas <strong>de</strong> DNA<br />
<strong>são</strong> "antiparalelas".<br />
No mo<strong>de</strong>lo do RNA, note o grupo -OH extra na pentose, além do uso da<br />
base uracila (U) no lugar da timina (T) usada no DNA.<br />
38
A estrutura mostrada no diagrama é um exemplo <strong>de</strong> DNA.<br />
:<br />
O polímero mostrado no diagrama po<strong>de</strong> ser i<strong>de</strong>ntificado como um ácido<br />
nucléico porque em seu esqueleto covalente se alternam um açúcar e um<br />
fosfato.<br />
Qual ácido nucléico?<br />
DNA ou RNA ? Há duas diferenças principais na estrutura da ca<strong>de</strong>ia <strong>de</strong><br />
DNA quando comparada à do RNA.<br />
39
<strong>1.</strong> O açúcar presente no esqueleto <strong>de</strong> DNA não possui um grupo hidroxila (-OH) na<br />
posição 2'.<br />
O RNA tem uma hidroxila na posição 2';<br />
2. As bases do DNA <strong>são</strong> A, G, C e T.<br />
As bases do RNA <strong>são</strong> A, G, C e U.<br />
40
Significado Clínico dos Níveis <strong>de</strong> pH<br />
Introdução<br />
O bicarbonato como tampão<br />
<strong>Os</strong> principais sistemas-tampão que agem no corpo <strong>são</strong> as proteínas (por causa <strong>de</strong><br />
<strong>aminoácidos</strong> como his, asp e glu), o fosfato e o bicarbonato. Todos eles têm valores <strong>de</strong><br />
pKa menores que o pH fisiológico. Como conseqüência, sua capacida<strong>de</strong> <strong>de</strong><br />
tamponamento aumenta à medida que o pH diminui e sai da faixa fisiológica. A maioria<br />
dos <strong>de</strong>svios do pH sangüíneo ocorrem para a direção ácida. Assim, o baixo valor do pKa<br />
<strong>de</strong>sses sistemas-tampão os torna a<strong>de</strong>quados para resistir à acidose metabólica.<br />
Dos três, apenas o bicarbonato tem a característica <strong>de</strong> ser continuamente produzido e<br />
retirado do sangue, o que tem conseqüências importantes. Assim, a variação da<br />
concentração <strong>de</strong> seus componentes confere ao sistema do bicarbonato uma influência<br />
mais dinâmica sobre o pH (e a capacida<strong>de</strong> <strong>de</strong> tamponamento) do que a <strong>das</strong> proteínas e<br />
do fosfato, sistemas cuja composição é mais estática.<br />
Produção <strong>de</strong> Bicarbonato<br />
<strong>Os</strong> componentes do sistema-tampão do bicarbonato <strong>são</strong> produzidos metabolicamente<br />
em gran<strong>de</strong> quantida<strong>de</strong>. Portanto, o corpo não <strong>de</strong>pen<strong>de</strong> da ingestão <strong>de</strong> compostos<br />
exógenos ou <strong>de</strong> sínteses complexas para a manutenção <strong>de</strong>sse sistema-tampão.<br />
Remoção <strong>de</strong> Bicarbonato<br />
Através da respiração, o sistema-tampão do bicarbonato mantém um equilíbrio direto<br />
com o meio externo (pulmões e ar). Isso permite que ele responda rapidamente a<br />
alterações endógenas. Por outro lado, ele po<strong>de</strong> ser positivamente (ou negativamente)<br />
afetado pela manipulação <strong>das</strong> condições do ambiente.<br />
<strong>Os</strong> componentes ácidos do sistema do bicarbonato (i.e. H + e CO2) atravessam<br />
rapidamente as membranas biológicas, sem <strong>de</strong>pen<strong>de</strong>r, portanto, <strong>de</strong> uma cinética <strong>de</strong><br />
transporte complexa.<br />
41
O componente aniônico (básico) do sistema (HCO3 - ) é transportado rapidamente<br />
em to<strong>das</strong> as células por um sistema <strong>de</strong> troca <strong>de</strong> íons. Conseqüentemente, o sistematampão<br />
do bicarbonato ajuda também a manter o pH do meio intracelular, além do pH<br />
extracelular.<br />
<strong>Os</strong> componentes ácidos do sistema do bicarbonato <strong>são</strong> transportados dos tecidos<br />
para os pulmões pela hemoglobina. Assim, essa importante proteína participa tanto na<br />
produção como na remoção da aci<strong>de</strong>z metabólica.<br />
Importância Clínica: Acidose e Alcalose<br />
A produção <strong>de</strong> CO2 pelo metabolismo é normalmente equivalente à quantida<strong>de</strong> <strong>de</strong><br />
CO2 expirada nos pulmões, sem resultar, portanto, em produção líquida <strong>de</strong> H2CO3.<br />
Entretanto, algumas circunstâncias po<strong>de</strong>m <strong>de</strong>sbalancear essa equação, criando<br />
situações <strong>de</strong> relevância médica.<br />
Condição Causas possíveis<br />
Condição Causas possíveis<br />
42
Condição Causas possíveis<br />
alcalose<br />
respiratória<br />
alcalose<br />
metabólica<br />
hiperventilação, produzindo diminuição do CO2 no sangue.<br />
ingestão <strong>de</strong> álcali (base), vômitos prolongados (perda <strong>de</strong> HCl) ou<br />
<strong>de</strong>sidratação extrema levando a retenção <strong>de</strong> bicarbonato pelos rins.<br />
(O aspecto comum é a perda <strong>de</strong> H + não <strong>de</strong>corrente <strong>de</strong> uma baixa do<br />
CO2 sangüíneo)<br />
Tratamento<br />
Como os <strong>de</strong>sequilíbrios <strong>de</strong> origem respiratória <strong>são</strong><br />
causados por alterações no CO2, o melhor tratamento é o<br />
que envolve ventilação. Se fosse utilizada a administração<br />
<strong>de</strong> bicarbonato para aumentar o pH em casos acidose<br />
respiratória, o resultado po<strong>de</strong>ria ser fatal, pois os<br />
mecanismos <strong>de</strong> compensação também estão trabalhando<br />
para aumentar a concentração <strong>de</strong> bicarbonato.<br />
Como os problemas <strong>de</strong> origem metabólica envolvem o HCO3 - , o melhor tratamento é<br />
uma infu<strong>são</strong> <strong>de</strong> bicarbonato (na acidose) ou <strong>de</strong> NH4Cl (na alcalose). O NH4Cl se<br />
dissocia em NH4 + e Cl - . O NH4 + (íon amônio) está em equilíbrio com NH3 (amônia) e H + .<br />
Por ser volátil, a amônia é expirada nos pulmões, <strong>de</strong>ixando para trás H + e Cl - (ácido<br />
clorídrico), o que diminui o pH do sangue. A acidose metabólica está freqüentemente<br />
associada a uma alcalose respiratória compensatória. Essa situação é <strong>de</strong>licada, pois a<br />
capacida<strong>de</strong> <strong>de</strong> tamponamento do sangue fica sensivelmente diminuída.<br />
43
REGULAÇÃO RESPIRATÓRIA DO pH<br />
OBJETIVOS: Descrever a ventilação pulmonar, a produção e o transporte<br />
<strong>de</strong> dióxido <strong>de</strong> carbono para os alvéolos pulmonares. Analisar a pres<strong>são</strong><br />
parcial do dióxido <strong>de</strong> carbono e a eliminação pulmonar na regulação do pH<br />
do sangue. Descrever o mecanismo <strong>de</strong> ação do centro respiratório.<br />
CONCEITOS GERAIS<br />
<strong>Os</strong> principais mecanismos reguladores do equilíbrio ácido-base do organismo<br />
<strong>são</strong> os sistemas tampão, a regulação respiratória e a regulação renal. Esses<br />
mecanismos atuam em conjunto e, em circunstâncias normais, mantém<br />
inalterada a concentração <strong>de</strong> íons hidrogênio dos líquidos orgânicos,<br />
assegurando as condições i<strong>de</strong>ais para a função celular. A alimentação e a<br />
ativida<strong>de</strong> física produzem <strong>de</strong>svios do pH que <strong>são</strong> prontamente compensados,<br />
quando as funções respiratória e renal <strong>são</strong> a<strong>de</strong>qua<strong>das</strong>.<br />
Em <strong>de</strong>terminados estados patológicos ou em certas alterações pulmonares ou<br />
renais, a produção <strong>de</strong> ácidos ou a retenção <strong>de</strong> bases no organismo, po<strong>de</strong>m ser<br />
tão intensos que os mecanismos <strong>de</strong> compensação tornam-se incapazes <strong>de</strong><br />
manter o equilíbrio a<strong>de</strong>quado. Nessas condições, o sistema regulador colapsa e<br />
o pH dos líquidos orgânicos se altera; as funções celulares <strong>de</strong>terioram e quando<br />
a condição persiste, em geral, ocorre a morte do indivíduo. <strong>Os</strong> sistemas tampão<br />
e os mecanismos respiratórios <strong>são</strong> os principais reguladores do pH dos líquidos<br />
do organismo diante <strong>de</strong> alterações bruscas do equilíbrio entre os ácidos e as<br />
bases.<br />
VENTILAÇÃO PULMONAR<br />
O pulmão humano possui cerca <strong>de</strong> 300 milhões <strong>de</strong> alvéolos, que equivalem a<br />
uma superfície <strong>de</strong> aproximadamente 70 metros quadrados, <strong>de</strong>stinada a trocar<br />
gases com o ar atmosférico. A função respiratória se processa mediante três<br />
ativida<strong>de</strong>s distintas, mas inter-relaciona<strong>das</strong> e coor<strong>de</strong>na<strong>das</strong>:<br />
44
• ventilação, que consiste no processo através do qual o ar atmosférico<br />
alcança os alvéolos, para as trocas gasosas;<br />
• perfu<strong>são</strong>, que consiste no processo pelo qual o sangue venoso alcança os<br />
capilares dos alvéolos, para as trocas gasosas;<br />
• difu<strong>são</strong>, o processo pelo qual o oxigênio da mistura gasosa alveolar passa<br />
para o sangue, ao mesmo tempo em que o dióxido <strong>de</strong> carbono (CO2)<br />
contido no sangue passa para o gás dos alvéolos.<br />
O sistema respiratório po<strong>de</strong> ser representado simplificadamente, por uma<br />
membrana com enorme superfície em que, <strong>de</strong> um lado existe o ar atmosférico e<br />
do outro lado o sangue venoso. Através <strong>de</strong>sta membrana, ocorrem as trocas<br />
gasosas. A enorme superfície disponível para as trocas gasosas permite que em<br />
um minuto o organismo possa eliminar até 200 mL <strong>de</strong> dióxido <strong>de</strong> carbono (CO2).<br />
Por esta gran<strong>de</strong> capacida<strong>de</strong> <strong>de</strong> eliminar o CO2 do sangue, o pulmão é o mais<br />
importante regulador do equilíbrio ácido-básico do organismo. O mecanismo<br />
regulador respiratório po<strong>de</strong> manter o pH na faixa normal, variando a quantida<strong>de</strong><br />
<strong>de</strong> dióxido <strong>de</strong> carbono eliminada nos alvéolos.<br />
PRODUÇÃO DO DIÓXIDO DE CARBONO (CO2)<br />
As etapas terminais do metabolismo celular consistem na combustão da<br />
glicose e <strong>de</strong> outros metabólitos, com liberação <strong>de</strong> energia química e produção<br />
<strong>de</strong> dióxido <strong>de</strong> carbono e água. O dióxido <strong>de</strong> carbono formado no organismo<br />
difun<strong>de</strong>-se para os líquidos intersticiais e <strong>de</strong>stes para o sangue. O dióxido <strong>de</strong><br />
carbono (CO2) combina-se com a água (H2O), para formar o ácido carbônico<br />
(H2CO3); uma pequena parte se dissocia nos íons bicarbonato (HCO3 - ) e<br />
hidrogênio (H + ), conforme esquematizado na figura. A maior parte do ácido<br />
carbônico existe no sangue como CO2 dissolvido e água, em equilíbrio. O<br />
dióxido <strong>de</strong> carbono é transportado pelo sangue venoso para os capilares<br />
pulmonares, sob três formas:<br />
• Gás dissolvido - Cerca <strong>de</strong> 5% do CO2 é transportado simplesmente<br />
dissolvido na água do plasma.<br />
45
• Íon bicarbonato - Cerca <strong>de</strong> 75% do total <strong>de</strong> CO2 é transportado sob a<br />
forma <strong>de</strong> íon bicarbonato, produto da reação com a água <strong>das</strong> hemácias,<br />
catalisada pela enzima anidrase carbônica, que torna a reação 5.000<br />
vezes mais rápida. O íon hidrogênio resultante da reação é captado pela<br />
hemoglobina (sistema tampão <strong>das</strong> hemácias).<br />
• Combinado à hemoglobina - <strong>Os</strong> restantes 20% do CO2 ligam-se à<br />
hemoglobina em local diferente do que se liga o oxigênio, mediante uma<br />
ligação química facilmente reversível, para transporte pelo sangue<br />
(carbamino hemoglobina).<br />
ELIMINAÇÃO DO DIÓXIDO DE CARBONO<br />
Figura 8 . Representa a eliminação do CO2, muito volátil, ao nível da<br />
membrana alvéolo-capilar.<br />
46
A produção díária <strong>de</strong> dióxido <strong>de</strong> carbono é elevada e <strong>de</strong>pen<strong>de</strong> da ativida<strong>de</strong><br />
metabólica dos indivíduos. O índice metabólico é o fator <strong>de</strong>terminante da<br />
produção do CO2 e, portanto, da sua eliminação pelos pulmões. <strong>Os</strong> gases tem<br />
um comportamento especial quando estão em solução. A quantida<strong>de</strong> <strong>de</strong> gás<br />
existente em uma solução é medida pela sua pres<strong>são</strong> parcial, ou seja, a pres<strong>são</strong><br />
ou a ten<strong>são</strong> exercida pelo gás na solução, in<strong>de</strong>pen<strong>de</strong>nte da presença <strong>de</strong> outros<br />
gases. A pres<strong>são</strong> parcial é proporcional à quantida<strong>de</strong> <strong>de</strong> gás existente na<br />
solução. Por essa razão, a quantida<strong>de</strong> <strong>de</strong> CO2 existente no sangue é medida<br />
pela sua pres<strong>são</strong> parcial. A pres<strong>são</strong> parcial do dióxido <strong>de</strong> carbono é<br />
representada pelo símbolo PCO2. Nos capilares alveolares, o dióxido <strong>de</strong><br />
carbono do sangue venoso se difun<strong>de</strong> para o gás dos alvéolos. A difu<strong>são</strong> do<br />
CO2 para os alvéolos é comandada pela diferença <strong>de</strong> pres<strong>são</strong> parcial (PCO2)<br />
entre o sangue venoso e o gás alveolar; esta difu<strong>são</strong> rapidamente equilibra a<br />
pCO2 do sangue com a PCO2 do gás dos alvéolos pulmonares. A eliminação do<br />
CO2, reduz a quantida<strong>de</strong> <strong>de</strong> ácido carbônico, conforme representado na figura 8.<br />
A redução do CO2 do sangue, elimina ácido e eleva o pH. O aumento da<br />
quantida<strong>de</strong> <strong>de</strong> dióxido <strong>de</strong> carbono no sangue, altera o pH para o lado ácido; a<br />
redução da quantida<strong>de</strong> (ou da ten<strong>são</strong> parcial) do dióxido <strong>de</strong> carbono no sangue,<br />
altera o pH para o lado alcalino. É com base nessa relação que o sistema<br />
respiratório modifica o pH.<br />
47
MECANISMO DA AUTO-REGULAÇÃO DO pH<br />
Figura Mecanismo <strong>de</strong> regulação respiratória do pH, através da variação da<br />
eliminação do CO2.<br />
A concentração <strong>de</strong> íons hidrogênio do sangue ou, em outras palavras, o<br />
pH do sangue, modifica a ventilação alveolar, através do centro respiratório.<br />
Esta estrutura do sistema nervoso central se comporta como um “sensor” do pH<br />
do sangue. Quando a concentração <strong>de</strong> íons hidrogênio do sangue está elevada<br />
(pH baixo) o centro respiratório aumenta a freqüência dos estímulos<br />
respiratórios, produzindo taquipneia. Com o aumento da freqüência respiratória,<br />
aumenta a eliminação do CO2 do sangue; a redução dos níveis sanguíneos do<br />
CO2 eleva o pH. A concentração <strong>de</strong> H+ no sangue é permanentemente<br />
acompanhada pelo centro respiratório, que regula seus estímulos <strong>de</strong> acordo com<br />
ela, conforme <strong>de</strong>monstra o diagrama da figura 9. Ao contrário, quando a<br />
concentração <strong>de</strong> íons hidrogênio (H+) está baixa (pH elevado), o centro<br />
respiratório diminui a freqüência dos estímulos à respiração e ocorre bradipneia,<br />
que reduz a eliminação do CO2 tentando corrigir o pH do sangue.<br />
48
Na realida<strong>de</strong>, a regulação respiratória do pH, por estímulos do centro<br />
respiratório, não normaliza o pH do sangue, porque, à medida que a<br />
concentração do íon hidrogênio se aproxima do normal, o estímulo que modifica<br />
a ativida<strong>de</strong> respiratória vai <strong>de</strong>saparecendo. Apesar disso, a compensação<br />
respiratória é extremamente eficaz para impedir gran<strong>de</strong>s oscilações do pH.<br />
RESUMO<br />
A função respiratória se processa mediante três mecanismos interligados: a<br />
ventilação pulmonar, através da qual o ar atmosférico alcança os alvéolos; a<br />
perfu<strong>são</strong> pulmonar, através da qual o sangue venoso alcança os capilares<br />
alveolares para as trocas gasosas e a difu<strong>são</strong> pulmonar, através da qual o<br />
dióxido <strong>de</strong> carbono do sangue é eliminado para os alvéolos e o oxigênio do ar<br />
inspirado é captado pelo sangue venoso.<br />
O dióxido <strong>de</strong> carbono (CO2) é o produto final do metabolismo aeróbico. O<br />
CO2 alcança o líquido extracelular e o sangue para eliminação nos alvéolos. A<br />
quantida<strong>de</strong> <strong>de</strong> CO2 é expressa pela sua pres<strong>são</strong> parcial, representada pela sigla<br />
PCO2. Como a PCO2 do sangue venoso é maior que a PCO2 do gás alveolar, o<br />
CO2 se difun<strong>de</strong> do sangue para os alvéolos.<br />
Quando o CO2 <strong>de</strong>ixa o sangue, diminui a quantida<strong>de</strong> <strong>de</strong> ácido carbônico e em<br />
conseqüência o pH ten<strong>de</strong> a se elevar. Se, ao contrário, a eliminação do CO2 for<br />
reduzida, haverá acúmulo <strong>de</strong> ácido carbônico no sangue, com conseqüente<br />
redução do pH.<br />
A concentração do íon hidrogênio no sangue ou, em outras palavras, o pH do<br />
sangue, modifica a ventilação pulmonar, através <strong>de</strong> estímulos do centro<br />
respiratório.<br />
Quando o pH do sangue está baixo (acidose), o centro respiratório aumenta a<br />
freqüência respiratória e, <strong>de</strong>sse modo, acentua a eliminação do CO2.<br />
Quando o pH do sangue está elevado (alcalose), o centro respiratório diminui a<br />
freqüência respiratória e, <strong>de</strong>sse modo, acumula CO2 no sangue, reduzindo a sua<br />
eliminação.<br />
49
Bioquímica – Questionários (Profa. Karem)<br />
Tampões Fisiológicos<br />
<strong>1.</strong> Descrever o funcionamento do sistema tampão HCO3 - /H2CO3, presente no<br />
plasma sanguíneo.<br />
2. Explique o efeito da adição <strong>de</strong> H + e <strong>de</strong> CO2 sobre o pH do plasma.<br />
3. Faça um esquema representando a eliminição <strong>de</strong> CO2 junto aos alvéolos<br />
pulmonares.<br />
4. Como o CO2 é transportado pelo sangue venoso para os capilares pulmonares?<br />
5. Explique o que é acidose e alcalose. Como uma respiração mais rápida ou mais<br />
lenta influencia nesses dois casos?<br />
6. Como atua a enzima anidrase carbônica?<br />
7. O que significa pCO2? Como a pCO2 atua nos níveis on<strong>de</strong> se realizam as trocas<br />
gososas ?<br />
8. Como o centro respiratório realiza a regulação respiratório do pH? O que<br />
significa taquipnéia e bradipnéia?<br />
9. Quais os principais sistemas tampões que agem no organismo?<br />
10. Qual o pH do sangue? Uma queda no pH <strong>de</strong> 7,4 para 7,2 representa um<br />
aumento <strong>de</strong> 60% na concentração <strong>de</strong> H + . Explique isso.<br />
<strong>Aminoácidos</strong><br />
<strong>1.</strong> Explique o que <strong>são</strong> <strong>aminoácidos</strong>. Dar a estrutura geral <strong>de</strong> um aminoácido.<br />
2. Num aminoácido o grupo R po<strong>de</strong> ser polar carregado, polar não carregado e<br />
apolar. Explique e dê um exemplo <strong>de</strong> cada um.<br />
3. Explique os termos hidrofóbico e hidrofílico. Dar um exemplo <strong>de</strong> grupos R que<br />
representem essas duas categorias.<br />
4. O que é uma ligação peptídica. Exemplifique.<br />
5. Quantos <strong>são</strong> os <strong>aminoácidos</strong> essenciais. Em que eles diferem?<br />
6. Explique a estrutura <strong>de</strong> ressonância em uma ligação peptídica.<br />
7. Como po<strong>de</strong>m ocorrer as interações entre as proteínas?<br />
50
8. Explique os tipos <strong>de</strong> atrações: eletrostáticas, hidrofóbicas, ligações <strong>de</strong><br />
hidrogênio e <strong>de</strong> Van <strong>de</strong>r Waals.<br />
9. Numa seqüência <strong>de</strong> <strong>aminoácidos</strong> como estes <strong>são</strong> representados. Dar exemplos.<br />
10. Classifique os <strong>aminoácidos</strong> a seguir, em polar carregado, polar não carregado e<br />
apolar, <strong>de</strong> acordo com seus grupos R:<br />
• Ala Arg Cys Gly His Leu Phe Tyr Glu Ser<br />
Proteínas<br />
<strong>1.</strong> O que <strong>são</strong> proteínas? Como <strong>são</strong> forma<strong>das</strong>?<br />
2. O que é estrutura primária <strong>de</strong> uma proteína?<br />
3. O que é estrutura secundária <strong>de</strong> uma proteína?<br />
4. Qual a diferença entre alfa-hélice e folha-beta. Dar um exemplo <strong>de</strong> cada.<br />
5. O que é estrutura terciária <strong>de</strong> uma proteína? Cite um exemplo.<br />
6. O que <strong>de</strong>termina a estrutura terciária <strong>de</strong> uma proteína?<br />
7. O que é estrutura quaternária <strong>de</strong> uma proteína? Cite um exemplo.<br />
8. Qual a diferença entre proteínas simples e conjuga<strong>das</strong>? Dar exemplos.<br />
9. Qual a diferença entre proteínas estruturais e biologicamente ativas? Dar<br />
exemplos.<br />
10. O que <strong>são</strong> enzimas? Explique o seu mecanismo <strong>de</strong> atuação.<br />
Lipí<strong>de</strong>os<br />
<strong>1.</strong> Faça um organograma contendo todos os lipí<strong>de</strong>os.<br />
2. Quais as características comuns dos lipí<strong>de</strong>os?<br />
3. Defina ceras. Dê exemplos.<br />
4. Defina triglicerí<strong>de</strong>os. Dê exemplos.<br />
5. Qual a diferença entre óleos e gorduras?<br />
6. O que é uma reação <strong>de</strong> saponificação?<br />
7. O que é um sabão? Qual o seu mecanismo <strong>de</strong> ação?<br />
8. O que <strong>são</strong> fosfolipí<strong>de</strong>os? Dar um exemplo <strong>de</strong>stacando os aspectos estruturais<br />
mais importantes.<br />
51
9. O que <strong>são</strong> esfingolipí<strong>de</strong>os? Dar um exemplo <strong>de</strong>stacando os aspectos estruturais<br />
mais importantes.<br />
10. O que <strong>são</strong> esterói<strong>de</strong>s? Dar um exemplo <strong>de</strong>stacando os aspectos estruturais<br />
mais importantes.<br />
1<strong>1.</strong> O que é o colesterol. Qual sua função biológica? E suas <strong>de</strong>svantagens?<br />
12. O que <strong>são</strong> hormônios esterói<strong>de</strong>s. Cite três exemplos.<br />
Carboidratos<br />
<strong>1.</strong> Defina carboidratos. Quais suas funções biológicas.<br />
2. O que <strong>são</strong> monossacarí<strong>de</strong>os, oligossacarí<strong>de</strong>os, dissacarí<strong>de</strong>os e<br />
polissacarí<strong>de</strong>os? Dar um exemplo <strong>de</strong> cada.<br />
3. O que <strong>são</strong> açúcares? Dar exemplos.<br />
4. Quais as diferenças entre aldoses e cetoses?<br />
5. Explique a classificação dos monossacarí<strong>de</strong>os <strong>de</strong> acordo com o número <strong>de</strong><br />
carbonos.<br />
6. Qual a importância biológica <strong>das</strong> pentoses ? Cite as duas pentoses mais<br />
importantes.<br />
7. Qual a importância biológica <strong>das</strong> hexoses ? Cite a hexose mais importante.<br />
8. Como se forma um hemiacetal ? O que é um anômero?<br />
9. Quais as diferenças entre as fórmulas <strong>de</strong> Fischer, Haworth e Conformacional ?<br />
Represente a glicose usando essas três fórmulas, inclusive os seus isômeros.<br />
10. O que <strong>são</strong> enantiômeros? O que <strong>são</strong> substâncias <strong>de</strong>xtrógiras e levógiras?<br />
1<strong>1.</strong> Como se formam os dissacarí<strong>de</strong>os? Cite 2 dissacarí<strong>de</strong>os importantes e on<strong>de</strong><br />
<strong>são</strong> encontrados.<br />
12. Como se formam os polissacarí<strong>de</strong>os? Cite 3 polissacarí<strong>de</strong>os importantes e on<strong>de</strong><br />
<strong>são</strong> encontrados.<br />
52