You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Embryologi.<br />
Udvikling fra mave-tarm kanalen deles op i fortarm, mellemtarm og bagtarm.<br />
Fortarm<br />
Oesophagus – ved. 4 uge, lungeknoppen (som bliver til trachea og lunger) vokser ned og danner<br />
oesophagus. Øverste muskulatur udvikles fra det splanchniske mesenchym, inn vagus. Nederste er<br />
glat muskulatur, også vagus (parasymp). Misdannelser som oesophegotracheal fistel er et spaltet<br />
spiserør som er hæftet til trachea.<br />
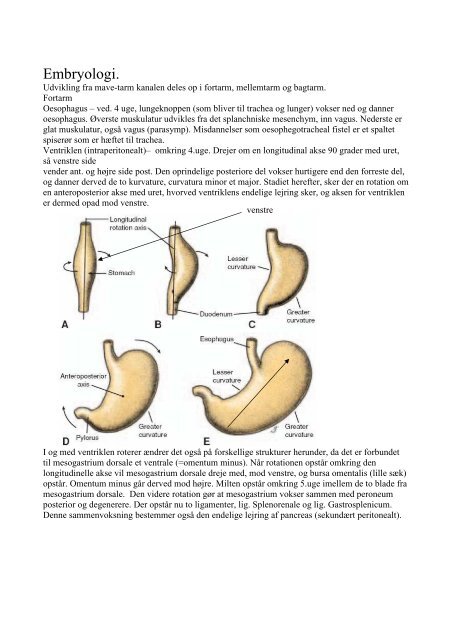
Ventriklen (intraperitonealt)– omkring 4.uge. Drejer om en longitudinal akse 90 grader med uret,<br />
så venstre side<br />
vender ant. og højre side post. Den oprindelige posteriore del vokser hurtigere end den forreste del,<br />
og danner derved de to kurvature, curvatura minor et major. Stadiet herefter, sker der en rotation om<br />
en anteroposterior akse med uret, hvorved ventriklens endelige lejring sker, og aksen for ventriklen<br />
er dermed opad mod venstre.<br />
venstre<br />
I og med ventriklen roterer ændrer det også på forskellige strukturer herunder, da det er forbundet<br />
til mesogastrium dorsale et ventrale (=omentum minus). Når rotationen opstår omkring den<br />
longitudinelle akse vil mesogastrium dorsale dreje med, mod venstre, og bursa omentalis (lille sæk)<br />
opstår. Omentum minus går derved mod højre. Milten opstår omkring 5.uge imellem de to blade fra<br />
mesogastrium dorsale. Den videre rotation gør at mesogastrium vokser sammen med peroneum<br />
posterior og degenerere. Der opstår nu to ligamenter, lig. Splenorenale og lig. Gastrosplenicum.<br />
Denne sammenvoksning bestemmer også den endelige lejring af pancreas (sekundært peritonealt).
Under rotationen om den anteroposteriore akse vil mesogastrium dorsale vende nedad og vokse<br />
kraftigt denne ved. Dette medfører at krøset vokser udover colon transversum og danner nu<br />
omentum majus. Dette er ved start to blade men vokser sammen til et, og derefter sammen med<br />
colon transversum mesenterium.<br />
Lig. Falciforme er fra leveren tilden ventrale kropsvæg, og lig. Teres hepatis er bundet hertil<br />
(navlestrengen efter fødsel). Omentum minus går fra curvatura minor ventriculus og duodenum til<br />
leveren og heri ligger ductus choledocus, v. Portae, a hepatica propria.<br />
Duodenum – pga. Ventriklens rotation vil duodenum blive C formet. Ligger retroperitonealt.<br />
Forsynes af truncus coeliacus og a.mesenterica superior, da duodenum er den terminale del af<br />
fortarmen og den cephale del af mellemtarmen.<br />
Lever (intra) og galdeblære – opstår fra leverknoppen i 3. uge. Og vokser ind i septum transversum.<br />
Indsnævringen fra der sker mellem leverknoppen og duodenum bliver ductus choledocus<br />
grundlæggelse. En udvækst herfra danner galdeblæren.<br />
Pancreas – dannes af de to knopper som vokser frem fra duodenums endodermalbeklædning. Den<br />
ventrale knop som har tæt relation til galdegangen, vil ende ved den dorsale knop ved duodenums c-
form dannelse. Kanalen fra den dorsale pancreas forsvinder.<br />
Misdannelser i pancreas og lever/galde kan være obstruktioner i udførelsesgangene.<br />
Mellemtarmen:<br />
Mellemtarmen kommunikerer med blommesækken via ductus vitellinus. Fra duodenum og colon<br />
transversum. Tarmen danner en slynge omkring a. Mesenterica superior, den primære slynge. Den<br />
cephale gren af bliver til den distale del af duodenum, jejunum og en del af ileum. Den kaudale gren<br />
bliver til den distale del af ileum, caecum, appendix, colon ascendens og 2/3 af colon transversum.<br />
Tarmen roterer omkring a. Mesenterica superior 270 grader, og derefter begynder tyndtarmen at<br />
dannne bugtede slynger. Colon tiltager i længde men bugter ikke.<br />
Tyndtarmen trækker sig tilbage i bughulen og tyktarmen kommer til at ligge fremme, og dele af<br />
colon bliver beliggende i fossa iliaca.<br />
Colon ascendens og descenden er retroperitonealt lejret.<br />
Abnormaliteter:
Bagtarmen:<br />
Udvikles til den distale del af colon transversum, colon descendens, colon sigmoideum, rectom og<br />
analkanal.<br />
Cloaca er endodermbeklædt og overfladen er ektoderm beklædt, kontaktfladen imellem ekto- og<br />
endoderm danner kloakmembranen. Den kaudale del af analkanalen lukkes og rekanaliseres af<br />
ectoderm, hvorved den forsynes af aa. Rectales inferior og aa. Pudendae internae. Den kranielle del<br />
stammer fra endoderm og forsynes af a. Rectalis superior og a. mesenterica inferior.<br />
Allantois adskilles af septum urorectale (mesoderm) og bliver til urinblæren.
Biokemi<br />
Ketone metabolisme<br />
Under fastetilstande vil Fedtsyrer i leveren via beta-oxidation blive til Acetyl CoA. Disse vil danne<br />
acetoacetate, acetone og beta-hydroxybuturate som er ketone stoffer.<br />
Syntesen af ketone stoffet acetoacetat: 2 Acetyl CoA(thiolase, -CoASH)<br />
Acetoacetyl CoA (HMG CoA synthase, +acetyl CoA –CoASH)HMG CoA (HMG CoA<br />
Lyase, -Acetyl CoA) Acetoacetate. Kan spontant omdannes til Acetone ved afgivelse af CO2<br />
eller beta hydroxybutyrate ce en dehydrogenase og med hjælp af NADH+H+.<br />
Ketonet beta-hydroxybutyrate som optages i musklerne danner acetoacetate og smatidig i denne<br />
reaktion NAD+NADH+H+. Acetoacetat bliver omdannet til acetoacetyl CoA vha. Omdannel fra<br />
succinyl CoA til Succinate. Acetoacetyl CoA danner 2 Acetyl CoA ved thiolase hjælp, og disse<br />
indgår så i TCA cyklussen. Net energi fra et molekyle beta-hydroxybutyrate er 21,5ATP.<br />
Nogle aminosyrer som leucine, isoleucine, tryprophan, phenyalanin og tyrosine kan kataboliseres til<br />
acetoacetyl CoA eller Acetyl CoA, og kaldes derfor ketoniske aminosyrer.<br />
Kap 32<br />
Triacylglycerol = 3 fedtsyrer som er esterificeret til et glycerol molekyle. Når disse bliver nedbrudt<br />
i tarmen danner de en fri fedtsyre og to monoacylglycerol.
Fra vi indtager fedt i form af triglycerider, bliver det nedbrudt til<br />
fedtsyrer og 2-monoacylgllycerol, som transporteres i tarmen via<br />
miceller dannet af gallesyrer. Når disse fedtmolekyler bliver optaget<br />
af epithelcellen i tarmen vil det gå til SER hvor den vil lave 2monoacylglycerol<br />
om til diacylglycerol, ved påsættelse af en<br />
fedtsyrer via CoASH. Det samme sker igen og der dannes<br />
triacylglycerol. Fra RER bliver apoprotein ApoB-48 udskilt og<br />
begge disse veje går til golgi hvor der dannes chylomikroner som<br />
kan indtræde i lymfen. Apoproteiner fungere som en<br />
grundlæggende bestanddel før at lipoproteinet kan fungere. Hvis<br />
TG når blodet, vil disse smelte sammen med blodet og gøre flowet<br />
langsommere. ApoB48 er meget tæt relateret til ApoB-100 som<br />
syntetiseres i leveren, og bruges f.eks. i VLDL. Begge apoproteiner<br />
kodes af det samme gen, hvor B48 er 48% af størrelsen fra ApoB-<br />
100.<br />
Når et chylomikron bliver frisat i lymfen kaldes det et spirrende chylomikron, hvor HDL omdanner<br />
dette til et modet chulomikron. Modenheden er en proces hvor Apoproteinerne ApoC2 og ApoE<br />
bliver overført fra HDL til chylomikronet. ApoE fungerer som en membran receptor og ApoC2<br />
fungere som en LPL aktivator.<br />
Kig på figuren, siger det hele.<br />
LPL bliver produceret af muskelceller,<br />
fedtceller og brystkirtler. LPL er mest<br />
aktiv efter et måltid, da flere<br />
chylomikroner er til stede, og insulin er<br />
med til at stimulere syntesen af LDL.<br />
Chylomikrone rester bliver genkendt af<br />
hepatocytten, via ApoE.
Kap 33<br />
Dannelsen af citrate sker når Acetyl CoA koncentrationen i motochondriet stiger. Denne stigning<br />
inhiberer pyruvate dehydrogenasen (pyruvate Acetyl CoA) og derved aktiverer pyruvate<br />
carboxylasen (pyruvateOAA). Når denne koncentration dermed stiger går det sammen med<br />
Acetyl CoA og danner citrat. Citrat er i stand til at kunne diffundere over membranen til cytosolet. I<br />
cytosolet er citrat lyase som kløver citrat til acetyl CoA og OAA. OAA danner malate ved<br />
NADHNAD+ og derefter pyruvate ved NADP+ NADPH-CO2. Det er her den dannede<br />
NADPH bruges til at danne palmitat.<br />
Acetyl CoA carboxylase er reguleret allosterisk, ved<br />
positiv og negativ feedback. Ved højt kalorie indtag<br />
dannes citrate og insulin frigives som aktivere enzymet<br />
ved phospotase (fjernes et P). Når man er i et lav energi<br />
stadie, vil AMP aktiveret protein kinase gå ind og<br />
hæmme enzymaktiviteten (tilføjes et P).<br />
Fedtsyresyntese ??:<br />
Lipogenesen i leveren. Primært vises, at via<br />
glycolysen dannes pyruvate som indgår<br />
citruscyklussen. Citrate transporteres fra<br />
mitochondriet til cytocolet og danner acetyl<br />
CoA som bliver dannnet til Malonyl CoA<br />
via aCoA carboxylase. Herefter dannes<br />
palmitate fra fedtsyre syntesen, og TG<br />
dannes og pakkes sammen med<br />
apoproteiner og andre lipider i form af<br />
VLDL. Når disse træder ud i blodbanen,<br />
sidder der LPL ved fedt og muskelvæv som<br />
nedbryder VLDL så vævet kan optage<br />
TG(fedtdepot og beta oxidation i muskel),<br />
og glycerolet bliver transporteret tilbage til<br />
leveren, for igen at danne TG.
I fedtcellerne vil insulin stimulere glukose metabolismen fra glycerol-3-P til TG, og den vil<br />
dephosphorylere pyruvat DH så pyruvate kan oxideres i TCA cyklussen.<br />
Under fatse tilstande vil lav insulin og høj glucagon aktivere cAMP som derefter aktiverer PKA<br />
som phosphorylerer hormon sensitiv lipase der nedbryder TG til FA og glycerol. Dette bliver<br />
frigivet til blodbanen.<br />
Former for lipider ↓<br />
Glycerophospholipider (GPL) – komponent i lipoproteiner, galde og surfactant. Dannes af<br />
phsphatidsyre som omdannes til diacylglycerol også til glycerophospholipid. Alle understående<br />
lipider i boxen, er former for GPL.<br />
Sphingolipider – membran protein især i myelinskeder.<br />
En hovedgruppe på glycerolipiderne er en polær hydrofil gruppe som sidder på den 3. carbon del af<br />
glycerolet.<br />
Kap 34<br />
Cholesterol: transporteres i lipoproteiner, forstadiet for galdesalt og steroid hormoner, stabiliserer<br />
celle membraner. Pakkes i chylomikroner i tarmen og VLDL i leveren. Acetyl CoA er forstadiet for<br />
cholesterol<br />
Cholesterol absorption i tarmene er en vigtig reguleringsfaktor, da det bestemmer hvilken del af<br />
sterolet som skal gå til galdesalt og hvilke der skal laves til steroider.<br />
Syntese af cholesterol (sker i cytosolet): 1: Acetyl CoA Acetoacetyl CoA (HMG CoA<br />
Synthase) HMG CoA (HMG-CoA reductase)Mevalonat 2: 3 phosphat grupper sættes på og<br />
slutproduktet i fase to bliver dimethylallyl pyrophosphat. 3: Dimethylallyl pyrophosphat+delta3isopenteny<br />
pyrophasphat –>(-2P)Geranyl pyrophosphat (+isopentenyl pyrophosphat, -2P)<br />
Farnesyl pyrophosphat (+NADPH+H+, Farnesyl pyrophosphat, -NADP+, 2PP) Squalene<br />
4: Squalene (+ NADPG+H+, O2, - H2O, NADP+) Squalene 2,3-epoxide Lanosterol <br />
Cholesterol.<br />
Galdesalt: Chenocolin syre og cholin syre. Konjugerede form hedder Taurocholin syre og<br />
glycocholin syre (kræver ATP og Acetyl CoA).
A: SCAP og S2P fremmer syntesen af SREBP<br />
som binder til et upstream segment på genet<br />
som er transkriptor for HMG CoA reductase.<br />
Øget antal steroler hæmmer syntesen af<br />
SREBP.<br />
B: Øget antal steroler giver øget proteolyse af<br />
enzymet.<br />
C: Øget glucagon hæmmer enzymet, hvor<br />
insulin aktiverer enzymet.<br />
Primære gallesalte: Cholin- &<br />
Chenocholin syre<br />
Sekundære gallesalte:<br />
deoxycholin syre og litholin<br />
syre<br />
Colesterol lægger sig også i membranen på et lipoprotein for at holde dets kugleform.<br />
Apoproteiner fungerer som en aktivator, stabilisator og receptor.<br />
Chylomikroner: Største af alle lipoproteiner med den mindste densitet pga. det rige indhold af TG.<br />
De bliver sekreret til lymfen og træder ind i blodbanen via v. subclavia sinister. De vigtigste<br />
apoproteiner er apoB-48, apoCII og apoE. ApoCII aktiverer LPL som hydroliserer chylomikronet,<br />
som derefter frigiver sit indhold til målvævet. Leveren optager derefter chylomikron resterne ved at<br />
binde til apoE, hvor der derefter sker endocytose.<br />
VLDL: Hvis man indtager et overskud af fedt eller glucose, vil dette omdannes til TG og derefter<br />
transporteres via VLDL til muskler eller fedtvæv hovedsageligt. Frigives i v. hepatica.
IDL: VLDL rester som ikke optages af leveren former IDL som via hepatic triglycerid lipase<br />
(HTGL) danner LDL.<br />
LDL: Er rig på cholesterol og cholesterol ester. Ca 60 % går til leveren de sidste 40% går f.eks. til<br />
gonadal celler og adrenocortical celler som bruger cholesterolet til a syntetisere steroider. apoB-100<br />
vil binde til en apoB-100 receptor på cellerne.<br />
HDL: opsamler cholesterol fra cellemembraner og modner chylomikroner og VLDL ved at<br />
overfører apoproteiner.<br />
Familiær hyperkolesterolæmi: morbus Müller-Harbitz (ældre bet.), Müller-Harbitz' sygdom (ældre<br />
bet.), familiær hyperkolesterolæmi: arveligt betinget (·autosomal·dominant) stofskiftesygdom der<br />
ubehandlet er karakteriseret ved forhøjet ·kolesterol-koncentration (se ·LDL-kolesterol) i blodet og<br />
tidlig hjerte-kar-sygdom pga. aterosklerose, se ·atherosclerosis; skyldes mutation i genet for ·LDLreceptoren,<br />
locus (LDLR) på kromosom 19p. ·Deletioner er hyppige. ·Homozygoti medfører<br />
aflejringer af kolesterol i hud (·xantomer) og arterier med risiko for hjertedød inden 20-års-alderen.
LRP (LDL receptor-related protein) – minder strukturelt om LDL men modtager flere ligander.<br />
Man mener at den fjerner rester af VLDL og chylomikroner. Insulin øger syntesen af disse<br />
receptorer.<br />
Makrofager har scavenger (rense) receptorer, som ikke bliver reguleret og optager alt hvad der er i<br />
blodet. Når den optager lipider kaldes det for en skumcelle. For mange skumceller i blodet bliver til<br />
arterosklerotiske plaques.<br />
Kap 38<br />
Atherosklerose: Langsomt fremadskridende karlidelse<br />
der kendetegnes ved aflejring af fedtstof i det inderste<br />
lag af arterievæggen. Er den almindeligste karsygdom;<br />
begynder i tidlig barndom og er makroskopisk påviselig<br />
ved praktisk talt alle ·autopsier på mennesker over 40 år.<br />
Kan nedsætte iltforsyningen til forskellige organer samt<br />
forårsage blodpropdannelse (·thrombosis) og udposning<br />
af arterievæggen (·aneurysma); ligger til grund for de<br />
fleste dødsfald. De grundlæggende årsager og<br />
udviklingsmekanismer er ikke kendt, men en række<br />
faktorer spiller utvivlsomt en rolle: ·hyperkolesterolæmi,<br />
forhøjet blodtryk (·hypertension), ændringer i<br />
·lipoproteiner og hormonforstyrrelser. Der er formentlig<br />
sammenhæng mellem stort cigaretforbrug, fedtholdig<br />
ernæring og ateromatose af hjertets kransårer (arteriae<br />
coronariae).<br />
Ved metabolisme af aminosyrer kan det gå to veje.<br />
En carbon del og en nitrogen del. Carbon delen<br />
bruges som brændsstof eller kan lagres som<br />
glycogen eller fedtsyrer. Nitrogenet danner urea<br />
via ureacyklussen.<br />
Under fastetilstande vil muskelprotein kløves til aminosyrer. Nogle af disse vil omdannes til<br />
glutamin og alanin som frigives til blodet. Glutamin optages i nyrer og tarme og omdannes til<br />
alanin, som derefter bliver optaget i leveren. Leveren omdanner carbon delen til keton stoffer og<br />
glucose og nitrogen delen dannes til urea og udskilles i urinen.
Transaminations reaktion:<br />
Fjernelse af en aminogruppe tilføjes til en alpha<br />
keto syre som danner en ny aminosyrer.<br />
Ex. Aspartat fjerner sin aminogruppe og danner<br />
oxaloacetat. Samtidig bliver denne aminogruppe<br />
tilføjet til alpha-ketogluterate og sanner<br />
glutamat.<br />
Der sker altså degradering og syntetisering.<br />
Når aminogruppen skal fjernes (deanimering), er det som ammoniak (NH3) eller ammonium ionen<br />
(NH4+). Ammoniak kan diffundere over cellemembranen og ind i urinen hvor den binder en proton<br />
og danner ammonium ionen, som øger pH. Når denne ion er dannet kan den ikke længere<br />
diffundere over membranen.<br />
Glutamate kan deanimeres vha. glutamate DH som danner alpha-ketoglutarate. NAD+ og NADP+<br />
kan fungere som co-faktor under denne proces.<br />
Histidine kan direkte deamineres og danne NH4+ og urocanat. Glutamin danner glutamat og NH4+<br />
vha. glutaminase, asparagin danner aspartat og NH4+ ved asparaginase. Threonin og serin behøver<br />
PLP (pyridoxal phosphat) for omdannelsen.<br />
Alanin og glutamin er vigtige nitrogen bærere. Alanin fra musklen bliver eksporteret til leveren som<br />
danner pyruvat til glucose af carbon delen, som igen kan gå tilbage til musklen, og urea af nitrogen<br />
delen. Dette kaldes glucose/alanin cyklussen.<br />
Ved forhøjetet NH4+ i celler vil alpha-KG optage en NH4+ og danne glutamate vha. NADPH<br />
(enzym = GDH). Glutamate kan igen optage en NH4+ og danne glutamin vha ATP (glutamin<br />
synthetase), og derefter optages i leveren hvor den smider de to NH4+ ud som urea og i urin.
Ureacyklussen<br />
1: NH4+ og bicarbonat går sammen og danner vha. 2 ATP (CPSI, dette enzym findes i<br />
mitochondriet i lever og tarme) carbamoyl phosphat.<br />
2: Carbamoyl phosphat går sammen med Ornithin for at danne citrullin (afgiver et P ved ornithin<br />
transcarbamoylase). Citrullin kan nu diffundere over membranen ved at bytte med et ornithin<br />
molekyle, for at vedligeholde elektroneutraliteten.<br />
3: I cytosolet går citrullin sammen med aspartat og ATP for at danne Argininosuccinat (synthase).<br />
Aspartat dannes ved transaminering af OAA.<br />
4: Arganinosuccinat kløves (lyase) og afgiver fumarate og danner arginin. Fumarate bruges i TCA<br />
cyklussen til at gendanne OAA eller til at danne glucose i glyconeogenesen.<br />
5: Arginin danner Urea og ornithin vha. arginesen. Urea udskilles som urin og ornithin genbruges I<br />
mitochondriet ved “exhange” med citrullin.<br />
Ornithin er en aminosyrer og kan undergå tranamination ved at danne glutamat semialdehyd og<br />
alpha-KG glutamat.
Krebs bicyklus. Fra fumarate til aspoartat<br />
Regulering af ureacyklus ↓<br />
Fra Holdtimen<br />
Citullinæmi = en recessivt arvelig lidelse, der skyldes en genetisk stofskiftefejl i omdannelsen af<br />
urinstof. Aminosyren arginin dannes ikke og forstadierne hertil - bl.a. citrullin og ammoniak -<br />
ophobes. Symptomerne viser sig sædvanligvis straks efter fødslen ved et inaktivt, slapt barn,<br />
opkastninger, kramper og hurtig vejrtrækning.<br />
NH4+ (ladet) og NH3 (uladet) eksisterer i ligevægt med pK = 9.3. Ved physiologisk pH er der således ca<br />
100/1 NH4+/NH3. NH3 kan frit diffundere over cellemembraner.<br />
Måling af defekt i OTC i urin: Orotat. Frit NH4+ indlejres i carbamoylfosfat vha carbamoylfosfat<br />
synthetase 1 (CPSI i mitochondrier, irreversibel process). Ved OTC defekt ophobes det carbamoylfosfat som<br />
normalt skulle være omdannet til citrullin, men overskuddet af carbamoylfosfat kan under disse betingelser<br />
omdannes af CAD (CPSII, aspartate transcarbomoylase, dihydroorotase i cytosolen) fra pyrimidinbiosyntesen<br />
til orotat. Pyrimidine biosynthesen er nøje reguleret hos raske individer fordi det er en pathway<br />
som er involveret i nucleinsyre biosyntesen; forøgelse af orotat udskillesen ses derfor sjældent hos raske.<br />
Dannelsen af orotat og hepatisk lækage af ornithine til cirkulationen kan ikke modvirke forekomst af<br />
hyperammoniæmi. Højt niveau af urin orotat kan benyttes ved differential diagnose mellem carbamoyl fosfat<br />
synthtase I (CPSI) og ornithin transcarbamoylase (OTC) defekt.<br />
I patienter med citrullinæmi (eller argininosuccinic aciduria) kan nitrogen udskilles i form af citrullin (eller<br />
argininosuccinat). Dannelsen af disse metabolitter er begrænset af lave ornithin-niveauer der resulterer fra
den metaboliske blokade. Arginin supplement kan få gendannet pools af ornithin og derved maximere<br />
udskillelsen af citrullin (eller argininosuccinat). Det høje niveau af citrullin menes mindre toksisk end<br />
akkumulering af NH4+ og glutamin.<br />
Arginin kan supplementeres hvis det er deficient, hvilket det kan være specielt hos nyfødte med citrullinæmi<br />
(type I), men ikke nødvendigvis er hos voksne (type II) hvor argininosuccinat syntetase aktivitet kan være<br />
opretholdt i nyrerne.<br />
Kap 41.<br />
Puriner (adenin & guanin) og pyrimidiner (cytosin, thymin & uracil) bruges til at synteticerer<br />
nukleotider. Nukleotider er forstadie til DNA & RNA, strukturelle dele af Coenzymer so, NADH,<br />
FAD og Coenzym A. Desuden bruges de i nedbrydningsprocesser som ATP og GTP.<br />
Meget få nukleotider optages igennem føden og kun ca. 5 % bliver cirkuleret rundt og brugt, resten<br />
udskilles i urinen. Derfor er biosyntesen en nødvendighed.<br />
Nukleotid = Base+sukker+phosphat<br />
Nukleosid = Base+sukker<br />
Dannelsen af puriner starter ved at ribose 5’-phosphat (som er dannet af pentose, som igen er dannet<br />
fra glukose) danner PRPP ved at ATP (AMP)afgiver to phosphatgrupper. PRPP går sammen<br />
med glutamin og danner 5-phosphoribosylamin. Denne reaktion skaber nitrogen 9 og purin ringen.<br />
Næste omgang bliver et helt glycine molekyle tilføjet med hjælp fra ATP, som giver purin dets<br />
carbon 4 & 5 samt nitrogen 7. Carbon 8 kommer fra N 10 -formyl-FH4, endnu et glutamin afgiver en<br />
NH3 og danner Nitrogen 3. Carbon 6 dannes af et CO2 molekyle og aspartat danner nitrogen 1, og<br />
sidst dannes carbon 2 af N 10 -formyl-FH4 igen. Der er nu dannet IMP (inosine monophosphat) og i<br />
alt 6ATP er brugt til dannelsen af denne purin nukleotid. IMP indeholder basen hypoxanthin som er<br />
koplet til ribose ved N-glycosid binding mellem nitrogen 9 på basen og carbon 1 på ribose. Fra<br />
IMP kan der både dannes GMP eller AMP. AMP dannder først adenylosuccinate ved tilføjelse af<br />
aspartat og GTP, hvor der derefter afgives fumarate og AMP er dannet. GMP dannes ved tilføjelse<br />
af NAD+og vand hvor XMP dannes (xanthosine monophosphat) Glutamine donerer derefter en<br />
aminogruppe, og ATP danner processen samtidig til dannelse af GMP.<br />
Hele processen: Ribose 5’-phosphat (ATP→AMP; PRPP synthetase)PRPP<br />
(H2O+Glutamin→glutamat+PPi; glutamin ohosphoribosyl amidotransferase) 5’phosphoribosylamin<br />
(Glycin+ATP→ADP+Pi; phosphoribosylglycinamid synthetase)<br />
Glycinamid ribosyl 5’-phosphat (2 N 10 -formyl-FH4+glutamin+CO2+aspartat)IMP.<br />
IMP (NAD + +H2O→NADH+H+; IMP dehydrogenase) XMP (ATP+glutamin→<br />
glutamate+AMP+PPi; GMP synthetase) GMP.<br />
IMP (Aspartat+GTP→GDP+Pi; adenylosuccinat synthetase)Adenylosuccinat(afgiver<br />
fumarate; adenylosuccinase)AMP
Fire enzymer bliver reguleret allosterisk<br />
under processen. PRP synthetase, glutamin<br />
phoshoribosyl amidotransferase, IMP DH,<br />
adenylosuccinat synthetase. Dannes der for<br />
meget sker der negativ feedback. PRPP<br />
påvirkes af GDP & ADP.<br />
Balance af indhold af ATP og GTP sker ved<br />
at når der er højt indhold af GTP, dannes der<br />
AMP, og ligeledes for ATP og GMP.<br />
Gendannelse og genbrug af<br />
nukleosider, nukleotider og frie<br />
baser. For at baser kan bruges i<br />
andre væv, syntetiseres de i leveren<br />
til nukleosider, hvor de derefter<br />
transporteres via røde blodceller<br />
rundt i systemet. Mål vævet kan iså<br />
omdanne det igen. Der sker altså en<br />
interkonventering af de forskelloge<br />
trin.<br />
APRT = adenin phosphoribosyl<br />
transferase<br />
HGPRT = hypoxanthin-guanin<br />
phosphoribosyltransferase.<br />
Purin nukleoti cyklus: Især i muskler og i hjernen sker<br />
denne cyklus. Enzymer fra ”salvage” processen bruges til<br />
at deaminere AMP til IMP ved afgivelse af ammoniak,<br />
som bliver til urea. Fra IMP til AMP bruges aspartat og<br />
der udskilles Fumarat, som bruges i TCA cyklussen.<br />
Dannelsen af pymidiner kræver at basen skal dannes først. Dette sker ud fra glutamin CO2 og 2ATP<br />
går sammen + ribose 5’phosphat og dannes vha. enzymet CPS-II. Der dannes carbamoyl phosphat.<br />
Aspartat tilføjes herefter ved aspartat transcarbomylase. Molekylet danner en ring struktur vha.<br />
dihydroorotase, hvor der dannes orotat. Dannelsen af UMP sker ved at PRPP overfører R5’P ved en
orotat phosphoribosyl transferase, og der sker derefter en decarboxylereing. De første tre enzymer<br />
kendes som CAD og de sidste to som UMP synthetase. UMP→UDP→UTP. Ved at tilføje en<br />
aminogruppe fra glutamin dannes CTP ved CTP synthetase og både UTP og CTP er med til at<br />
danne RNA.<br />
”salvage” af urasil og cytosin danner uridin og cytidin ved at bruge ribose 1-phosphat som substrat<br />
og phosphorylere dette. Thymin bruger deoxyribose 1-phosphat og derfor vil disse arbejde<br />
uafhængigt af hinanden.<br />
Regulering af dannelsen af pyrimidiner sker ved hæmning eller aktivering af CPS-II. UTP hæmmer<br />
og PRPP aktivere. Under starten af S-fasen i en celle cyklus vil PRPP dominere, og i slutningen af<br />
S-fasen vil UTP dominere.<br />
Reduktion af ribose til deoxyribose. ATP og dATP er med til at<br />
regulere enzymet ribonukleotid reduktase, men selve reguleringen<br />
er yderst kompleks.<br />
Degradering af purin sker ved at AMP→IMP→Inosine→Hypoxanthin→xanthine→urin syre<br />
eller GMP→guanin→xanthin→urin syre.<br />
Degradering af pyrimidiner sker ved at nukleotiderne bliver dephospholyreret og nukleosiderne<br />
bliver kløvet til at danne en base og sukker. Base konverteres til CO2, NH4+ og beta alanin (fra<br />
cytosin’s deaminering til uracil). Thymin konverters til CO2, NH4+ og beta-aminoisobutyrat.<br />
Dannelsen af dette udskilles i urinen eller indgår i ureacyklussen.<br />
Både purin og pyrimidin degradering dannes meget lidt energi.<br />
Fra Holdtimer:<br />
Podagra er en lidelse som skyldes medfødte defekter i urinsyre metabolismen (øget produktion eller<br />
nedsat elimination).<br />
Adenin og Guanin<br />
cytosin og thymin<br />
Slutprodukter fra degradering af puriner og pyrimidiner – podagra symptomer
i. Purin katabolisme kan give anledning til podagra symptomer, idet slutproduktet<br />
for både AMP og GMP nedbrydning er urat (figur 41.19). Forøgede mængder af<br />
urat, kan resultere i formation af uratkrystaller.<br />
ii Pyrimidin katabolisme giver ikke umiddelbart anledning til podagra symptomer da<br />
slutproduktet ikke er urat. Cytosin deamineres og danner herved uracil, som<br />
konverteres til β-alanin (+CO2 + NH4+), som kan udskilles i urin (fig. 41.20)<br />
iii.Thymin konverteres til C02, NH4<br />
+ og β-aminoisobutyrat (fig. 41.20), som direkte kan<br />
udskilles i urin eller som kan konverteres videre til produkter som udskilles som urea<br />
og efterfølgende I urinen.<br />
Histologi:<br />
Nerver – se noter fra modul 2.<br />
AH 67 spinalganglie AH 66 grænsestreng bodian AH 72 tværskåret nerve<br />
AH 73 tværskåret nerve osmium AH 64 rygmarv<br />
MILTEN; SPLEN.<br />
-Sekundært lymfoidt organ, innskutt i blodbanen. 150-200g.<br />
-Renser blodet for beskadigede blodceller og fremmede partikkler og er sete for immunreaksjoner<br />
ovenfor blodbårne antigener. Disse oppfanges av antigen-presenterende celler og bindes til<br />
overflaten av follikulære dendritske celler.<br />
OPPBYGGNING;<br />
-Omgitt av en kapsel av tett kollagent bindevev, med noe glatt muskulatur.<br />
-Fra kapselen strekker deg seg tallrike trabekler inn i parenchymet. Disse virker avstivende og<br />
opprettholder kommunikerende avsnitt.<br />
-Gjennom hilum kommer blodkar, lymfekar og nerver inn i organet.<br />
-Parenchymet benevnes miltens pulpa, og deles i den røde og hvite pulpa.
DEN HVITE PULPA;<br />
-Består av lymfoidt vev i form av periarterielle lymfoide skjeder (PALS) som omgir de arterielle<br />
kar fra de forlater trabeklene og til dannelsen av kapillærer. Retiklet består av retikulumceller og<br />
retikulære fibre. Cellene er hovedsakelig T-lymfocytter.<br />
-De periarterielle skjedene utgår den thymus avhengige zone i milten.<br />
-Overgangs sonen mellom den hvite og røde miltpulpa kalles marginalzonen. Her er cellene mindre<br />
tettpakket, og rik på B-Lymfocytter.<br />
DEN RØDE PULPA;<br />
-Består hovedsakelig av sinusioder, adskilt av miltstrenger.<br />
-Miltstrenger er sammenhengende strenger eller plater av vev som utfyller rommet mellom<br />
sinusiodene. Strengene består av retikulum av retikulum fibre og celler, og i maskene av disse<br />
forekommer alle blodets formende elementer.<br />
-Miltsinusoidene; en modifisert form for kapillærer med en stor diameter, opptil 50m. Består av<br />
avlange endothelceller, som står i kontakt med hverandres laterale flater uten kontaktkomplekser.<br />
Sinusiodeveggen passeres derfor lett av blodets formende elementer<br />
BLOD-FILTER FUNKSJONEN;<br />
-Intermediær sirkulasjon; blodets passage fra arteriolene til venolene. Her er man ikke sikker på om<br />
det foregår i en såkalt lukket sirkulasjon, hvor blodet tømmer seg ut i miltsinusiodene, eller en åpen<br />
sirkulasjon, hvor blodet tømmer seg ut i strengene i den røde pulpa. Det er påvist at milten utfører<br />
sine filtrerende funksjoner ved åpen sirkulasjon, og at mesteparten av blodet som siver gjennom<br />
milten på et gitt tidspunkt, og gjennomsiver den røde pulpa for å gå over i sinusiodene. Dette tar ca<br />
30-60 min.<br />
KRETSLØPET/BLOD-FILTER FUNKSJONEN;<br />
-A.lienalis/a.splenica forgrener seg i rami lienalis som forgrener seg i trabekelarterier. Disse<br />
fortsetter over i den hvite pulpa som sentralarterier, som ligger i marginalzonen. Sentralarteriene<br />
forløper videre i penselarterioler før den treder inn i den røde pulpa som hylsterkapillærer, hvor<br />
blodet går over i miltsinusiodene. Disse tømmer seg i pulpavener, som går over i trabekelvener<br />
(pulpavenen kjennetegnes ved at den har enlaget endothel. Trabekelvenene danner ved hilum<br />
v.linealis og forlater milten.<br />
FORDØYELSESSYSTEMET:<br />
-Utgjøres av tractus digestorius, som strekker seg fra leppene til anus, og de accesoriske<br />
fordøyelseskjertler.<br />
-Hovedavsnittene i tractus digestorius utgjøres av munnen os, svelget pharynx, spiserøret<br />
oesophagus, magesekken ventriculus og tarmen intestinum.<br />
-De accesoriske kjertlene ligger uten for selve fordøyelseskanalen, men munner ut i denne og er<br />
utviklet fra dennes epithelbekledning. De utgjøres av 3 store munnspyttkjertler, glandula parotis,<br />
glandula submandibularis og glandula sublingualis. Det er også 2 store kjertler knyttet til<br />
tynntarmen, leveren med galdeblæren, og bukspyttkjertelen.
DEN GENERELLE OPBYGNING;<br />
Tunica mucosa; det inderste lag slimhinde, som i alle avsnitt består av en epithelial bekledning,<br />
lamina epithelialis, og et understøttende lag av cellerikt løst bindevev, lamina propria. Fra<br />
oesophagus til anus er det også et lag av glatt muskulatur, lamina muscularis submucosa.<br />
Tela submucosa; bindevevslag under tunica mucosa som forekommer i hele canalis<br />
alimentarius, men mangler i munn og svelg. Er relaivt løst, men binder slimhinnen til ned<br />
underliggende lag, samtidig som det tillater bevegelse.<br />
Tunica muscularis; et tykt lag av glatt muskulatur omgir submucosa i det maeste av<br />
fordøyelseskanalen, men mangler visse områder i munn, pharynx og oesophagus hvor det er<br />
tverrstripet muskulatur.<br />
Tunica adventita; ytterst lag av bindevev, og hefter pharynx, oesophagus og rectum til<br />
omgivelsene, mens megesekken og tarmkanalen er bekledd av peritoneum. Peritoneum er en serøs<br />
membran som betegnes tunica serosa, og består av enlaget plateepithel.<br />
MUNNEN;<br />
-Munnhulen, cavum oris, er over alt bekledd med munnslimhinnen som består av flerlaget<br />
plateepithel og en lamina propria av løst bindevev. I de områder hvoe slimhinnen er utsatt for<br />
mekanisk påvirkning gjennomgår det flerlagede plateepithelet keratinisering med dannelse av et<br />
hornlag.<br />
LEPPER OG KINN;<br />
-Leppernes form dannes av m.orbicularis oris. Det kutane område er bekledd av tynn hud hvor det<br />
forekommer hårfollikler og talg og svettekjertler. På leppernes røde del, prolabiet, er det også<br />
forhornet epithel, men uten hår og kjertler. Fargen skapes av vaskulariseringen. Prolabiet danner en<br />
muko-kutan overgangszone mellom hud og munnslimhinnen. I munnslimhinnen er det uforhornet<br />
epithel. I både lepper og kinn finnes det submucosa som binder slimhinnen til den dypereliggende<br />
muskulaturen. I submucosa finnes små kjertler, enten muko-serøse eller rent mukøse.<br />
SH 21 - læben<br />
GUMMEN;<br />
-Forhornet epithel med rikt vaskuliserte bindevevspapiller. Lamina propria inneholder tykke<br />
kollagene fibre. Ingen submucosa eller kjertler.<br />
GANEN;<br />
-Den harde gane; forhornet epithel med høye papiller. Submucosa binder slimhinnen fast til den<br />
harde ganes periost, og inneholder mange mukøse kjertler i den posteriore del.
-Den bløte gane; på den orale overflate bekledd med uforhornet flerlaget plateepithel, mens det på<br />
den pharyngeale flate går over i ciliært pseudolagdelt cylinderepithel. Submucosa inneholder på den<br />
orale flate mukøse kjertler, og på den pharyngale side muko-serøse. Hovedsubstansen er tverrstripet<br />
muskulatur.<br />
TUNGEN; Lingua<br />
-Muskuløst organ som medvirker til å bringe føden mellom tennene og dannelse av talelyder.<br />
Smakssansene er også plassert her.<br />
-Corpus lingua, den bevegelige del er tilheftet radix lingua.<br />
-Sulcus terminalis, oppdeler den dorsale overflate i en 2/3 forreste del og 1/3 bakerste del mot<br />
svelget. Spissen av sulcusen peker bakover og danner en fordypning, foramen caecum.<br />
-Slimhinen er fast bundet til muskulaturen, da det kun finnes submucosa under. Nedbindingen skjer<br />
ved aponeurosis linguae.<br />
-På tungeryggen er det papiler som består av en bindevevskjerne bekledd med et flerlaget<br />
plateepithel, og det skilles mellom 4 ulike typer papiler;<br />
Papillae filiformes; de minste, men fleste. Trådformet, 2-3mm høye med bakudrettede spisser.<br />
Det forhornete epithel pådisse gir tungens grålige farge.<br />
Papillae fungiformes; svampformede, færre og forekommer spredt i mellom de filiforme<br />
papillaene. Mindre forhorning og dermed en rødere farge. Kan inneholde smaksløk på toppen.<br />
Papillae circumvallatae; ca 10 stk som ligger i rekke foran sulcus terminalis. De største og<br />
ligger i en typisk nedsenkning(vollgraven) i tungeoverflaten. Epithelet er uforhornet og de<br />
inneholder smaksløker. Bredere og lavere enn de fungiforme. Står i forbindelse med serøse<br />
spyttkjertler.<br />
Papillae foliatae; bladformede og finnes baktil på tungens siderand, en på hver side.Har tallrike<br />
smaksløker.<br />
SH 23 papilla vallata<br />
-Smaksløkene er altså mest forekommende på circumvallatae, foliate og fungiforme papiller, men<br />
finnes også i ganen, pharynx og larynx.<br />
-De kan ses som ovale lyse legemer som strekker seg vinkelrett fra basalmembranen til en liten<br />
fordypning, smaksporen, i overflaten av det flerlagede plateepithel.<br />
-Består av ca 50 celler, og av 4 ulike celletyper; basalceller som proliferer til mørke celler, som<br />
igjen differenterer til intermediære celler, som til slutt blir lyse celler.<br />
MUNNSPYTTKJERTLENE:<br />
-Spyttet er fargeløst og en oppløsning av proteiner, glykoproteiner og karbohydrater m.m. Det<br />
produseres ca 1l pr.døgn, og mesteparten stammer fra de 3 store spyttkjertler. PH er ca 7 og<br />
inneholder enzymet ptyalin som spalter stivelse. Regulasjonen av spyttsekresjon er styrt av deres
innervasjon. De store mottar både symaptisk og parasympatisk innervasjon. Stimuleres av smak,<br />
følesans, lukt og psykisk stimuli. Dets funksjon er å holde slimhinnene fuktige og virke<br />
bløtgjørende på føden.<br />
OPPBYGNING;<br />
-Alle spyttkjertler er oppbygget av serøse og mukøse kjertelceller, og ut fra dette kan de<br />
klassifiseres i 3 kategorier;<br />
Serøse kjertler: utelukkende serøse kjertelceller, og secernerer tyntflytende spytt som inneholder<br />
ptyalin, men ikke mucin. I serøse endestykker er cellernes basale cytoplasma kraftig basofilt, mens<br />
apex er lyst eosinofilt, evt med synlige sekretgranula. Kjernen er avrundet og lokalisert i den basale<br />
halvdel av cellene. (PAS-kraftig blå, glukogenkorn).<br />
Mukøse kjertler: utelukkende mukøse kjertel celler og utskiller rent mucin. I mukøse<br />
endestykker er cellene fylt opp av mucindråper og har et lyst, vakuoleret utseende. Kjernen som er<br />
sterkt avladet av de opphopede mucindråpene er lokalisert helt basalt i cellene. (PAS-kraftig rød)<br />
Blandede kjertler: inneholder både serøse og mukøse celler, og sekretet inneholder både mucin<br />
og ptyalin. I overveiende mukøse kjertler blir ofte de serøs celler forskudt til endene hvor de danner<br />
mørkt farvede halvmåner, von Ebnerske halvmåner.<br />
Myo-epitheliale celler: forekommer i alle munnspyttkjertler, og er lokalisert mellom<br />
kjertelcellene og basallamina. De er avlange celler med lange utløpere (som om man griper om en<br />
kule). Cellene medvirker til uttømming av sekretet ved kontraksjon av utløperne.<br />
-Den første del av utførselsgangsystemet betegnes innskuddsstykker. Det er små rør med lavt<br />
kubisk epithel hvor kjernene utfyller nesten cytoplasmaet.<br />
-Innskuddstykkene fortsetter i intralobulære spyttrør, som har et kraftig eosinofil cylindrisk epithel.<br />
-Fra spyttrørene når sekretet over i større interlobulære utførselsganger. De har enlaget<br />
sylinderepithel som går over i pseudolagdelt epithel for til slutt å ende i flerlaget i<br />
hovedutførselsgangen.<br />
-De store spyttkjertler er;<br />
Glandula parotis; den største og ligger i munnhulens bindevev. Den er tubulo-alvolær kjertel<br />
som er rent serøs. Omgitt av en bindevevskapsel, hvorfra bindevevssepta strekker seg inn og<br />
oppdeler den i lobuli. Ductus parotideus utmunner i vestibulum oris på papilla parotidea ut for<br />
2.molar.<br />
Glandula submandibularis; tubulo-alveolær kjertel som er blandet, med overveiende serøse<br />
celler-sero-mukøs. Ductus submandibularis åpner seg i munnhulens bunn når tungebåndet. Et<br />
velutviklet bindevevsstroma og kapsel.<br />
Glandula sublingualis; tubulo-alveolær og blandet, overveiende mukøs, muko-serøs. De få<br />
serøse celler danner halvmåner. Kapselen er lite utviklet, men selv kjertelen er fint lobulert. 10-12<br />
utførselsganger, ductus sublingualis, som åpner seg i plica sublingualis. Èn stor, ductus sublingualis<br />
major munner ut sammen med ductus submandibularis.<br />
-Glandula lingualis posterior; på radix lingua. Rent mukøs. Farges kraftig røde av PAS-fargning pga<br />
glykoproteiner.
SH 29 gl. Parotidea AH 18 – gl. Submandubularis SH 30 do. PAS farvning<br />
SH 31 gl. Sublingualis<br />
TENNENE;<br />
-Viktig funksjon ved å avbite føden i passende stykker, samt betydning for talen.<br />
-2 ulike sett tenner, dentes decidui som er melketennene, og det permanente settet tenner, dentes<br />
permanentes.<br />
-Hver tann består av tannkronen som er den synlige, og tannroten som sitter fast nedkilet i<br />
tannhulen. Tannhalsen danner en innsnevring svarende til overgangen mellom krone og rot.<br />
Hulrommet i tannens indre kalles pulpahulen, og den inneholder kar og nerver. Rothulen fortsetter i<br />
rotkanalen.<br />
-Det harde tannvev utgjøres av dentin som utgjør det meste av tannen og omgir pulpahulen.<br />
Dentin er lyst gul, og det er den som danner tannens farge. I kronen er dentinen bekledt av emalje<br />
som er gjennomsiktig og har en blåhvit farge. I roten er dentinen dekket av et lag cement.<br />
-Det bløte tannvev er pulpa som oppfyller pulpahulen, rothinnen som fastholder roten i<br />
alveolehullet og gingiva, tannkjøttet, som bekler alveoleknokkelen nærmest tannkronen og omgir<br />
tannen.<br />
SH 23<br />
TANNENS UTVIKLING;<br />
-Starter med en hestesko formet fortykkelse av epithelet på det embryonale kjeveanlegg i 7<br />
føtaluke. Rotykkelsen danner 2 kamre, vestibulum oris fra den ytre, og tannlisten fra den indre.<br />
-Videre utvikles tannknoppene som er avlange fortykkelser som strekker seg ned i mesenchymet og<br />
begynner å utvikle melketennene.<br />
-Tannknoppene innvagineres av mesenchymet, og betegnes nå tannpapillen.<br />
-Ut fra tannpapillen utvikles dentinen og pulpaen.
-Tannknoppen blir etterhvert kappeformet og betegnes emaljeorgan, dette stadiet kalles også<br />
kappestadiet (etter formen).<br />
-Det dannes et indre emaljeepithel som produserer celler som blir stellate reticulum. Det ytre<br />
emaljeepithel danner celler som differenterer til ameoblaster. Etter formen kalles dette nå<br />
klokkestadiet.<br />
-De mesenchymale celler i tannpapillen differenterer høye sylindriske celler, odontoblaster.<br />
-Videre dannes roten, ved at det indre og ytre emaljeepithel legger seg inn til hverandre og danner<br />
den epitheliale rotkjede som vokser ned i mesenchymet. Rotkjeden går etter hvert til grunne og<br />
erstattes av et lag cement som dannes av cementoblaster.<br />
-Det første tannanlegg utvikles foran i underkjeven, så i overkjeven, og de første tannknopper viser<br />
seg i 10 føtaluke.<br />
Dentin; dannes av odontoblaster, som er differentert fra de mesenchymale cellene, secenerer<br />
ved merokrin sekresjon dentinmatrix, og betegnes predentin (ikke ferdig). Prematrixen gjennomgår<br />
en mineralisering, og under den fortsatt sekresjon trekker odontoblastene seg tilbake og danner en<br />
kanal inne i dentinen. Det ses derfor alltid et lag av predentin mellom odontoblastlaget og den<br />
mineraliserte dentin. Fullt mineralisert dentin består av 70% uorg og 20% org mat, samt 10% vann.<br />
Hardere enn knokkelvev.<br />
Emalje; produseres av ameloblasterne i den indre emaljeepithel. De secernere emaljematrix,<br />
som hurtig gjennomgår mineralisering. Ameloblastene er høye sylindriske celler med basalt stillte<br />
ovale kjerner. Secernering skjer ved merokrin sekresjon. 96% uorg, 1% org.matr og 3% vann =<br />
legemets hardeste hardeste substans.<br />
Tannpulpa; utvikles fra mesenchym i tannpapillen. Tannpulpaen er løst bindevev, med<br />
fibroblasten som dominerende celletype. Rikt vaskularisert, en arterie trer inn gjennom rothullet.<br />
Nervene følger karrene i deres forløp.<br />
Cement; den ytre og indre emaljeepithellag danner den epitheliale rotskjede, Hertwigs<br />
rodskede. Etter dannelsen av den første rotdentin degenererer rotskjeden, og de mesenchymale<br />
celler som kommer i kontakt med dentinen differenterer til cementoblaster. De påleirer cement<br />
pådentinen.<br />
Rothinnen; bindevevet som hefter tannen til det alveolære knokkel. Bundter av kollagene fibre<br />
(sharpeyske fibre) i cementen strekker seg gjennom rothinnen og fastholder tannen i rothullet. Her<br />
er det somatiske nerveender fra n.trigeminus.<br />
Gingva; tannkjøttet, en del av munnslimhinnen som bekler alveoleknokkelen nærmest<br />
tannkronen. Overgangen mellom tannkjøttet og tannen kalles sulcus gingivalis. På den innvendige<br />
overflate her er epithelet uforhornet, mens resten av gingva er forhornet.<br />
SVELGET; Pharynx<br />
-Fra kraniets basis til oesophagus. En bløte gane avskiller ufullstendig en øvre region, pars nasalis<br />
fra en nedre, pars oralis og pars laryngea.<br />
-Epithelet i pars nasalis er ciliært pseudolagdelt sylinderepithel, mens resten av pharynx er flerlaget<br />
plateepithel.<br />
-Epithelet jviler direkte på et fibro-elastisk lag, som utgjør lamina propria.<br />
-Tunica muscularis består av tverrstripet muskulatur.
-Tunica adventita har karakter av en fascia.<br />
-I pars nasalis og pars oralis er det ansamlinger av lymfoidt vev som danner;<br />
Tonsilla pharyngea; den bakerste del av pars nasalis. Pseuodolagdelt sylinderepithel med cilier<br />
og begerceller. Omgis av en tykk bindevevskapsel. Epithelet danner en rekke folder hvor et tykt lag<br />
av lymfoidt vev befinner seg. Danner ikke krypter. Hos børn er kan de være forstørret og kaldes<br />
polypper, undergår atrofi under puberteten.<br />
Tonsilla palatinae; “mandelen”, ligger i en fordypning, sinus tonsilaris, mellom de to<br />
ganebuer. Det lymfoide vev ligger i lamina propria. Inneholder kimsentre. Overflaten er bekledd av<br />
flerlaget plateepithel. Epithelet danner fler tonsilkrypter. Er omgitt av en kapsel av tett bindevev, og<br />
sender septaer av mer løst bindevev inn mellom kryptene. Utenfor kapselen er det mukøse kjertler.<br />
Tonsilla lingualis; ansamling lymfoidt vev på tungerotens lamina propria. Flerlaget<br />
plateepithel, som danner dybe krypter, bælghuler.<br />
-Disse mengdene av lymfoidt vev i svelgveggen danner en “svelgring” Waldeyersk svælgring, og<br />
deltar i organismens forsvar mot inntrengende mikroorganismer.<br />
CANALIS ALIMENTARIUS;<br />
SH 36 tonsilla pallatina<br />
-Utgjøres av oesophagus, ventrikkelen, tynntarm og tykktarm.<br />
-I alle disse avsnittene er det 4 konstante lag;<br />
Tunica mucosa<br />
Tela submucosa<br />
Tunica muscularis<br />
Tunica adventitia/serosa (peritoneum).<br />
OESOPHAGUS; Fra cartilago cricoidea til ventrikkelen. Har den mest utviklede muskulatur.<br />
Tunica mucosa;<br />
Lamina epithelialis: Flerlaget uforhornet plateepithel. I overgangen til ventrikkelen endres det til<br />
enlaget sylindrisk.<br />
Lamina propria: Løst bindevev som kan inneholde neon få lymfefolikler, samt kar og høye<br />
papiller.<br />
Lamina muscularis mucosae: Longitudinelt forløpende glatte muskelfibre.<br />
Tela submucosa;<br />
Moderat tett bindevev, som tillater utvidelse av lumen.
Tunica muscularis;<br />
Består av et indre sirkulært, stratum cirkulare, og ytre lag longitudinelt lag, stratum<br />
longitudinelle. De to er adskilt av bindevev. Den første 1/3 består av tverrstripet muskulatur, men<br />
går over i glatt, den miderste 1/3 af glat og skelet og nederste 1/3 af glat muskulatur.<br />
Tunica adventita;<br />
Løst bindevev, som hefter oesophagus til omgivelsene. Kan inneholde kar og nerver.<br />
-I oesophagus forekommer det både cardiakjertler og submucosakjertler. De er mukøse og secenerer<br />
mucin.<br />
-Finnes en nedre oesophageal sphincter, noen cm over cardia, og en øvre oesophageal sphincter på<br />
overgangen mellom pharynx og oesophagus.<br />
-Oesophagus` motorikk styres av parasympatiske tråder fra n.vagus, og sympatiske fra truncus<br />
sympaticus.<br />
SH 37 – midterste 1/3 del<br />
MAVESEKKEN;Ventriculus/gaster. Hvor føden utsttes for mekanisk og kjemisk påvirkning<br />
-Inngangen benevnes cardia, mens utgangen heter pylorus. Til venstre for cardia er den<br />
kuppelformede fundus. Curvatura major og minor.<br />
Tunica mucosa; Den frie overflate bekledes av høyt enlaget sylinderepithel.<br />
Overflateepithelene er alle slimsecenerende og utgjør tilsammen en secenerende epitheloverflate.<br />
Ved pylorus fortsetter det i enlaget sylinderepithel. Overflateepithel cellene secenerer mucin som<br />
kleber til slimhinnen i form av et tykt lag. De secenerer også bikarbonat som fungerer som en buffer<br />
ovenfor saltsyren, men også beskyttende.<br />
Slimhinnen danner ved overflaten tallrike folder, plica gastricae. Det finnes også et nett av lave<br />
furer, foveolae gastrica. I bunden av foveolae gastrica munner glandulae gastrica kjertlene ut. Disse<br />
er forskjellige i ulike deler av ventrikkelen; omkring cardia er det cardiakjertler, corpus og fundus<br />
utgjør en zone av corpus-fundus kjertler, og kjertlene langs curvatura minor og den pylorusnære<br />
delen kalles pyloruskjertler.<br />
-Corpus-fundus kjertler; inneholder 5 celletyper, hovedceller (i basis), paritalceller (i corpus),<br />
mukøse halsceller (i collum), endokrine celler og stamceller.<br />
-Hovedcellene: serøse, secenerer pepsinogen, som blir pepsin - spalter proteiner og nedbryter<br />
kollagen.<br />
-Paritalceller: store, runde med mørk kjerne. Acidofilt, som forårsakes av mitochondriene.<br />
Sekresjonsproduktet er saltsyre. Secenerer også glykoproteiner som er viktig for opptaket av bvitaminer.<br />
-Mukøse halsceller: innskutt mellom paritalcellene. Lavt sylindriske. Produserer mucin, og<br />
medvirker til å bekytte slimhinnen.
-Stamceller: lavt sylindriske eller kubiske, forekommer i et lite antall. Kan differentere til alle de<br />
ulike cellene i ventrikkelslimhinnen.<br />
-Pyloruskjertler: tubulære men mer forgrenede enn corpus-fundus kjretlene. Hormonproduserende<br />
celler. Har en hvit lysning i lumen. Cytoplasmaet er lyst med kjernen basalt.<br />
-Cardiakjertler: forekommer rundt innmunningen av oesophagus og er tubulære mukøse kjertler.<br />
Lamina propria; løst meget cellerikt retikulært bindevev som utfyller spaltene mellom kjertlene.<br />
Inneholder lymfocytter.<br />
Lamina muscularis mucosae; kraftig, består av et indre sirkulært og et ytre longitudinelt lag.<br />
Tela submucosa; løst bindevev, som inneholder blod, lymfe og nervekar.<br />
Tela muscularis: består av 3 lag, et longitudinelt, et sirkulært og et skrått forløpende. Det<br />
sirkulære danner i pylorus delen m.sphincter pylori.<br />
Tunica serosa (peritoneum): bekleder hele ventrikkelen. Består av mesothel (enlaget epithel)<br />
og submesothelialt bindevev.<br />
AH-13, Fundus SH- 39 Corpus SH-40 Pylorus<br />
TYNNTARMEN: Intestinum tenue, ca 5m lang.<br />
-Oppdeles i duodenum (tolvfingertarmen 25-30cm lang), jejunum (de proximale 2/5) og ileum (de<br />
distale 3/5). Alle delene har lik histologisk oppbyggning.<br />
Tunica mucosa: enlaget sylinderepithel. I slimhinnen er det ulike struktuelle strøk for å øke den<br />
luminale overflate, deriblandt plica cirkulares (x3) som består av både mucosa og submucosa (de<br />
forsvinner gradvis i ileum), og villi intestinales som øker overflaten med opptil 10x.<br />
-Villi intestinales: er opptil 1mm lange og omgir hele tarmen og plica sirculares. Består av<br />
lamina epithelialis og lamina propria (bindevev og retikulært vev). Kan inneholde strøk av glatte<br />
muskelceller og noen kar. På villi er det en børstesøm (ses som en rød linje), som er mikrovilli<br />
(20x). De består av enlaget cylinderepithel med basale cellekjerner. Innimellom disse kan<br />
begerceller ses. De er mukøse og kjennetegnes med sin avrundede form og lyst cytoplasma med en<br />
trekantet basofil kjerne.<br />
-De Liberkuhnske krypter, som er kjertler mellom villi, øker også overflaten. Epithelet består av<br />
6 celletyper; absorptive celler, begerceller, Paneth-celler, entero-endokrine celler, stamceller og Mceller.<br />
-Lamina propria; løst retikulært bindevev, som er svært cellerikt. Strekker seg helt opp i villi.<br />
Ileum: Peyerske plaque, ansamlinger av lymfefollikler.
-Lamina muscularis mucosae; består av et indre sirkulært og ytre longitudinelt lag. Spinkle<br />
lag strekker seg helt opp i villi.<br />
Skille mellom duodenum og jejenum: bredere villi i duodenum, tykt lag av Brunnske kjertler i<br />
tela submucosa i duodenum. Lite bindevev.<br />
Tela submucosa; består av relativt løst bindevev, hvor de større blod og lymfekar løper.<br />
Inneholder de Bruunske kjertler i duodeum, som secenerer tyntflytende og mukøst sekret med lett<br />
basisk pH. De har en beskyttende effekt.<br />
Tunica muscularis; består av et indre sirkulært og ytre longitudinelt lag.<br />
Tunica serosa; mesothel med underliggende subserosa.<br />
SH 41 – Duodenum SH 42 - Jejunum<br />
TYKKTARMEN;<br />
-inndeles i caecum og appendix veriformis, colon og rectum og canalia analis. I tykktarmen foregår<br />
absorpsjon av vann og uorganisk salter. Avføringen, fæces, blir av fast konsistens. Begerceller<br />
produserer mucin som virker som smøremiddel ved transport og beskyttende for slimhinnen.<br />
Tunica mucosa: høyt sylindrisk. Tykktarmshinnens overflate er ganske glatt, idet det ikke er<br />
villi. Det er tubulære kjertler i form av Lieberkuhnske krypter. Rikelig med begerceller. Kan også<br />
ses en børstesøm.<br />
-Lamina propria: cellerikt retikulært bindevev, men er sparsom pga de tettsittende kjertlene.<br />
-Lamina muscularis mucosa: et indre sirkulært og ytre longitudinelt lag.<br />
Tela submucosa: Består av løst bindevev som kan inneholde fettvev, samt kar og nerver.<br />
Tunica muscularis: Det indre sirkulære lag er komplett, men det ytre danner 3 flate<br />
longitudinelle bånd, tenae coli.<br />
Tunica serosa: består av mesothel og subserøst bindevev og danner appendix epiploicae. De er<br />
små fettfylte peritoneumduplikaturer på tykktarmens overflate.<br />
-Canalis analis: danner et overgangsområde mellom tarm og enetarmsåpningen, hvor slimhinne går<br />
over i hud. Det kan ses longitudinelle slimhinnefolder, columae anales, som inneholder grener av a<br />
og v rectalis sup. Columnae anales er forbundet med små slimhinnefolder, valvulae anales, som<br />
igjen danner små utposninger, sinus anales. Valvulae og sinus danner en bølget linje, linea<br />
pectinata. Slimhinnen svarer til analkanalen.
SH 43 Colon<br />
APPENDIX VERIFORMIS; Blindtarmen.<br />
-Avgår fra caecum som en liten blindt endene utposning. Struktuelt likt oppbygget som tykktarmen,<br />
men med visse særtrekk. Blandt annet en tykkere vegg, pga store mengder lymfoidt vev som danner<br />
et sammenhengende lag av follikler.<br />
Tunica mucosa: Lumen er uregelmessig, og kan hos den voksne være lukket. Villi mangler, og<br />
de Lieberkuhnske krypter forekommer sjelden eller lite. De endokrine celler finnes, og farges<br />
kraftig sorte av sølvfargning, samt begerceller og panethceller. Epithelet består av sylindriske celler,<br />
og har en børstesøm, men få begerceller.<br />
-Lamina propria: infiltrert av lymfocytter - et sekundært lymfoidt organ og danner en ring av<br />
solitære follikler.<br />
-Muscularis submucosa er svakt utviklet.<br />
Tunica submucosa: tykk og inneholder mange fettceller.<br />
Tunica muscularis: tynnere enn hos den øvrige tykktarm. Det ytre longitudinelle lag er<br />
sammenhengende uten teniae.<br />
Tunica serosa: lik serosa på tarmen forøvrig.<br />
SH 44 appendix SH 45 appendix sølvfarvning<br />
BLODKAR, LYMFEKAR OG NERVER.<br />
-Arteriene avgir små grener til serosa, gjennomborer muscularis og danner et plexus i submucosa.<br />
Herfra avgår grener i luminal retning, som både forsyner muscularis mucosa og danner kapillærnett<br />
i lamina propria. Venene følger i grove trekk arteriene.<br />
-Lymfekar: de begynner som blindt endende lymfekapillærer i bindevevet mellom kjertlene.<br />
Lymfekapillærene anastomoserer med hverandre og dreneres til et tettmasket plexus i den dype del<br />
av lamina propria parallelt med muscularis mucosae. Fra dette plexet avgår det grener gjennom
muscularis mucosae, og det dannes et nytt plexus i submucosa. Store lymfekar løper herfra og<br />
følger blodkarrene.<br />
-Nerver: mottar autonome motoriske (både parasympatisk og sympatisk) og sensoriske fibre. De<br />
parasympatiske fibre stammer fra n.vagus og n.splanchnici, og danner synapser med<br />
postganglionære i plexus myentericus eller submucosus.<br />
DE ACCESSORISKE FORDØYELSESKJERTLER:<br />
Pancreas: rent serøs, retroperitonell beliggende ut for 2 og 3 lendehvirvel. Ca 20 cm lang og<br />
veier ca 100g.<br />
-Er ikke omgitt av en kapsel, men av løst bindevev. Fine bindevevssepta oppdeler kjertlen i<br />
lobuli.<br />
-Består av både en exokrin og endokrin del. Den exokrine del inneholder acinære celler, som<br />
hvert døgn danner 1500ml pancreassaft som uttømmes i duodeum. Den endokrine del består av de<br />
Langerhanske øyer som bl.a produserer insulin og glukagon, som har avgjørende effekt på<br />
karbohydratstoffskiftet. Disse avgis i kretsløpet.<br />
-Den exokrine del: pancres er tubulo-acinøs kjertel. Acini er avrundet og består av et lag<br />
pyramideformet epithelceller, med apex inn mot et sentralt beliggende lumen. Kjernene er runde og<br />
lokalisert i den basale del av cellene, som er kraftig basofil.<br />
-Den apikale del er fylt opp av sekretgranula som farges av sure fargingsstoffer, og dermed<br />
eosinofil i HE-farging.<br />
-Utførselssystemet: den første intraacinære del av utførselsgangsystemet er begynnelsen av<br />
intralobulære innskuddsstykker, som har kubisk eller lavt sylindrisk epithel. Innskuddsstykkene<br />
tømmer seg i større interlobulære ganger med sylindrisk epithel. De interlobulære gangene munner<br />
ut i de to hovedutførselsgangene; ductus pancreaticus og ductus pancreaticus accessorius.<br />
Ductus pancreaticus munner i papilla duodeni major sammen med papilla choleoductus. Ductus<br />
pancreaticus munner 2 cm over i papilla duodeni minor. Begge utførselsgangene er bekledd med<br />
enlaget, høyt sylindrisk epithel med bindevevslag utenpå.<br />
-Pancreasaften inneholder enzymer som kan bryte ned det meste av hovedbestanddelene av føden,<br />
samt bikarbonater som virker nøytraliserende på den sure ventrikkelchymus. Enzymene seceneres<br />
av acinære celler. Reguleringen er hormonell og nærvøs.<br />
-Den endokrine del: cellene er samlet i små grupper, de Langerhanske øyer. De forekommer spredt<br />
i det exokrine vev. Cellene ses som lyst eosinofile med ganske likt utseende som de acinære celler.<br />
SH 34 pancreas
LEVEREN: Hepar, legemets største kjertel, 1500g.<br />
-Omgitt av en tynn kapsel, Glisons kapsel, som er peritoneum bekledd (area nudae).<br />
-I porta hepatis trer a.hepatica og v.portae inn i leveren, mens ductus hepaticus communis trer<br />
ut. Mottar altså både venøst og arteriellt blod. Vena portae fører venøst blod fra tarm, milt og<br />
pancreas, og dreneres til vena cavae inferior.<br />
-Et livsnødvendig organ med en rekke funksjoner, bl.a dens exokrine del består av sekresjon av<br />
galle, og syntesisere substanser som avgis til blodet, deriblandt proteiner.<br />
-Oppbyggning: Glisons kapselen oppdeler leverparenchymet i lobuli. Kapselen er fortykket<br />
rundt v.cavae inf og i portae hepatis. Intralobulært finnes det et avstivende nett av retikulære fibre.<br />
-Den struktuelle enhet i leverern er leverlobulus som er et sekskantet prisme. Lobuli avgrenser<br />
det interlobulære bindevev. Hver lobuli inneholder 6 Glissonske triader. På tversnitt ses det at<br />
lobuliene inneholder strenger av leverceller, hepatocytter, som stråler perifert fra et lite sentralt kar,<br />
sentralvenen, og som adskilles av sinusioder. Sinusiodene forbinder de terminale forgreningene av<br />
a.hepatica og v.portae med sentralvenen som er den første begynnelse til vv.hepatica.<br />
-Blodkar: Rikelig blodforsyning. Blodet tilføres via v.portae og a.hepatica. De deler seg hurtig i<br />
større forgreninger, som følger bindevevet inn i leveren og forgrener seg i mindre og mindre grener.<br />
Karrene inngår i den Glissonske triade (a.hepaticae, v.portae og ductus hepaticus comm), og fra den<br />
avgår det endegrener som forløper på tvers mellom to lobuli. Fra disse endegrenene avgår det<br />
mindre grener som trer inn i lobuli hvor de går over i et nett av sinusioder. Sinusiodene utfyller<br />
rommene mellom levercelleplatene. Sinusiodene stråler inn mot sentrum, hvor de munner i<br />
sentralvenen. Blodet fra sentralvenen samler seg i innskuddsvener, som igjen samler seg i<br />
samlevener og munner ut i vv.hepaticae og videre i v.cava inferior.<br />
-Sinusiodeveggen består av endothelceller. Sinusiodene er større enn kapillærer.<br />
Leversinusiodenes vegg er diskontinuerlig og har ingen basallamina. Det kan påvises Kupfferceller,<br />
som er stjerneformede og er makrofager. Det kan ses at sinusiodene er omgitt av<br />
perivaskulært rom, det Disses rom, som adskiller endothelcellene fra levercellenes overflate. Denne<br />
har et stort antall mikrovilli som endothelcellene hviler på. Rommet inneholder retikulært nett.<br />
Gjennom dette rommet kan plasma fritt strømme og lett komme i kontakt med leversellenes<br />
overflate, og dermed femme utvekslingen av substanser.<br />
(Acinus: den del av leverlobus som vaskulariseres av samme kar gren (1/6).)<br />
-Leverceller: utgjør 80%, polyhedrale parenchymceller. Har 6 overflater, kjernene er store,<br />
runde og sentralt plassert. Kjernen er lys, med en eller flere nucleoli. Cytoplasmaet varierer, men<br />
det ses spredte basofile klumper av ergoastoplasma og tallrike mitochondrier. Spredte Golgi-app og<br />
et velutviklet ER.<br />
SH 5 Lever SH 47 lever PAS SH 4 Lever<br />
GALDEVEIENE:
-Begynner med de intralobulære galdekapillærer som forbindes med de interlobulære som forløper i<br />
denGLissonske triade. Disse løper sammen under dannelse av stadig større ganger som til slutt<br />
forlater leveren som ductus hepaticus comm. Denne forener seg med ductus cysticus fra<br />
galdeblæren under dannelse av ductus choledochus. Munner til slutt i duodeum. Epithelet er høyt<br />
sylindrisk og hviler på lamina propria som inneholder små mukøse kjertler. I bindevevet ses strøk<br />
av glatt muskulatur, unntatt i overgangen til duodeum, hvor den er ringformet og danner<br />
m.sphincter Oddi.<br />
GALDEBLÆREN: Vesica biliaris. Kan romme 50ml. På undersiden av høyre leverlapp.<br />
-Tunica mucosa: ett enkelt lag høyt sylindriske epithelceller. Kjernene er ovale og basalt stilt.<br />
Cytoplasmaet er eosinofilt. Lamina propria består av løst bindevev. Ingen muscularis mucosae.<br />
Slimhinnengrenser direkte opp til<br />
-Tunica muscularis: omgis av bindevev, som har karakter av kapsel. Hvor galdeblæren er bekledd<br />
av peritoneum går laget over i tela subserosa. Bindevevslagene inneholder blodkar, nerver og<br />
lymfekar til galdeblæren.<br />
-Leveren har stor evne til regenerering, ved f.eks kreftsvulst operasjoner.<br />
LEVERENS FUNKSJONER:<br />
Depotfunksjon; lagre glukose i form av glykogen - regulering av blodsukkeret. Lagrer også B<br />
og A vit, samt jern og folinsyre.<br />
Dannelsested for en rekke plasmaproteiner, som blandt annet er nødvendig for blodets<br />
koaguleringseffekt.<br />
Omsettning og transport av lipider.<br />
Omsetter fettoppløslige forbindelser, (legemidler og pesticider som forurenser maten) vha ulike<br />
enzymer dannet i ER.<br />
Osettningen av steroidhormoner, f.eks kjønnshormoner.<br />
Dens exokrine funksjon er produksjonen av galde. Galde syntesiseres ut fra cholesterol. Galde<br />
er både fordøyelsessekret og ekskresjonsmedium. Galdesyren i form av galdesalt har betydning for<br />
fordøyelsen da de fremmer fordøyelsen og absorpsjonen av fett ved micelledannelse. Galde<br />
inneholder også mange Ig-A som tas opp fra portae-blodet og utskilles i galden og dermed i<br />
tarnlumen, hvor det utgjør det sekretoriske Ig-A i tarmlumen. Galden opplagres i galdeblæren inntil<br />
tilstedeværelse av føde, spesielt lipider. Det skilles ut ca 500ml pr døgn.<br />
GALDEBLÆREN:<br />
Tunica mucosa: lamina prop, tykk, mange kar. Lamina epithelialis: enlaget sylinderepithel.<br />
Tela submucosa: ingen..<br />
Tunica muscularis: tynn.<br />
Tunica serosa: tykk, karrik subserøst bindevev.<br />
SH 50 Galdeblære
KORT OPPSUMMERING;<br />
Duodenum Jejunum Ileum Colon<br />
Plica circulares + + (-) -<br />
Villi<br />
intestinales<br />
+ + + -<br />
Lieberkuhn`sk<br />
e krypter<br />
+ + + +<br />
Peyer`ske<br />
plaques<br />
- - + -<br />
Brunner`ske<br />
kjertler<br />
+ - - -<br />
Paneth-celler + + + -<br />
EC-celler<br />
(serotoninprod<br />
userende)<br />
+ + + +<br />
Brystkirtlerne glundula mammae<br />
Udvikles fra hudektoderm.<br />
Brystvorterne = papillae mammae og areola mammae (området omkring disse). Er flerlaget<br />
pladeepithel. Papillae indeholder glat muskulatur både cirkumferentielt og longitudinelt, som<br />
fremkalder erektion af papillen. I areola findes kirtler som fremtræder gennem huden og kaldes gl.<br />
areolares eller montgomeryske kirtler. Disse secernerer fedtholdigt sekret under laktation, og der<br />
findes desuden sved og talgkirtler heri. Findes en del sensoriske nervetråde i huden.<br />
Brystkirtlen er en alveolær kirtel og består af 20 lapper, som adskilles af fedt og bindevæv. Hver lap<br />
har sin egen udførselsgang til papillen, ductus lactiferus. Denne er et 2 laget epithel, som består af<br />
enlaget kubisk epithel basalt og enlaget cylindrisk superficielt. Ved udmundinget går epithelet over<br />
i flerlaget pladeepithel. Inden udmunden findes sinus lactiferus der tjener som et reservoir af<br />
mælken. Hver lap har flere lobuli som modtager én terminal ductus. Fra kirtlernes lobi findes<br />
bindevævsstrøg som hæftes til huden, lig. Suspensorium mammae. De sekretoriske endestykker<br />
består af alveoler som er beklædt med kubisk eller cylindrisk epithel.<br />
Under graviditet øges parenchymet og der sker en reduktion i intra og interlobulære bindevæv.<br />
SH 88 – HE SH 87 – Van gierson
ANS<br />
Sypaticus T1-L3.<br />
Efferente fibre: Preganglionært<br />
neuron fra lateral hornet (grå<br />
substans) via den ventrale rod,<br />
igennem rami communicantes albi<br />
(myelineret) ind i et sympatisk<br />
paravertebralt ganglie, som derefter<br />
ascenderer, descenderer, danner<br />
synnapse eller direkte i et<br />
prævertebral ganglion. De findes 3<br />
prævertebrale ganglier, ganlion<br />
coeliacum T5-T12 (mavesæk, lever,<br />
pancreas, galdeblære, tyndtarm, milt,<br />
nyre), ganglion mesentericum<br />
superior T10-T12 (tyk- og tyndtarm),<br />
ganglion mesentericum inferior L1-<br />
L3 (Nedre tyktarm, rectum, blæren).<br />
Korte præganglionære neuroner og<br />
lange postganglionære neuroner.<br />
Parasympaticus<br />
Lange præganglionære neuroner, korte post ganglionære neuroner.<br />
N. III, n.oculumotorius fra nucleus i tectum– præganglionære neuroner til ganglion ciliare, derefter<br />
postganglionære neuroner til øjet.<br />
N. VII, n.facialis fra nucleus salvatorius superior– prægang til ganglion pterygopalatinum og<br />
ganglion submandibularis, herefter postgang til glandula lacrimale, submandibular og sublinguale.<br />
N. IX, n.glossypharyngeus fra nucleus salvatorius inferior – prægang til ganglion oticus hvorefter<br />
postgang følges med n.auriculotemporalis for derefter at innervere glandula parotidea. Baroreceptor<br />
stimulans og kemoreceptor stimulans føres herigennem fra sinus carotis.<br />
N. X, n. vagus fra nucleus ambiguius – Står for ca. 75% af den parasympatiske aktivitet. Lange<br />
pregang direkte til diverse plexus til lunger, hjerte, lever og GI. Modtager også baroreceptor<br />
stimulans og kemoreceptor stimulans fra arcus aorta.<br />
Desuden findes der parasympatiske fibre fra S1-S3 som innerverer kønsorganerne rectum, blæren<br />
og en del af tyktarmen.
Medulla oblongata:<br />
- Nucleus tractus solitarius, modtager afferente indput<br />
fra hjerte-, respiratioriske og GI receptorer.<br />
- Ventrolaterale medulla område, præganglionær<br />
sympatisk kontrol center.<br />
Pons:<br />
- Parabrachiale region, kardiovaskulær og respiratorisk<br />
kontrolcenter<br />
Midbrain:<br />
- Periaqueductal grå substans, registrere smerte.<br />
Hypothalamus – regulerer ANS funktion.<br />
Blodcirkulation<br />
Modtager ca. 20% af CO, og bruger ca. 20% af kroppens iltoptag. Begge disse fordobles efter et<br />
stort måltid. For at kunne fordøje maden behøver tarmene blodtilførsel.<br />
Tunica mucosa modtager ca. 60-70% af total blodforsyning til tarmene. Fenestrerede kapillærer.<br />
Høj vandabsorption i tarmene pga. højere kolloid osmotisk tryk end hydrostatisk tryk.<br />
Leveren har en gennemblødning på ca. 1,5L/min. Storstedelen af gennemblødningen kommer fra<br />
tarmene og mavesækken. Har den højeste iloptagelse af alle organer. Leveren modtager<br />
blodforsyning fra a. hepatica og v. porta. Fordi v. porta drænerer tarmene, mavesækken, milten og<br />
pancreas betyder det at 75% af ilten kommer fra a. hepatica. Alt dette tømmes i v.hepatica.<br />
ENS & Motilitet<br />
Kun monoglycerider, dipeptider og monosaccarider optages i tyndtarmen, molekyler der optages<br />
igennem føden må derfor behandles kemisk.<br />
Spytkirtlerne indeholder amylase til at nedbryde kulhydrater og lipase til at nedbryde lipider.<br />
Proteiner bliver nedbrudt i mavesækken vha. pepsin. Enzymer til fordøjelse af maden i tyndtarmen<br />
kommer fra pancreas og er lipase, chymotrypsin og amylase. Tyndtarmens lumen hjælper også med<br />
at udskille enzymer til at fordøje maden.<br />
Endokrin mekanisme = udløser gastrin i blodet som stimulerer H+ mavesækkens cellevæg.<br />
Neural mekanisme = udløser nerver og neurotransmittere til ENS og CNS.<br />
Parakrine mekanisme = udløses af sensor celler påvirker naboceller uden at indtræde i blodet.<br />
8-9L væske passerer tarmene pr. dag, hvoraf 1L sekrerer tarmene selv.<br />
Glat muskulatur kan både aktiveres elektromekanisk (via AP) eller pharmakomekanisk (via ligand<br />
binding fx fra parakrine celler).<br />
Parasympaticus = motalitet↑ og sekretion↑. Indeholder også afferente fibre som registrerer<br />
ændringer fra chemoreceptorer og mechanoreceptorer. Vagovagal refleksen.<br />
Øger kontraktiliteten.<br />
Sympaticus = Danner enten synnapser eller innerverer direkte effektor celler.<br />
Hæmmer kontraktiliteten<br />
Interneuroner = GI er selvregulerende og fungerer som en minihjerne. Dette betyder at den kan selv<br />
regulerer sine egne stimuli.
Slow-wave: Konstant bølge af en mindre depolarisering uden AP. Dette betyder at der er en rytmisk<br />
strøm hele tiden i mave-tarmkanalen. Når Føde og væsker skal skubbes igennem vha.<br />
muskelarbejde begynder et AP at skyde der hvor slow wave peaker.<br />
HORMONE SOURCE TARGET ACTION<br />
Cholecystokinin I cells in duodenum and jejunum and<br />
neurons in ileum and colon<br />
Gastric-inhibitory<br />
peptide<br />
Pancreas<br />
Gallbladder<br />
↑ Enzyme secretion<br />
↑ Contraction<br />
K cells in duodenum and Jejunum Pancreas Exocrine: ↓ fluid absorption<br />
Endocrine: ↑ insulin release<br />
Gastrin G cells, antrum of stomach Parietal cells in body of<br />
Stomach<br />
Gastrin-releasing<br />
peptide<br />
Vagal nerve endings G cells in antrum of<br />
Stomach<br />
Glucagon α Cells of pancreatic islets of<br />
Langerhans<br />
↑ H + secretion<br />
↑ Gastrin release<br />
Liver ↑ Glycogenolysis<br />
↑ Gluconeogenesis<br />
Guanylin Ileum and colon Small and large intestine ↑ Fluid absorption<br />
Motilin Endocrine cells in upper GI tract Esophageal sphincter<br />
Stomach Duodenum<br />
Neurotensin Endocrine cells, wide-spread in GI<br />
tract<br />
Peptide YY Endocrine cells in ileum and colon Stomach<br />
Pancreas<br />
↑ Smooth-muscle contraction<br />
Intestinal smooth Muscle Vasoactive stimulation of<br />
histamine release<br />
↓ Vagally mediated acid<br />
secretion<br />
↓ Enzyme and fluid secretion<br />
Secretin S cells in small intestine Pancreas ↑ HCO3- and fluid secretion<br />
by pancreaticducts<br />
Somatostatin D cells of stomach and duodenum, δ<br />
cells of pancreatic islets<br />
Stomach ↓ Gastric-acid secretion<br />
Stomach ↓ Gastrin release<br />
Intestine ↓ Fluid absorption/↓ secretion<br />
↓ Smooth-muscle contraction<br />
Pancreas ↓ Endocrine/exocrine<br />
secretions<br />
Liver ↓ Bile flow<br />
Substance P Enteric neurons Enteric neurons Neurotransmitter<br />
Vasoactive intestinal<br />
peptide<br />
ENS neurons Small intestine ↓ Smooth-muscle relaxation<br />
↓ Secretion by small intestine<br />
Pancreas ↓ Secretion by pancreas
Spinchters fungerer som envejs ventiler for at føre føden kaudalt.<br />
Den øvre oesophagale spinchter (UES) = separerer pharynx og oesophagus. Har det højeste<br />
hviletryk. Synkecenteret og respirationscenteret i oblongata er i tæt relation til hinanden. UES<br />
afslappes ved synkningsprocessen.<br />
Den nedre oesophagale spinchter (LES) = separerer oesophagus fra mavesækken. Lader føden<br />
passerer fra spiserør til mavesæk, og forhindre reflux af føde til spiserøret.<br />
Pylorisk sphinchter = separerer mavesækken fra duodenum. Regulerer tømning af mavesækken og<br />
forhindrer reflux af føde hertil. Kan kun klare en lille trykgradient.<br />
Ileocecale sphincter = separerer ileum og cecum. Reguleres af ANS. Distentiun af ileum afslapper<br />
sphincteren, hvorimod distention af colon ascendens kontraherer sphincteren.<br />
Extern og intern anal sphincter = Interne er involuntært styret hvorimod den externe er både<br />
voluntær og involuntært styret.<br />
Under hvile vil der stadig være aktivitet i tarmene, for at kunne føre maden videre i systemet. Dette<br />
kaldes et migrating motor complex (MMC) og består af 4 faser og som har et interval på 1½-2 timer.<br />
1. fase – en forlænget hvileperiode (uvirksom) 2. fase – øget AP frekvens og dermed kontraktilitet<br />
3. fase – elektrisk og mekanisk aktivitet peaker og varer et par minutter 4. fase – nedsat aktivitet<br />
som overgår i fase 1 igen. Det er under MMC man får fjernet partikler over 2mm som ikke kan<br />
fordøjes.<br />
Oesophagus motilitet: primær peristaltisk bevægelse er en rytmisk bevægelse omkring fødebollen,<br />
hvor UES starter med at afslappes, også LES til indtræden i ventriklen. Sekundær peristaltisk<br />
bevægelse er hvis fødebollen ikke følger med den første bevægelse. Her vil afferente fibre sende<br />
besked til CNS, hvor efter der sendes en ny bølge ud.
Ventrikkel motilitet: Når ventriklen fyldes har den en såkaldt receptiv relaxation, hvorpå den<br />
udvides. Herefter vil pacemakerceller omkring midt på corpus give peristaltiske bevægelser, hvor<br />
maveindholdet vil presses ned mod duodenum, og slippe føden videre her. Frekvens =ca. 3-5/min.<br />
Tyndtarmens motilitet: Segmentere bevægelser forløber sig igennem tarmen, hvor segmentet<br />
kontrahere og slapper af, så chymen kan blandes med tarmsekret og absorberes.<br />
Imellem måltiderne sker der det der hedder migrating motility, hvor ufordøjede dele får lov til<br />
komme igennem tyndtarmen også kaldet MMC.<br />
Tyktarmens motilitet: Chymus indtræder i cecum (ca. 500ml/dag) ved at trykket åbner for den<br />
ileocecale sphinchter, som derefter lukker igen, så chymus ikke kan refluxe. Under faste vil tarmen<br />
lave segmentære bevægelser i haustra ca. 1-5/min som gør det muligt at absorbere næring. Under et<br />
måltid vil der være det der hedder mass movement, som presser fæces videre i colon.
Gastrisk funktion (Kap 41)<br />
Mavesækkens anatomi.<br />
Opdeles i tre hoved segmenter<br />
1) Cardia som ligger lige distalt for oesophagus, er blottet for syresekretion.<br />
2) Corpus størstedelen af mavesækken . den mest poximale del kaldes fundus. Indeholder<br />
parietal celler, hovedceller, mucus sekrerende celler og endokrine celler<br />
3) Antrum, den mest distale del. Indeholder ikke parietalceller.
Overfladearealet forøges pga. de mange kirtler i mucosa.<br />
Parietalcellerne udskiller syre i form af HCl. Clfrigives<br />
passivt, og H+ må frigives via H-K<br />
pumpen mha. APTase. H2O og CO2 spaltes til<br />
H+ og HCO3- vha. carbon anhydrase.<br />
På den basale del af parietal cellerne sidder 3<br />
receptorer som har en funktion til frigivelse af<br />
H+.<br />
M3 receptorer som stimuleres af ACh (via n.<br />
vagus)<br />
H2 receptorer som stimuleres af histamine, som<br />
bliver frigivet af ECL (enterochromaffin like<br />
cell) i intersticiet.<br />
CCK receptorer som stimuleres af gastrin.<br />
Gastrin = stimulerer syre<br />
sekretion, frigiver histamine fra<br />
ECL celler, regulerer mucose i<br />
corpus.<br />
G celler = producerer gastrin og<br />
frigiver dette ved GRP (gastrin<br />
releasing peptide) fra vagus.<br />
Somatostatin inhiberer<br />
frigivelse af gastrin.<br />
D celler = producerer<br />
somatostatin som inhiberer<br />
gastrin frigivelse både i G celler<br />
og parietal celler samt frigivelse<br />
af histamine i ECL celler.<br />
Omeprezol er en inhibitor for<br />
syresekretion.<br />
Sectin = produceres i S celler og reducere syresekretion ved 3 mekanismer, 1) inhibere gastrin<br />
frigivelse i antrum, 2) stimulere frigivelse af somatostatin, 3) direkte nedregulering af H+ sekretion<br />
i parietal cellerne.<br />
GIP (gastric inhibitory protein) = inhiberer direkte syresekretion i parietal cellerne, og indirekte ved<br />
at inhibere frigivelse af gastrin. Frigiver også insulin fra pancreas.<br />
Prostataglandin E2 = inhiberer syresekretion i parietalceller ved at inhibere histamin sekretion i<br />
ECL.
Syre sekretion sker i 3 faser ved fordøjelse af maden.<br />
Cephal fasen: Denne fase initieres af synken, lugten, smagen og tanken om mad. Dette aktivere<br />
vagus og syre sekretion sker. Dette stimulere sekretion via ACh direkte, stimulerer histamin<br />
sekretion fra ECL, stimulering af GRP til frigivelse af gastrin og inhibereing af D celler.<br />
Denne fase står for 30% af total syre sekretion og det sker inden maden når mavesækken.<br />
Gastriske fase: Føden når mavesækken og stimulerer syre sekretion. Ved distention af<br />
mavesækken igangsættes vagovagal refleksen som sender afferente fibre til medulla oblongata, som<br />
derefter sender efferente informationer til cellerne i mavesækken, som eliciterer syre sekretion.<br />
Peptoner i antrum stimulerer direkte G celler til at frigive gastrin. Peptoner opstår ved at en lav pH<br />
fremmer konvertering af pepsinogen til pepsin, og pepsin nedbryder proteiner til peptoner.<br />
Denne fase står for ca. 50-60% af den totale syresekretion.<br />
Intestinal fasen: De mange peptoner i den proximale del af tyndtarmen, giver også syre sekretion.<br />
Denne fase står for ca. 5-10% af den totale syre sekretion.<br />
Pepsinogen kommer fra hovedcellerne primært og stimuleres af agonister som calcium cAMP og<br />
vigtigst ACh. Pepsinogen omdannes til pepsin ved pH mellem 3-5. Er pH dog under 3-3,5 vil<br />
pepsin være med til at omdanne pepsinogen til pepsin.<br />
Mucus secerneres af tre celler, overflade mucus celler, mucus neck celler og kirtel mucus celler.<br />
Mucin er et molekyle som også secerneres herfra og danner et mucus gel lag som beskytter<br />
overfladen af epithelet.<br />
Dette gel lag fungere som en neutraliserings zone. HCO3- ligger i dette lag, og prøver H+ ioner at<br />
penetrere vil HCO3- gå sammen med H+ og danne H2CO3 CO2+H2O.<br />
Når føden skal passere ind til mavesækken vil LEC og den øvre del af mavesækken afslappes.<br />
Afslapning i fundus reguleres af den vagovagale refleks og kaldes den receptive refleks. Trykket i<br />
mavesækken øges ikke ved fyldning af føde, dette sker først når en hvis tærskelværdi er nået. Dette<br />
skyldes at der sker aktiv dilation i fundus og kaldes en gastrisk tilpasning. Trykket stiger først<br />
omkring 800ml fyldning.<br />
Føden som ligger i corpus bliver skubbet ned i antrum. Her aflukkes det og bliver ”malet”. Kun<br />
partikler mindre end 2mm fortsætter videre i duodenum. Noget af føden passerer tilbage i corpus<br />
igen for at bliver processeret endnu engang, for at opløse det til mindre partikler.
Kap 42<br />
Pancreas saft neutraliserer mavesyren i tyndtarmen, og færdiggører fordøjelsen heri.<br />
Acinar celler: producerer og export af protein. I den apikale del af disse celler finder man zymogen<br />
granula, som indeholder pre-enzymer (amylase & mucin) til fordøjelse af maden. Disse aktiveres<br />
først ved indtræden i tyndtarmen, hvor enterokinase konverterer trypsinogen til trypsin som så<br />
aktiverer disse granula. Man finder to vigtige receptorer på disse celler, CCK receptorer og ACh<br />
(muscarin) receptorer hvorpå der stimuleres sekretion.<br />
Ca2+: CCK & Ach er med<br />
til at stimulere en øget<br />
mængde calcium, som<br />
derefter kan aktivere<br />
calmodulin & PKC til at<br />
frigive sekret.<br />
cAMP: CCK øger cAMP<br />
produktion som videre<br />
aktivere PKA som<br />
stimulerer sekretion.<br />
Sekretin og VIP er også<br />
med til at øge sekretion<br />
via aktivering til cAMP.
Pancreatiske dukt celler: Hovedfunktionen for disse celler er at sekrere HCO3-, som skal gøre<br />
sekretet fra acinar cellerne mere basisk inden de forlader kirtlen. HCO3- kommer to steder fra inden<br />
den forlader den apikale del af cellen ind i lumen. Dels vha. carbonanhydrase (CO2 & OH-) og dels<br />
direkte vha. en Na/HCO3 cotransporter. HCO3- forlader derefter cyosolet ved en Cl-HCO3<br />
exchanger. Det er altså nødvendigt at Cl- er til stede i lumen. Der er to kanaler som hjælper til med<br />
dette ORCC (Outward rectifying Cl Channel, humeralregulation) som er ATP afhængig og CFTR<br />
(cystisk fibrose transmembran regulator, fra CF genet, humeral regulator)kanalen som er cAMP<br />
afhængig. cAMP øges ved at secretin binder til receptoren på den basolaterale del. For at H+ ikke<br />
ophobes i cellen vil det forlade cellen vha. af en H+ pumpe som behøver ATP og en Na/H pumpe.<br />
Glycoproteiner sekreres også fra disse celler.<br />
Pancreas sekrerer ca. 1,5L væske/dag 5-15 g proteiner a 20 forskellige slags som amylase, lipase<br />
proteaser. Under hvile stadiet. Hvor ingen føde indtages vil der være en konstant, men lille<br />
sekretion af enzymer fra pancreas. Ved indtagelse af føde under et måltid vil denne stige 5-20 gange<br />
normalen.<br />
Under et MMC vil sekretionen følges med faserne dvs. i fase II & III vil der ske sekretion.<br />
Telezepine er en hæmmer for sekretion og CCK er en stimulator. Atropin hæmmer sekretion af<br />
enzymer og HCO3-.<br />
Ligesom den gastriske sekretion af HCl som er delt i tre faser, deles sekretion af enzymer også op i<br />
tre faser, den cephale-, gastriske- og intestinale fase.<br />
Cephale fase: Ved lugt og smagen af føden øges sekretionen af enzymer i pancreas via stimulering<br />
af efferente nervefibre til sekretion af ACh som sætter sig på muscarin receptorer i acinar cellerne.<br />
Gastriske fase: Ved tilstedeværelse af føde i maven, sker der pancreas sekretion ved at der frigives<br />
hormoner, stimulering af nerveveje og pH værdien i mavesækken. Stimulering af gastrin i<br />
mavesækken stimuleres også i pancreas under denne fase.<br />
Intestinal fasen: Føde i tyndtarmen stimulerer pancreas sekretion ved tre mekanismer. 1) mavesyre<br />
i duodenum stimulerer S celler som frigiver secretin, som stimulerer dukt celler til at frigive HCO3-<br />
og vand.<br />
2) lipider (monoglycerider) i I celler frigiver CCK som stimulerer acinar celler til at frigive<br />
fordøjelsesenzymer. 3) den samme stimuli som trigger I celler aktiverer vagovagal refleksen til også<br />
at stimulerer acinar cellerne.<br />
Pancreas fungerer også som et reserve lager af enzymer. Det er ikke altid at alle enzymer skal<br />
bruges til at fordøje et måltid, så derfor lagres enzymerne i pancreas, hovedsageligt dem til<br />
kulhydrater og proteiner.<br />
Efter en maximal sekretion af enzymer i pancreas vil lipider i den distale del af tyndtarmen<br />
indhibere denne sekretion som skyldes peptid YY. Somatostation og glucagon kan også virke<br />
inhiberende.<br />
Spytkirtlerne: Den største agonist for spyt sekretion er ACh (M3 receptor) og NA (alpha & beta)<br />
fra parasympaticus og sympaticus.<br />
Øget beta (sympaticus) stimuli giver øget cAMP som stimulerer amylase sekretion hvorimod alpha<br />
øger Ca2+. PArasympaticus fungerer på samme måde som på alpha receptorer.<br />
Spyt dukt celler: absorberer Na, Cl og sekrerer K, HCO3- og H+.<br />
Spyt er med til at nedbryde bakterier så epithelceller ikke beskadiges, det lubrikerer dog også<br />
mundhule og svælg. Proline rige proteiner secerneres også og bruges til at få maden til at glide<br />
lettere ned og beskytter og vedligeholder tænder. Det fjerner desuden også snavs fra smagsløgene,<br />
så man kan smage noget ”nyt”. Spysekretion har en netto sekretion af HCO3- som er med til at gøre<br />
mavesyren mere basisk som vil refluxe op i oesophagus.
Parasympaticus stimuleres ved lugt, duft eller smag (Pavlov). CN. VII går til ganglion<br />
submandibulare og derefter til gl. submandubulare og gl. sublingualis, hvor CN. IX går til ganglion<br />
oticus også til gl. parotidea.<br />
Sympaticus går via ganglion cervicale superior og følges med kar til kirtlerne. Det har også den<br />
effekt at sekrere spyt, men også nedsætte flow modstanden i dukt cellerne.<br />
Kap 43<br />
Tyndtarmen består af villi og lieberkühns krypter. Cellerne i villi er ansvarlig for næring og<br />
elektrolyt absorption og krypterne er ansvarlig for sekretion.<br />
Tyktarmen har ikke villi men et overflade epitel, dog stadig med krypter. De fungerer på samme<br />
måde som i tyndtarmen, dog kun elektrolytter.<br />
Nederst i krypterne ligger der stamceller som konstant danner nye celler. Overfladearealet i<br />
tyndtarmen udgøres af tarmfoldningen, villi og mikrovilli.<br />
Føde = 2L/dag; Spyt = 1½L/dag; Gastrisk sekretion = 2L/dag; Pancreas sekretion = 1½L/dag; Galle<br />
sekretion = ½L/dag; Tyndtarm = 1L/dag sekretion og 6,5L reabsorberes 8,5L/dag passerer lumen i<br />
tyndtarmen; Tyktarmen = 1,9L/dag reabsorberes; Faeces = 200g/dag.<br />
Segmental heterogenitet = Ion transport langs tarmen.<br />
krypt-villus/overflade heterogenitet = Iontransport langs villi eller krypter.<br />
Tyndtarmen er net-absorber for Na, Cl,K, H2O og sekret HCO3-.<br />
Villi og overflade epithel er ansvarlig for absorption af Na+.<br />
Na/K pumpen er ansvarlig for store dele af transporten af natrium over cellen også grundet den<br />
elektrokemiske gradient.<br />
A: Denne Glukose/amino-Na koblede<br />
transporter sker kun i tyndtarmen, som<br />
regel i forbindelse med et måltid, og er<br />
den primære af transporterne.<br />
B: Den øgede sekretion af HCO3- i<br />
lumen fra pancreas mv. øger Na+<br />
absorptionen og stimulerer den apikale<br />
Na-H exhanger. Na-H exhanger på den<br />
basolaterale membran er ikke en del af<br />
transcellulære bevægelse af Na, den<br />
sørger kun for at vedligeholde pH i<br />
cellen.<br />
C: Via en parallel Na-H og Cl-HCO3<br />
exhanger, optager kroppen NaCl<br />
imellem måltiderne. Dette er den<br />
primære mekanisme og sker i ileum og<br />
den proximale del af colon.<br />
D: En direkte kanal for Na+ findes i<br />
den distale del af colon. Stoffer som<br />
aldosterone stimulerer en øget Na+<br />
absorption.
Cl- absorption kan være en ren passiv transport drevet af den elektrokemiske gradient enten<br />
paracellulært eller transcellulært. Der sker primært en paracellulær passiv transport i den proximale<br />
del af tyndtarmen (jejunum). I den proximale del af colon sker det hovedsageligt via en Cl-HCO3<br />
exchanger.<br />
Igennem stortset hele tarmsystemet sker der en lille sekretion af Cl- fra celler i krypterne. Denne er<br />
en aktiv transport og kan fx stimuleres af ACh.<br />
Passiv K+ absorption i jejunm og ileum sker i sammenhæng med vandoptag.<br />
Passiv K+ sekretion som står for størstedelen af den totale net sekretion af K+ i tyktarmen og sker<br />
når lumen har et potentiale på 15-25mV.<br />
Aktiv K+ sekretion sker vha. en NA/K transporter og en Na/K/Cl cotransporter primært i den<br />
proximale colon. K+ sekretion fra den apikale del sker primært kun via Na/K/Cl cotransporter,<br />
Na/K bruges som en genbrugs transporter, hvorpå denne er mest aktiv under når lumen ikke<br />
behøver så meget K+.<br />
Aldosterone: øger passiv sekretion ved at øge Na/K pumpens aktivitet. Netto effekten er at øget<br />
lumen potentialet, så der sker en sekretion. Aldosterone øger også begge transportere på den<br />
apikale og basolaterale membran til aktiv transport af K+.<br />
Angiotensin øger absorption i tyndtarmen af NaCl.<br />
Histamine fra mastceller kan både påvirke direkte på epithelcellerne eller via ENS og derefter til<br />
epithelcellerne.<br />
Agonister til at stimulerer absorption er chorticosteroider og somatostatin.<br />
Kap 44<br />
Kulhydraternes fordøjelse & absorption:<br />
Tyndtarmen kan kun optage monosaccarider. Ca. 45%-60% af kulhydrater er i form af stivelse som<br />
er en polysaccarid som består af amylose og amylopectin. Ca. 30-40% af kulhydrater er i form af<br />
disaccarider som lactose (fra mælk) og sucrose (alm. Sukker). Ca. 5-10% er af monosaccarider som<br />
fructose og glucose. Kostfibre findes som opløselige og uopløseligesom lignin, pectin og cellulose<br />
findes i frugt, grøntsager og korn. Disse kan ikke fordøjes i tyndtarmen men enzymer fra<br />
tyktarmens bakterier kan nedbryde dem til en vis grad, undtagen cellulose.<br />
Amylase i spyt begynder nedbrydning af stivelse ved fødeindtag men stopper når det når<br />
mavesækken, hbor amylase i pancreas færdiggører processen. Det kan ikke nedbryde alpha 1,4 og<br />
alpha 1,6 bindinger.<br />
Lactase nedbryder lactose til glycose og galactose samt alpha 1,4 bindinger. Maltase kan nedbryde<br />
alpha 1,4 bindinger. Sucrase nedbryder sucrose til clucose og fructose. Isomaltase er det eneste<br />
enzym som kan nedbryde alpha 1,6 bindinger.<br />
Glucose og galactose bliver optaget via en Na/glucose transporter (SGLT1) på den apikale<br />
membran, den basolaterale membran bruger en GLUT2 transporter. Fructose kan dog kun optages<br />
på den apikale membran via en GLUT5 transporter. Er Na ikke tilstede vil det forringe<br />
absorptionen.<br />
Protein fordøjelse & absorption: (optag er ca. 70-100g/dag, for lidt)<br />
Proteiner skal nedbrydes fra peptider til aminosyrer. Dette kan ske vha. enzymer i lumen, proteaser<br />
eller via flere membranproteiner. Proteiner kommer både fra føde og fra endogene kilder (nucleus).<br />
Proteiner som kommer fra dyr bliver hurtigere fordøjet end dem fra planter. Ca. 50% af proteiner<br />
kommer fra endogene kilder, som indtræder i tyndtarmen. Det meste af nitrogen føres ud som<br />
fæces.<br />
Protein enzymer forekommer som proenzymer, hvilket betyder at de skal aktiveres først.<br />
Trypsinogen aktiveres via en enteopeptidase (på enterocytter), som er et membran protein, til
trypsin. Trypsin kan derefter aktiverer chymotrypsin, elastase, carboxypeptidase A&B. Der findes<br />
også peptidaser i cytocolet, som kun nedbryder proteiner af di- eller tripeptider.<br />
Enterocytter bruger ca. 10% af de optagede aminosyrer til at syntetiserer proteiner. Der findes ca. 7<br />
apikale transporterer for AA hvor de fleste er Na+ afhængige og ca. 4 basolaterale transportere hvor<br />
3 af dem behøver Na+.<br />
Lipid fordøjelse & absorption: (optag er ca. 140g/dag, bør være under 70g/dag)<br />
Ca. 90% af lipider der optages er triglycerider.<br />
Kød mm. Indeholder mange mættede fedtsyrer hvor grønt indeholder mange umættede fedtsyrer.<br />
5% er phospolipider (membranlipider).<br />
Lipaser nedbryder triglycerider til di- og monoglycerider samt fede syrer. Nedenstående tre figurer<br />
viser transporten af lipider.
Leverens fysiologi (fra R& T)<br />
Leveren er det største orgaan og får ca ¼ af cardiac output. V. Porta afgiver næring fra<br />
tarmsystemet til leveren som derefter optager og lagre dette. Leveren er også med til at regulere<br />
blodglukose niveauet og lipider i blodet i form af VLDL. Mange plasma proteiner bliver også<br />
syntetiseret i leveren.<br />
Anatomi: To hepatocytter ligger sig som regel omkring en galdekanal som er adskildt af et<br />
pericellulært rum ved tight junctions. Galden fra kanalerne tømmer sig i en galde dukt som derefter<br />
vil gå sammen med pancreas dukten og ud i duodenum. Drænagen af galde bliver reguleret af en<br />
spinchter nemlig Oddi’s Sphinchter.<br />
Det perisinusoidale rum også kaldt Disse’s rum separerer sinosoiden med dets endothellvæg fra<br />
hepatocytterne, hvor hepatocytterne har en form for cilier der øger kontakt overfladen til at optage<br />
den næring der udskilles fra sinusoiderne.<br />
I sinusoiderne finder man Kupffer celler som er nogle monocyte-macrophag celler. Disse laver<br />
endocytose på bakterier mv. fra blodet som ikke skal optages i levercellerne.<br />
Stellate celler er celler som indeholder lipid-dråber som oplagrer vitamin A. Under inflammatoriske<br />
processer omdannes disse celler til myofibroblaster som sekrerer type-I-kollagen.<br />
Leverens lymfesystem ligger sig opad centrale vener, v. porta og langs a. hepatica. Størstedelen af<br />
drænagen sker fra sinusoiderne.<br />
Leveren er regenererende og kan både øges i masse eller tabe sin masse ved apoptose. Faktorer som<br />
TGF (transforming), HGF (Hepatic) og EGF (Epidermal) kan stimulere DNA-syntesen. TNF<br />
(tumor necrosis factor) kan forårsage ukontrolleret celledød.<br />
Stoffer som indtages kan være ”giftige” såsom alkohol. For at disse hydrofobe stoffer kan udskilles<br />
via nyrerne som urin, skal disse omdannes til hydrofile stoffer. Konversionen sker ved to faser.<br />
1.fase: Se figur.
Fase 1.<br />
Fase 2: Slutproduktet fra fase 1<br />
undergår yderligere reaktioner så<br />
produktet bliver hydrofilt. Sulfate,<br />
glycin, taurin og glukoron syrer<br />
bruges i denne fase.<br />
Processen i disse faser forringes med<br />
alderen.
Kulhydrat metabolisme:<br />
Glucose optages via fødes og kan lagres i leveren som glycogen cia glycogenesen. Glucose G-6-<br />
P G-1-PUDP glucose glycogen. Lactase og aminosyrer kan danne pyruvate som derefter<br />
også kan lagres som glycogen. Via glycogenolysen kan glycogen omdannes til glucose i hvile<br />
perioder. Insulin er med til at regulerer begge synteseveje.<br />
Både fructose og galactose som er monosaccarider kan også undergå omdannelse til glycogen.<br />
Glyconeogenesen er AA og lactat glycogen. Denne proces stimuleres af glucagon og adrenalin.<br />
Lipid Metabolisme:<br />
Optager frie fedtsyrer og lipoproteiner. Lipider cirkulerer i plasma som lipoproteiner fordi lipider og<br />
vand ikke er blandbare.<br />
Under hvile tilstande bliver fedtsyrer flyttet fra fedtvæv og optaget i leveren. Dette bliver brugt af<br />
hepatocytter til at frigive energi via beta oxidation, til at danne keton stoffer (acetoacetate og betahydroxybutyrate)<br />
syntetiserer triglycerider som er nydvendig til dannelsen af VLDL’s.<br />
Chylomicroner er den letteste af de fire lipoprotein klasser. De bliver dannet i tyndtarmen og i store<br />
mængder under fordøjelsen. Hovedfunktionen af disse er at transportere store mængder af det<br />
absorberede fedt ud i blodbanen.<br />
VLDL er rig på triglycerider (TG) og transporterer mange af disse fra leveren og ud i kroppen. TG<br />
fra VLDL kan bluve nedbrudt af lipoprotein lipase.<br />
LDL transporterer cholesterol ester fra leveren til andre organer.<br />
HDL transporterer cholesterol i perifert væv til leveren.<br />
Reguleringen af sekretion af lipoproteiner fra leveren sker hormonelt vha. østrogen og thyroid<br />
hormoner.
Protein metabolisme:<br />
Kroppen kan syntetisere alle aminosyrer på nær ni.<br />
Leveren syntetiserer mange af kroppens plasma proteiner, hvor albumin er den vigtigst som sørger<br />
for at vedligeholde det kolloid osmotiske tryk. Andre proteiner som fibrinogen, prothrombin,<br />
transferrin, haptoglobin og hemopexin syntetiseres også i leveren.<br />
Efter urea er glutamine den næst vigtigste metabolit til at danne ammoniak.<br />
Vitamin A, D og K bliver lagret i leveren.<br />
Haptoglobin binder frit hæmoglobin i blodet. Hæmoglobin/haptoglobin komplekset fjernes hurtigt i<br />
leveren og bevarer jern i kroppen.<br />
Hemopexin danner kompleks med fri hæm i blodet, og fjernes i leveren.<br />
Transferrin transporterer jern i blodet og vedligeholder homeostasen.<br />
Jern som kommer via transferrin afgives til<br />
hepatocytten og jern lagres som ferritin.<br />
Transferrin receptoren og apotransferrin<br />
gendannes, og apotransferrin kan nu binde<br />
til jern igen. Leveren står som et lager af<br />
jern, andre celler kan også bruge jern fra<br />
transferrin.<br />
Jo mere ferritin i leveren, jo lavere syntese<br />
af transferrin.<br />
Ferroportin eksporterer jern. Hepcidin<br />
inhiberer jern.<br />
Jern optages også via ødelagte røde<br />
blodceller hvor de phagocyteres, og hæm<br />
delen som indeholder jerne frasorteres og<br />
oplagres.<br />
Leveren fungerer også som en forstærkning af hormoner og modificering af disse.<br />
Hormoner bliver desuden også degraderet i leveren.<br />
Hæmatokrose = For meget jern i kroppen.
Galde sekretion:<br />
Leveren sekrerer ca. 600-1200mL/dag galde ind i duodenum. Galde indeholder galde salt, bilirubin<br />
(galde pigment/farve), cholesterol, phospholipider og proteiner.<br />
Gallesyrer og gallesalter:<br />
Gallesyrene produseres i leveren fra kolesterol og betegnes de primære og sekundære. De primære<br />
er cholic acid og chenodeoxycholic acid, og udskilles som konjugater som taurin eller glycin. I<br />
tarmlumen omdannes de primære til de sekundære ved kontakt med tarmens bakterier. De<br />
sekundære er deoksycholic og lithochlic acid.<br />
Ved neutral pH er gallesyrene ionisert og betegnes gallesalt. Gallesalt er ikke fedtopløselige<br />
ligesom som gallesyren, og kan derfor ikke absorberes ved diffusion. Derfor har gallesaltene en<br />
oppgave å utføre i hele tynntarmens lengde før de aktivt suges opp i terminale del av ileum.<br />
Gallesaltene er nødvendig for å fordøye fett og opptak av de fettløslige vitaminene.<br />
Den ene siden av gallesaltmolekylene er negativt ladet selvom at de er hydrofile, mens den andre<br />
enden er hydrofob, og overstiger gallesaltkonsentrasjonen et visst nivå har de en tendens til å danne<br />
en micellestruktur. Triacylglyserider, fosfolipider og kolesterol løser seg i micellens indre<br />
hydrofobe del. Gallesaltene har en emulgerende rolle på fødens lipider, og kan på denne måten<br />
legge forholdene bedre til rette for lipasene (se lipidspaltingen).<br />
Gallesaltene absorberes på ulike måter:<br />
- Ved diffusjon langs hele tynntarmens lengde.<br />
- I den terminale ileum ved en aktiv prosess (langt de fleste på denne måten).<br />
- Bakterier i terminale ileum som omdanner gallesalter til gallesyrer som dermed kan lettere<br />
absorberes.<br />
Både gallesaltene og gallesyrene som suges opp returnerer med v.porta til leveren bundet til<br />
albumin eller HDL hvor de på nytt utskilles med gallen. Denne resirkuleringen kalles det<br />
enterohepatisk kretsløp. Dette er en meget effektiv resirkuleringsmekanisme og sikrer den ønskede<br />
gallesaltmengde som kreves pr.døgn. Vi har ca 2-4 gr gallesalter som sirkulerer 3-16 ganger i dette<br />
kretsløpet for å dekke dagsbehovet som kan komme opp i 30 gr. Til tross for effektive<br />
absorpsjonmekanismer mister vi omkring 500ml pr.døgn i fæces. Tapet dekkes av nysyntese i<br />
leveren.<br />
Gallesaltene transporteres aktivt fra levercellen og over i gallen. Sekretet levercellene produserer<br />
har tilnærmet lik ionesammensettning som blodet, og som hos pankreas forandres volumet og<br />
ionesammensetningen av sekretet når det strømmer gjennom utførselsgangene. HCO3 - transporteres<br />
aktivt over i gallen, og dermed kan HCO3 - konsentrasjonen bli høyere enn i blodet.<br />
Reguleringen av gallesekresjon: sekresjon av galle stimuleres gjennom økt parasympatisk aktivitet<br />
i vagusnerven og gjennom påvirkning av sekretin. Den viktigste faktoren er likevel levercellens<br />
tilgang på gallesalter via det enterohepatiske kretsløp.<br />
Jo høyere konsentrasjon av gallesalter er i blodet, jo mer gallesalter utskilles av levercellene, og<br />
desto større blir gallevolumet. Plasmakonsentrasjonen av gallsalter er høyest, og gallesekresjonen<br />
størst, når gallesaltene resirkulerer mellom leveren og tynntarmen etter et måltid.<br />
Mellom et måltid lagres og konsentreres gallen i galleblæren, slik at plasmakonsentrasjonen er lav,<br />
og dermed er sekresjonen lav, men levercellens gallesyreproduksjon er høy.
Konsentreringen av gallen forgår ved at Na + og Cl - transporteres aktivt ut av blæren og over i blodet,<br />
mens vann følger etter ved osmose. Etter et måltid trekker galleblæren seg sammen, samtidig som<br />
sphincter oddi ved innmunningen til duodenum slapper av. Denne kontraksjonen utløses av<br />
kolecystokinin. Slik får kolecystokinin en dobbeltrolle ved at den både sørger for at fettspaltende<br />
enzymer fra pancreas og galle fra leveren kommer over i tarmen, slik at fettet fordøyes.<br />
Kolecystokinin frigis når fettsyrer påvirker kolecystokininholdige epithelceller i duodenum, og slik<br />
faller konsentrasjonen av kolecystokinin vekk når fettet er fordøyd.<br />
Samspillet mellom ventrikkelaktivitet og sekresjon av bukspytt og galle.<br />
En økt aktivitet i vagusnerven utløser en økt produksjon av saltsyre og pepsinogen i ventrikkelen,<br />
og økt produksjon av bukspyttenzymer og en liten utskillelse av galle fra levercellene allerede før<br />
maten har kommet i ventrikkelen. Slik blir fordøyelses organene ”forberedt”. Når maten kommer<br />
ned i magesekken skjer denne stimuleringen enda kraftigere, gjennom de lange refleksene.<br />
Etterhvert som kymus kommer over i duodenum, stimulerer den lave pH sammen med fett og<br />
peptider til utskillelse av kolecystokinin og sekretin, slik at økte mengder galle og bukspytt kommer<br />
over i duodenum. Samtidig hemmes ventrikkeltømmingen. Dette samspillet er viktig for at kymus<br />
skal holde seg tilstrekkelig tid i ventrikkelen slik at proteiner og karbohydrater kan fordøyes litt der,<br />
samt at hastigheten gjør det mulig å holde en ønskelig pH i duodenum.
Fra holdtimen 1.<br />
Erytrocyt optages af makrofag. Hæmoglubin deles i Hæm og Globin. Hæm bliver til Fe3+ og<br />
Bilirubin som gåt sammen med albumin og danner et kopleks. Globin nedbrydes til aminosyrer.<br />
B-A koplekset transpoteres til leveren via. V.portae som optages i hepatocytten, som sker via<br />
QATP-1 transpotøren. Herefter sker der en konjugering, hvor bilirubin går sammen med<br />
glucoronsyre som derefter transporteres ud i galdegangen ved en MRP2 transporter. Derefter<br />
oplagres det enten i galdeblæren som galde eller udskilles i tarmen, hvor enzymer nedbryder det til<br />
urobilinogen som videre dannes til urobilin og udskilles i nyrer eller som sterobilin som udskilles<br />
via fæces. Der sker dog primært en reabsorption af bilirubin.<br />
Icterus = ↑bilirubin som giver gul hud+gule slimhinder = gulsot.<br />
Kliniske aspekter<br />
1. ↓albumin (præhepatisk,intrahepatisk; ukonjugeret)<br />
2. ↓optagelse i hepatocytten (Intrahepatisk; ukonjugeret)<br />
3. ↓konjugering (intrahepatisk; konjugeret)<br />
4. Okklusion (galdesten) tilbageflux i leveren (posthepatisk; konjugeret)<br />
5. ↓transport til galdekapillær (intrahepatisk; konjugeret)<br />
6. Pancrea/tarmlidelse (posthepatisk; konjugeret)
7. ↑henfald af erytrocytter (præhepatisk; ukonjugeret)<br />
Fra holdtimen 2<br />
Enterocytter: Ferritin (kan binde 4500 Jern atomer)<br />
Hepatocytter: Ferritin (primære lager), Hæmosiderin.<br />
Makrofag: Ferritin<br />
Aconitase: inhibere transkriptase af jern, men initiere brug af jern.
1. B12 indtages<br />
2. B12 skilles fra føde grundet pepsin<br />
3. B12 binder til haptocorrin (for at overleve i det sure pH)<br />
3a. IF dannes og udskilles fra parietalceller<br />
4. Proteaser adskiller B12 & haptocorrin (Duodenum)<br />
5. Der dannes IF-B12 kompleks<br />
6. Receptor medieret endocytose.<br />
Omdannelsen fra homocystin til metionin sker ved en tilkobling af en metylgruppe vha. HMmetyltransferase<br />
hvor B12 fungere som coenzym.<br />
Folat danner erytrocytter. Mangler B12, vil folat dermed tage dennes plads og erytrocyt dannelsen<br />
forringes.<br />
Skal man udregne pH udfra HCL koncentrationen i mol/L ved at tage –log [H3O+] så hvis HCL er<br />
0,1mol/L vil pH blive –log[0,1] = 2<br />
2L væske – spyt 1L – Mavesaft 2L – galde ½L – pancreas 1½L – tyndtarm optag 7-8L – Colon<br />
optag 1-2L<br />
Den endokrine pancreas. (ca. 10% af pancreas celler)<br />
Hormonerne Insulin, glucagon og somatostatin udskilles fra Langerhanske øer. Man finder<br />
hovedsageligt disse ø-grupper af celler i den bagerste del af pancreas. Øerne består af 4 hormon<br />
producerende celletyper. Alpha (glucagon), beta (insulin), delta (somatostatin) og f (pancreatiske<br />
polypeptider) celler. Disse celler er forbundet med både gap og tight junctions.<br />
Øerne er forbundet til ANS og regulerer deres sekretion herfra.<br />
Beta celler svarer til 70-90% af cellerne i de langerhanske øer. Blodforsyningen kommer indenfra<br />
og ud til periferien.<br />
Ved øget blodglucose stiger sekretionen af insulin. Andre faktorer som AA arginin og fedtsyrer (16-<br />
18 C) stimulerer også sekretionen af insulin. Somatostatin og adrenalin er en inhibitor for insulin.<br />
Anderledes er det for glycagon, hvor dette stimuleres ved lavt blodsukker. Dog stimuleres det ved<br />
arginine og inhiberes ved somatostation som ved insulin.<br />
Insulin lagrer glukose vha. GLUT4 transportere som primært findes i skeletmuskulatur og fedtvæv.<br />
Disse transportører rekrutteres fra vesikler ved inslulin stimulering. Så der er både nogle som sidder<br />
fast på selve membranen, og flere kommer til ved insulin stimulering.
Insulin promoverer glycogen lagring i væv vha. To enzymer. Glycogen synthase aktiveres og<br />
dermed inaktiveres glycogen phosphorylase.<br />
Insulin inhiberer hormone-sensitiv lipase som dermed indhiberer nedbrydelse af triglycerider.<br />
Glucagon er med til at initiere nedbrydelsen af glycogen til glucose, via binding til en membran<br />
receptor som igangsætter en kaskade reaktion. Glucagon er også med til at stimulere<br />
glyconeogenesen til dannelse af glucose fra AA og samtidig udskillelse af Urea.<br />
Clycagon aktiverer lipolysen i leveren (dog meget få fedtceller i leveren). Sidst aktiverer glucagon<br />
ketogenesen som frigiver ketoner.<br />
Fordi Insulin og glucagon er modsætninger bestemmes den metaboliske status ved en I/G ratio.<br />
Denne ratio ligger i fødestadiet på ca 30, hvor den i faste perioder er på 2 og ved længerevarig faste<br />
ned til 0,5.
Glukose stimulerer insulin sekretion<br />
via Ach og CCK. Antibiotika<br />
hæmmer K+ kanaler (KATP<br />
blokkere). Disse sænker<br />
hvilemembranpotentialet og AP<br />
sker ikke så hyppigt, hvilket sænker<br />
udskillelsen af insulin. Findes også<br />
K+ openers.<br />
Insulin og c-peptid findes i molær<br />
ratio 1:1 i modne granula<br />
C-peptidet udskilles via urin.<br />
Leveren: GLUT-2 transporter (ikke sensitiv for insulin. Insulin øger glycogenesen, hæmmer<br />
glycogenolysen, øger glycolysen og hæmmer glyconeogenesen.<br />
Muskel: øger dannelsen af GLUT-4 transportere- ↑glycogen.<br />
Fedtceller: øger dannelsen af GLUT-4 transportere - ↑ lipogenese<br />
Diabetes Mellitus:<br />
Type I: B cellerne kan ikke producere insulin. Autoimmun lidelse hvor immunforsvaret ødelægger<br />
disse celler. Træning er vigtigt for diabetikere da glucosen optages af musklerne.<br />
Type II: Denne type diabetes er det ikke B cellerne der har en dysfunktion, men targetcellernes<br />
insulinreceptor der ikke reagerer på glucose optaget.
Fra holdtimen:<br />
1time efter et måltid: Glucose transport (GT) stiger i muskel og fedt, glykolyse (GL) i lever stiger<br />
pga. Insulin, gluconeogenese(GNG) bliver nedsat pga. Lavt glucagon niveau og insulin hæmmer,<br />
oget glykogenese(GG) pga. Øget insulin, nedsat glycogenolyse(GGL), øget lipogenese(LG) pga<br />
insulin stimulering (de novo syntese, når lageret af glycogen er opfyldt), ingen lipolyse(LL) da det<br />
hæmmes af insulin, ingen ketogenese.<br />
Faste natten over. Ingen GT, -GL, +GNG pga. ↑glucagon, -GG, +GGL, -LG, +LL.<br />
Ubehandlet Type I diabetes: øger glucose, fedtsyrer og VLDL i blodet. – GT,GL,GG,GGN,LG. +<br />
GNG,LL og ketogenese.<br />
Type II er som Type I dog mere moderat.
Lactation:
Sekretindhold i mælk: Proteiner – lactalbumin, casein, IgA. Lactose, vand, mælkelipider,<br />
elektrolytter.
Mæthedscenteret (satiety center) er lokaliseret i hypotalamus i VMN. Dette center styrer kontrollen<br />
af føde optag. En læsion på dette center kan give en hæmning af mæthedsfornemmelsen og derfor<br />
blive ved med at spise (Hyperphagi).<br />
Sultcenteret (Hunger center) er også lokaliseret i den laterale del af hypotalamus LHA. Stimuleres<br />
dette, bliver man mere sulten. Sker der dog en læsion af denne, vil der ske fuldstændigt ophør af<br />
føde indtag (aphagi).<br />
To former for neurotransmittere styrer vores føde indtag. Orexigene faktorer som er ”appetitvækkende”<br />
falder under kategori med LHA, og anoreigene faktorer falder under VMN.<br />
Kortidsregulering: Hypoglykæmi (lavt blodsukker
Langtidsregulering: Leptin som bliver udkildt af fedtceller er med til at inhibere LHA og stimulere<br />
VMN.<br />
Hyperplastisk fedme: øget antal af fedtceller. Normalt udvikler man kun fedtceller som barn og<br />
beholder dem man har i voksenlivet.<br />
Hypertrofisk fedme: øget størrelse på fedtceller. Sker kun i voksenlivet. Kan reguleres ved øget<br />
aktivitet, da visse hormoner stimuleres. Kan skyldes fejl på leptin receptorer.<br />
Hvile metabolisk aktivitet kræver 2100kcal/dag (ved person på 70kg).