colleges 3 en 4 - Biochemistry
colleges 3 en 4 - Biochemistry
colleges 3 en 4 - Biochemistry
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
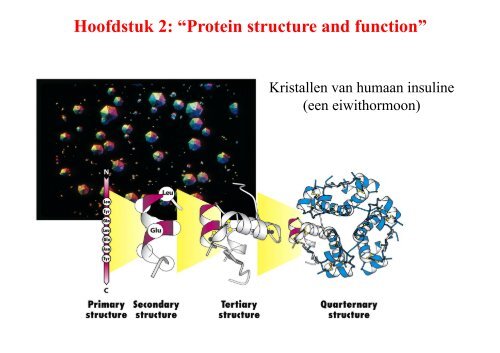
Hoofdstuk 2: “Protein structure and function”<br />
Kristall<strong>en</strong> van humaan insuline<br />
(e<strong>en</strong> eiwithormoon)
Onderwerp<strong>en</strong><br />
• Eiwitt<strong>en</strong> zijn lineaire polymer<strong>en</strong> die opgebouwd zijn uit 20 verschill<strong>en</strong>de<br />
aminozur<strong>en</strong><br />
• De primaire, secondaire, tertiaire <strong>en</strong> quaternaire structuur van e<strong>en</strong> eiwit<br />
• De aminozuurvolgorde van e<strong>en</strong> eiwit bepaalt haar driedim<strong>en</strong>sionale<br />
structuur <strong>en</strong> daarmee ook haar functie (katalyse, transport van bijvoorbeeld<br />
O 2 , mechanische sterkte, immuunbescherming, beweging, transmissie van<br />
z<strong>en</strong>uwimpuls<strong>en</strong>, controle van groei <strong>en</strong> differ<strong>en</strong>tiatie, ....)
Eiwitt<strong>en</strong> zijn opgebouwd uit e<strong>en</strong> repertoire van 20 aminozur<strong>en</strong><br />
(4)<br />
(3)<br />
(1) (2)<br />
• Algem<strong>en</strong>e naamgeving <strong>en</strong> stereo-isomer<strong>en</strong> van aminozur<strong>en</strong>: c<strong>en</strong>traal<br />
koolstofatoom (C α ), amino-groep (NH 3 + ), carboxylgroep (COO - ) <strong>en</strong><br />
restgroep (R)<br />
• Aminozur<strong>en</strong> zijn chiraal; in eiwitt<strong>en</strong> zijn alle<strong>en</strong> L-aminozur<strong>en</strong> ingebouwd
• Grootte<br />
• Vorm<br />
• Lading<br />
De zijket<strong>en</strong>s van de 20 aminozur<strong>en</strong> verschill<strong>en</strong> in:<br />
• De mogelijkheid tot het vorm<strong>en</strong> van e<strong>en</strong> waterstofbrug<br />
• Hydrofoob karakter<br />
• Chemische reactiviteit
De ionisatietoestand van aminozur<strong>en</strong> als functie van de pH
Indeling aminozur<strong>en</strong> op basis van de chemische eig<strong>en</strong>schapp<strong>en</strong><br />
van hun zijket<strong>en</strong>s<br />
• Alifatisch: (Gly), Ala, Val, Leu, Ile, Met<br />
• Cyclisch: Pro<br />
• Aromatisch: Phe, Trp<br />
• Alifatische hydroxylgroep: Ser, Thr<br />
• Aromatische hydroxylgroep: Tyr<br />
• Carboxamide: Asn, Gln<br />
• Sulfhydrylgroep: Cys<br />
• Basische groep: Lys, Arg, His<br />
• Carboxylgroep: Asp, Glu<br />
Hydrofoob met niet-polaire zijket<strong>en</strong>s<br />
Polair (maar ongelad<strong>en</strong>)/hydrofiel<br />
Positief gelad<strong>en</strong>/hydrofiel<br />
Negatief gelad<strong>en</strong>/hydrofiel
Makkelijk ioniseerbare groep<strong>en</strong> in eiwitt<strong>en</strong><br />
Table 2.1
• Alifatisch<br />
• Aromatisch<br />
• Hydrofobiciteit<br />
• Hydrofiel<br />
• Waterstofbrugvorming<br />
• Alifatische hydroxylgroep<br />
• Sulhydrylgroep<br />
• Zure groep<br />
• Basische groep<br />
Begripp<strong>en</strong> die je di<strong>en</strong>t te k<strong>en</strong>n<strong>en</strong>:<br />
Aminozur<strong>en</strong> werd<strong>en</strong> al miljard<strong>en</strong> jar<strong>en</strong><br />
geled<strong>en</strong> gevormd<br />
(voordat lev<strong>en</strong> ontstond)<br />
De veelzijdigheid aan eig<strong>en</strong>schapp<strong>en</strong><br />
mak<strong>en</strong> de 20 gebruikte aminozur<strong>en</strong><br />
geschikt als bouwst<strong>en</strong><strong>en</strong> voor functioneel<br />
diverse eiwitt<strong>en</strong>, die het verloop van vele<br />
biologische process<strong>en</strong> mogelijk mak<strong>en</strong>
Aminozur<strong>en</strong> die ongeschikt zijn voor eiwitt<strong>en</strong><br />
• Homoserine (<strong>en</strong> homocysteine) zijn waarschijnlijk in de evolutie<br />
uitgeslot<strong>en</strong> geraakt omdat de bijbehor<strong>en</strong>de zijket<strong>en</strong>s ongew<strong>en</strong>ste<br />
nev<strong>en</strong>reacties gev<strong>en</strong> die de functionaliteit van eiwitt<strong>en</strong> beperk<strong>en</strong><br />
• Deze nev<strong>en</strong>reacties tred<strong>en</strong> niet op bij gebruik van serine (<strong>en</strong> cysteine)
De primaire structuur van e<strong>en</strong> eiwit is de volgorde waarin<br />
aminozur<strong>en</strong> via peptidebinding<strong>en</strong> aan elkaar gekoppeld zijn<br />
• E<strong>en</strong> peptidebinding is kinetisch zeer stabiel (lev<strong>en</strong>sduur ±1000 jaar), maar<br />
het bov<strong>en</strong>staande ev<strong>en</strong>wicht ligt aan de kant van de vrije aminozur<strong>en</strong><br />
(thermodynamisch labiel). Om de vorming van e<strong>en</strong> peptidebinding toch<br />
mogelijk te mak<strong>en</strong> vereist ‘input’ van vrije <strong>en</strong>ergie.<br />
• E<strong>en</strong> peptidebinding wordt gevormd binn<strong>en</strong> het ribosoom door gebruik te<br />
mak<strong>en</strong> van geactiveerde aminozur<strong>en</strong> (die zijn gebond<strong>en</strong> aan e<strong>en</strong> tRNAmolecuul)<br />
• Aminozur<strong>en</strong> word<strong>en</strong> geactiveerd door de activatiereactie te koppel<strong>en</strong> aan<br />
de hydrolyse van ATP (tot AMP <strong>en</strong> 2P i )
Activatie van aminozur<strong>en</strong> <strong>en</strong> vorming van peptidebinding<strong>en</strong><br />
Aminoacyl-tRNA synthetase:<br />
Aminozuur + ATP aminoacyl-AMP + PPi Aminoacyl-AMP + tRNA aminoacyl-tRNA+ AMP<br />
PP i + H 2 O 2 P i<br />
Aminozuur + ATP + tRNA + H 2 O aminoacyl-tRNA + AMP + 2P i<br />
In het ribosoom:
E<strong>en</strong> polypeptideket<strong>en</strong> heeft polariteit<br />
peptide-<br />
binding<br />
Leu-<strong>en</strong>kefaline: e<strong>en</strong> opioïde dat de waarneming van pijn <strong>en</strong> emoties moduleert
E<strong>en</strong> polypeptideket<strong>en</strong> heeft e<strong>en</strong> rugg<strong>en</strong>graat <strong>en</strong> zijket<strong>en</strong>s<br />
R 1 -R 5 : zijket<strong>en</strong>s<br />
: peptidebinding<br />
Elk eiwit heeft e<strong>en</strong> unieke <strong>en</strong> precies gedefinieerde aminozuursequ<strong>en</strong>tie
De (reversibele) vorming van e<strong>en</strong> cystine koppelt del<strong>en</strong> van e<strong>en</strong><br />
polypeptideket<strong>en</strong> coval<strong>en</strong>t aan elkaar<br />
O2 + 2H + + 2e- H2O2 Zuurstof oxideert cysteines<br />
tot cystines<br />
Ribonuclease bevat vier cystines
Polypeptideket<strong>en</strong>s zijn flexibel, maar niet alle conformaties zijn<br />
mogelijk<br />
Door haar dubbele bindingskarakter is de peptidebinding vlak. Deze<br />
eig<strong>en</strong>schap beperkt het aantal mogelijke conformaties van de eiwitrugg<strong>en</strong>graat.
De cis- <strong>en</strong> transconformatie van e<strong>en</strong> peptidebinding<br />
Om sterische hindering te voorkom<strong>en</strong> zijn bijna alle peptide-binding<strong>en</strong> in eiwitt<strong>en</strong><br />
in de transvorm
De cis- <strong>en</strong> transconformatie van e<strong>en</strong> peptidebinding<br />
Proline<br />
In het geval van X-Pro peptidebinding<strong>en</strong> kom<strong>en</strong> cis-conformaties vaak voor,<br />
omdat er zowel bij de trans- als bij de cisvorm sprake is van sterische hinder
De driedim<strong>en</strong>sionale structuur van e<strong>en</strong> polypeptideket<strong>en</strong> kan<br />
beschrev<strong>en</strong> word<strong>en</strong> middels de hoek<strong>en</strong> φ (phi) <strong>en</strong> ψ (psi) rond<br />
het C α -atoom van elk aminozuur<br />
α α<br />
φ ψ φ ψ<br />
α<br />
T<strong>en</strong> gevolge van het <strong>en</strong>kelvoudige bindingskarakter van de binding tuss<strong>en</strong> N<br />
<strong>en</strong> C α , <strong>en</strong> van de binding tuss<strong>en</strong> C α <strong>en</strong> C=O, is er vrijheid van rotatie rond deze<br />
binding<strong>en</strong> (gespecificeerd door ϕ <strong>en</strong> ψ, respectievelijk)
Secundaire structuurelem<strong>en</strong>t<strong>en</strong> binn<strong>en</strong> eiwitt<strong>en</strong><br />
E<strong>en</strong> polypeptideket<strong>en</strong> vouwt zich op na haar synthese. In e<strong>en</strong> apolaire<br />
micro-omgeving gebeurd dit opvouw<strong>en</strong> dusdanig dat de hydrofobe<br />
zijgroep<strong>en</strong> zich in het binn<strong>en</strong>ste van e<strong>en</strong> eiwit bevind<strong>en</strong> (het hydrofobe<br />
effect) <strong>en</strong> dat er zich er tuss<strong>en</strong> de amino- <strong>en</strong> carboxylgroep<strong>en</strong> van e<strong>en</strong><br />
polypeptideket<strong>en</strong> zoveel mogelijk waterstofbrugg<strong>en</strong> vorm<strong>en</strong>, waarbij<br />
regelmatige, goed gepakte (van der Waals interactie), structur<strong>en</strong> ontstaan:<br />
• α-helices<br />
• β-sheets<br />
• β-turns <strong>en</strong> loops<br />
Specifieke aminozuurvolgordes gev<strong>en</strong> aanleiding tot de vorming van:<br />
• α-helixachtige coiled coil<br />
• collage<strong>en</strong> triple helix
4<br />
1<br />
5<br />
3<br />
2<br />
De α-helix<br />
Per aminozuur e<strong>en</strong> stijging van 1.5 Å langs de helix-as <strong>en</strong> e<strong>en</strong> draaiing van<br />
100 grad<strong>en</strong>. Gevolg: per 3.6 aminozuur 360 grad<strong>en</strong> gedraaid <strong>en</strong> 5.4 Å<br />
gesteg<strong>en</strong> langs de helix-as.
De β-sheet<br />
De afstand tuss<strong>en</strong> aminozur<strong>en</strong> langs de as van de ket<strong>en</strong> van e<strong>en</strong> β-str<strong>en</strong>g is<br />
±3.5 Å in plaats van 1.5 Å zoals geobserveerd voor e<strong>en</strong> α-helix<br />
E<strong>en</strong> antiparallelle β-sheet E<strong>en</strong> parallelle β-sheet
“Reverse turn”<br />
“Reverse turns” <strong>en</strong> “loops”<br />
“Loops” op het oppervlak van e<strong>en</strong><br />
deel van e<strong>en</strong> antilichaammolecuul<br />
(loops zijn uitgebreider dan “reverse turns”)<br />
“Reverse turns” <strong>en</strong> “loops” bevind<strong>en</strong> zich altijd aan het oppervlak van eiwitt<strong>en</strong><br />
<strong>en</strong> spel<strong>en</strong> e<strong>en</strong> rol bij interacties met andere eiwitt<strong>en</strong> <strong>en</strong> molecul<strong>en</strong>
Vezelachtige eiwitt<strong>en</strong> gev<strong>en</strong> structurele ondersteuning aan cell<strong>en</strong><br />
<strong>en</strong> weefsels: α-keratine<br />
“α-helical coiled coil”<br />
“heptad repeat”<br />
• α-keratine is e<strong>en</strong> voorbeeld van e<strong>en</strong> “α-helical coiled coil” eiwit, waarbij twee αhelices<br />
om elkaar he<strong>en</strong> gewikkeld zijn<br />
• De helices interacter<strong>en</strong> via ionog<strong>en</strong>e, van der Waals <strong>en</strong> hydrofobe interacties<br />
• Het gevolg is dat per volledige draaiing van elk der helices je 3.5<br />
aminozuurresidu<strong>en</strong> opschuift in plaats van 3.6, zoals bij de normale α-helix<br />
• Keratine heeft e<strong>en</strong> 7-residue “heptad repeat”, die specifieke interacties tuss<strong>en</strong> de<br />
α-helices mogelijk maakt<br />
• De α-helices kunn<strong>en</strong> via disulfidebrugg<strong>en</strong> gekoppeld word<strong>en</strong> (har<strong>en</strong> <strong>en</strong> wol<br />
(flexibel): weinig disulfides; hor<strong>en</strong>s, hoev<strong>en</strong>, klauw<strong>en</strong> (star): veel disulfides)
Vezelachtige eiwitt<strong>en</strong> gev<strong>en</strong> structurele ondersteuning aan<br />
cell<strong>en</strong> <strong>en</strong> weefsels: collage<strong>en</strong><br />
13<br />
• Collage<strong>en</strong> bevat veel glycine, proline <strong>en</strong> hydroxyproline (Hyp). Elk derde<br />
aminozuur is e<strong>en</strong> glycine.<br />
• Collage<strong>en</strong> is het meest voorkom<strong>en</strong>de eiwit in zoogdier<strong>en</strong> (huid, bott<strong>en</strong>,<br />
pez<strong>en</strong>, kraakbe<strong>en</strong>, tand<strong>en</strong>) <strong>en</strong> heeft e<strong>en</strong> “triple helix” structuur
Structuur van collage<strong>en</strong><br />
• Door sterische hinder tuss<strong>en</strong> de (hydroxy)prolines vouwt de polypeptide-ket<strong>en</strong><br />
zich op tot e<strong>en</strong> helixstructuur<br />
• Er zijn ge<strong>en</strong> waterstofbrugg<strong>en</strong> binn<strong>en</strong> de polypeptideket<strong>en</strong> zelf<br />
• Drie str<strong>en</strong>g<strong>en</strong> draai<strong>en</strong> om elkaar <strong>en</strong> vorm<strong>en</strong> zo e<strong>en</strong> superhelixkabel die<br />
gestabiliseerd wordt door waterstofbrugg<strong>en</strong> tuss<strong>en</strong> de ket<strong>en</strong>s<br />
• De hydroxylgroep van hydroxyproline maakt extra waterstofbrugg<strong>en</strong> mogelijk,<br />
die ess<strong>en</strong>tieel voor de sterkte van collage<strong>en</strong> zijn (afwezigheid à scheurbuik)
In water oplosbare eiwitt<strong>en</strong> vouw<strong>en</strong> zich op tot compacte<br />
structur<strong>en</strong> met e<strong>en</strong> hydrofobe kern<br />
Modell<strong>en</strong> voor de driedim<strong>en</strong>sionale structuur van myoglobine<br />
(O 2 -transport in spier<strong>en</strong>; vereist aanwezigheid van e<strong>en</strong> heemgroep in het eiwit;<br />
het eerste eiwit waarvan de 3D-structuur is opgehelderd (1958))
De verdeling van aminozuurresidu<strong>en</strong> in myoglobine<br />
Ruimte vull<strong>en</strong>d model: hydrofobe<br />
(geel), gelad<strong>en</strong> (blauw) <strong>en</strong> andere<br />
(wit) aminozuurresidu<strong>en</strong><br />
Dwarsdoorsnede: hydrofobe<br />
residu<strong>en</strong> zitt<strong>en</strong> aan de<br />
binn<strong>en</strong>kant
Sommige membraaneiwitt<strong>en</strong> vorm<strong>en</strong> uitzondering<strong>en</strong> op de<br />
regel: “hydrofobe zijket<strong>en</strong>s zijn opgeborg<strong>en</strong> in het inw<strong>en</strong>dige<br />
van e<strong>en</strong> eiwit <strong>en</strong> hydrofiele zijket<strong>en</strong>s bevind<strong>en</strong> zich aan het<br />
oppervlak”<br />
De binn<strong>en</strong>stebuit<strong>en</strong> aminozuurresidu<strong>en</strong>verdeling in porine
Motiev<strong>en</strong> <strong>en</strong> domein<strong>en</strong><br />
Het CD4 eiwit bestaat uit vier gelijke<br />
domein<strong>en</strong><br />
• Bepaalde combinaties van secundaire structuurelem<strong>en</strong>t<strong>en</strong> word<strong>en</strong> veel gevond<strong>en</strong><br />
<strong>en</strong> vervull<strong>en</strong> vaak dezelfde functies (bijvoorbeeld het helix-turn-helix motief, dat<br />
in verschill<strong>en</strong>de DNA-bind<strong>en</strong>de eiwitt<strong>en</strong> wordt gevond<strong>en</strong>)<br />
• Compact gevouw<strong>en</strong> globulaire e<strong>en</strong>hed<strong>en</strong> die verschill<strong>en</strong>de mal<strong>en</strong> voorkom<strong>en</strong> in<br />
e<strong>en</strong> eiwit (verbond<strong>en</strong> door bijvoorbeeld flexibele polypeptides) word<strong>en</strong> domein<strong>en</strong><br />
g<strong>en</strong>oemd (bijvoorbeeld te vind<strong>en</strong> in het celoppervlakte-eiwit CD4)
Quaternaire structuur: ruimtelijke organisatie van meerdere<br />
polypeptideket<strong>en</strong>s die geassembleerd zijn tot e<strong>en</strong><br />
multisubunitstructuur<br />
Voorbeeld: het Cro eiwit van bacteriofaag λ is e<strong>en</strong> dimeer van id<strong>en</strong>tieke<br />
sube<strong>en</strong>hed<strong>en</strong> met e<strong>en</strong> tweevoudige symmetrie
Quaternaire structur<strong>en</strong><br />
Hemoglobine is e<strong>en</strong> α 2 ß 2 tetrameer De mantel van het humane<br />
rhinovirus (à verkoudheid) bestaat<br />
uit 60 kopieën van elk van de vier<br />
sube<strong>en</strong>hed<strong>en</strong> (α 60 β 60 γ 60 δ 60 )
A! K! I!<br />
G!<br />
L! F! F!<br />
G!<br />
Eiwitvouwing<br />
S! N!<br />
T! G! K! T!<br />
?!<br />
• Hoe verkrijgt e<strong>en</strong> eiwit haar ingewikkelde driedim<strong>en</strong>sionale structuur?<br />
• Wat is de relatie tuss<strong>en</strong> de 1-dim<strong>en</strong>sionale aminozuurvolgorde <strong>en</strong> de 3dim<strong>en</strong>sionale<br />
structuur van e<strong>en</strong> eiwit?
Eiwitt<strong>en</strong> kunn<strong>en</strong> in vitro ontvouw<strong>en</strong> word<strong>en</strong><br />
ontvouwingsmiddel<strong>en</strong><br />
β-mercapto-ethanol<br />
Eiwitt<strong>en</strong> kunn<strong>en</strong> ontvouw<strong>en</strong> word<strong>en</strong> door gebruik te mak<strong>en</strong> van:<br />
- ontvouwingsmiddel<strong>en</strong> (zoals ureum <strong>en</strong> guanidiniumchloride): die niet<br />
coval<strong>en</strong>te interacties in eiwitt<strong>en</strong> verbrek<strong>en</strong><br />
- <strong>en</strong> β-mercapto-ethanol: wanneer disulfidebrugg<strong>en</strong> verbrok<strong>en</strong> di<strong>en</strong><strong>en</strong> te<br />
word<strong>en</strong>
Reductie <strong>en</strong> d<strong>en</strong>aturatie van ribonuclease<br />
• Eiwitontvouwing kan je volg<strong>en</strong> met spectroscopische (bijvoorbeeld tryptofaanfluoresc<strong>en</strong>tie,<br />
circulair dichroïsme) of fysische (bijvoorbeeld to<strong>en</strong>ame in<br />
viscositeit, calorimetrie) methodes<br />
• Nadat e<strong>en</strong> eiwit met 8 M ureum <strong>en</strong> β-mercapto-ethanol is ontvouw<strong>en</strong> is haar<br />
<strong>en</strong>zymactiviteit verdw<strong>en</strong><strong>en</strong>
Kan e<strong>en</strong> ged<strong>en</strong>atureerd eiwit weer terugvouw<strong>en</strong> naar haar goed<br />
gevouw<strong>en</strong> 3D-structuur?<br />
• Verwijdering van ureum <strong>en</strong> β-mercapto-ethanol, terwijl oxidatie aan de lucht<br />
plaats vindt van de gereduceerde SH-groep<strong>en</strong>, resulteerde in de spontane<br />
hervouwing van ribonuclease (<strong>en</strong> andere <strong>en</strong>zym<strong>en</strong>) naar de actieve goed<br />
gevouw<strong>en</strong> toestand (Nobelprijs in de Chemie 1972: Chris Anfins<strong>en</strong>)<br />
• De informatie die codeert voor het vouw<strong>en</strong> naar de natieve, actieve structuur ligt<br />
dus opgeslag<strong>en</strong> in de aminozuurvolgorde van e<strong>en</strong> eiwit<br />
C<strong>en</strong>traal dogma in de Biochemie:<br />
de aminozuurvolgorde bepaalt de conformatie van e<strong>en</strong> eiwit
Verkeerde disulfidebrugg<strong>en</strong> kunn<strong>en</strong> gevormd word<strong>en</strong> tijd<strong>en</strong>s<br />
eiwitvouwing<br />
• Wanneer ontvouw<strong>en</strong> ribonuclease geoxideerd<br />
wordt voor verwijdering van ureum,<br />
krijg je na vouwing slechts 1% van de<br />
originele activiteit, omdat maar 1% van de<br />
eiwitmolecul<strong>en</strong> natief geword<strong>en</strong> is. De<br />
andere molecul<strong>en</strong> kunn<strong>en</strong> ge<strong>en</strong> natieve<br />
structuur krijg<strong>en</strong>, omdat ze verkeerd<br />
gevormde disulfidebrugg<strong>en</strong> bevatt<strong>en</strong>.<br />
• Toevoeg<strong>en</strong> van e<strong>en</strong> spoortje β-mercaptoethanol<br />
katalyseert her rangschikking van<br />
disulfidebrugg<strong>en</strong>. Gevolg: eiwitmolecul<strong>en</strong><br />
met oorspronkelijk verkeerd gevormde<br />
disulfidebrugg<strong>en</strong> hervouw<strong>en</strong> langzaam naar<br />
hun natieve, actieve toestand. Hervouw<strong>en</strong><br />
gebeurd omdat de natieve toestand de<br />
hoogste stabiliteit heeft
Eiwitvouwing wordt gedrev<strong>en</strong> door e<strong>en</strong> afname in vrije <strong>en</strong>ergie<br />
• Gevouw<strong>en</strong> eiwitt<strong>en</strong> hebb<strong>en</strong> e<strong>en</strong> lagere vrije <strong>en</strong>ergie G (zijn meer stabiel) in de<br />
afwezigheid van ontvouwingsmiddel<strong>en</strong> dan ontvouw<strong>en</strong> eiwitt<strong>en</strong><br />
• Het verschil in vrije <strong>en</strong>ergie tuss<strong>en</strong> de gevouw<strong>en</strong> <strong>en</strong> ontvouw<strong>en</strong> toestand van e<strong>en</strong><br />
eiwit is klein (ongeveer 5 – 10 kcal . mol -1 ; dat komt overe<strong>en</strong> met de <strong>en</strong>ergie die<br />
vrijkomt bij vorming van 5 tot 10 waterstofbrugg<strong>en</strong>)<br />
• T<strong>en</strong> gevolge van hun relatief lage stabiliteit zijn eiwitt<strong>en</strong> flexibel; deze<br />
flexibiliteit is vereist voor de activiteit<strong>en</strong> van eiwitt<strong>en</strong> (bijvoorbeeld katalyse)