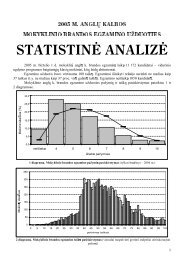
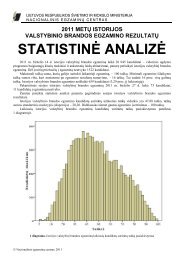
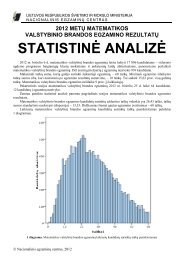
Chemijos valstybinio brandos egzamino programa - Nacionalinis ...
Chemijos valstybinio brandos egzamino programa - Nacionalinis ...
Chemijos valstybinio brandos egzamino programa - Nacionalinis ...
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
7.2. įgyti problemųsprendimo gebėjimųgebėti panaudoti įgytas chemijos ţinias ir tyrimų duomenis spręsdami problemas irpriimdami sprendimus; gebėti susieti gamtos mokslų įvairių temų bei sričių ţinias;gebėti efektyviai ir racionaliai pasirinkti problemoms spręsti tinkamusinformacijos šaltinius, kritiškai juos įvertinti, kompetentingai ir kūrybiškaianalizuoti ir naudoti; gebėti glaustai ir aiškiai reikšti mintis, pagrįsti savonuomonę, diskutuoti mokslo, technologijų ir aplinkosaugos temomis;7.3. įgyti praktinėsveiklos gebėjimų7.4. susiformuotivertybinesnuostatasformuoti hipotezes, gebėti planuoti ir atlikti nesudėtingus bandymus jomspatikrinti, saugiai naudotis laboratorine įranga, indais ir cheminėmis medţiagomis,analizuoti ir apibendrinti bandymų duomenis, vertinti jų tikslumą ir patikimumą,juos vaizdţiai pateikti, formuluoti argumentuotas išvadas;būti valingi, savarankiški ir kūrybiški, gerbiantys kiekvieną ţmogų, gebantysbendrauti ir bendradarbiauti, kritiškai mąstyti, mokantys dirbti savarankiškai irkomandoje, atviri naujoms idėjoms ir tikrovės kaitai, besidomintys mokslo irtechnologijų laimėjimais, nusiteikę atsakingai veikti, mokytis visą gyvenimą;jausti pagarbą gamtai, atsakomybę uţ aplinką ir jos tausojimą.III. MOKINIŲ GEBĖJIMAI8. Siekdami chemijos mokymosi tikslų ir uţdavinių, mokiniai turi įgyti ţinių, tobulinti gebėjimus irsusiformuoti vertybines nuostatas.9. Mokinių pasiekimus įprasta skirstyti į šias grupes:9.1. žinios ir supratimas;9.2. problemų sprendimo gebėjimai;9.3. praktiniai (eksperimentavimo) gebėjimai;9.4. vertybinės nuostatos.10. <strong>Chemijos</strong> <strong>valstybinio</strong> <strong>brandos</strong> <strong>egzamino</strong> metu bus tikrinami mokinio žinios ir supratimas,problemų sprendimo gebėjimai ir praktiniai gebėjimai.11. Ţinių ir supratimo gebėjimai siejami su mokinių gebėjimu atgaminti informaciją ir ją suprasti.12. Tikrinant gebėjimą atgaminti informaciją, mokinys turėtų:12.1. atpažinti tekste, formulėse, lygtyse, schemose, grafikuose,12.2. paminėti,12.3. pavadinti,12.4. apibrėžti (nusakyti sąvokos turinį),12.5. išvardyti,12.6. atrinkti iš pateikto teksto, sąrašo, formulės, reakcijos lygties tam tikrus cheminius elementus,junginius, medţiagas, reakcijas ar kitus cheminius faktus, simbolius, terminus, objektus, reiškinius,procesus;12.7. nurodyti tam tikrų cheminių elementų, medţiagų, junginių, reakcijų priklausomybę tam tikraigrupei, klasei.13. Tikrinant gebėjimą suprasti informaciją, mokinys turėtų:13.1. skaityti ir rašyti ţinomas* chemines formules ir lygtis;13.2. atlikti paprasčiausius skaičiavimus naudodamasis viena ţinoma* formule ar ţinoma*reakcijos lygtimi;13.3. apibūdinti (nusakyti būdingąsias ţymes), pavaizduoti schema arba grafiku, suprantamaiaprašyti savais ţodţiais, paaiškinti ţinomų* cheminių elementų, medţiagų, junginių sandarą, savybes,gavimą ir panaudojimą;13.4. klasifikuoti, palyginti, susieti sąvokas, dėsningumus, nurodyti prieţastis, pateikti tinkamųpavyzdţių;_______________________ tokia formulė, medţiaga ar lygtis, kuri yra paminėta dalykiniuose <strong>egzamino</strong> turinio reikalavimuose.2
13.5. apibūdinti ir paaiškinti chemijos ţinių taikymą kasdieniame gyvenime ir technologijose,aplinkosauginių problemų cheminius aspektus.14. Išplėstinio kurso reikalavimai apima bendrojo kurso reikalavimus. Išsamūs ţinių ir supratimoreikalavimai mokiniams, kurie mokėsi pagal bendrojo ir išplėstinio kurso <strong>programa</strong>s, pateikiami skyriuje„Valstybinio <strong>brandos</strong> <strong>egzamino</strong> reikalavimai“.15. Problemų sprendimas – tai gebėjimas naudotis, apibendrinti ir kritiškai vertinti įvairiągamtamokslinę informaciją, ją naudoti cheminio ir aplinkosauginio pobūdţio problemoms spręsti.Besikuriančiai tarptautinei bendruomenei ir informacinei visuomenei vis svarbesni tampa asmensgebėjimai susieti ir taikyti įgytas ţinias ir supratimą, naudotis šiuolaikinėmis, tarp jų ir informacinėmis,technologijomis, priimti argumentuotus sprendimus ir numatyti jų pasekmes. Mokinių gebėjimą taikytiįgytas ţinias ir supratimą chemijos bei aplinkosaugos problemoms spręsti apibūdina problemųsprendimo gebėjimai. Mokinys turi gebėti:15.1. spręsti cheminio ir aplinkosauginio pobūdţio problemas, apdorodamas skaitinius ir grafiniusduomenis, tyrimų rezultatus;15.2. atrinkti, kritiškai vertinti, kūrybiškai panaudoti problemoms spręsti reikalingą informaciją irvaizdţiai pateikti gautus rezultatus;15.3. atlikti skaičiavimus, daryti ir tikrinti išvadas, siūlyti sprendimus ir numatyti procesų eigą,remdamasis ryšių tarp medţiagų sandaros ir savybių dėsningumais bei priklausomybėmis;15.4. pagal pateiktą aprašymą arba schemą analizuoti ir vertinti eksperimentą.16. Į problemų sprendimo gebėjimus įjungiami ir gebėjimai, susiję su praktiniais darbais. Probleminiųklausimų tematika neišeina uţ bendrojo ir išplėstinio kurso programų turinio ribų.17. Praktiniai gebėjimai ugdomi ir tikrinami mokykloje atliekant praktinius darbus. <strong>Chemijos</strong><strong>valstybinio</strong> <strong>brandos</strong> <strong>egzamino</strong> metu praktiniai gebėjimai tiesiogiai netikrinami dėl techninių sunkumų,ribotų finansinių galimybių ir kitų prieţasčių. Tačiau uţduotyse bus klausimų, kuriuos spręsdamasmokinys galės panaudoti įgytus praktinius gebėjimus, padėsiančius išsiaiškinti, ar mokinys yra atlikęsprogramoje numatytus praktinius darbus, ar suprato praktinio darbo planavimo, atlikimo, rezultatųvertinimo ir apibendrinimo proceso principus.18. Egzamino metu vertybinės nuostatos nėra vertinamos, nes tai padaryti ypač sudėtinga. Tačiauvertybinis ugdymas yra labai svarbi asmens ugdymo proceso dalis ir vertybinės nuostatos turėtų būtiformuojamos su deramu dėmesiu. Kiekvieno mokytojo pareiga ugdyti mokinių domėjimąsi gamta iraplinka, nusiteikimą rinktis sveiką gyvenimo būdą, supratimą, kad nuo kiekvieno iš mūsų priklausoaplinkos kokybė ir ţmonių gerovė.IV. VALSTYBINIO BRANDOS EGZAMINO REIKALAVIMAI19. <strong>Chemijos</strong> valstybiniu <strong>brandos</strong> egzaminu siekiama įvertinti chemijos ţinias, supratimą irgebėjimus tų mokinių, kuriems jie bus reikalingi studijuojant ar būsimoje profesinėje veikloje.20. Egzaminų programoje siekiama pabrėţti gebėjimų spręsti problemas svarbą, aiškiaireglamentuojant ţinių ir supratimo ir problemų sprendimo klausimų santykį <strong>egzamino</strong> uţduotyje.<strong>Chemijos</strong> <strong>valstybinio</strong> <strong>brandos</strong> <strong>egzamino</strong> uţduotyje maţdaug 50 proc. visų klausimų bus skirta ţinioms irsupratimui tikrinti, apie 50 proc. klausimų – gebėjimui spręsti problemas. Pagrindiniai reikalavimaimokiniams, kurie mokėsi pagal bendrojo ir išplėstinio kurso <strong>programa</strong>s, pateikiami 1 lentelėje:1 l e n t e l ėProblemųsprendimo irpraktiniaigebėjimaiRinkti ir apdorotiskaitinę ar grafinęinformaciją irtyrimų duomenisReikalavimai mokiniams, kuriemokėsi pagal bendrojo kursoprogramąRasti bendrojo kurso turinioreikalavimus atitinkančią informacijąlentelėse, schemose, grafikuose,diagramose, cheminėse formulėse irReikalavimai mokiniams, kurie mokėsipagal išplėstinio kurso programąRasti išplėstinio kurso turinioreikalavimus atitinkančią informacijąlentelėse, schemose, grafikuose,diagramose, cheminėse formulėse ir3
Problemųsprendimo irpraktiniaigebėjimaiAtrinkti, kritiškaivertinti irkūrybiškaipanaudotiinformaciją.Vaizdţiai pateiktigautus rezultatus.Atliktiskaičiavimus,daryti išvadas irsprendimus,remiantis ryšiųtarp medţiagųsandaros ir savybiųdėsningumais beipriklausomybėmis.Pagal pateiktąaprašymą arschemą analizuotiir vertintipraktinius darbus.Prasmingai taikytiįgytas chemijosţinias irgebėjimus.Reikalavimai mokiniams, kuriemokėsi pagal bendrojo kursoprogramąlygtyse, mokslo populiarinimotekstuose, ją analizuoti ir apibendrinti.Atlikti nesudėtingus vidurkių,procentų, santykių, išeigųskaičiavimus.Nubraiţyti grafiką pagal pateiktusduomenis.Pateikti trumpą apibendrintąinformaciją raštu, lentele, grafiku,diagrama, schema, chemine formule arlygtimi.Remiantis turima informacija darytiišvadas ir siūlyti sprendimus.Pasitelkti atitinkamą dėsningumą arpriklausomybę, reikalingą problemaispręsti, atlikti paprasčiausius formuliųir lygčių pertvarkymus.Turėti nuomonę apie praktinio darbotinkamumą keliamai problemai spręsti,pastebėti klaidas ir pasiūlyti, kaip jasištaisyti.Numatyti cheminių procesų eigą irpasekmes.Taikyti chemijos ţinias ir gebėjimusaiškinant gamtos reiškinius bei sprendţiantgyvenimiškas ir aplinkosauginesproblemas, kritiškai vertinti hipotezes,išvadas, pasiūlytus problemųsprendimus.Reikalavimai mokiniams, kurie mokėsipagal išplėstinio kurso programąlygtyse, mokslo populiarinimo tekstuose,kritiškai ją vertinti ir panaudoti problemaispręsti.Palyginti apskaičiuotus vidurkius,procentus, santykius, išeigas, darytiišvadas ir jas pagrįsti.Nustatyti pagal grafiką reikiamas dydţiųvertes.Vaizdţiai pateikti apibendrintą platesniopobūdţio informaciją raštu, lentele,grafiku, diagrama, schema, cheminėmisformulėmis ir lygtimis.Remiantis turima informacija darytiišvadas, siūlyti problemų sprendimus irjuos pagrįsti.Atlikti skaičiavimus, vartoti tinkamusmatavimo vienetus, daryti ir tikrintiišvadas, numatyti ir spręsti, pritaikantdėsningumą ar priklausomybę kitamnegu duotasis cheminiam elementui,junginiui ar reakcijai.Atlikti formulių ir lygčių pertvarkymus,skaityti, rašyti ir sudaryti cheminesformules bei lygtis.Daryti išvadas, ar praktinio darboplanavimas, eiga ir rezultatai atitinkakeliamą hipotezę ar tikslą, įvertinti gautųrezultatų tikslumą, pasiūlyti tinkamąeksperimento variantą keliamaiproblemai spręsti.Numatyti cheminių procesų eigą irpasekmes esant kitoms negu duotosiossąlygoms arba panaudojus kitas neguduotosios medţiagas.Prasmingai taikyti chemijos terminus irsąvokas, remtis jos dėsniais ir teorijomisaiškinant gamtos reiškinius beisprendţiant gyvenimiškas iraplinkosaugines problemas.4
V. EGZAMINO TEMATIKA21. Egzamino turinys suskirstytas į 6 temas:21.1. Cheminis eksperimentas. Bendrieji cheminiai skaičiavimai.21.2. Atomo sandara. Periodinis dėsnis, periodinė elementų lentelė. Cheminis ryšys.21.3. Neorganinių medţiagų sudėtis ir savybės, gavimas ir panaudojimas.21.4. Organinių junginių sandara ir savybės, gavimas ir panaudojimas.21.5. Cheminės reakcijos. Cheminė pusiausvyra. Tirpalai.21.6. Chemija ir aplinka.22. Išsamūs mokinių ţinių ir supratimo reikalavimai iš kiekvienos temos ir potemio pateikiami toliauesančioje lentelėje. Reikalavimai mokiniams, kurie mokėsi pagal išplėstinio kurso programą, apimareikalavimus mokiniams, kurie mokėsi pagal bendrojo kurso programą, todėl 2 lentelėje išplėstinio kursoskiltyje įrašyta tik tai, ką mokinys privalo ţinoti ir suprasti geriau, negu reikalaujama bendrajame kurse.2 l e n t e l ėReikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąI tema. CHEMINIS EKSPERIMENTAS. BENDRIEJI CHEMINIAI SKAIČIAVIMAI1. Cheminis eksperimentas1.1. Pavadinti ir tinkamai naudoti šiuoscheminius indus ir prietaisus: mėgintuvėlis,cheminė stiklinė, matavimo cilindras, pipetė,kūginė, plokščiadugnė, apvaliadugnė, Viurco,matavimo kolbos, piltuvėlis, šaldytuvas,dalijamasis piltuvas, garinimo lėkštelė, kamštis sudujų nuvedamuoju vamzdeliu, laboratorinis stovas,spiritinė lemputė.1.2. Praktiškai atpaţinti jonusH ,Ag ,2Ba , 2 2OH , Cl , SO 4 , CO 3 ir uţrašyti jų atpaţinimoreakcijų lygtis.1.3. Praktiškai gauti, surinkti ir atpaţinti O 2 ,H 2 , CO 2 dujas ir uţrašyti atitinkamų reakcijųlygtis.1.4. Atpaţinti eteno dujas ir uţrašyti jųatpaţinimo reakcijos su bromo vandeniniu tirpalulygtį. 1.2. Praktiškai atpaţinti jonus NH 4 , Na ,2 Ca , I ir uţrašyti jų atpaţinimo reakcijų lygtis.1.4. Praktiškai gauti, surinkti ir atpaţinti NH 3,eteno dujas ir uţrašyti jų atpaţinimo reakcijos suKMnO 4 lygtį.1.5. Praktiškai atpaţinti glicerolį, metanalį,gliukozę (kaip aldehidą ir kaip daugiahidroksilįalkoholį), krakmolą.1.6. Praktiškai gauti esterį.1.7. Praktiškai paruošti tirpalą, kai nurodytatirpinio masės dalis.1.8. Praktiškai išskirti mišinius garinant,filtruojant, distiliuojant, kristalinant.1.7. Praktiškai paruošti reikiamos molinėskoncentracijos tirpalą.5
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą2. Cheminiai skaičiavimai2.1. Atlikti skaičiavimus taikant formules: 2.1. Atlikti skaičiavimus taikant formules:m N ; n ;n m praktinėc ; 100%,V N AV m teorinėm Vn ; n ;Vpraktinis M V 100% ,MV teorinisw(medţiagos)=npraktinis 100% .mnkomponento teorinis= 100%.mvisomišinio2.2. Apskaičiuoti santykinį dujų tankį kitų dujųatţvilgiu.2.2. Taikyti dujų tūrių santykių dėsnįsprendţiant uţdavinius.2.3. Pagal duotą reakcijos lygtį apskaičiuotireaguojančių arba susidarančių medţiagų kiekį,masę, tūrį, kai ţinomas kurios nors reakcijojedalyvaujančios medţiagos kiekis, masė, tūris.2.7. Nustatyti medţiagų, sudarytų iš dviejųelementų, formules, kai ţinomos abiejų jąsudarančių elementų masės dalys, ir atvirkščiai.2.3. Pagal duotą reakcijos lygtį apskaičiuotiprodukto kiekį, masę, tūrį, kai yra duoti abiejųpradinių medţiagų kiekiai, masės, tūriai.2.4. Atlikti skaičiavimus pagal reakcijos lygtį,kai yra duotas kurios nors iš reaguojančiųmedţiagų arba reakcijos produktų masės ar tūriopokytis; apskaičiuoti reakcijos metu įvykusįmedţiagos masės ar tūrio pokytį.2.5. Apskaičiuoti procentais mišinio sudėtį, kaireakcijoje dalyvauja tik viena medţiaga ir kaireakcijoje dalyvauja abi medţiagos.2.6. Pagal pateiktas reakcijų lygtis apskaičiuotipradinės medţiagos, turinčios priemaišų, kiekį,masę, tūrį, kai ţinomas produkto kiekis, masė,tūris, ir atvirkščiai.2.7. Nustatyti medţiagų formules, kai ţinomi šiųmedţiagų degimo produktų kiekis, masė, tūris irmedţiagų tankiai arba santykiniai tankiai.II tema. ATOMO SANDARA. PERIODINIS DĖSNIS, PERIODINĖELEMENTŲ LENTELĖ. CHEMINIS RYŠYS1. Atomo sandara1.1. Apibūdinti atomo sandarą, nurodytiprotonų, neutronų ir elektronų skaičių, jų krūviusir vietą atome.1.2. Parašyti pirmų trijų periodų cheminiųelementų atomų elektronų išsidėstymą lygmenyse.1.3. Tinkamai vartoti sąvokas atomas, molekulė,jonas, oksidacijos laipsnis, atominis skaičius,masės skaičius, molis, molinė masė.1.1. Apibūdinti izotopus kaip to paties elementoatomų rūšis, turinčias vienodą protonų ir elektronųskaičių, bet skirtingą neutronų skaičių branduolyje.1.2. Parašyti ketvirto periodo cheminių elementųatomų elektronų išsidėstymą lygmenyse.1.3. Nurodyti atomų ir jonų panašumus beiskirtumus.6
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą2.1. Apibūdinti periodinės elementų lentelėsstruktūrą: ţinoti grupes, periodus.2. Periodinis dėsnis, periodinė elementų lentelė2.2. Apibūdinti periodinį dėsnį. 2.2. Paaiškinti periodinės elementų lentelėssandarą, siejant ją su periodiniu dėsniu, atomosandara ir periodiškumu.2.3. Apibūdinti metalų ir nemetalų išsidėstymąperiodinėje lentelėje.2.4. Apibūdinti šias elementų šeimas: šarminiųmetalų, šarminių ţemių metalų, halogenų irinertinių dujų.2.3. Paaiškinti, kaip kinta metališkosios irnemetališkosios elementų savybės, atomų dydţiai,elementų junginių (oksidų ir nemetalų hidridų)bazinės ir rūgštinės savybės perioduose ir Agrupėse. Apibūdinti pereinamųjų metalųišsidėstymą periodinėje lentelėje.3. Cheminis ryšys3.1. Apibūdinti elektrinio neigiamumo sąvoką irją taikyti aiškinant joninį bei kovalentinį ryšius.3.2. Apibūdinti joninį ryšį, pateikti joninio ryšiosusidarymo pavyzdţių.3.3. Apibūdinti kovalentinį nepolinį ryšį H 2 , O 2 ,Cl 2 , N 2 molekulėse. Uţrašyti šių molekuliųelektronines ir struktūrines formules.3.4. Apibūdinti kovalentinį polinį ryšį HCl,H 2 O, NH 3 , CH 4 molekulėse. Uţrašyti šiųmolekulių elektronines ir struktūrines formules.3.1. Apibūdinti cheminio ryšio tipą organiniuoseir neorganiniuose junginiuose ir jo priklausomybęnuo elektrinio neigiamumo.3.2. Palyginti tipiškų joninių ir kovalentiniųjunginių fizikines savybes.3.4. Paaiškinti vandenilinį ryšį tarp HF, H 2 O,NH 3 , alkoholių, karboksirūgščių, aminų molekulių,taip pat baltymo molekulėje.3.5. Paaiškinti koordinacinį ryšį remiantis jonųNH 4 + ir H 3 O + pavyzdţiu.3.6. Apibūdinti metališkąjį ryšį.III tema. NEORGANINIŲ MEDŢIAGŲ SUDĖTIS IR SAVYBĖS, GAVIMAS IR PANAUDOJIMAS1.1. Suskirstyti medţiagas į vienines irsudėtines.1. Neorganinių medžiagų grupės1.2. Suskirstyti sudėtines medţiagas į oksidus,hidroksidus, rūgštis ir druskas, pateikti jųpavyzdţių.1.2. Apibrėţti, kas yra hidridai, klasifikuoti juosį metalų ir nemetalų hidridus, palyginti jų savybes,pateikti pavyzdţių.7
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą2. Rūgštys2.1. Nurodyti, jog rūgščių tirpalų pH7.3.3. Paaiškinti, kad šarmai ir jų tirpalai yraėdţios, slidţios, tirpinančios riebalus medţiagos.3. 3.4. Uţrašyti reakcijų lygtimis šarmų sąveiką su:– rūgštimis (HCl, HNO 3 , H 2 SO 4 );– rūgštiniais oksidais (CO 2 , SO 2 , SO 3 ).3.9. Nurodyti, kad amfoteriniai hidroksidaireaguoja ir su rūgštimis, ir su šarmais.2.3. Uţrašyti reakcijų lygtimis HCl, HNO 3,H 2 SO 4 sąveiką su:– – amoniaku,– metalų hidroksidais,– – įvairiomis druskomis, kai vyksta jonų mainųreakcijos.3. Bazės. Hidroksidai2.4. Uţrašyti rūgščių (HCl, HNO 3 ) gavimo išatitinkamų druskų dėl poveikio koncentruotaH 2 SO 4 reakcijų lygtis.3.1. Nurodyti, kad bazėms priskiriami junginiai,kuriuos tirpinant vandenyje susidaro OH jonai.Reakcijų lygtimis pagrįsti, kad NH 3 ir karbonataiyra bazinės prigimties medţiagos.3.4. Uţrašyti šarmų sąveikos su tirpiomisdruskomis, kai susidaro netirpūs junginiai, reakcijųlygtis.3.5. Uţrašyti šarmų sąveikos su H 2 SO 4 , kaisusidaro sulfato ir vandenilio sulfato druska,reakcijų lygtis.3.6. Uţrašyti NaOH tirpalo sąveikos su metalais(Zn, Al) reakcijų lygtis.3.7. Uţrašyti netirpių hidroksidų sąveikos suHCl, HNO 3 , H 2 SO 4 reakcijų lygtis.3.8. Uţrašyti netirpių hidroksidų skilimokaitinant reakcijų lygtis.3.9. Uţrašyti amfoterinių hidroksidų Zn(OH) 2 ,Al(OH) 3 sąveikos su NaOH tirpalu reakcijų lygtis.3.10. Uţrašyti Ca(OH) 2 gavimo iš CaO reakcijos 3.10. Uţrašyti šarmų gavimo iš metalų (Na ir8
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąlygtį.4.1. Apibrėţti, kas yra oksidai, ir sudaryti jųformules.4.2. Klasifikuoti oksidus į bazinius, rūgštinius,amfoterinius.4.3. Uţrašyti reakcijų lygtimis bazinių IIA grupėsmetalų oksidų sąveiką su:– – rūgštimis (HCl, HNO 3 , H 2 SO 4 ),– – rūgštiniais oksidais (CO 2 , SO 2 , SO 3 ),– – vandeniu.4.4. Uţrašyti reakcijų lygtimis rūgštinių oksidų(CO 2 , SO 2 , SO 3 ) sąveiką su:– šarmais,– vandeniu.4. OksidaiCa) reakcijų lygtis.4.3. Uţrašyti reakcijų lygtimis bazinių oksidųsąveiką su:– rūgštimis,– rūgštiniais oksidais,– vandeniu.4.4. Uţrašyti reakcijų lygtimis rūgštinių oksidųsąveiką su:– šarmais,– baziniais oksidais,– vandeniu.4.5. Nurodyti, kad amfoteriniai oksidai ZnO, 4.5. Uţrašyti ZnO, Al Al reaguoja ir su rūgštimis, ir su šarmais. 2 O 3 sąveikos su HCl irNaOH tirpalais reakcijų lygtis.2 O 34.6. Uţrašyti oksidų gavimo reakcijų lygtis:metalas+O 2 ,nemetalas+O 2 .5.1. Apibrėţti druskas kaip junginius, sudarytus išmetalo arba amonio katijonų ir rūgšties liekanosanijonų.5.2. Sudaryti druskų formules ir pavadinimus,kai duoti metalo arba amonio katijonas ir ţinomosrūgšties anijonas.5.3. Uţrašyti druskų tirpalų sąveikos sudruskomis, kai įvyksta jonų mainai, reakcijų lygtis.5. Druskos4.6. Uţrašyti CO 2 , SO 2 , SO 3 sąveikos su NaOHir Ca(OH) 2 , kai susidaro dviejų tipų druskos, reakcijųlygtis.5.3. Uţrašyti reakcijų lygtimis druskų sąveikąsu:– rūgštimis (HCl, HNO 3 , H 2 SO 4 ),– šarmais.5.4. Uţrašyti druskų tirpalų sąveikos su metalaisreakcijų lygtis.5.5. Uţrašyti netirpių karbonatų (CaCO 3 ,MgCO 3 ) ir vandenilio karbonatų (Ca(HCO 3 ) 2 ,9
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą5 5.6. Uţrašyti neutralizacijos reakcijos lygtį, kaisąveikaujant rūgščiai (HCl, HNO 3 , H 2 SO 4 ) iršarmui gaunama druska.6.1. Apibūdinti metalų fizines savybes (agregatinębūseną, elektrinį ir šilumos laidumą, kalumą,plastiškumą, blizgesį, tankį).7.1. Naudojantis metalų įtampų eile, uţrašytimetalų sąveikos su O 2 , Cl 2 , S, H 2 O, praskiestųdruskos ir sieros rūgščių tirpalais, reakcijų lygtis.8.1. Nurodyti, kokie metalų junginiai įeina į rūdųsudėtį (oksidai, sulfidai, sulfatai, karbonatai).8.2. Apibūdinti, kas yra lydinys, pateikti ketaus,plieno, bronzos, duraliuminio panaudojimopavyzdţių.9.1. Uţrašyti Na ir Ca sąveikos su O 2 susidarantoksidams, su Cl 2 reakcijų lygtis.9.2. Nurodyti, kad šarminiai metalai ir šarminiųţemių metalai aktyviai reaguoja su vandeniu.9.3. Nurodyti IA grupės metalų junginių(Na 2 CO 3 , NaCl, NaOH, NaHCO 3 , NaNO 3 , KNO 3 )Mg(HCO 3 ), NaHCO 3 ) terminio skilimo reakcijųlygtis.5.6. Uţrašyti druskų gavimo reakcijų lygtis:metalas+nemetalas,metalas+rūgštis (praskiestos HCl ir H 2 SO 4 ),metalas+druska,bazinis oksidas+rūgštis,šarmas+rūgštis,bazinis oksidas+rūgštinis oksidas,šarmas+rūgštinis oksidas,6. Metalaišarmas+druska,rūgštis+druska,druska+druska.7. Bendrosios metalų savybės6.1. Susieti metališkąsias savybes su metališkuojuryšiu.6.2. Apibūdinti metalus kaip reduktorius.8. Metalų gavimo būdai ir panaudojimas7.1. Naudojantis metalų įtampų eile, uţrašytimetalų ir druskų tirpalų sąveikos reakcijų lygtis.8.1. Uţrašyti geleţies, cinko ir vario gavimoatitinkamai iš Fe 2 O 3 , ZnO ir CuO reakcijų lygtis,kai reduktorius yra C, CO arba H 2 .9. IA ir IIA grupių metalai9.1. Uţrašyti IA ir IIA grupių metalų sąveikos suO 2 susidarant oksidams, H 2 , S, halogenais, H 2 Oreakcijų lygtis.10
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąsvarbiausias naudojimo sritis.9.4. Nurodyti IIA grupės metalų junginių (MgO,CaO, Ca(OH) 2 , CaCO 3 , CaSO 4 2H 2 O) naudojimosritis.9.5. Apibūdinti vandens kietumą ir nurodyti jošalinimo būdus.9.5. Uţrašyti lygtis reakcijų, kurioms vykstantpašalinamas laikinas ir pastovus vandens kietumas.10. Metalų korozija ir svarbiausi apsaugos nuo korozijos būdai10.1. Apibūdinti koroziją kaip metalų dirbinių iraplinkos sąveiką, nurodyti korozijos daromą ţalą irsvarbiausius apsaugos nuo korozijos būdus.11.1. Nurodyti bendruosius išorinius nemetalųpoţymius (fizines savybes).11.2. Apibūdinti bendrąsias dujų savybes,molinį dujų tūrį, Avogadro dėsnį.12.1. Apibūdinti H 2 fizines savybes.12.2. Uţrašyti H 2 sąveikos su O 2 , Cl 2 , N 2reakcijų lygtis.12.3. Nurodyti H 2 gavimo pramonėje šaltinius(gamtines dujas, vandenį).12.4. Nurodyti svarbiausias H 2 naudojimo sritis.13.1. Apibūdinti O 2 fizines savybes.13.2. Apibūdinti deguonies alotropinesatmainas.13.3. Uţrašyti O 2 sąveikos su H 2 , S, C, Ca, Cureakcijų lygtis.13.4. Nurodyti O 2 gavimo šaltinius (orą,vandenį).13.5. Nurodyti svarbiausias O 2 naudojimosritis.13.6. Apibūdinti oro sudėtį tūrio procentais.13.7. Apibūdinti O 2 apykaitą gamtoje.10.1. Apibūdinti koroziją kaip oksidacijosredukcijosprocesą. Nurodyti, kad koroziją sukelia:– ore esantys vandens garai ir O 2 ,– CO 2 , SO 2 ir kiti ištirpę vandenyje junginiai,veikiantys kaip elektrolitai.11. Nemetalai12. Vandenilis13. Deguonis11.1. Apibūdinti nemetalus kaip oksidatorius.12.4. Uţrašyti reakcijos lygtį, kai H 2 gaunamas išmetano konversijos būdu.11
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą14.1. Ţinoti, kad halogenų molekulės yradviatomės.14.2. Apibūdinti F 2 , Cl 2 , Br 2 , I 2 fizines savybes(spalvą, agregatinę būseną).14.3. Uţrašyti Cl 2 sąveikos su H 2 , metalaisreakcijų lygtis.14.4. Nurodyti, kad HCl yra dujos, kuriostirpdamos vandenyje sudaro druskos rūgštį.14.6. Nurodyti svarbiausias Cl 2 ir jo junginiųnaudojimo sritis, jodo ir jo junginių biologinęreikšmę.15.1. Apibūdinti S, SO 2 , H 2 SO 4 fizines savybes.15.2. Uţrašyti S sąveikos su O 2 , H 2reakcijų lygtis.14. Halogenai15. Siera ir jos junginiai, metalais15.3. Uţrašyti SO 2 ir SO 3 sąveikos su H 2 Oreakcijų lygtis.15.5. Nurodyti ir praktiškai taikyti saugausdarbo su sieros rūgštimi taisykles.15.6. Apibūdinti sieros oksidų ţalą sveikatai iraplinkai.16. Azotas ir jo junginiai14.3. Uţrašyti Cl 2 sąveikos su vandeniureakcijos lygtį.14.5. Palyginti halogenų cheminį aktyvumągrupėje ir uţrašyti reakcijų pavyzdţių.14.6. Nurodyti fluoro, chloro ir jų junginiųbiologinę reikšmę.15.4. Uţrašyti H 2 SO 4 pramoninio gavimoSSO 2 SO 3 H 2 SO 4 reakcijų lygtis.15.5. Paaiškinti remiantis koncentruotos H 2 SO 4sąveika su Cu, jog ši rūgštis yra stiprusoksidatorius.15.6. Nurodyti svarbiausias H 2 SO 4 naudojimosritis.16.1. Apibūdinti azoto fizines savybes. 16.1. Susieti N 2 molekulės sandarą su joinertiškumu.16.2. Uţrašyti N 2 sąveikos su H 2 , O 2 reakcijųlygtis.16.3. Apibūdinti azoto oksidų ţalą sveikatai iraplinkai.16.4. Apibūdinti NH 3 fizines savybes.16.5. Nurodyti svarbiausias NH 3 naudojimosritis.16.6. Uţrašyti HNO 3 pramoninio gavimo12
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą16.9. Nurodyti augalams reikalingusmakroelementus, pateikti paprasčiausių trąšųpavyzdţių.17.1. Apibūdinti anglies alotropines atmainas:deimantą ir grafitą.17.3. Apibūdinti anglies (II) oksido ir anglies(IV) oksido fizikines savybes.17.4. Uţrašyti CO gavimo reakcijos lygtį, kaianglis dega trūkstant deguonies.17.5. Apibūdinti CO poveikį ţmogausorganizmui.17.6. Uţrašyti reakcijų lygtimis CO 2 sąveiką su:– H 2 O,– NaOH ir Ca(OH) 2 ,– baziniais IIA grupės metalų oksidais.17.7. Pateikti CO 2 naudojimo pavyzdţių.17. Anglis ir jos junginiaiN 2 NH 3 NO NO 2 HNO 3 reakcijų lygtis.16.7. Paaiškinti remiantis koncentruotos irpraskiestos HNO 3 sąveika su Cu, jog ši rūgštis yrastiprus oksidatorius.16.8. Nurodyti svarbiausias HNO 3 naudojimosritis.16.9. Uţrašyti daţniausiai naudojamų trąšųformules, apskaičiuoti ir palyginti trąšas pagalmaisto elementų masės dalis.17.1. Apibūdinti deimanto ir grafito sandarą.17.2. Apibūdinti adsorbcijos reiškinį.17.4. Uţrašyti CO susidarymo iš CO 2 reakcijoslygtį.17.5. Susieti CO redukcines savybes su jopritaikymu metalurgijoje.IV tema. ORGANINIŲ JUNGINIŲ SANDARA IR SAVYBĖS, GAVIMAS IR PANAUDOJIMAS1.1. Nurodyti, kad anglis yra pagrindinisorganinių junginių elementas.1.2. Apibūdinti angliavandenilius kaip junginius,sudarytus tik iš anglies ir vandenilio.1.3. Pateikti sočiųjų angliavandenilių (alkanų)pavyzdţių, uţrašyti jų molekulines, pilnasstruktūrines ir sutrumpintas struktūrines formules.1.4. Apibūdinti homologinę eilę, pateiktipavyzdţių. Tinkamai vartoti sąvokas homologas,homologinis skirtumas, homologinė eilė.1.5. Uţrašyti ir mokėti naudotis sočiųjųangliavandenilių homologinės eilės bendrąja1. Organinių junginių struktūra1.3. Paaiškinti iliustruojant pavyzdţiais, kadstruktūrinės formulės rodo, kokia tvarka ir kokiaisryšiais atomai sujungti į molekules.13
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąformule.1.6. Pavadinti sočiuosius nešakotos grandinėsangliavandenilius (nuo metano iki heksanoimtinai). Pagal pavadinimą uţrašyti struktūrines irsutrumpintas struktūrines nešakotos grandinėsangliavandenilių nuo C 1 iki C 6 formules.1.7. Apibūdinti izomerus kaip tos pačioscheminės sudėties, bet skirtingos struktūrosjunginius, pateikti pavyzdţių.1.8. Nurodyti svarbiausias organinių junginiųpavadinimų sudarymo taisykles (ilgiausiosgrandinės radimas, jos numeravimas, atšakųpavadinimo ir vietos nustatymas).1.9. Uţrašyti struktūrines formules ir pavadintisočiųjų angliavandenilių nuo C 4 iki C 5 izomerus.1.10. Pagal duotas struktūrines formulesatpaţinti ir pavadinti sočiųjų angliavandenilių ikiC 5 izomerus.2.1. Uţrašyti metano degimo ir reakcijos suchloru lygtis. Nurodyti pagrindinius metanogavimo šaltinius (gamtinės dujos, nafta),naudojimą (kuras, chlorinti metano produktai).2.3. Paaiškinti, kad naftą distiliavimo būdugalima suskirstyti į įvairaus kuro frakcijas(benziną, ţibalą, gazolį, mazutą) arba naudoti kaipţaliavą įvairiems angliavandeniliams gauti.Apibūdinti naftos ir jos perdirbimo produktųnaudojimą.2.5. Uţrašyti ir naudotis alkenų bendrosiomisformulėmis, apibūdinti juos kaip nesočiuosiusangliavandenilius, turinčius dvigubąjį ryšį.1.8. Taikyti pagrindines IUPAC nomenklatūrostaisykles (kelių atšakų numeravimo ir išvardijimotvarka, funkcinių grupių, alkoholių, aldehidų,karboksirūgščių, esterių, aminų, halogenintųangliavandenilių pavadinimai).1.9. Uţrašyti struktūrines formules ir pavadintisočiųjų angliavandenilių nuo C 4 iki C 6 izomerus.1.10. Pagal duotas struktūrines formulesatpaţinti ir pavadinti sočiųjų angliavandenilių ikiC 6 izomerus.1.11. Uţrašyti ir naudotis cikloalkanųformulėmis iki C 6 .2. Organinių junginių savybės ir panaudojimas2.1. Apibūdinti fizines ir chemines metanosavybes, uţrašyti metano skilimo ir konversijosvandens garais reakcijų lygtis. Uţrašyti ir išlygintisočiųjų angliavandenilių degimo lygtis.2.2. Uţrašyti ir paaiškinti paprasčiausių alkanųradikalinio pakeitimo reakcijos mechanizmą.2.3. Nurodyti, kokius būdingiausiusangliavandenilius galima išskirti iš gamtinių dujų,naftos.2.4. Paaiškinti, kaip skyla sotiejiangliavandeniliai naftos ir jos frakcijų krekingometu, uţrašyti tokios reakcijos pavyzdţių.2.5. Paaiškinti dvigubojo ryšio susidarymąnaudojantis ir ryšių sąvokomis.2.6.Uţrašyti, atpaţinti ir pavadinti alkenų nuo14
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą2.7. Apibūdinti eteno fizines ir cheminessavybes (uţrašyti eteno degimo, reakcijų su H 2 ,Br 2 , HBr lygtis).2.8. Paaiškinti eteno polimerizaciją tinkamaivartojant sąvokas monomeras, polimeras,polimerizacijos laipsnis.2.9. Apibūdinti fizines benzeno savybes,taikymą buityje ir pramonėje.2.12. Organinių junginių struktūrinėseformulėse atpaţinti hidroksigrupę ir priskirtijunginį alkoholių klasei.2.13. Apibūdinti fizines ir chemines metanolio iretanolio savybes (uţrašyti degimo, oksidacijos ikietanalio ir esterifikacijos reakcijų lygtis).2.14. Uţrašyti 1,2,3-propantriolio (glicerolio)struktūrinę formulę ir nurodyti, kad jis priklausodaugiahidroksilių alkoholių klasei.2.15. Nurodyti etanolio gavimo būdus (etenohidrataciją, gliukozės fermentaciją).2.16. Apibūdinti metanolio ir etanoliosvarbiausias naudojimo sritis ir poveikįorganizmui.2.17. Organinių junginių struktūrinėseformulėse atpaţinti aldehido ir karboksigrupes irC 2 iki C 6 struktūrinius izomerus, paaiškintigeometrinės izomerijos reiškinį alkenuose, pateikticis – izomerų ir trans – izomerų pavyzdţių.2.7. Pritaikyti prisijungimo prie alkenųreakcijoms Markovnikovo taisyklę remiantispropeno pavyzdţiu. Uţrašyti reakcijosmechanizmą. Uţrašyti eteno hidratacijos reakcijoslygtį. Uţrašyti eteno gavimo iš etanolio ir išmetano reakcijų lygtis.2.8. Nurodyti svarbiausias eteno naudojimosritis, iliustruoti reakcijų pavyzdţiais.2.9. Apibūdinti ir ryšių išsidėstymą benzenomolekulėje. Pateikti aromatinių angliavandeniliųpavyzdţių.2.10. Uţrašyti benzeno ir metilbenzeno degimobei katalizinių pavadavimo reakcijų su Br 2 ir suazoto rūgštimi lygtis.2.11. Pateikti benzeno dalyvavimo prijungimoreakcijose pavyzdţių (su H 2 ir Cl 2 ).2.12. Apibūdinti monohidroksilių sočiųjųnešakotos grandinės alkoholių homologinę eilę ikiC 6 , suteikti jiems pavadinimus pagal IUPACnomenklatūrą. Pateikti pirminių, antrinių ir tretiniųalkoholių pavyzdţių.2.13. Apibūdinti būdingiausias hidroksigrupėschemines savybes (uţrašyti reakcijų su Na, HCl,dehidratacijos reakcijų lygtis).2.14. Apibūdinti fizines ir chemines 1,2-etandiolio, 1,2,3-propanolio (glicerolio) ir fenoliosavybes. Uţrašyti reakcijų lygtimis 1,2,3-propantriolio (glicerolio) sąveiką su Cu (OH ) 2 ;fenolio sąveiką su Na, NaOH ir bromo vandeniniutirpalu.2.15. Apibūdinti etanolio gamybos iš krakmoloturinčių medţiagų fermentacijos būdu ir išceliuliozės hidrolizės būdu procesus.2.17. Apibūdinti sočiųjų nešakotos grandinėsaldehidų, ketonų ir sočiųjų monokarboksirūgščių15
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąpriskirti junginius aldehidų, karboksirūgščiųklasėms.2.19. Apibūdinti fizines ir chemines metanaliosavybes, uţrašyti jo sąveikos su Ag 2 O reakcijoslygtį.2.20. Apibūdinti paprasčiausių aldehidųsvarbiausias naudojimo sritis.2.21. Apibūdinti fizines ir chemines etanorūgšties savybes, uţrašyti jos neutralizacijos iresterifikacijos reakcijų lygtis.2.22. Nurodyti etano rūgšties naudojimo sritis.2.23. Struktūrinėse organinių junginių formulėseatpaţinti esterio grupę, nurodyti, kokiaikarboksirūgščiai ir kokiam alkoholiui sureagavussusidarė esteris.2.24. Nurodyti, kad esteriai dėl malonaus kvaponaudojami maisto pramonėje, parfumerijoje kaiptirpikliai.2.25. Apibūdinti riebalus kaip 1, 2, 3-propantriolio (glicerolio) ir karboksirūgščiųesterius. Nurodyti riebalų gamtinius šaltinius.Paaiškinti riebalų biologinę reikšmę.2.27. Atpaţinti amino grupę organinių junginiųstruktūrinėse formulėse ir priskirti junginį aminųklasei.2.29. Uţrašyti bent vienos aminorūgštiesstruktūrinę formulę.homologines eiles iki C 6 , pavadinti jų narius pagalIUPAC nomenklatūrą. Nurodyti trivialiuosiusmetano, etano ir oktadekano rūgščių beipropanono pavadinimus.2.18. Pagal pateiktą bendrąją formulę priskirtijunginį sočiosioms ar nesočiosiomskarboksirūgštims.2.19. Apibūdinti būdingiausias aldehidofunkcinės grupės chemines savybes, uţrašytialdehidų oksidacijos Cu(OH) 2 ir hidrinimoreakcijų lygtis.2.20. Apibūdinti propanono svarbiausiasnaudojimo sritis.2.21. Apibūdinti būdingiausias karboksigrupėschemines savybes (jonizacija vandenyje, druskųsudarymas, esterifikacijos reakcija, uţrašyti šiųreakcijų lygtis).2.23. Uţrašyti esterių susidarymo ir jų hidrolizėsreakcijų lygtis, pavadinti reaguojančias irsusidarančias medţiagas pagal IUPACnomenklatūrą.2.25. Uţrašyti riebalų hidrolizės reakcijos lygtį,pavadinti pagal IUPAC nomenklatūrą gaunamusproduktus. Apibūdinti skirtumą tarp gyvulinių iraugalinių riebalų.2.26. Nurodyti ryšį tarp riebalų sunaudojimomaistui ir organizmo polinkio susirgti širdies irkraujagyslių ligomis.2.27. Uţrašyti pirminių, antrinių, tretinių aminųir anilino struktūrines formules. Palyginti pirminiųir antrinių aminų bei amoniako bazines savybes.2.28. Apibūdinti fizines ir chemines metilaminosavybes, uţrašyti jo sąveikos su vandeniu ir surūgštimis reakcijų lygtis.2.29. Apibūdinti fizines ir chemines aminorūgščiųsavybes (uţrašyti reakcijų su bazėmis, su rūgštimislygtis, dipeptido susidarymo reakcijos lygtį).2.30. Naudojantis schemomis paaiškinti, kad 2.30. Atpaţinti peptidinį ryšį baltymų16
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programąbaltymai yra įvairių aminorūgščių polimerai.Paaiškinti baltymų biologinę reikšmę.2.33. Apibūdinti gliukozės susidarymąfotosintezės metu, uţrašyti bendrąją šios reakcijoslygtį. Apibūdinti gliukozės biologinę reikšmę.2.34. Paaiškinti, kad sacharozė yra disacharidas,sudarytas iš gliukozės ir fruktozės.2.35. Apibūdinti krakmolą ir celiuliozę kaipgliukozės gamtinius polimerus ir jų biologinęreikšmę.2.36. Apibūdinti polietileno ir polipropilenosavybes (lengvumą, termoplastiškumą, mechaninįstiprumą, atsparumą rūgštims ir šarmams).2.38. Nurodyti svarbiausias polietileno irpolipropileno polimerų naudojimo sritis.struktūrinėse formulėse. Apibūdinti pirminę irantrinę baltymų struktūras.2.31. Uţrašyti baltymų hidrolizės reakcijos lygtį,apibūdinti gaunamus produktus. Bendrais bruoţaisaptarti baltymų hidrolizę ir sintezę organizme.2.32. Naudojantis schemomis aptarti nukleinorūgščių sudėtį ir biologinę reikšmę.2.33. Uţrašyti bendrąsias gliukozės susidarymofotosintezės metu ir gliukozės alko holinio rūgimoreakcijų lygtis.2.35. Uţrašyti krakmolo hidrolizės reakcijoslygtį ir apibūdinti hidrolizės reikšmę organizmui.2.36. Uţrašyti polimerizacijos reakcijos lygčiųpavyzdţių. Naudojantis polimerų struktūrinėmisformulėmis nurodyti, iš kokių monomerų sudarytipolitetrafluoretilenas, polivinilchloridas,polistirenas. Apibūdinti šių polimerų būdingąsiassavybes, lemiančias jų naudojimo sritis.2.37. Apibūdinti polikondensacijos reakciją.Uţrašyti nailono susidarymo reakcijos lygtį.V tema. CHEMINĖS REAKCIJOS. CHEMINĖ PUSIAUSVYRA. TIRPALAI1.1. Pagal parašytą reakcijos lygtį atpaţintioksidacijos-redukcijos reakcijas. Apskaičiuotielementų oksidacijos laipsnius, kai duota junginioformulė.1.2. Nustatyti oksidatorių ir reduktorių beiišlyginti paprasčiausias oksidacijos-redukcijosreakcijų lygtis.1.4. Apibūdinti egzotermines ir endoterminesreakcijas.1. Cheminės reakcijos1.1. Apskaičiuoti elementų oksidacijos laipsniusjonuose.1.2. Išlyginti pateiktas sudėtingesnesoksidacijos-redukcijos reakcijų lygtis.1.3. Apibūdinti elektrolizę kaip oksidacijosredukcijosreakcijas, vykstančias NaCl ir CuCl 2tirpaluose bei NaCl lydale. Uţrašyti atitinkamųreakcijų lygtis.1.4. Pagal uţrašytas termochemines reakcijųlygtis skirti egzotermines ir endoterminesreakcijas. Atlikti skaičiavimus pagal duotą17
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programątermocheminę lygtį, susiejant išsiskiriančios arbasuvartojamos šilumos kiekį su reakcijojedalyvaujančios medţiagos kiekiu, mase, tūriu iratvirkščiai.1.5. Apibrėţti, kas yra katalizatorius. 1.5. Apibrėţti cheminių reakcijų greičio sąvokąir nurodyti jį lemiančius veiksnius: reagentųprigimtį, koncentraciją, temperatūrą, katalizatoriųpoveikį. Įvertinti, kaip pakis reakcijos greitispakėlus temperatūrą, kai duotas temperatūrinisreakcijos greičio koeficientas.2.1. Apibūdinti grįţtamąsias ir negrįţtamąsiasreakcijas.3.1. Apibūdinti vandens molekulės sandarą irfizines savybes.3.3. Tinkamai vartoti sąvokas nesotus, sotus,persotintas tirpalas3.4. Apibūdinti medţiagų tirpumopriklausomybę nuo temperatūros.3.5. Apibūdinti tirpalų koncentracijos raiškątirpinio masės dalimi. Spręsti uţdaviniusnaudojantis šiuo tirpalų koncentracijos raiškosbūdu.2. Cheminė pusiausvyra3. Tirpalai2.1. Apibūdinti cheminę pusiausvyrą kaipdinaminę būseną, kai dvi priešingos viena kitaireakcijos vyksta vienodais greičiais.2.2. Parašyti pusiausvyros konstantos išraiškąpateiktai grįţtamosios reakcijos lygčiai.2.3. Numatyti pusiausvyros poslinkį pagalpusiausvyros konstantos skaitinę vertę.2.4. Apibūdinti reakcijos pusiausvyros poslinkį(Le Šateljė principas) keičiantis slėgiui,koncentracijai, temperatūrai.3.1. Paaiškinti vandens molekulių jonizacijosprocesą.3.2. Apibūdinti vandenilinį ryšį tarp vandensmolekulių ir jo įtaką vandens savybėms.3.4. Naudojantis tirpumo kreivėmis apskaičiuoti,kokia masė medţiagos ištirps arba išsiskirs ištirpalo pakeitus tirpalo temperatūrą.3.5. Apibūdinti tirpalų koncentracijos raiškąmoline koncentracija. Spręsti uţdavinius, kaippereiti nuo molinės koncentracijos prie tirpiniomasės dalies, ir atvirkščiai (kai duotas tirpalotankis).3.6. Apskaičiuoti tirpalo koncentraciją, kaisumaišomi du tirpalai, turintys skirtingas tirpiniomasės dalis.3.7. Apskaičiuoti tirpalo koncentraciją, kaitirpalas skiedţiamas.18
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą3.8. Apibūdinti ir tinkamai vartoti sąvokasneelektrolitas, stiprusis ir silpnasis elektrolitas.3.9. Nurodyti, kad stipriesiems elektrolitamspriskiriama:– tirpios druskos,– tirpūs metalų hidroksidai,– stipriosios rūgštys.3.10. Nurodyti, kad silpnesniesiemselektrolitams priskiriama:– silpnosios rūgštys,– amoniakas,– vanduo.3.11. Rašyti bendrąsias, jonines ir sutrumpintasjonines reakcijų tirpaluose lygtis.3.12. Praktiškai taikyti indikatorius rūgščių irbazių tirpalams atpaţinti.3.13. Susieti tirpalų rūgštingumą ir bazingumąsu vandenilio jonų rodiklio pH reikšmėmis.3.10. Nurodyti, kad silpnesniesiemselektrolitams priskiriami aminai.3.13. ApskaičiuotiH aq irOH aq jonų molinękoncentraciją tirpale, kai duotas stipriosios rūgštiesarba stipriosios bazės kiekis, masė, tūris,koncentracija arba tirpalo pH.3.14. Apskaičiuoti tirpalo pH, kai duotaOH aq molinė koncentracija, ir atvirkščiai.H aq ir19
Reikalavimai mokiniams, kurie mokėsi pagalbendrojo kurso programąReikalavimai mokiniams, kurie mokėsi pagališplėstinio kurso programą1.1. Nurodyti, kad kurui degant susidaro anglies,sieros ir azoto oksidai, pateikti pavyzdţių, kaipšiais oksidais teršia aplinką energetikos irpramonės įmonės bei transportas.1.2. Paaiškinti reakcijų lygtimis „rūgščiųjųlietų“ susidarymą. Apibūdinti jų daromą ţaląaplinkai ir organizmams.1.3. Apibūdinti „šiltnamio“ reiškinį, jo prieţastisir galimas pasekmes.1.4. Apibūdinti „ozono sluoksnio“ sąvoką,paaiškinti jo reikšmę aplinkai ir ţmogui. Ţinoti,kaip apsisaugoti nuo per didelio Saulės spinduliųpoveikio.1.5. Pasiūlyti būdus ir priemones oro taršaimaţinti.2.1. Nurodyti gamtinių vandenų taršos šaltinius(netinkamas trąšų naudojimas, tarša naftos produktais,buitinė tarša), pateikti pavyzdţių, kaip šitarša gali būti sumaţinama.I tema. CHEMIJA IR APLINKA1. Oro tarša3. Vandens tarša1.4. Paaiškinti, kad oro tarša (ypač halogenintiangliavandenilių dariniai) lemia „ozono sluoksnio“retėjimą. Pateikti pavyzdţių, kokių priemoniųbuvo imtasi siekiant sumaţinti šią ţalą.2.1. Apibūdinti gamtinių vandenų taršospasekmes ir keliamus pavojus, pagrįsti nuotekųmechaninio ir cheminio valymo būtinybę.3.1. Paaiškinti netinkamo atliekų tvarkymokeliamus pavojus ir pateikti pavyzdţių, kaip jasreikia tvarkyti.3. Dirvožemio tarša3.1. Apibūdinti dirvos taršą sunkiaisiaismetalais, naftos produktais, pertręšimu, pesticidaisir kitomis cheminėmis medţiagomis, pasiūlytipriemonių padėčiai pagerinti.VI. EGZAMINO MATRICA23. Egzamino matricos paskirtis – uţtikrinti proporcingą <strong>egzamino</strong> klausimų pasiskirstymą pagalchemijos dalyko temas ir tikrinamus gebėjimus.24. Egzamino matrica reglamentuoja klausimų pasiskirstymą pagal tikrinamus gebėjimus.Pavyzdţiui, chemijos <strong>valstybinio</strong> <strong>brandos</strong> <strong>egzamino</strong> uţduotyje klausimams, tikrinantiems ţinių irsupratimo gebėjimus, skiriama maţdaug 50 proc. visų taškų, o klausimams, tikrinantiems problemųsprendimo gebėjimus – 50 proc. visų taškų. <strong>Chemijos</strong> <strong>valstybinio</strong> <strong>brandos</strong> <strong>egzamino</strong> matrica pateiktalentelėje (3 lentelė).24.1. 3 lentelėje parodyta, kiek uţduoties taškų procentais tenka kiekvienai turinio temai ir gebėjimųgrupei, pavyzdţiui, chemija ir aplinka klausimams bus skirta nuo 3 iki 7 proc. uţduoties taškų, iš jų – nuo1 iki 3 proc. bendrojo kurso klausimų, problemų sprendimo gebėjimams tikrinti – 50 proc. uţduoties20
taškų. Temoms skirtų uţduoties taškų dalis procentais tiems mokiniams, kurie mokėsi pagal bendrąjįkursą, nurodyti su prierašu bk.TemosGebėjimaiKlausimaiţinių ir supratimo problemų sprendimo3 l e n t e l ėProcentaiCheminis eksperimentas. Bendriejicheminiai skaičiavimai.18-227-9 bk.Atomo sandara. Periodinis dėsnis,8-12periodinė elementų lentelė. Cheminis3-5 bk.ryšys.Neorganinių medţiagų sudėtis irsavybės, gavimas ir panaudojimas.18-227-9 bk.Organinių junginių sandara ir savybės,gavimas ir panaudojimas.28-3211-13 bk.Cheminės reakcijos. Cheminėpusiausvyra. Tirpalai.13-175-7 bk.Chemija ir aplinka.3-71-3 bk.Iš viso egzamine 50 50 100VII. EGZAMINO STRUKTŪRA25. Egzamino uţduotys pateikiamos kaip atskiras vientisas uţduočių rinkinys. Valstybinio <strong>brandos</strong><strong>egzamino</strong> uţduočių rinkinį sudaro klausimai su pasirenkamaisiais atsakymais, trumpojo atsakymoklausimai, struktūriniai klausimai ir sprendimų ir atsakymų lapas. Kitos <strong>egzamino</strong> uţduočių detalėspateikiamos 4 lentelėje.4 l e n t e l ėEgzamino struktūra ir apibūdinimasValstybinis <strong>brandos</strong> egzaminasI dalis30 klausimų (30 taškų)Klausimai su pasirenkamaisiais atsakymaisII dalis10 klausimų (10 taškų)Trumpojo atsakymo klausimaiIII dalis6–10 klausimų (50– 60 taškų)Struktūriniai klausimaiIš viso taškų90– 100 taškųEgzamino trukmė3 val.Atsakymai pateikiamiSprendimų ir atsakymų lape26. Nurodymai valstybiniam chemijos <strong>brandos</strong> egzaminui:26.1. Egzamino metu galima naudotis rašymo priemonėmis (parkeriu, tušinuku, pieštuku),trintuku, liniuote, skaičiuokliu be tekstinės atminties.26.2. Visus atsakymus į uţduočių klausimus privalu tamsiai mėlyna spalva rašančiu rašikliuįrašyti sprendimų ir atsakymų lape. Pateikiamas vertinti tik sprendimų ir atsakymų lapas.26.3. Grafikai taip pat turi būti braiţomi tamsiai mėlyna spalva rašančiu rašikliu.26.4. Pasirinktus atsakymus į I dalies klausimus reikia paţymėti kryţeliu sprendimų ir atsakymųlape (ţymėti tik vieną atsakymo variantą). Šio ţymėjimo taisyti negalima. Jei bus paţymėta daugiau kaipvienas atsakymo variantas, tas klausimas bus vertinamas 0 taškų. Suklydus atsakymas gali būti taisomassprendimų ir atsakymų lape nurodytoje vietoje.26.5. II dalies klausimų atsakymai įrašomi tam skirtoje sprendimų ir atsakymų lapo vietoje į vienąlangelį įrašant tik po vieną skaitmenį ar raidę.21
26.6. Sprendimų ir atsakymų lape skirtoje vietoje įrašomi III dalies klausimų sprendimai iratsakymai. Uţ ribų parašyti atsakymai nebus vertinami.VIII. VERTINIMAS27. Valstybinį <strong>brandos</strong> egzaminą laikiusių mokinių darbai koduojami ir vertinami centralizuotai.Valstybinio <strong>brandos</strong> <strong>egzamino</strong> vertinimas yra norminis, atliekamas lyginant tarp savęs visų egzaminąlaikiusių mokinių rezultatus. Vertintojai mokinių darbus įvertina taškais, kuriuos <strong>Nacionalinis</strong> egzaminųcentras perskaičiuoja į balus nuo 1 iki 100 pagal valstybinių <strong>brandos</strong> egzaminų Vertinimo komitetonustatytą ir patvirtintą minimalią <strong>egzamino</strong> išlaikymo ribą taškais.28. Vertinimo komisija mokinių darbus vertina taškais vadovaudamasi vertinimo instrukcija. Uţkiekvieną teisingai atsakytą klausimą su pasirenkamaisiais atsakymais mokinys gauna 1 tašką.Struktūriniuose klausimuose šalia kiekvieno smulkesnio klausimo nurodomas jo vertinimas taškais.22