72121 â ×××××××× ×©× ××ª× ×ª×¨××× ×ס' 3: ×××××ר×פס×× - TeachLine
72121 â ×××××××× ×©× ××ª× ×ª×¨××× ×ס' 3: ×××××ר×פס×× - TeachLine
72121 â ×××××××× ×©× ××ª× ×ª×¨××× ×ס' 3: ×××××ר×פס×× - TeachLine
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
– ביוכימיה של התא<br />
72120<br />
מנגנוני קטליזה אנזימתית -<br />
כימוטריפסין<br />
1
כימיה אורגנית 0<br />
נוקלאופיל –<br />
ריאגנט אשר יוצר קשר על ידי תרומת שני אלקטרוני הקשר.<br />
זוג אלקטרונים בלתי קושרים.<br />
צריך להכיל<br />
•<br />
–<br />
אלקטרופיל ריאגנט אשר נמשך לאלקטרונים, ומקבל את שני אלקטרוני הקשר<br />
בתגובה. בדרך כלל נושא מטען או מטען חלקי חיובי.<br />
•<br />
התקפה נוקלאופילית<br />
את האלקטרופיל.<br />
– תגובה שבה<br />
נוקלאופיל<br />
"תוקף"<br />
באמצעות אלקטרוני הקשר<br />
•<br />
2<br />
)<br />
פחמן קרבונילי מהווה אלקטרופיל<br />
נפוץ בתגובות ביולוגיות. ( C=O<br />
•
אסטרגיות של קטליזה<br />
–Covalent catalysis האתר הפעיל מכיל בדרך<br />
קוולנטי זמני עם הסובסטרט.<br />
נוקלאופיל חזק שיוצר קשר<br />
•<br />
A<br />
B<br />
OH<br />
+ X<br />
X +<br />
2<br />
A + +<br />
A B X B<br />
שני השלבים צריכים להיות מהירים יותר מהריאקציה ללא קטליזה.<br />
3
אסטרגיות של קטליזה<br />
–Metal ion catalysis<br />
אופנים:<br />
–<br />
–<br />
ייצוב מטען.<br />
יצירת נוקלאופיל חזק יותר.<br />
יון המתכת באנזים יכול לפעול בכמה<br />
•<br />
הידוק הקשר בין האנזים והסובסטרט.<br />
עיצוב הקשר בין האנזים והסובסטרט.<br />
–<br />
–<br />
4
אסטרגיות של קטליזה<br />
General acid/base<br />
ה– אנזים מגלם<br />
תפקיד של חומצה או בסיס.<br />
בסיס/חומצה ספציפיים – תגובות בהם הבסיס<br />
או החומצה בעצמם משתתפים בתגובה )מים(.<br />
בסיס/חומצה כלליים – הסרה או הוספה של<br />
פרוטונים לזירוז התגובה, מסייע בבניית<br />
נוקלאופיל חזק.<br />
לעתים קרובות His ישחק את תפקיד הבסיס<br />
או החומצה.<br />
•<br />
•<br />
•<br />
•<br />
5
אסטרגיות של קטליזה<br />
–Catalysis by approximation האנזים מאפשר אוריינטציה<br />
ספציפית אשר מגבירה את הסיכוי להתרחשות ריאקציה.<br />
•<br />
6
פרוטאז =<br />
כימוטריפסין<br />
אנזים המקטלז ביקוע של קשרים פפטידים, בתגובת הידרוליזה.<br />
שייך למשפחת .serine proteases<br />
למרות שהידרוליזה של קשר פפטידי היא תהליך מועדף תרמודינמית ,)0>0(<br />
7<br />
אנזים מתגבר על מכשולים אלו על ידי כך שמספק סביבה ספציפית<br />
הריאקציה יכולה להתרחש מהר יותר.<br />
)האתר הפעיל( שבה
התפקיד הביולוגי של כימוטריפסין<br />
כימוטריפסין שייך לאנזימי מערכת העיכול. מיוצר ומופרש מהלבלב אל המעי הדק.<br />
אנזימי העיכול מיוצרים בלבלב כ zymogens שהם פרקורסורים לא-פעילים שהופכים<br />
לאנזימים פעילים רק כאשר מגיעים לאתר הפעולה שלהם במעי הדק.<br />
8
הביקוע הספציפי בשרשרת הפפטידית של כימוטריפסינוגן גורם<br />
לשינוי קונפורמציה שחושף את האתר הפעיל של האנזים.<br />
שלוש השרשראות הפפטידיות המרכיבות את האנזים הפעיל<br />
מחוברות זו לזו באמצעות קשרים דיסולפידיים.<br />
9<br />
– צהוב<br />
קשרים דיסולפידיים
הסובסטרט<br />
לכימוטריפסין יש העדפה<br />
ברורה לביקוע קשר פפטידי<br />
אחרי שייר נפחי והידרופובי.<br />
כימוטריפסין מבקע באופן סלקטיבי את הקשר הפפטידי<br />
הארומטיות.<br />
בקצה<br />
’C של חומצות האמינו<br />
כיס הקישור ההידרופובי אחראי לספציפיות של האנזים לסובסטרט.<br />
10
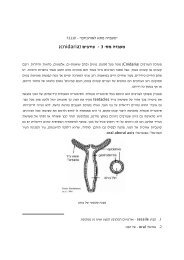
המבנה של כימוטריפסין<br />
אתר הקישור<br />
ירוק –כיס הקישור בו יושב השייר הצידי של<br />
החומצה האמינית הארומטית<br />
חלבון גלובולרי, מבנה שניוני שרובו בקונפורמצית β. שלוש שרשראות<br />
מחוברות בקשרים דיסולפידים.<br />
11<br />
אדום –<br />
הפעיל.<br />
חומצות האמינו המרכיבות את האתר
ניסוי של הרטלי וקילבי משנת 1954:<br />
Burst phase<br />
12<br />
כימוטריפסין פועל ב-2 שלבים. קטליזה קוולנטית.<br />
+ + + +<br />
A B X A X B A X B
תוצאות ניסוי זה היוו חלק מההוכחות לקיומו של תוצר הביניים אציל-אנזים קוולנטי.<br />
הריאקציה מתחילה בקצב מהיר שאחריה התמתנות של הקצב. שלב הקצב המהיר<br />
)phase משקף את האצילציה המהירה שעוברות כל מולקולות האנזים )משוחררת כמות<br />
ניטרופנול כמעט מקבילה סטוכיומטרית לכמות האנזים( והקצב עבור ערך ה<br />
האנזים מוגבל ע"י שלב הדה-אצילציה האיטי.<br />
burst (<br />
turnover של<br />
13
מנגנון הפעולה של כימוטריפסין<br />
תוצר ביניים קוולנטי<br />
-<br />
)acylation phase(<br />
-<br />
ביקוע הקשר הפפטידי ויצירת קשר אסטרי בין<br />
שלב האצילציה<br />
הפחמן הקרבונילי של הפפטיד והאנזים )יצירת אציל-אנזים קוולנטי שהוא תוצר ביניים<br />
זמני(.<br />
שלב הדה-אצילציה phase( )deacylation – הידרוליזה של הקשר האסטרי ורגנרציה<br />
של האנזים.<br />
14
מנגנון הפעולה של כימוטריפסין - מפורט<br />
שלב האצילציה phase( )acylation<br />
אתר הקישור ההידרופובי קובע את הספציפיות של כימוטריפסין.<br />
15
Ser 195<br />
הנוקליאופיל בשלב האצילציה הוא אטום החמצן של ה. pKa של ההידרוקסיל של<br />
סרין בד"כ גבוה מכדי שהצורון המיונן יהיה נוכח ב pH פיזיולוגי, אולם הסביבה הכימית<br />
של בכימוטריפסין גורמת להנמכת ה pKa שלו.<br />
כיצד?<br />
Ser 195<br />
The catalytic triad<br />
16
17<br />
The catalytic triad
שלב 1<br />
– הסובסטרט נקשר לאנזים. Ser 195 מעביר פרוטון ל<br />
נוקליאופילית על הפחמן הקרבונילי של הסובסטרט.<br />
His 57<br />
ומבצע התקפה<br />
מתקבל תוצר ביניים טטרהדרלי קצר-חיים שבו יש מטען שלילי על החמצן הקרבונילי של<br />
הסובסטרט. מטען זה מיוצב ע"י קשרי מימן ב hole“ ."oxyanion<br />
18
שלב 2<br />
– חוסר יציבות של המטען השלילי על החמצן הקרבונילי מוביל לפירוק תוצר<br />
הביניים. יצירה מחדש של הקשר הכפול עם הפחמן מחליפה את הקשר בין הפחמן וקבוצת<br />
האמינו של הקשר הפפטידי וכך נשבר הקשר הפפטידי.<br />
נוצר אציל-אנזים.<br />
קבוצת האמינו עוברת פרוטונציה ע"י<br />
.His 57<br />
19
–<br />
שלב 3<br />
אמין השתחרר מהאנזים.<br />
20
שלב הדה-אצילציה phase( )deacylation<br />
.His 57 מולקולת המים<br />
( 57 His מקבל<br />
שלב 4<br />
– מולקולת מים נכנסת דרך<br />
קשר מימן עם<br />
עוברת דה-פרוטונציה<br />
פרוטון(. יון ההידרוקסיד תוקף את<br />
הקשר האסטרי של האציל-אנזים.<br />
תוצר ביניים טטרהדרלי נוצר. מטען<br />
שלילי על חמצן קרבונילי מיוצב על<br />
ידי קשרי מימן ב hole“ ."oxyanion<br />
21
Ser 195 משתחרר. His 57 עובר דה-פרוטונציה<br />
–<br />
שלב 5<br />
חוסר יציבות מוביל לפירוק תוצר הביניים.<br />
ומעביר פרוטון ל<br />
.Ser 195<br />
22
– קומפלקס אנזים-תוצר .)EP(<br />
שלב 6<br />
23
בשלב 7<br />
התוצר משתחרר מהאתר הפעיל<br />
כך שהאנזים מוכן שוב לפעולה.<br />
24
מנגנון הפעולה של כימוטריפסין מדגים עקרונות קטליטיים המצויים בשימוש ע"י<br />
אנזימים רבים:<br />
–<br />
Covalent catalysis<br />
האתר הפעיל מכיל קבוצה ריאקטיבית, בד"כ נוקלאופיל<br />
חזק, שבמהלך הקטליזה עובר מודיפיקציה קוולנטית זמנית.<br />
בכימוטריפסין –<br />
יצירת אציל-אנזים.<br />
– מולקולה אחרת מ H 2 O<br />
General acid-base catalysis<br />
.proton donor/acceptor<br />
בכימוטריפסין<br />
הריאקציה.<br />
-<br />
משמשת בתפקיד<br />
His 57 תיפקד כבסיס בשלבים מסוימים וכחומצה בשלבים אחרים במהלך<br />
25
שאלה 1:<br />
להלן פרוטאזות הדומות לכימוטריפסין. נתונים אתרי הקישור של שתיים מהן,<br />
יהיה אופי הסובסטרטים של כל אחת מהן:<br />
נסו לנחש מה<br />
כימוטריפסין קושר בעיקר חומצות אמינו הידרפוביות גדולות )ארומטיות(, כפי שרואים יש לו<br />
כיס קישור גדול. טריפסין חותך אחרי שיירים טעונים חיובית )ליזין וארגינין( בעוד אלסטאז<br />
חותך אחרי שיירים קטנים.<br />
26
שאלה 2<br />
Asp 102<br />
במחקר נעשתה מוטציה ב בכימוטריפסין<br />
והוחלט לבדוק את הפעילות של האנזים המוטנט.<br />
מה יהיה ההבדל בערכי K m ו- בין האנזים המוטנט ל-WT?<br />
k cat<br />
ל Asn<br />
תשובה<br />
k cat<br />
היות ש Asp 102 משתתף ב-triad catalytic היכולת של האנזים ליצור נוקלאופיל חזק<br />
יותר תקטן, ולכן גם שלב האצילציה וגם שלב הדה-אצילציה יהיו איטיים יותר<br />
כך ש יהיה נמוך בהרבה.<br />
עם זאת, לא ניתן לקבוע לגבי K m בצורה ודאית היות שאנו לא יודעים איזה מהשלבים<br />
יואט בצורה משמעותית יותר.<br />
27
:3<br />
Tosyl-l-phenylalanine chloromethyl ketone (TPCK)<br />
His 57<br />
.<br />
שאלה<br />
מעכב באופן ספציפי כימוטריפסין<br />
הריאגנט<br />
על ידי קישור קוולנטי ל<br />
א ציינו מדוע המעכב ספציפי עבור כימוטריפסין.<br />
ב. הציעו ריאגנט, בהתבסס על מבנה TPCK שעשוי להיות מעכב יעיל של טריפסין.<br />
TPCK<br />
פתרון:<br />
ספציפי לכימוטריפסין היות והטבעת הפנילית של עוברת אינטראקציה יעילה עם כיס<br />
הקישור של האתר הפעיל של כימוטריפסין. כך קבוצת הכלורומתיל מוצבת במיקום המאפשר הגבה עם<br />
His 57<br />
ב . החלפה של שייר ה Phe בארגינין או ליזין תיצור ריאגנטים שיהיו ספציפיים לעיכוב טריפסין.<br />
28<br />
Phe<br />
ב TPCK<br />
א. TPCK
urst<br />
שאלה 4<br />
כאשר כימוטריפסין מפרק סובסטרט מסוים X, לא נמדד שלב<br />
בצורה לינארית לכל אורכה. מה ההסבר הסביר ביותר?<br />
והריאקציה מתנהגת<br />
א. כימוטריפסין מפרק את התוצר באסטרטגיה של חומצה ובסיס כלליים ואין תוצרי<br />
ביניים בתגובה.<br />
ב. הסובסטרט המדובר מתפרק בצורה דומה כמו בניסוי של הרטלי וקילבי אך התוצר<br />
אשר אותו "רואים" בניסוי הוא התוצר השני שמשתחרר.<br />
ג. שלב יצירת האציל-אנזים הוא שלב קובע המהירות ושלב פירוק האציל-אנזים הוא<br />
השלב המהיר.<br />
ד. כימוטריפסין אינו מסוגל לפרק את קומפלקס האציל-אנזים במקרה של פירוק<br />
סובסטרט X.<br />
29<br />
תשובה ב נכונה מבחינה עקרונית,<br />
תשובה ג נותנת הסבר ביולוגי<br />
אך היא מתארת טעות של הנסיין.
שאלה 5<br />
איזה משפט הוא הנכון ביותר לגבי השלשה הקטליטית של כימוטריפסין?<br />
א. שלושת השיירים משמשים בתגובה כחומצות או בסיסים כלליים.<br />
ב. סרין 195 משתתף בתגובה וקושר קוולנטית את השייר של היסטידין 57 ולכן התגובה<br />
נחשבת כקטליזה קוולנטית.<br />
ג. סרין 195 אשר בדר"כ מהווה נוקלאופיל חלש משמש כנוקלאופיל חזק בריאקציה<br />
בכימוטריפסין.<br />
ד. אספרטאט 102 משמש גם נוקלאופיל וגם אלקטרופיל בריאקציה.<br />
30<br />
ג