lez.1 biochimica - Omero
lez.1 biochimica - Omero
lez.1 biochimica - Omero
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Biochimica 6 CFU 6x7=42 ore http//omero,farm.unipi.itL’esame finale è costituito da una prova orale che riguarderà gli argomenti svoltidurante il corso.L'esame finale potrà essere diluito mediante prove “in itinere” programmate. Per glistudenti che abbiano sostenuto positivamente tali prove, l’esame di profitto saràcostituito da uno scrutinio condotto dalla commissione sulla base dei risultatiottenuti nelle suddette prove eventualmente integrate da un ulteriore colloquioA. L. Lehninger, D. L. Nelson, M. M. Cox “Principi di Biochimica” ed. ZanichelliPer quanto riguarda la Struttura e funzione delle biomolecole :R.H. Garret e C.M. Grisham "Biochimica" ed. ZanichelliL. Stryer "Biochimica" ed. Zanichelli (specialmente per la parte della emoglobia emioglobina)Mathews e Van Holde "Biochimica" ed.Casa Editrice AmbrosianaPer il Metabolismo intermedio e sua regolazione:R.H. Garret e C.M. Grisham "Biochimica" ed. ZanichelliMathews e Van Holde "Biochimica" ed.Casa Editrice AmbrosianaJ.D. Rawn “Biochimica” ed. Mc Graw-HillPer il Messaggi tra cellule e tessuti : ormoniR.H. Garret e C.M. Grisham “Biochimica” ed. ZanichelliC.M. Caldarera “Biochimica Sistematica Umana” ed. Clueb cap.7 e 8
Un legame ionico si forma fra atomi che hannouna forte differenza di elettronegatività(grandezza introdotta per confrontarerapidamente la forza con cui ogni atomo tienelegati a sé i suoi elettroni), cioè la cuidifferenza dei valori di elettronegatività èsuperiore a 1,7.Quando due atomi si avvicinano (un metallo e unatomo di un elemento degli ultimi gruppi), glielettroni del livello più esterno dell’atomo menoelettronegativo passano all’atomo piùelettronegativo. Quest’ultimo diviene quindi unoione negativo, mentre l’altro atomo diviene unoione positivo (uno ione è un atomo, dotato di caricaelettrica). Fra i due ioni con cariche elettricheopposte si stabilisce un’attrazione di tipoelettrostatico che li tiene uniti: quest’attrazionecostituisce il legame. I composti contenenti legamiionici sono chiamati composti ionici (NaCl, MgCl 2,ecc).
Formazione del legame ionico nel cloruro di sodio (NaCl)1 – L’atomo di sodio perde il suo elettrone esterno e diventauno ione positivo.= Atomo di sodio(Na)Na Na + + e -
2 – L’atomo di cloro acquista l’elettrone perduto dal cloro ediventa ione negativo.Cl + e - Cl - clicca quiclicca quiper tornareper
Oltre agli ioni formati da un solo atomo esistono ancheioni negativi molecolari, cioè raggruppamenti di atomicon una o più cariche elettriche diffuse su tutto il gruppo.Esempi comuni sono gli ioni nitrato (NO 3-), solfato (SO 42-).Ioni positivi molecolari sono più rari. Tra questi ritroviamolo ione ammonio (NH 4+).Anche questi ioni possono dare luogo a composti ionici,comportandosi esattamente come gli ioni monoatomici.Un esempio è un composto costituito da ioni calcio e ioninitrato che ha formula Ca(NO 3) 2, dove occorrono due ioninitrato per bilanciare le due cariche positive dello ionecalcio.
Il legame covalente si forma fra atomi la cui differenza deivalori di elettronegatività non è maggiore di 1,7. I dueatomi mettono in comune un elettrone ciascuno. Glielettroni che vengono messi in comune sono elettronispaiati, cioè elettroni che si trovano isolati in un orbitale.Quando i due atomi si avvicinano a sufficienza, avvieneuna parziale sovrapposizione dei due orbitali in cui sitrovano gli elettroni spaiati: i due orbitali si compenetranol’un l’altro per una certa regione di spazio, che apparterràcontemporaneamente ad entrambi gli orbitali e diconseguenza gli elettroni che si trovano in questi orbitaliapparterranno contemporaneamente ai due atomi.Il legame covalente è il legame chimico più forte e sidistinguono due tipi di legame covalente:1 - il legame covalente puro;2 - il legame covalente polare.
Un legame covalente è detto “puro” quando siforma fra atomi con lo stesso valore dielettronegatività, oppure valori molto vicini. Inquesto caso, gli elettroni che vengono messi incomune fra i due atomi vengono attratti con lastessa forza da entrambi i nuclei e, perciò,vengono ad essere condivisi in maniera ugualefra i due atomi (c’è una distribuzionesimmetrica della nube elettronica). Esempisono la molecola dell’idrogeno (H 2) o del cloro(Cl 2).
IL LEGAME NELLA MOLECOLA DI IDROGENO H 2L’atomo di idrogeno ha solo un elettrone esterno e quindispaiato. Il gas nobile più vicino all’idrogeno è l’elio (He), cheha due elettroni nel livello più esterno, cioè ha il primolivello energetico completamente occupato. L’idrogenotende a raggiungere la configurazione dell’elio, cioè atrovare un modo per avere due elettroni nel primo livello.Se due atomi di idrogeno mettono in comune i loro elettroni,ognuno di essi avrà due elettroni, sia pure in comune conl’altro atomo.H H H H
Un legame covalente polare si forma tra atomi chehanno elettronegatività diversa, ma non tanto diversada rendere possibile la formazione di un legame ionico(la differenza dei valori di elettronegatività è sempreminore di 1,7).I due atomi mettono in comune i loro elettroni spaiati,tramite la sovrapposizione degli orbitali in cui sitrovano questi elettroni. Tuttavia la coppia di elettroninon è equamente condivisa fra i due atomi: glielettroni passano più tempo attorno all’atomo piùelettronegativo, rendendolo parzialmente (non c’è untrasferimento completo di una carica elettrica da unatomo all’altro, quindi non si formano ioni) negativo,mentre l’altro atomo diviene parzialmente positivo.
Una molecola biatomica contenente un legame polareè sempre polare, cioè ha un’estremità positiva eun’estremità negativa.Nel caso di molecole con più di due atomi, la situazionepuò essere diversa, e dipende dalla geometria dellamolecola e dalla somma vettoriale dei momentidipolari associati ai vari legami polari.Possiamo considerare alcuni esempi:- la molecola dell’acqua (H 2O)- la molecola del biossido di carbonio (CO 2)
Il legame dativo (o di coordinazione) è un legamecovalente in cui due elettroni di legame provengonoda uno stesso atomo.Quindi, perché fra due atomi si possa formare unlegame dativo, uno dei due deve avere una coppiadi elettroni in uno stesso orbitale, non impegnata inun nessun legame, e l’altro atomo deve avere unorbitale vuoto nel quale poter “alloggiare” questacoppia. Allora la coppia di elettroni viene messa incomune fra i due atomi. I due orbitali sisovrappongono e si forma il legame. L’atomo chefornisce la coppia di elettroni si chiama agentenucleofilo o donatore, mentre l’altro atomo sichiama agente elettrofilo o accettore.
Esempi di legame dativo all’interno delle molecole li ritroviamo negli ossiacidi delcloro(idrogeno + ossigeno + cloro):H Cl OLa molecola del più semplice di essi, l’acido ipocloroso (HClO), contiene duelegami covalenti, uno tra l’atomo di cloro e quello di ossigeno,l’altro tra l’atomo diossigeno e quello di idrogeno:ClO HIn questa molecola, l’atomo di cloro ha tre coppie di elettroni disponibili, cioè nonimpegnate in legami. Anche l’ossigeno ne ha due, ma, essendo l’ossigeno unatomo fortemente elettronegativo tende ad avere il ruolo di accettore. Se un altroatomo di ossigeno si avvicina alla molecola di HClO, esso “accoppia” i suoi dueelettroni spaiati in un unico orbitale, in modo tale da avere un orbitale vuoto nelquale “alloggiare” una delle coppie di elettroni del cloro. Si forma così il legamelegame dativo Odativo tra l’atomo di ossigeno (accettore) e l’atomo di cloro (donatore). Lamolecola che risulta è quella dell’acido cloroso, HClO 2.ClO H
Il legame a idrogeno, o a ponte di idrogeno, è un legame che siforma fra molecole che contengono un atomo di idrogenolegato ad un altro atomo più elettronegativo e di piccoledimensioni.Il legame in queste molecole è covalente polare, con polaritàaccentuata: l’atomo di idrogeno è parzialmente positivo, l’altroatomo è parzialmente negativo. Si stabilisce allora un’attrazioneelettrostatica fra l’atomo di idrogeno di una molecola e l’altroatomo di un’altra molecola. Gli atomi che sono allo stessotempo sufficientemente elettronegativi e piccoli sono soltantotre: quelli dell’azoto, dell’ossigeno e del fluoro. Quindi siformano legami a idrogeno quando un atomo di idrogeno èlegato a uno di questi tre atomi. Quindi come esempi possiamoanalizzare in dettaglio:la molecola dell’acqua (H 2O)la molecola del fluoruro di idrogeno (HF)
LEGAMI A IDROGENO NELLA MOLECOLA DIACQUA (H 2O)Nella molecola di acqua, l’atomo di ossigeno èparzialmente negativo, mentre i due atomi di idrogenosono parzialmente positivi. Quando due molecole diacqua si avvicinano, si stabilisce un’attrazioneelettrostatica fra l’atomo di ossigeno di una di esse euno degli atomi di idrogeno dell’altra. Si forma così unlegame a idrogeno fra le due molecole.d +d -d + d -d + d+
Macromolecole BiologicheInterazioni noncovalentiD— H−−Aδ - δ + δ -
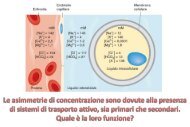
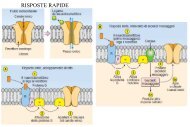
Macromolecole BiologicheLe interazioni non covalentiInterazioni fra atomi che non sono legati da legami covalenti.Le interazioni non covalenti sono molto meno intense rispetto alle interazionicovalenti (poche kcal/mol rispetto a 83 kcal/mol per un legame C–C).Questi legami deboli possono formarsi sia fra parti diverse della stessamacromolecola, sia fra parti di macromolecole diverse.Essi giocano un ruolo fondamentale in molti processi biologici, fra cui lafedele replicazione del DNA, il folding delle proteine, il riconoscimentospecifico di substrati da parte di enzimi, il riconoscimento di molecolesegnale.Le interazioni non covalenti si possono classificare in:- interazioni elettrostatiche- legami idrogeno- interazioni di van der Waals- effetto idrofobico
Macromolecole BiologicheLe interazioni non covalentiEnergie di legame associate alle principali interazioni non covalenti:Tipo di interazione non covalente Energia di legame (kcal/mole)Interazioni elettrostatiche 0.3-4Legame idrogeno 0.5-4Interazioni di van der Waals 0.03-0.1Nel considerare i vari contributi energetici che stabilizzano una proteina nonsi può prescindere dal fatto che la proteina è immersa in un solvente, che ècostituito principalmente da acqua. Le proprietà fisiche del solvente sonoestremamente importanti per la stabilità della proteina.
Macromolecole BiologicheEffetto idrofobicoLe interazioni fra acqua e superfici non polari non sono favorevoli: propriocome l’olio disperso nell’acqua tende a raccogliersi in un’unica goccia, anchei gruppi non polari nelle proteine tendono ad aggregarsi, per ridurre lasuperficie apolare a contatto con l’acqua.Questa preferenza di specie non polari per ambienti non acquosi viene dettoeffetto idrofobico: esso è uno dei principali fattori di stabilità delle proteine.L’effetto idrofobico fa sì che sostanze non polari minimizzino il loro contattocon l’acqua, e molecole anfipatiche (come per esempio i detergenti) forminomicelle in soluzioni acquose.Il meccanismo fisico per cui entità non polari sono escluse da soluzioniacquose è di carattere entropico.
Macromolecole BiologicheEffetto idrofobicoLe molecole d’acqua allo stato liquido formano dinamicamente un altonumero di legami idrogeno, in funzione della temperatura.L’introduzione di una molecola non polare nell’acqua liquida crea una sortadi cavità nell’acqua, che temporaneamente rompe alcuni legami idrogeno frale molecole d’acqua, poiché un gruppo non polare non può né accettare nédonare legami idrogeno con le molecole d’acqua.Le molecole d’acqua spostate si riorientano performare il maggior numero di nuovi legamiidrogeno, creando una struttura ordinata, unaspecie di gabbia, detta clatrato, intorno allamolecola non polare.
Macromolecole BiologicheEffetto idrofobicoPoiché il numero di modi con cui le molecole d’acqua formano legamiidrogeno sulla superficie di un gruppo non polare è inferiore a quello chefarebbero in sua assenza si ha una diminuzione di entropia del sistema.Anche se, da un punto di vista entalpico, il sistema clatrato è più stabile(ΔH < 0, per una debole liberazione di energia dovuto alla formazione dilegami idrogeno ed interazioni di van der Waals), globalmente:ΔG = ΔH – TΔS > 0 processo non spontaneoQuindi perchè il processo sia spontaneo (DG
Legame Dativo:È un legame che si forma per condivisione di una coppia di elettronitra due atomi, ma è uno solo dei due atomi che cede la sua coppia(doppietto) che alla fine risulta in comune. Detto in altre parole piùsemplici, si forma quando c’è un atomo che può fornire coppie dielettroni. Esempio:H H +H+ + H N H N HH HAmmoniaca Ione Ammonio
Legami chimici secondari “Forza di London”Le forze di london sono determinate da una forza di naturaelettrostatica che si manifesta tra le molecole apolari. Ogni molecolaapolare, infatti, presenta un’estremità positiva e un’estremitànegativa. La parte positiva attira a sé la parte negativa di unamolecola vicina; le varie molecole risultano così legate l’una all’altrada una forza attrattiva di natura elettrostatica, dette appunto forze diLondon . Esempio di molecole apolari:
Forze di Van der WaalsLe forze di Van der Waals sono forze attrattive che si esercitano tra lemolecole polari, è l’intensità delle forze aumenta al crescere delledimensioni delle molecole. Le forze attrattive si giustificano tenendoconto del fatto che ogni nucleo atomico esercita attrazione sui suoielettroni ma anche (pur se in misura molto minore) sugli elettroni diatomi vicini. Da queste azioni attrattive si generano deboli legami trale molecole. Le forze di Van der Waals sono presenti ad esempio tra lemolecole di Br2, nel bromo allo stato liquido.ATTRAZIONELegame a idrogenoNelle molecole contenenti atomi di idrogeno legati ad atomi di piccoledimensioni, di notevole elettronegatività , si instaura un legamecovalente, cioè lo spostamento degli elettroni di legame verso l'atomopiù elettronegativo l'idrogeno risulta parzialmente positivo e l'altroatomo parzialmente negativo:
pertanto tra l'idrogeno e un'altra analoga molecola si manifestanodelle forze di carattere elettrostatico più deboli dei normali legamiionici o covalenti ma sufficienti a costituire ostacolo al movimentodelle molecole; la presenza di questi legami influenza soprattutto leproprietà fisiche. Un singolo atomo di idrogeno risulta quindi legatocontemporaneamente a due atomi distinti, all'uno con un legamecovalente e all'altro con un legame molto più debole, il legame aidrogeno appunto, che comunemente si rappresenta con dei puntini.Ecco un esempio di legame a idrogeno:O···HOcioè l’acido aceticoH3CCC CH 3OH···O
LEGAMI CHIMICILEGAMI PRINCIPALILEGAMI SECONDARILEGAMI IONICILEGAMI COVALENTIPURILEGAMI COVALENTIPOLARILEGAMI METALLICILEGAME DATIVOFORZA DI LONDONFORZA DI VAN DERWAALSLEGAME A IDROGENO
Diversità tra i viventiProprietà della VITALa CELLULAClassificazione dei viventi1
Ciascun vivente nasce, cresce, genera dei figli a luisimili e muore. La nascita, la crescita, la generazionedi figli e la morte rappresentano le più evidentimanifestazioni della vita.Perché un vivente può realizzare questi eventi ?Tutti i viventi possiedonodelle caratteristiche comuni2
Le proprietà della vita (1/4)1Organizzazioneparticellesubatomicheatomo molecola organulo cellula tessuto organo apparatopopolazione comunità ecosistema biosferaorganismoTutti i viventi sono formati damateria, organizzata in molecole,come i non viventi. La composizionechimica del vivente è, tuttavia,qualitativamente diversa rispetto aquella dell'ambiente che locirconda. Le molecole dei viventi,inoltre, sono organizzate in"impalcature" che costituisconosistemi altamente complessi.La vita è organizzata su più livellidi complessità crescente3
Le proprietà della vita (2/4)2Capacità di trasformaremateria ed energiaAttraverso la nutrizione il ciboPer mantenere la loro particolareorganizzazione i viventi devonoassumere materia e “spendere”energia. L’energia è indispensabileper trasformare la materia instrutture viventi.viene trasformato in materia vivente4
Le proprietà della vita (3/4)3 Capacità di rispondereagli stimoliUn vivente può muoversi perafferrare la preda, per sfuggire alpericolo, o, come nel caso dellepiante, per “inseguire”la luce.Un vivente è inoltre in grado ditrasformarsi per sopravvivereanche in condizioni avverse(evoluzione).Un vivente è in grado di reagiredi fronte al pericoloe di adattarsi ai cambiamenti ambientali4 Adattamento5
Le proprietà della vita (4/4)5 Capacità moltiplicarsiQualsiasi organismo vivente èdestinato presto o tardi ascomparire: con la riproduzione lavita passa da un individuo all’altro,permettendo la perpetuazionedella specie.La riproduzione consente di mantenerela vita nel tempo6
La cellula : espressione minima della vitaTutti gli esseri viventi sono costituiti da una o più cellule: è la cellula la piùpiccola porzione organizzata di materia che possiede le caratteristiche della vita.si autoregolascambia materiaed energiacon l’ambienteCELLULAsi riproducesi può evolvere7
La cellula procariotaLa cellula procariota è organizzataper garantire la sopravvivenza diorganismi molto semplici, conminime richieste energetiche, e nonrisulta specializzata nel compierefunzioni particolari.Tutto il volume cellulare è occupatoda un liquido di consistenzagelatinosa (il citoplasma), in cuisono immersi tuti i costituentichimici della cellula, e dei piccoliorganuli (ribosomi), deputati allasintesi delle proteine.Il materiale genetico (DNA) si trovafluttuante nel citoplama, in unaregione priva di una membrana chela delimiti (non esiste un nucleo veroe proprio).Esiste invece una struttura rigida diprotezione e di contenimento, laparete cellulare, che la separadall’ambiente esterno.membrana cellulareregione nuclearecitoplasmaribosomiparete cellulare8
La cellula eucariotaLa cellula eucariota è un tipo dicellula molto più voluminosa ecomplessa della cellula procariota.Al suo interno lo spazio èorganizzato in settori cui competeuna certa funzione in modo daassicurarne la sopravvivenza e lariproduzione.Le diverse regioni all’interno dellacellula sono delimitate damembrane interne. In particolare ,una membrana (membrananucleare) delimita il nucleo, in cuisi trova il materiale genetico (DNA)che presiede al controllo di tutte leattività della cellula stessa.La cellula eucariota possiede inoltrenumerosi organuli, in alcuni deiquali hanno luogo i processimetabolici fondamentali : neiribosomi, ad es.,avviene la sintesidelle proteine; i mitocondri sonola sede della respirazione cellularemitocondricitoplasmamembrana nuclearemembranacellulareReticolo endoplasmaticocon ribosominucleo9
Tassonomia : livelli gerarchiciLa chiave della classificazione naturaledel mondo vivente è la specie.GeneriFamiglieOrdiniClassiSPECIEPhylaDivisioniLinneoRiconoscere individui della stessa specie può risultare abbastanzacomplesso. Ecco una definizione di specie universalmenteaccettata: “la specie rappresenta una categoria sistematicacomprendente una o più popolazioni di individui con caratterisimili, in grado di accoppiarsi originando prole feconda”.Varie specie con caratteristiche comuni vengono raggruppate ingeneri; a loro volta i generi possono essere riuniti tra loro peralcuni caratteri generali e raggruppati in famiglie; le famiglie inordini; gli ordini in classi; le classi in tipi di phila per glianimali e divisioni per i vegetali; i phila/divisioni in regni.REGNI10
PIANTEFUNGHIANIMALII cinque regniOrganismi eucarioti pluricellulari( differiscono principalmente per ilmodo di nutrirsi )Il modello ad albero di Whittaker in cinqueregni evidenzia l’origine comune e la successivaevoluzione di tutte le forme viventi.Organismi eucarioti per lo piùunicellulariPROTISTIMONEREOrganismi unicellulari procarioti11
Caratteristiche dei regniRegno Tipo cellula Nutrizione Num. celluleMonere Procariote Autotrofi eeterotrofiProtisti Eucariote Autotrofi eeterotrofiUnicellulariPrincipalmenteunicellulariFunghi Eucariote Eterotrofi PrincipalmentepluricellulariVegetali (Piante) Eucariote Autotrofi PluricellulariAnimali Eucariote Eterotrofi Pluricellulari12
Amminoacidi
Un amminoacido è un composto che contiene sia ungruppo carbossilico sia un gruppo amminico.Gli -amminoacidi sono i più importanti in biologia perchérappresentano i monomeri con cui vengono formate leproteine
Gli Amminoacidi si ottengono per idrolisi delle proteine chesono polimeri naturali composti da unità di Aa legate fra loroda legami ammidici (peptidici). Gli amminoacidi servonocome fonte di azoto per altri composti:Basi azotate del DNA e RNAEme e strutture simili nella mioglobina, emoglobina,citocromi, enzimi etc etcAceticolina e altri neurotrasmettitoriOrmoni e fosfolipidiInoltre possono essere utilizzati come fonte di energia sel’azoto viene rimosso : Catabolismo
Tranne che nella glicina (NH 2 CH 2 COOH) dove R=H, il carbonio è uncentro chirale e tutti gli amminoacidi che si ottengono per idrolisi delleproteine sono otticamente attivi.Essi hanno configurazione L relativamente alla gliceraldeide. Laconvenzione di Fischer introdotta per i carboidrati vale anche per gliamminoacidi:N.B.: - in natura carboidrati serie D, Amminoacidi serie L !- non c’è relazione tra configurazione relative e potere ottico rotatorio!
Gli amminoacidi portano tutti un nome comune e sonoidentificati da una abbreviazione di tre lettere.Possono essere classificati sulla base della polarità dellacatena in:Amminoacidi idrofobiciAmminoacidi neutri con catene non polariAmminoacidi neutri con catene polariAmminoacidi acidi con catene polariAmminoacidi basici con catene polariAmminoacidi idrofili
Aa con catena neutra, non polare
Aa con catena neutra, polare
Aa con catena polare, acida
Aa con catena polare, basica
Proprietà acido-base degli amminoacidinella molecola dell’amminoacido sono contemporaneamentepresenti una funzione carbossilica acida e una funzioneamminica basica. Sono reciprocamente compatibili?Gli aa con una sola funzione acida e una sola funzione basicavengono più correttamente rappresentati in una formaIONICA DIPOLARE
Questa struttura ionica è in accordo con:I punti di fusione elevati (glicina 233°C)Solubilità relativamente basse nei solventi organiciProprietà elettriche degli aa ai diversi valori di pH
Gli amminoacidi sono composti anfoteri che si possono comportaresia da acidi (cedendo un protone alla base forte)sia da basi (ricevendo un protone dall’acido forte)Questo comportamento è illustrato dai seguenti equilibri, validi per un aacon un solo gruppo amminico e un solo gruppo carbossilicoRCHNH 3+COOHOH -R CH COO -OH -H + H +NH 3+RCHNH 2COO -aa a pH basso (acido) ione dipolare aa a pH alto (base)RCHCOO -H +RCHCOOHNH 3+NH 3+aa è completamente protonato a pH acido
Titolazione degli AmminoacidiI valori di pK a per i gruppi ionizzabili degli amminoacidi sono per la maggior parteottenuti da titolazioni acido-base, misurando il pH della soluzione in funzionedella base aggiunta (o dell’acido).Dopo aggiunta di 0.5 moli di base il gruppo carbossilico è neutralizzato per metà. Laconcentrazione di ione carico positivamente è uguale a quella dello ione dipolare e il pH = pK a1del gruppo carbossilico. Il punto finale della prima parte della titolazione si raggiunge quando èstata aggiunta 1 mole di base: la specie predominante è lo ione dipolare. La parte restantedella curva rappresenta la titolazione del gruppo –NH 3+.Quando si aggiungono 0.5 moli di base(totale 1.5) la metà dei gruppi –NH 3+ sono neutralizzati e trasformati in NH 2 . A questo punto laconcentrazione dello ione dipolare è uguale a quella dello ione carico negativamente e il pH =pKa2 dell’aa. Aggiunte 2 moli di base l’aa è completamente convertito in anione.
Le curve di titolazione ci permettono di determinare il Punto isoelettrico:è il valore di pH al quale l’ aa ha carica netta = 0 (zwitterione) Esaminando la curva sivede che il pI si trova a metà tra la pka 1 e la pka2pI = ½ [pK a1 (COOH) + pK a2 (NH 3+ )]
Il punto isoelettrico degli amminoacidi con due gruppi acidi e unobasico, oppure con due gruppi basici e uno acido è molto diverso daquello degli amminoacidi con un solo gruppo dei due tipi.Se sono presenti due gruppi acidi (es. acido aspartico, acidoglutammico) il pI è acido (cca pH 3). Il motivo è la richiesta di uneccesso di acidità per sopprimere la dissociazione del secondo gruppocarbossilico (in modo che rimanga neutro).Se sono presenti due gruppi basici (es. lisina, arginina, istidina) il pI èbasico (cca pH 7,6-10,8). In tal caso è necessario un eccesso di baseper assicurare che uno soltanto dei due gruppi basici sia protonato.
Valori di pK aper gli amminoacidi polifunzionaliAmminoacidoα-CO 2HpK a1α-NH 3pK a2Catena lateralepK a3pIArginina 2.00 9.00 13.20 11.15Acido Aspartico 2.01 9.82 3.83 2.80Cisteina 1.71 10.78 8.33 5.02Acido Glutammico 2.19 9.67 4.25 3.22Istidina 1.82 9.17 6.04 7.59Lisina 2.17 9.00 10.80 9.65Tirosina 2.20 9.11 10.07 5.66
ElettroforesiSi tratta di un processo per la separazione dicomposti sulla base delle loro caricheViene impiegata per separare ed identificare misceledi amminoacidi e proteine.Le separazioni elettroforetiche possono essereeffettuate impiegando agar, carta, plastiche, acetatodi cellulosa come supporto solidoCome funziona?
Una striscia di carta viene saturata con untampone acquoso di pH predeterminato (es.pH=6.0) e funge da ponte tra due vaschetteelettrodiche. Un campione di aa viene caricatosotto forma di goccia sulla carta. Si applica unpotenziale elettrico tra le due vaschetteelettrodiche e gli aa migrano verso l’elettrodo dicarica opposta. Le molecole con alta densità dicarica si muovono con velocità maggiore, quelleche sono al punto isoelettrico rimangono fermeall’origine.
Gli amminoacidi concarica negativa alvalore di pH deltampone utilizzato,migrano versol’elettrodo positivo equelli con caricapositiva migranoverso l’elettrodonegativo. Quelli chenon hanno caricarimangono al puntod’origine.
Reazione con ninidrinaCromatografia su cartaDopo completa separazioneper rendere visibili gli aa sispruzza un colorante. Ilcolorante più comunementeusato è la ninidrina
AmminoacidieurotrasmettitoriProteineRCOO -+ NH 3ROCHN(R)(R)SCH 3OCNH(S)CH 3COOMetabolismoPenicillina(R)-Cys + (S)-Val
Amminoacidi proteinogenici con catena apolare (I)glicina gly Galanina ala AHOOCH 2 NHOOCH 2 NHCH 3valina val VHOOCH 2 NCH(CH 3 ) 2leucina leu LHOOCH 2 NCH 2 CH(CH 3 ) 2
Amminoacidi proteinogenici con catena apolare (II)isoleucina ile IHOOC CH 3H 2 NCH 2 CH 3metionina met MHOOCH 2 NCH 2 CH 2 SCH 3fenilalanina phe FHOOCH 2 NCH 2prolina pro PHOOCHN
Amminoacidi proteinogenici con catena polare (I)asparagina asn Nglutammina gln Qserina ser Streonina thr THOOCH 2 NHOOCH 2 NHOOCH 2 NHOOCH 2 NCH 2 CONH 2CH 2 CH 2 CONH 2CH 2 OHOHCH 3
Amminoacidi proteinogenici con catena polare (II)HOOCtriptofano trp W H 2 NCH 2NHtirosina tyr YHOOCH 2 NCH 2OHcisteina cys CHOOCH 2 NCH 2 SH
Amminoacidi proteinogenici con catena acida(anionici) o basica (cationici)HOOCacido aspartico asp DCH 2 COOHH 2 NHOOCacido glutammico glu ECH 2 CH 2 COOHH 2 Narginina arg Ristidina his HHOOCH 2 NHOOCH 2 NCH 2 CH 2 CH 2 NH C NHCH 2HNNNH 2lisina lys KHOOCH 2 NCH 2 CH 2 CH 2 CH 2 NH 2
Configurazione degli AmminoacidiH 2 Ncarbonio αCOOHCCOOHNH 2CHRHRProiezione di FischerCOOHCOOHNH 2 C H H C NH 2RRAmminoacido L Amminoacido DCHOHCOHCH 2 OHGliceraldeide DSerie L = H 2 a sinistraSerie D = H 2 a destra
Nomenclatura di Cahn-Ingold-PrelogHCOOHHCOOHH 3 C NH 2(S)-alaninaC 6 H 5 -CH 2 NH 2(S)-fenilalaninaCOOHCOOHH 2 NH 3 CHHCH 2 CH 3H 2 NHCH 3HOHL-isoleucinaacido (2S,3S)-2-ammino-3-metilpentanoicoL-treoninaacido (2S,3R)-2-ammino-3-idrossibutanoico