Lezione Fisiologia Farmacia - Omero
Lezione Fisiologia Farmacia - Omero
Lezione Fisiologia Farmacia - Omero
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
I Reni nell’Uomo<br />
L’importanza della funzione renale è evidenziata dalla notevole entità del<br />
– flusso ematico renale (circa 1.25 litri/min), il 25% della gittata cardiaca a riposo<br />
– consumo metabolico di O2 (circa 20 ml/min), l’8% del consumo corporeo complessivo a riposo.<br />
Ciò sorprende anche considerando l’esigua massa del tessuto renale (circa 300 g).
Funzioni renali<br />
Omeostatiche<br />
– Regolazione dell’osmolarità del liquido extracellulare (attraverso variazioni nel volume del solvente,<br />
l’acqua).<br />
– Regolazione del volume del liquido extracellulare (attraverso variazioni nella quantità totale dei soluti,<br />
principalmente il Na + ).<br />
– Regolazione della composizione ionica del liquido extracellulare (gli ioni regolati includono Na + , K + , Cl - ,<br />
Ca 2+ , Mg 2+ , SO4 2- , HPO4 2- ).<br />
– Regolazione dell’acidità del liquido extracellulare, cioè della concentrazione di H + (può essere ricondotta<br />
anch’essa al punto precedente).<br />
Per ogni sostanza, in media nel tempo, l’escrezione urinaria ne bilancia a zero gli ingressi e le uscite dal corpo (quantità<br />
totale costante), mantenendone la concentrazione a valori fisiologici.
Funzioni renali<br />
Omeostatiche<br />
– Regolazione dell’osmolarità del liquido extracellulare (attraverso variazioni nel volume del solvente,<br />
l’acqua).<br />
– Regolazione del volume del liquido extracellulare (attraverso variazioni nella quantità totale dei soluti,<br />
principalmente il Na + ).<br />
– Regolazione della composizione ionica del liquido extracellulare (gli ioni regolati includono Na + , K + , Cl - ,<br />
Ca 2+ , Mg 2+ , SO4 2- , HPO4 2- ).<br />
– Regolazione dell’acidità del liquido extracellulare, cioè della concentrazione di H + (può essere ricondotta<br />
anch’essa al punto precedente).<br />
Per ogni sostanza, in media nel tempo, l’escrezione urinaria ne bilancia a zero gli ingressi e le uscite dal corpo (quantità<br />
totale costante), mantenendone la concentrazione a valori fisiologici.<br />
Depurative<br />
– Escrezione dei prodotti di scarto del metabolismo, come urea (dalle proteine), acido urico (dagli acidi<br />
nucleici), creatinina (dalla fosfocreatina muscolare), derivati dell’emoglobina (danno il colore alle urine),<br />
metaboliti degli ormoni, ecc.<br />
– Escrezione delle sostanze estranee come tossine vegetali ed animali, farmaci, additivi alimentari, ecc.
Funzioni renali<br />
Omeostatiche<br />
– Regolazione dell’osmolarità del liquido extracellulare (attraverso variazioni nel volume del solvente,<br />
l’acqua).<br />
– Regolazione del volume del liquido extracellulare (attraverso variazioni nella quantità totale dei soluti,<br />
principalmente il Na + ).<br />
– Regolazione della composizione ionica del liquido extracellulare (gli ioni regolati includono Na + , K + , Cl - ,<br />
Ca 2+ , Mg 2+ , SO4 2- , HPO4 2- ).<br />
– Regolazione dell’acidità del liquido extracellulare, cioè della concentrazione di H + (può essere ricondotta<br />
anch’essa al punto precedente).<br />
Per ogni sostanza, in media nel tempo, l’escrezione urinaria ne bilancia a zero gli ingressi e le uscite dal corpo (quantità<br />
totale costante), mantenendone la concentrazione a valori fisiologici.<br />
Depurative<br />
– Escrezione dei prodotti di scarto del metabolismo, come urea (dalle proteine), acido urico (dagli acidi<br />
nucleici), creatinina (dalla fosfocreatina muscolare), derivati dell’emoglobina (danno il colore alle urine),<br />
metaboliti degli ormoni, ecc.<br />
– Escrezione delle sostanze estranee come tossine vegetali ed animali, farmaci, additivi alimentari, ecc.<br />
Endocrine<br />
– Secrezione dell’ormone Renina, componente di un circuito di regolazione della pressione circolatoria e<br />
del volume del liquido extracellulare.<br />
– Secrezione dell’ormone Eritropoietina (EPO), componente di un circuito di regolazione dell’ematocrito.<br />
– Secrezione dell’ormone 1,25-diidroxivitamina D3, componente di un circuito di regolazione della<br />
concentrazione del Ca 2+ extracellulare.
Anatomia renale<br />
Due nefroni: corticale e juxtamedullare<br />
Zona Corticale<br />
Lobulo<br />
Lobo<br />
Zona Midollare<br />
Piramide<br />
Pelvi<br />
Papilla<br />
Colonna<br />
Uretere<br />
Calice<br />
il Nefrone è<br />
– l’unità funzionale del rene<br />
– circa 1 milione lavorano in parallelo<br />
– disposti radialmente dalla corticale<br />
alla midollare<br />
– producono urina che defluisce dai<br />
dotti papillari nei calici, e da qui nella<br />
pelvi renale, l’uretere ed infine la<br />
vescica urinaria<br />
Capsula
Morfologia del nefrone (semplificata)<br />
Componente Tubulare:<br />
Capsula di Bowman<br />
Tubulo Prossimale<br />
Ansa di Henle<br />
Tubulo Distale<br />
Dotto Collettore<br />
Filtrazione<br />
Riassorbimento<br />
e Secrezione<br />
Componente Vascolare:<br />
Arteriola Afferente<br />
Capillari Glomerulari<br />
Arteriola Efferente<br />
Capillari Peritubulari<br />
Vasa recta<br />
Filtrazione<br />
Riassorbimento<br />
e Secrezione
Relazione fra nefroni e stratificazione lobare<br />
Ai due estremi della distribuzione abbiamo (vedi figura):<br />
Nefroni juxta-midollari (corpuscolo nei pressi della giunzione<br />
cortico-midollare, ansa di Henle scende in profondità fino alla<br />
papilla)<br />
Nefroni corticali superficiali (corpuscolo entro 1 mm dalla<br />
capsula renale, ansa di Henle non penetra la midollare<br />
interna).<br />
In mezzo si situano, con caratteristiche intermedie, i Nefroni<br />
medio-corticali.<br />
–La corticale contiene i corpuscoli renali mentre la midollare ne<br />
è priva<br />
–La midollare interna non contiene tratti ascendenti spessi<br />
dell’ansa di Henle ma solo tratti sottili<br />
1. Corpuscolo renale (Capsula di Bowman + Glomerulo)<br />
Tubulo Prossimale<br />
2. Tubulo contorto prossimale<br />
3. Tratto retto prossimale<br />
Ansa di Henle<br />
4. Tratto discendente sottile<br />
5. Tratto ascendente sottile<br />
6. Tratto ascendente spesso<br />
7. Macula densa<br />
Tubulo Distale<br />
8. Tubulo contorto distale<br />
Dotto Collettore<br />
9. e 10. Tratto corticale<br />
11. Tratto midollare esterno<br />
12. Tratto midollare interno e dotto papillare
Vascolarizzazione ai nefroni<br />
Arteria renale<br />
Arterie interlobari<br />
Arterie arcuate<br />
Arterie interlobulari<br />
Arteriole afferenti<br />
Capillari Glomerulari<br />
Arteriole Efferenti<br />
Capillari Peritubulari e Vasa recta<br />
Vene interlobulari<br />
Vene arcuate<br />
Vene interlobari<br />
Vena renale<br />
Nota. Pressioni idrostatiche elevate nei<br />
capillari glomerulari favoriscono la filtrazione<br />
verso lo spazio di Bowman, mentre quelle più<br />
basse nei capillari peritubulari e vasa recta<br />
(che sono a valle del doppio sistema<br />
arteriolare) favoriscono il riassorbimento<br />
dall’interstizio.
Le tre operazioni svolte dal rene<br />
Filtrazione Glomerulare, Secrezione Tubulare, Riassorbimento Tubulare<br />
Per ogni soluto (ma ciò vale anche per l’acqua) l’escrezione urinaria è pari alla somma di questi processi.
Filtrazione, riassorbimento e secrezione<br />
Definizione. La frazione di estrazione (FE) renale di una sostanza è il rapporto fra il flusso di<br />
questa sostanza che è escreto nelle urine ed il flusso che giunge ai reni per via ematica.<br />
Esempi di tre sostanze X, Y, Z dal basso peso molecolare, che quindi filtrano al glomerulo:<br />
Sostanza X: Filtra e viene poi riassorbita in misura incompleta (es. acqua, ioni inorganici, urea). FE
il Corpuscolo renale (sezione)<br />
Vascolarizzazione<br />
Arteriola afferente (ArtAff)<br />
Capillari glomerulari: disposti in parallelo<br />
Arteriola efferente (ArtEff)<br />
Barriera di filtrazione<br />
Endotelio capillare (En): fenestrato<br />
Membrana basale glomerulare (MBg): porosa<br />
Podociti (Po): epitelio interdigitato<br />
Mesangio glomerulare (M): cellule di supporto<br />
con funzione fagocitica e contrattile<br />
Apparato Juxtaglomerulare<br />
Cellule granulari (CellGr): producono renina<br />
Cellule mesangiali extraglomerulari (Meg)<br />
Cellule della macula densa (MD): epitelio<br />
specializzato nella misura del flusso luminale<br />
Afferenze nervose<br />
Dal simpatico: fibre noradrenergiche, innervano<br />
le arteriole e l’apparato juxtaglomerulare<br />
(FibNor)
la Barriera di filtrazione: struttura<br />
Le sostanze per filtrare devono passare attraverso:<br />
1. Endotelio capillare fenestrato<br />
2. Membrana basale porosa<br />
3. Epitelio specializzato, i podociti, i cui pedicelli sono interdigitati e<br />
diaframmati<br />
Tutte e tre partecipano alla selettività molecolare della barriera.<br />
I podociti garantiscono inoltre l’integrità meccanica della barriera<br />
che è sottoposta ad una notevole pressione transparietale.
la Barriera di filtrazione: struttura<br />
Le sostanze per filtrare devono passare attraverso:<br />
1. Endotelio capillare fenestrato<br />
2. Membrana basale porosa<br />
3. Epitelio specializzato, i podociti, i cui pedicelli sono interdigitati e<br />
diaframmati<br />
Tutte e tre partecipano alla selettività molecolare della barriera.<br />
I podociti garantiscono inoltre l’integrità meccanica della barriera<br />
che è sottoposta ad una notevole pressione transparietale.
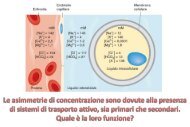
la Barriera di filtrazione: selettività dimensionale<br />
– L’acqua filtra per circa il 20% circa del Flusso Plasmatico Renale (FPR).<br />
– Tutte le molecole solute più piccole di 20 Å filtrano liberamente, cioè come l’acqua.<br />
– Tutte le molecole solute più grandi di 30–40 Å non filtrano.
la Barriera di filtrazione: selettività elettrica<br />
Esperimenti con polisaccaridi esogeni di diversa dimensione e carica (i destrani), hanno evidenziato che la carica elettrica<br />
netta delle molecole grandi influisce notevolmente sulla loro filtrabilità: le cariche negative sono frenate, mentre quelle<br />
positive attratte.<br />
Questo dipende da cariche negative fisse espresse sulla barriera di filtrazione che frenano il passaggio delle proteine<br />
plasmatiche, che a pH fisiologico (7.4) hanno appunto carica negativa.<br />
Patologie in cui queste cariche fisse sono compromesse si associano alla comparsa della proteinuria.
Fattori che determinano la filtrazione glomerulare<br />
Favorevoli<br />
P CG – Pressione idrostatica nei capillari glomerulari<br />
Contrarie<br />
P SB – Pressione idrostatica nello spazio di Bowman<br />
π CG – Pressione osmotica (oncotica o colloidale) dovuta alla concentrazione crescente delle sostanze non<br />
filtrate, nei capillari glomerulari<br />
Pressione netta di filtrazione<br />
PNF = P CG – P SB – π CG (la PNF media lungo i capillari è di circa 17 mmHg)
Fattori che determinano la filtrazione glomerulare<br />
Il flusso di liquido filtrato da tutti i glomeruli di entrambe i reni, detta Velocità di Filtrazione Glomerulare (VFG),<br />
è proporzionale alla pressione netta di filtrazione:<br />
VFG = k f PNF = k f (P CG – P SB – π CG )<br />
dove k f è il coefficiente di filtrazione, che misura la conduttanza idraulica complessiva delle barriere di<br />
filtrazione di tutti i nefroni.<br />
La VFG è di circa 125 ml/min (180 litri/giorno) e rappresenta in media il 20% del flusso plasmatico renale<br />
(FPR). Il rapporto fra VFG ed FPR è detta frazione di filtrazione.<br />
Il valore elevato della VFG è dovuto a:<br />
–elevata pressione idrostatica nei capillari glomerulari (più alta di quella tipica dei capillari di altri tessuti)<br />
–elevata permeabilità idraulica della barriera di filtrazione glomerulare (enormemente maggiore di quella<br />
tipica dei capillari di altri tessuti)<br />
–elevata superficie di filtrazione<br />
La VFG è influenzata sia in condizioni fisiologiche che patologiche da variazioni di ciascuna delle variabili<br />
presenti nell’equazione di sopra.
La Clearance Renale<br />
Vogliamo individuare un parametro numerico che indichi l’efficienza escretiva dei reni nei confronti di una<br />
generica sostanza X presente nel plasma.<br />
Potremmo utilizzare la quantità di X escreta nelle urine per unità di tempo<br />
Questa però non tiene conto della concentrazione di X nel plasma, quindi utilizziamo:<br />
Quantità di X escreta per unità di tempo = [X] urine • Flusso Urinario<br />
[X] plasma<br />
[X] plasma<br />
Questo parametro, detto Clearance della sostanza X, è di facile misurazione e si interpreta intuitivamente<br />
come: il volume di plasma completamente liberato da X per unità di tempo<br />
Questo volume liberato è da vedersi solo come una astrazione utile alla comprensione del significato di clearance: è un volume<br />
virtuale. Esso è in realta mescolato con il volume di plasma non liberato da X, quindi la concentrazione plasmatica di X<br />
diminuisce nel passaggio attraverso i reni. Esso diventa un volume reale solo per le sostanze filtrate e completamente secrete<br />
(vedi es. del PAI più avanti).<br />
La clearance di alcune sostanze ci permette di stimare sia la VFG che il FPR: Loro variazioni significative<br />
possono essere sintomo di malattie renali.
La clearance dell’INULINA stima la VFG in laboratorio<br />
Polisaccaride esogeno<br />
Viene infuso endovena mantenendo costante la sua concentrazione plasmatica<br />
–E’ liberamente filtrabile<br />
–Non è riassorbita, ne secreta<br />
Clearance Inulina =<br />
= Q escr per unità di t. = Q filtr per unità di t. = [IN] plasma • VFG = VFG<br />
[IN] plasma<br />
[IN] plasma<br />
[IN] plasma<br />
Il suo valore fisiologico è di 125 ml/min (180 L/giorno)
La clearance della CREATININA stima la VFG in clinica<br />
Nella pratica clinica si utilizza la clearance della creatinina<br />
Benchè meno accurata è più pratica dell’inulina: è una molecola endogena presente nel plasma e<br />
mantiene una concentrazione plasmatica abbastanza costante<br />
–E’ liberamente filtrabile<br />
–E’ debolmente secreta nel tubulo prossimale<br />
Sovrastima quindi la VFG del 10–20% (l’errore introdotto dalla secrezione tubulare può essere grande<br />
se la VFG è molto bassa)<br />
Metodo più preciso: Si misura il flusso urinario durante le 24h e le concentrazioni plasmatica ed urinaria<br />
di creatinina<br />
Metodo più rapido: Si misura solo la concentrazione plasmatica di creatinina<br />
In ogni dato paziente la sua produzione è costante<br />
(dipende dalla massa muscolare complessiva).<br />
Quindi la sua concentrazione plasmatica è<br />
inversamente proporziale alla VFG.<br />
Utile a individuare la comparsa (valore<br />
significativamente sopra la norma) o seguire il decorso<br />
di una patologia renale in un singolo paziente<br />
(variazioni nel tempo)
La clearance dell’ACIDO PARA-AMMINOIPPURICO (PAI) stima il FPR<br />
Piccolo anione organico esogeno<br />
Viene infuso endovena mantenendo costante la sua concentrazione plasmatica<br />
–E’ liberamente filtrabile<br />
–A basse concentrazioni è completamente secreto nel tubulo prossimale<br />
Clearance PAI =<br />
= Q escr per unità di t. = Q ai reni per unità di t. = [PAI] plasma • FPR = FPR<br />
[PAI] plasma<br />
[PAI] plasma<br />
[PAI] plasma<br />
Il suo valore fisiologico è di 625 ml/min
Nel rene isolato VFG ed FPR sono soggette a rapida autoregolazione<br />
Nel rene isolato (denervato e perfuso) si osserva una relativa costanza di FPR e VFG in un ampio<br />
ambito di pressione arteriosa media (P A fra 80 e 180mmHg).<br />
Ci aspettavamo invece che variazioni di P A si ripercuotessero sulla P CG e quindi sulla PNF con<br />
effetti amplificati sulla filtrazione (la PNF è piccola rispetto alla P CG ).<br />
Deve esistere un sistema di autoregolazione intrarenale che agisce sulle resistenze arteriolari<br />
afferenti per mantenere costante la P CG .<br />
In vivo si ritiene che l’autoregolazione agisca nel breve periodo. Vedremo che in seguito a variazioni<br />
di lungo periodo della pressione arteriosa (dovute ad esempio a variazione del volume del LEC) i<br />
reni rispondono agendo anche sulla VFG.
L’autoregolazione deve agire a livello dell’arteriola afferente<br />
In assenza di autoregolazione un aumento<br />
della pressione arteriosa porterebbe ad un<br />
aumento di FPR e P CG .<br />
Quindi l’autoregolazione deve agire in modo<br />
da far diminuire entrambe i parametri.<br />
Vasocostrizione dell’arteriola afferente.
Il ruolo della vasocostrizione arteriolare<br />
Un calo del volume del LEC porta a vasocostrizione di<br />
entrambe le arteriole afferenti ed efferenti tramite:<br />
–rilascio di noradrenalina dalle terminazioni nervose del<br />
simpatico (legame a recettori alfa-adrenergici)<br />
–azione vasocostrittrice dell’angiotensina II<br />
>>> Mentre il flusso ematico renale (ed il FPR)<br />
diminuisce molto, la PCG varia poco<br />
>>> La pressione oncotica nei capillari glomerulari πCG<br />
aumenta più velocemente che di norma<br />
>>> La pressione netta di filtrazione PNF lungo i capillari<br />
glomerulari diminuisce più rapidamente che di norma<br />
Quindi:<br />
1. Diminuisce un pò la VFG.<br />
2. Aumenta la pressione oncotica e diminuisce la<br />
pressione idrostatica a valle del glomerulo (capillari<br />
peritubulari e vasa recta)<br />
>>> Aumenta la pressione netta di riassorbimento PNR<br />
nei tubuli a valle della capsula di Bowman (vedi slide<br />
molto precedente).
Meccanismi di autoregolazione: miogenico<br />
Comune ad arterie ed arteriole sistemiche, un aumento di pressione interna induce:<br />
>>> Distensione meccanica del vaso e dei miociti che lo avvolgono<br />
>>> Attivazione di canali ionici sensibili allo stiramento<br />
>>> Depolarizzazione del miocita ed ingresso di ioni calcio<br />
>>> Attivazione dei meccanismi contrattili
Meccanismi di autoregolazione: feedback tubulo-glomerulare<br />
Si basa sulla misura del flusso tubulare alla macula<br />
densa. Un aumento della pressione arteriosa porta a:<br />
>>> Aumento della P CG<br />
>>> Aumento della VFG e del carico filtrato di Na + e Cl -<br />
>>> Aumento della concentrazione di Na + e Cl - alla<br />
macula densa (il tratto ascendente spesso dell’ansa di<br />
Henle riassorbe Na + , Cl - e K + ma non acqua)<br />
>>> Trasporto e accumulo di questi ioni nelle cellule<br />
della macula densa, con rigonfiamento osmotico<br />
>>>Depolarizzazione e rilascio di trasmettitori paracrini<br />
ATP e adenosina<br />
>>>Diffusione e legame a recettori purinergici espressi<br />
da cellule granulari e del mesangio glomerulare<br />
>>> Aumento del tono contrattile dell’arteriola afferente<br />
(diminuisce la P CG ) e del mesangio (riduzione del<br />
coefficiente di filtrazione kf)
Meccanismi di autoregolazione: feedback tubulo-glomerulare<br />
Si basa sulla misura del flusso tubulare alla macula<br />
densa. Un aumento della pressione arteriosa porta a:<br />
>>> Aumento della P CG<br />
>>> Aumento della VFG e del carico filtrato di Na + e Cl -<br />
>>> Aumento della concentrazione di Na + e Cl - alla<br />
macula densa (il tratto ascendente spesso dell’ansa di<br />
Henle riassorbe Na + , Cl - e K + ma non acqua)<br />
>>> Trasporto e accumulo di questi ioni nelle cellule<br />
della macula densa, con rigonfiamento osmotico (figura)<br />
>>>Depolarizzazione e rilascio di trasmettitori paracrini<br />
ATP e adenosina<br />
>>>Diffusione e legame a recettori purinergici espressi<br />
da cellule granulari e del mesangio glomerulare<br />
>>> Aumento del tono contrattile dell’arteriola afferente<br />
(diminuisce la P CG ) e del mesangio (riduzione del<br />
coefficiente di filtrazione kf)
Importanza ed entità del riassorbimento tubulare<br />
Esempio dell’acqua e alcune sostanze liberamente filtrabili, per un individuo medio in condizioni di dieta<br />
normale.<br />
Sostanza Carico filtrato/gg Quantità escreta tipica/gg % Riassorbita<br />
Acqua 180 litri 1.8 litri 99.0<br />
Na + 630 grammi 3.2 grammi 99.5<br />
Glucosio 180 grammi 0 grammi 100<br />
Urea 56 grammi 28 grammi 50<br />
Il carico filtrato di queste sostanze è molto maggiore del contenuto corporeo!