Corrosione dei metalli - DipCIA - Università degli studi di Cagliari.
Corrosione dei metalli - DipCIA - Università degli studi di Cagliari.
Corrosione dei metalli - DipCIA - Università degli studi di Cagliari.
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong> - introduzione<br />
Bernhard Elsener<br />
Professore <strong>di</strong> Scienza <strong>dei</strong> Materiali<br />
Dipartimento <strong>di</strong> Chimica Inorganica ed Analitica<br />
Università <strong>degli</strong> Stu<strong>di</strong> <strong>di</strong> <strong>Cagliari</strong><br />
http://<strong>di</strong>pcia.unica.it/superf/<br />
Email: belsener@unica.it<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005
1 Definizione <strong>di</strong> corrosione<br />
Protetti in ambiente alcalino<br />
materiali<br />
Armature nel calcestruzzo<br />
corrosione<br />
ambiente<br />
reazioni<br />
<strong>Corrosione</strong> in presenza <strong>di</strong> cloruri<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005<br />
1 Definizione <strong>di</strong> corrosione<br />
Composizione chimica<br />
Qualità della superficie<br />
Film <strong>di</strong> liquido<br />
- ossigeno<br />
- pH<br />
- ossidanti<br />
- cloruri<br />
materiali<br />
corrosione<br />
ambiente reazioni<br />
elettrochimica<br />
- ano<strong>di</strong>ca<br />
- cato<strong>di</strong>ca<br />
- corrente<br />
“Non esistono materiali resistenti alla corrosione”<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005
2 Termo<strong>di</strong>namica<br />
<strong>Corrosione</strong> generale<br />
Formazione della ruggine in superficie<br />
2Fe + 2H 2 O + O 2 --><br />
2Fe(OH) 2<br />
2 Fe o --> 2 Fe 2+ + 4 e - O 2 + 2H 2 O + 4 e - --> 4OH -<br />
Reazione ano<strong>di</strong>ca<br />
Reazione cato<strong>di</strong>ca<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005<br />
2 Termo<strong>di</strong>namica<br />
Anodo<br />
E Anodo<br />
Separazione ipotetica<br />
due reazioni parziali<br />
Me o Me 2+ +2e - 2H + +2e - H 2<br />
Potenziale <strong>di</strong> equilibrio<br />
Catodo<br />
E Catodo<br />
!U = E A - E C<br />
!U < 0 reazione possibile<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005
2 Termo<strong>di</strong>namica - seria galvanica<br />
Catodo<br />
nobile<br />
E H2 = 0<br />
Anodo<br />
non nobile<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005<br />
2 Termo<strong>di</strong>namica - reazioni cato<strong>di</strong>che<br />
2<br />
1.5<br />
il potenziale<br />
<strong>di</strong>minuisce con il pH<br />
Catodo<br />
E H2 = 0<br />
Potenziale (V NHE)<br />
1<br />
0.5<br />
0<br />
-0.5<br />
O 2 + 2H 2 O + 4e - = 4OH -<br />
2H + + 2e - = H 2<br />
acqua<br />
stabile<br />
Anodo<br />
-1<br />
-1.5<br />
0 2 4 6 8 10 12 14<br />
pH<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005
2 Termo<strong>di</strong>namica - <strong>metalli</strong> nobili<br />
2<br />
1.5<br />
rame si corrode<br />
in presenza <strong>di</strong> O 2<br />
E H2 = 0<br />
Potenziale (V NHE)<br />
1<br />
0.5<br />
0<br />
-0.5<br />
O 2 + 2H 2 O + 4e - = 4OH -<br />
Cu (rame)<br />
2H + + 2e - = H 2<br />
!U = E A - E C<br />
rame non si corrode<br />
in aci<strong>di</strong><br />
-1<br />
-1.5<br />
0 2 4 6 8 10 12 14<br />
pH<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005<br />
2 Termo<strong>di</strong>namica - <strong>di</strong>agrammi <strong>di</strong> Pourbaix<br />
zona <strong>di</strong> stabilità<br />
<strong>degli</strong> ossi<strong>di</strong><br />
zona <strong>di</strong> ioni solubili<br />
(corrosione)<br />
zona <strong>di</strong> immunità<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005
2 Termo<strong>di</strong>namica - <strong>di</strong>agrammi <strong>di</strong> Pourbaix<br />
zona <strong>di</strong> stabilità<br />
<strong>degli</strong> ossi<strong>di</strong><br />
zona <strong>di</strong> ioni solubili<br />
(corrosione)<br />
zona <strong>di</strong> immunità<br />
I <strong>di</strong>agrammi <strong>di</strong> Pourbaix in<strong>di</strong>cano su base termo<strong>di</strong>namica<br />
i prodotti stabili per un dato materiale e pH<br />
Nessuna informazione sulla velocità del processo<br />
<strong>Corrosione</strong> <strong>dei</strong> <strong>metalli</strong>: introduzione<br />
Prof. Bernhard Elsener<br />
Laboratorio <strong>Corrosione</strong> e protezione <strong>dei</strong> <strong>metalli</strong> AA 2004 / 2005



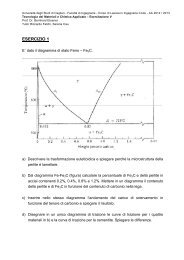











![[70/0085-M] INGEGNERIA CIVILE - DipCIA - Università degli studi di ...](https://img.yumpu.com/29223104/1/184x260/70-0085-m-ingegneria-civile-dipcia-universita-degli-studi-di-.jpg?quality=85)
