Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it Aldeidi e Chetoni.pdf - PianetaChimica.it
www.pianetachimica.it La reazione procede per trasferimento di uno ione idruro dal dianione di un’aldeide idratata ad un’altra aldeide. Dopo neutralizzazione si ottiene un acido carbossilico ed un alcol. Il meccanismo è il seguente: O C : OH .. − − O : OH .. − O − H .. .. − C OH C O benzaldeide : O .. : − − C O H O C H trasferimento di idruro C H dianione H O − H dianione L’addizione aldolica tra aldeidi diverse è chiamata addizione aldolica incrociata, questa reazione porta in generale a miscele di prodotti a causa del fatto che un’aldeide può addizionarsi sia con sè stessa che con l’altra aldeide. Quindi, da due aldeidi A e B, si possono ottenere i prodotti AA, BB, AB, BA. Se tuttavia la reazione avviene tra un’aldeide che può solo essere attaccata ma non è capace di attaccare (un’aldeide non enolizzabile) e un chetone che può solo attaccare, ma non può essere attaccato (i chetoni non si addizionano in ambiente basico perchè il loro carbonile è poco reattivo), allora la reazione procede con successo. O C benzaldeide H + O − C OH H 3 C CH 3 H 2 O O + O H CH CH C CH 3 acetone 4-fenil-but-3-en-2-one Notate che in questa reazione, nonostante l’ambiente basico, si è ottenuto un chetone alfa beta insaturo. Questo è dovuto al fatto che il doppio legame è particolarmente stabilizzato non solo dal carbonile, ma anche dalla coniugazione con l’anello benzenico. In questo caso è molto difficile impedire la disidratazione dell’aldolo. Si può avere addizione aldolica incrociata anche tra un chetone ed una aldeide qualsiasi, a patto di far reagire l’aldeide con un grande eccesso dell’enolato del chetone. Questo si realizza trattando il chetone con una base molto forte come LDA (litio diisppropilammide, pKa 36) che lo trasforma tutto nel suo enolato e poi aggiungendo goccia a goccia l’aldeide. Questa non ha il tempo di trasformarsi in enolato, ma reagisce con l’eccesso di enolato del chetone che trova in soluzione. O CH 3 CH 2 C O LDA H H 2 O C C H 3 C CH 3 THF H 2 C .. CH 3 − O OH CH 3 CH 2 CH − O C O CH 2 C CH 3 acetone enolato dell'acetone 4-idrossiesan-2-one Prof. Mauro Tonellato – ITIS Marconi – Padova Aldeidi e chetoni 20
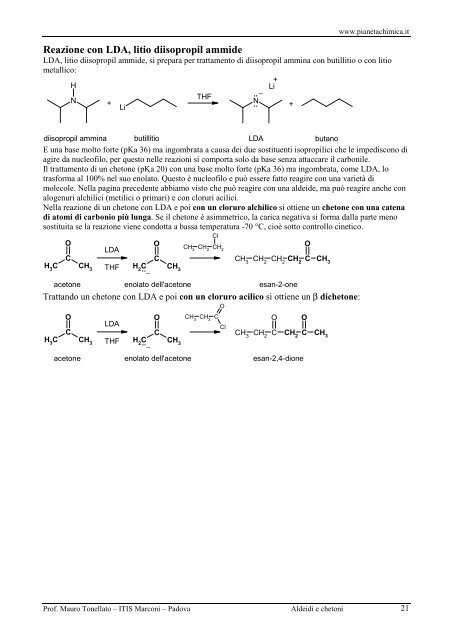
www.pianetachimica.it Reazione con LDA, litio diisopropil ammide LDA, litio diisopropil ammide, si prepara per trattamento di diisopropil ammina con butillitio o con litio metallico: H N + Li THF .. − Li+ N .. + diisopropil ammina butillitio LDA butano E una base molto forte (pKa 36) ma ingombrata a causa dei due sostituenti isopropilici che le impediscono di agire da nucleofilo, per questo nelle reazioni si comporta solo da base senza attaccare il carbonile. Il trattamento di un chetone (pKa 20) con una base molto forte (pKa 36) ma ingombrata, come LDA, lo trasforma al 100% nel suo enolato. Questo è nucleofilo e può essere fatto reagire con una varietà di molecole. Nella pagina precedente abbiamo visto che può reagire con una aldeide, ma può reagire anche con alogenuri alchilici (metilici o primari) e con cloruri acilici. Nella reazione di un chetone con LDA e poi con un cloruro alchilico si ottiene un chetone con una catena di atomi di carbonio più lunga. Se il chetone è asimmetrico, la carica negativa si forma dalla parte meno sostituita se la reazione viene condotta a bassa temperatura -70 °C, cioè sotto controllo cinetico. Cl O O CH 3 CH 2 CH O LDA 2 C C CH 3 CH 2 CH 2 CH 2 C CH 3 H 3 C CH 3 THF H 2 C CH 3 .. − acetone enolato dell'acetone esan-2-one Trattando un chetone con LDA e poi con un cloruro acilico si ottiene un b dichetone: O O CH 3 CH 2 C O O LDA Cl C C CH 3 CH 2 C CH 2 C H 3 C CH 3 THF H 2 C .. CH 3 − esan-2,4-dione O CH 3 acetone enolato dell'acetone Prof. Mauro Tonellato – ITIS Marconi – Padova Aldeidi e chetoni 21
- Page 1 and 2: ALDEIDI E CHETONI Introduzione Il g
- Page 3 and 4: www.pianetachimica.it Nel grafico p
- Page 5 and 6: www.pianetachimica.it Gli acetali s
- Page 7 and 8: www.pianetachimica.it Addizione di
- Page 9 and 10: www.pianetachimica.it Addizione di
- Page 11 and 12: www.pianetachimica.it Riduzione ad
- Page 13 and 14: www.pianetachimica.it Riduzione ad
- Page 15 and 16: www.pianetachimica.it Il reattivo d
- Page 17 and 18: www.pianetachimica.it O C Cl C CH 2
- Page 19: www.pianetachimica.it L’enolo att
www.pianetachimica.<strong>it</strong><br />
Reazione con LDA, l<strong>it</strong>io diisopropil ammide<br />
LDA, l<strong>it</strong>io diisopropil ammide, si prepara per trattamento di diisopropil ammina con butill<strong>it</strong>io o con l<strong>it</strong>io<br />
metallico:<br />
H<br />
N<br />
+<br />
Li<br />
THF .. − Li+<br />
N<br />
.. +<br />
diisopropil ammina butill<strong>it</strong>io<br />
LDA<br />
butano<br />
E una base molto forte (pKa 36) ma ingombrata a causa dei due sost<strong>it</strong>uenti isopropilici che le impediscono di<br />
agire da nucleofilo, per questo nelle reazioni si comporta solo da base senza attaccare il carbonile.<br />
Il trattamento di un chetone (pKa 20) con una base molto forte (pKa 36) ma ingombrata, come LDA, lo<br />
trasforma al 100% nel suo enolato. Questo è nucleofilo e può essere fatto reagire con una varietà di<br />
molecole. Nella pagina precedente abbiamo visto che può reagire con una aldeide, ma può reagire anche con<br />
alogenuri alchilici (metilici o primari) e con cloruri acilici.<br />
Nella reazione di un chetone con LDA e poi con un cloruro alchilico si ottiene un chetone con una catena<br />
di atomi di carbonio più lunga. Se il chetone è asimmetrico, la carica negativa si forma dalla parte meno<br />
sost<strong>it</strong>u<strong>it</strong>a se la reazione viene condotta a bassa temperatura -70 °C, cioè sotto controllo cinetico.<br />
Cl<br />
O<br />
O CH 3<br />
CH 2<br />
CH O<br />
LDA<br />
2<br />
C<br />
C<br />
CH 3<br />
CH 2<br />
CH 2<br />
CH 2<br />
C CH 3<br />
H 3<br />
C CH 3 THF H 2<br />
C CH 3<br />
.. −<br />
acetone<br />
enolato dell'acetone<br />
esan-2-one<br />
Trattando un chetone con LDA e poi con un cloruro acilico si ottiene un b dichetone:<br />
O<br />
O CH 3<br />
CH 2<br />
C<br />
O O<br />
LDA<br />
Cl<br />
C<br />
C<br />
CH 3<br />
CH 2<br />
C CH 2<br />
C<br />
H 3<br />
C CH 3 THF H 2<br />
C<br />
.. CH 3<br />
−<br />
esan-2,4-dione<br />
O<br />
CH 3<br />
acetone<br />
enolato dell'acetone<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 21