Aldeidi e Chetoni.pdf - PianetaChimica.it
Aldeidi e Chetoni.pdf - PianetaChimica.it Aldeidi e Chetoni.pdf - PianetaChimica.it
www.pianetachimica.it Alfa alogenazione Le aldeidi, trattate con Cl 2 o Br 2 , si ossidano formando acidi carbossilici. I chetoni enolizzabili, invece, trattati con Cl 2 o Br 2 vengono alogenati in posizione alfa. La reazione procede in modo molto diverso a seconda che sia condotta in catalisi acida o basica. O O + C H 2 O / H C H 3 C CH 2 CH 3 + Cl 2 H 3 C CH CH 3 + HCl 2-butanone catalisi acida Cl 3-cloro-2-butanone O O − C H 2 O / OH C H 3 C CH 2 CH − 3 + 3 Cl 2 O CH 2 CH 3 + CHCl 3 + 3 Cl − 2-butanone catalisi basica propanoato La velocità di questa reazione è v = k [chetone] cioè dipende solo dalla concentrazione del chetone, e non dipende da quella dell’alogeno, questo suggerisce che nello stadio lento si formi l’intermedio enolo e che questo poi reagisca velocemente con l’alogeno. Con la catalisi acida si ha la monoalogenazione del chetone dalla parte più sostituita, quindi nella prima reazione qui sopra si forma 3-cloro-2-butanone e non 1-cloro-2-butanone. Il cloroderivato, inoltre, è meno reattivo del chetone di partenza (il doppio legame dell’enolo è destabilizzato dal cloro elettronegativo) e quindi, se si usa una sola mole di Cl 2 , si ha la monoalogenazione. Inoltre, poichè lo stato di transizione è simile all’enolo, la reazione procede attraverso l’enolo più stabile, cioè quello col doppio legame più sostituito. : O: OH + OH H H C + C tautomeria C H 3 C CH CH 3 H O H 3 C CH CH 3 : O: H 3 C CH CH 3 H H 2-butanone .. : OH Cl Cl C H 3 C CH CH 3 veloce + O H C H 3 C CH CH 3 .. : Cl .. : − C H 3 C CH CH 3 Cl Cl enolo meno reattivo del chetone iniziale Con la catalisi basica si ha la polialogenazione del chetone dalla parte meno sostituita. Lo stato di transizione non assomiglia ad un enolo, ma ad un anione e dato che gli anioni meno sostituiti sono più stabili, lo strappo dell’H + avviene dal lato meno sostituito. L’intermedio simile ad un anione ha poi un’altra conseguenza, risulta più stabile se è alogenato (il cloro elettronegativo stabilizza la carica negativa). Quindi il chetone monoalogenato è più acido (pKa 14) del chetone iniziale e la seconda alogenazione è più veloce della prima e l’eventuale terza alogenazione (nel caso di metilchetoni) è ancora più veloce. O C H 2 C CH 2 CH 3 H 2-butanone (pKa 20) Cl O − .. : OH .. C HC CH 2 CH 3 H chetone monoalogenato (pKa 14) più acido del chetone iniziale 1^ tautomeria lenta −.. : OH .. O C C H 2 C .. − CH 2 CH 3 H 2 C CH 2 CH 3 2^ tautomeria più veloce Cl H enolato meno sostituito : O .. : − C HC CH 2 CH 3 enolato Prof. Mauro Tonellato – ITIS Marconi – Padova Aldeidi e chetoni 16 H O .. : O: − Cl Cl enolo più stabile Cl Cl
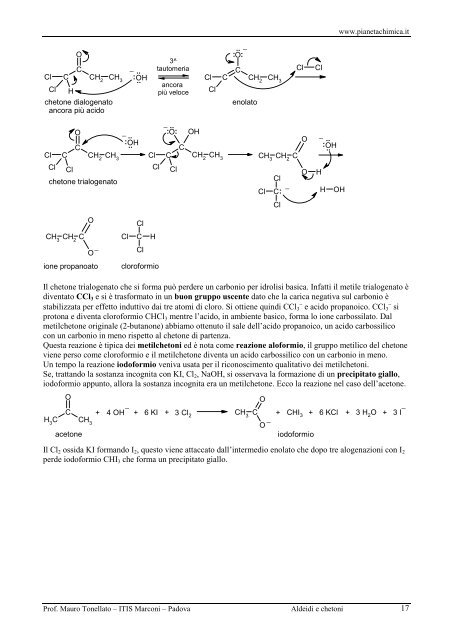
www.pianetachimica.it O C Cl C CH 2 CH 3 Cl H chetone dialogenato ancora più acido − .. : OH .. 3^ tautomeria ancora più veloce Cl Cl : O : − C C CH 2 CH 3 enolato Cl Cl O C Cl C CH 2 CH 3 Cl Cl chetone trialogenato O CH 3 CH 2 C O− ione propanoato − − O OH : OH .. : .. : O .. − C : OH .. .. Cl C CH 2 CH 3 CH 3 CH 2 C Cl Cl O H Cl Cl C: − H OH Cl Cl Cl C H Cl cloroformio Il chetone trialogenato che si forma può perdere un carbonio per idrolisi basica. Infatti il metile trialogenato è diventato CCl 3 e si è trasformato in un buon gruppo uscente dato che la carica negativa sul carbonio è stabilizzata per effetto induttivo dai tre atomi di cloro. Si ottiene quindi CCl 3 − e acido propanoico. CCl 3 − si protona e diventa cloroformio CHCl 3 mentre l’acido, in ambiente basico, forma lo ione carbossilato. Dal metilchetone originale (2-butanone) abbiamo ottenuto il sale dell’acido propanoico, un acido carbossilico con un carbonio in meno rispetto al chetone di partenza. Questa reazione è tipica dei metilchetoni ed è nota come reazione aloformio, il gruppo metilico del chetone viene perso come cloroformio e il metilchetone diventa un acido carbossilico con un carbonio in meno. Un tempo la reazione iodoformio veniva usata per il riconoscimento qualitativo dei metilchetoni. Se, trattando la sostanza incognita con KI, Cl 2 , NaOH, si osservava la formazione di un precipitato giallo, iodoformio appunto, allora la sostanza incognita era un metilchetone. Ecco la reazione nel caso dell’acetone. O O − C + 4 OH + 6 KI + 3 Cl 2 CH 3 C + CHI 3 + 6 KCl + 3 H 2 O + 3 I − H 3 C CH 3 O − acetone iodoformio Il Cl 2 ossida KI formando I 2 , questo viene attaccato dall’intermedio enolato che dopo tre alogenazioni con I 2 perde iodoformio CHI 3 che forma un precipitato giallo. Prof. Mauro Tonellato – ITIS Marconi – Padova Aldeidi e chetoni 17
- Page 1 and 2: ALDEIDI E CHETONI Introduzione Il g
- Page 3 and 4: www.pianetachimica.it Nel grafico p
- Page 5 and 6: www.pianetachimica.it Gli acetali s
- Page 7 and 8: www.pianetachimica.it Addizione di
- Page 9 and 10: www.pianetachimica.it Addizione di
- Page 11 and 12: www.pianetachimica.it Riduzione ad
- Page 13 and 14: www.pianetachimica.it Riduzione ad
- Page 15: www.pianetachimica.it Il reattivo d
- Page 19 and 20: www.pianetachimica.it L’enolo att
- Page 21: www.pianetachimica.it Reazione con
www.pianetachimica.<strong>it</strong><br />
O<br />
C<br />
Cl C CH 2<br />
CH 3<br />
Cl H<br />
chetone dialogenato<br />
ancora più acido<br />
− ..<br />
: OH ..<br />
3^<br />
tautomeria<br />
ancora<br />
più veloce<br />
Cl<br />
Cl<br />
: O<br />
: −<br />
C<br />
C CH 2<br />
CH 3<br />
enolato<br />
Cl<br />
Cl<br />
O<br />
C<br />
Cl C CH 2<br />
CH 3<br />
Cl Cl<br />
chetone trialogenato<br />
O<br />
CH 3<br />
CH 2<br />
C<br />
O−<br />
ione propanoato<br />
−<br />
− O OH<br />
: OH<br />
.. : .. :<br />
O<br />
..<br />
− C<br />
: OH<br />
..<br />
..<br />
Cl C CH 2<br />
CH 3 CH 3<br />
CH 2<br />
C<br />
Cl Cl<br />
O H<br />
Cl<br />
Cl C: − H OH<br />
Cl<br />
Cl<br />
Cl C H<br />
Cl<br />
cloroformio<br />
Il chetone trialogenato che si forma può perdere un carbonio per idrolisi basica. Infatti il metile trialogenato è<br />
diventato CCl 3 e si è trasformato in un buon gruppo uscente dato che la carica negativa sul carbonio è<br />
stabilizzata per effetto induttivo dai tre atomi di cloro. Si ottiene quindi CCl 3 − e acido propanoico. CCl 3 − si<br />
protona e diventa cloroformio CHCl 3 mentre l’acido, in ambiente basico, forma lo ione carbossilato. Dal<br />
metilchetone originale (2-butanone) abbiamo ottenuto il sale dell’acido propanoico, un acido carbossilico<br />
con un carbonio in meno rispetto al chetone di partenza.<br />
Questa reazione è tipica dei metilchetoni ed è nota come reazione aloformio, il gruppo metilico del chetone<br />
viene perso come cloroformio e il metilchetone diventa un acido carbossilico con un carbonio in meno.<br />
Un tempo la reazione iodoformio veniva usata per il riconoscimento qual<strong>it</strong>ativo dei metilchetoni.<br />
Se, trattando la sostanza incogn<strong>it</strong>a con KI, Cl 2 , NaOH, si osservava la formazione di un precip<strong>it</strong>ato giallo,<br />
iodoformio appunto, allora la sostanza incogn<strong>it</strong>a era un metilchetone. Ecco la reazione nel caso dell’acetone.<br />
O<br />
O<br />
−<br />
C + 4 OH + 6 KI + 3 Cl 2<br />
CH 3<br />
C + CHI 3 + 6 KCl + 3 H 2<br />
O + 3 I −<br />
H 3<br />
C CH 3<br />
O<br />
−<br />
acetone<br />
iodoformio<br />
Il Cl 2 ossida KI formando I 2 , questo viene attaccato dall’intermedio enolato che dopo tre alogenazioni con I 2<br />
perde iodoformio CHI 3 che forma un precip<strong>it</strong>ato giallo.<br />
Prof. Mauro Tonellato – ITIS Marconi – Padova <strong>Aldeidi</strong> e chetoni 17