Laboratorio: Comet test - DISAT
Laboratorio: Comet test - DISAT
Laboratorio: Comet test - DISAT
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
COMET ASSAY<br />
Nell’ambiente diversi xenobiotici hanno un’azione genotossica in quanto sono in grado di interagire<br />
con il DNA e alterarlo. Alcuni dei fattori che influenzano l’induzione di danni genetici in un<br />
organismo esposto ad un agente mutageno possono essere: la sua concentrazione, il suo ingresso e<br />
la sua distribuzione nell’organismo, la capacità metabolizzante dei tessuti con cui il composto viene<br />
a contatto, la reattività del composto chimico e/o i suoi metabolici con i bersagli cellulari,<br />
(soprattutto il DNA), la capacità delle cellule di ripartire o amplificare il danno, l’opportunità di<br />
espressione del danno genetico, l’abilità del tessuto bersaglio di riconoscere e sopprimere la<br />
moltiplicazione di cellule con proprietà aberranti.<br />
Prima che una lesione indotta al DNA venga fissata o stabilizzata, numerosi tipi di processi<br />
enzimatici, quali sistemi per fotoriattivazione o escissione, possono provvedere alla sua riparazione<br />
e l’effetto finale dell’insulto al DNA può essere nullo. Ciò è particolarmente vero per esposizione a<br />
basse dosi in cui gli enzimi del sistema riparativo non sono ancora totalmente saturati dal numero<br />
eccessivo di siti di DNA danneggiati.<br />
Gli effetti biologici generati da composti in grado di alterare il DNA sono mutazioni,alterazioni<br />
dell’espressione genica, aneuploidie, scambio di cromatidi fratelli e formazione di micronuclei.<br />
L’esposizione dell’uomo a sostanze mutagene può portare, da un lato, ad un aumento di mutazioni<br />
di cellule geminali, incrementando il rischio di malattie genetiche nelle generazioni successive, e<br />
dall’altro, a mutazioni in cellule somatiche che possono causare malattie neoplastiche.<br />
Per valutare le potenzialità genotossiche di tali xenobiotici negli organismi si sono sviluppati diversi<br />
<strong>test</strong> di genotossicità: qualsiasi sostanza in grado di generare una risposta positiva in questi <strong>test</strong> può<br />
essere considerata ad azione genotossica.<br />
Nel 1984 Ostling e Johanson furono i primi a sviluppare un metodo per l’indagine al fine di rilevare<br />
i danni indotti al DNA su singole cellule utilizzando l’elettroforesi su gel di agarosio. Questa<br />
tecnica che prende il nome di elettroforesi su gel a singola cellula (SCGE) o più comunemente<br />
<strong>Comet</strong> Assay (<strong>test</strong> della cometa), permette lo studio del danno primario al DNA rilevato come<br />
rotture a singolo o doppio filamento, siti alcalo-labili e cross-limk in cellule eucaristiche in vitro e<br />
in vivo in diversi tessuti di diversi organismi (uomo e roditori, pesci, molluschi, uccelli, organismi<br />
vegetali, etc….). L’estrema sensibilità del <strong>Comet</strong> assay e la capacità che ha di misurare il danno al<br />
DNA a livello di ciascuna cellula, lo hanno reso uno strumento mediante il quale risulta<br />
estremamente rapida la valutazione della genotossicità di sostanze o miscele di interesse. La<br />
capacità di registrare il danno in un numero alto di cellule dà forza statistica al metodo e, allo stesso<br />
tempo, permette di rilevare l’eterogeneità di risposta in una popolazione di cellule.
VERSIONE ALCALINA – pH >13.00<br />
Il <strong>Comet</strong> assay si basa sulla capacità de DNA di migrare, in presenza di un campo elettrico, fuori<br />
dalla cellula Il DNA di cellule danneggiate, visualizzato al microscopio, appare come una cometa<br />
con la <strong>test</strong>a (regione nucleare) e una coda determinata dai frammenti o filamenti di DNA che<br />
migrano più velocemente nella direzione dell’anodo; il DNA non danneggiato migra invece molto<br />
poco e rimane prevalentemente ai confini del nucleo.<br />
Il <strong>Comet</strong> assay si articola in diverse fasi principali:<br />
• Preparazione delle cellule su vetrini da microscopia immerse in agarosio<br />
• Lisi delle cellule per rompere le membrane e liberare il DNA<br />
• “Unwinding” del DNA (srotolamento del DNA)<br />
• Elettroforesi<br />
• Neutralizzazione degli alcali<br />
• Colorazione del DNA e visualizzazione dei vetrini al microscopio a fluorescenza<br />
La variazione di alcuni fattori, quali la concentrazione di agarosio nel gel, il pH, la temperatura e la<br />
durata dell’unwinding, il voltaggio, l’amperaggio e la durata dell’elettroforesi, devono essere messe<br />
a punto a seconda il tipo di cellula che si vuole analizzare.<br />
Soluzioni<br />
PBS 10 mM<br />
Il PBS (Phosphate buffered saline=tampone fosfato salino) è una soluzione tampone comunemente<br />
usata nei lab di biologia e biochimica che aiuta a mantenere costante il pH.<br />
Sciogliere i seguenti reagenti in acqua MilliQ<br />
NaCl 137 mM 8g/L<br />
KCl 2.68 mM 0.2g/L<br />
Na2HPO4 8.09 mM 1.44gL<br />
KH2PO4 1.468 mM 0.2g/L<br />
AGAROSIO Standard preparazione vetrini (0.65% - 1%)<br />
Sciogliere l’agarosio in PBS sterile (si scalda al microonde fino a completo scioglimento)<br />
AGAROSIO LMP (Low Melting Point –)(0.5% - 1%)<br />
Agarosio a basso punto di fusione. E’ indicato per analisi elettroforetiche di tipo preparativo quando<br />
è necessario recuperare i frammenti di DNA. Sciogliere l’agarosio in PBS sterile (si scalda al<br />
microonde fino a completo scioglimento) per mantenerlo sciolto durante la preparazione dei vetrini,<br />
metterlo in un bagno termostatato a 37° C)
LISI<br />
NaCl 2.5 M 146.1 g/L<br />
Na2EDTA 100 mM 37.2 g/L<br />
NaOH 300 mM 12 g/L<br />
Tris 10 mM 1.212 g/L<br />
Dopo aver sciolto completamente i sali aggiungere Sodium Lauroyl Sarcosinate 34 mM (10g/L)<br />
Portare a pH 10 con HCl. Portare la soluzione finale a 890 ml. Prima dell’uso si completa la<br />
soluzione con l’aggiunta di Triton 1% (tensioattivo che viene usato nella estrazione del DNA come<br />
parte della soluzione tampone della "lisi gently" ) e DMSO 10% (aggiunto solo per il sangue e<br />
tessuti animali) si agita e si trasferisce a 4°C per almeno 1 ora.<br />
BUFFER DI ELETTROFORESI pH >13.00<br />
In acqua MilliQ sciogliere NaOH (a seconda della molarità richiesta dal protocollo sperimentale -<br />
a pH neutro sono identificabili le DBS double strand break; a pH alcalino le SSB single strand<br />
breaks) e aggiungere 4 ml di EDTA (200 mM, pH 10). La soluzione deve essere conservata a 4°C<br />
per almeno 1 ora prima dell’utilizzo.<br />
SOLUZIONE DI NEUTRALIZZAZIONE<br />
Tris 400mM (pH 7.5) 48.45 g/L<br />
COLORANTE<br />
DAPI (4,6-diamino-2phenilindole)<br />
Protocollo sperimentale<br />
Le cellule da saggiare, intrappolate in un gel di agarosio (LMP), vengono distribuite su un comune<br />
vetrino da microscopio precedentemente preparato. Gli strati di agarosio possono variare a seconda<br />
del protocollo, ma generalmente sono due o tre. Sia la concentrazione delle cellule sul vetrino che la<br />
concentrazione dell’agarosio sono parametri importanti per una corretta analisi. Infatti un’alta<br />
concentrazione di agarosio può limitare la migrazione del DNA durante l’eletroforesi e un’alta<br />
concentrazione di cellule può determinare la sovrapposizione delle cellule stesse e quindi di delle<br />
eventuali comete. La stabilità del gel sul vetrino è inoltre un passaggio critico del <strong>test</strong>.<br />
Preparazione dei vetrini<br />
Scartavetrare i vetrini per una migliore adesione del gel di agarosio<br />
Distribuire uniformemente agarosio allo 0.65% sui vetrini<br />
Conservare i vetrini a +4° C over night in modo da far solidificare il gel mantenendo una certa<br />
umidità per evitare che si asciughi il gel.
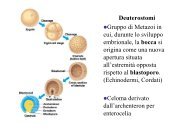
Preparazione del campione coelomociti (Eisenia foetida)<br />
Estrusione coelomociti<br />
Soluzione estraente<br />
2.5 mg/ml di Na2EDTA in una soluzione salina sterile 0.9% NaCl portarla a pH 7.5 e preparare<br />
una soluzione al 10% di etanolo assoluto.<br />
Prelevare direttamente i lombrichi (Eisenia fetida) dal terreno<br />
• metterli in un beker con dell’acqua per lavarli dal terreno. Asciugarli delicatamente.<br />
• riempire una eppendorf sterile da 1.5 ml con 1ml di soluzione estraente (per ogni lombrico)<br />
• mettere il lombrico nell’eppendorf e dopo averlo tenuto il tempo necessario affinché espelli<br />
le cellule coelomociti (colore giallino), toglierlo e rimetterli nel terreno.<br />
Ci vorrà circa un mese per riformare i colomociti<br />
Procedere con la centrifugazione a 4° C per 4 minuti a 500 rcf per avere un pellet.<br />
Togliere 0.9 ml di sovranatante e aggiungere 250 µl di PBS sterile. Risospendere delicatamente il<br />
pellet. Tenere i campioni in ghiaccio. Procedere con il <strong>Comet</strong>.<br />
40 µl coelomociti + 60 µl PBS<br />
10 µl coelomociti +PBS + 80 µl LMP (0.65%) preparazione campione su vetrino<br />
85 µl sul vetrino (per ogni campione) – coprioggetto – 4° C per 10’<br />
togliere coprioggetto ; procedere con la lisi<br />
Lisi delle cellule<br />
Dal momento in cui inizia questa operazione è essenziale lavorare al buio, per evitare che il DNA<br />
possa essere danneggiato da radiazioni luminose. In questo passaggio vengono lisate le cellule, in<br />
modo da rompere le membrane cellulari e consentire la successiva migrazione del DNA durante<br />
l’elettroforesi:<br />
1<br />
• mettere sui vetrini la soluzione di lisi tenuta precedentemente a 4° C per almeno 1 h<br />
• lasciare 30’ (sangue), 10’(coelomociti) in soluzione di lisi a 4°C<br />
• sciacquare delicatamente i vetrini con PBS sterile per eliminare qualsiasi residuo di sali e<br />
detergenti e immergerli nella stessa soluzione per 2’.<br />
2
“Unwinding” del DNA<br />
In questa fase i vetrini vengono incubati nel buffer alcalino di elettroforesi (Ph>13) per<br />
consentire lo srotolamento dei doppi filamenti del DNA in modo tale da esprimere la presenza di<br />
siti labili (ALS - Alkile Labile Sites) e le SSB (Single Strand Breaks) come rotture del singolo<br />
filamento.<br />
Elettroforesi<br />
• mettere intorno alla vaschetta di elettroforesi del<br />
ghiaccio in modo che la soluzione non si<br />
surriscaldi durante la corsa.<br />
• versare il buffer precedentemente preparato,<br />
nelle camere laterali della vaschetta<br />
• posizionare i vetrini in modo da non avere spazi<br />
fra loro<br />
• rabboccare le camere laterali della vaschetta con<br />
il buffer e ricoprire i vetrini in modo da creare<br />
uno “strato” uniforme.<br />
• lasciare 15’ (sangue) 25’ (coelomociti)<br />
Le condizioni di elettroforesi sono molto importanti. Collegare i cavi alla vaschetta e dopo aver<br />
impostato i parametri, 1V/cm - 250 mA -13’ per i campioni di sangue; 1V/cm – 300 mA - 20’ per<br />
i coelomociti, fare partire l’elettroforesi. Prima di fare partire la corsa, bisogna controllare che lo<br />
“strato” che ricopre i vetrini sia adeguato al mantenimento dei parametri da noi impostati e quindi<br />
una buona riuscita dell’elettroforesi,<br />
Neutralizzazione degli alcali<br />
Sciacquare delicatamente i vetrini con Tris pH 7.5 sterile e immergerli nella stessa soluzione per<br />
10’.<br />
3<br />
1<br />
Colorazione del DNA e visualizzazione dei vetrini al microscopio a fluorescenza.<br />
Possono essere utilizzati diversi fluorocromi per la visualizzazione delle cellule al microscopo:<br />
etidio bromuro, propizio induro, DAPI (4,6-diamino-2phenilindole) e SYBR Green I. Mettere in<br />
ogni campione pochi µl di colorante, mettere il coprioggetto aspettare qualche minuto. Una volta<br />
colorato, il campione è pronto per l’osservazione al microscopio ottico a fluorescenza (obiettivo<br />
40X). E’ preferibile analizzare i vetrini non oltre le 48 ore circa dalla preparazione, per evitare che<br />
si asciughi il gel, compromettendo la visione delle cellule. Per avere una stima della frequenza delle<br />
tre tipologie di cellule all’interno di ogni vetrino, viene eseguita una conta al microscopio delle<br />
cellule classificandole nelle tre categorie nuclei intatti, comete, ghost.<br />
Immagine ottenuta al microscopio con colorazione DAPI<br />
3<br />
2
a - Nuclei intatti<br />
Il materiale genetico rimane sostanzialmente confinato all’interno del nucleo; la migrazione nel<br />
corso dell’elettroforesi è nulla o minima. Questi nuclei appartengono a cellule con DNA intatto che<br />
non hanno subito effetti genotossici rilevanti.<br />
b - <strong>Comet</strong>e<br />
Le comete presentano una “<strong>test</strong>a” costituita dalla porzione di DNA intatto e una “coda” che<br />
contiene i frammenti di DNA minori che anno migrato durante l’elettroforesi. I nuclei che generano<br />
comete hanno subito effetti genotossici che possono essere stimati attraverso la misura dei<br />
parametri sotto indicati<br />
c - Ghost<br />
Le ghost si riconoscono per l’assoluta mancanza di un corpo centrale e presentano una forma<br />
allargata a “macchia”. Il DNA è del tutto frammentato e degradato, fenomeno che non può essere<br />
imputabile unicamente ad un danno genotossico, ma ad un effetto citotossico importante o a cellule<br />
apoptotiche giunte alla fine del ciclo vitale.<br />
a – nucleo intatto b – cometa c - ghost<br />
Lo scopo della visualizzazione dei campioni la microscopio è la quantificazione del numero di<br />
cellule che presentano il DNA frammentato rispetto a quelle con nucleo intatto, e la quantificazione<br />
del danno genetico subito attraverso misurazioni di determinati parametri strutturali della cometa<br />
stessa (<strong>test</strong>a - superficie occupata dal nucleo; coda – superficie DNA migrato; densità - rapporto<br />
tra il numero di pixel e la superficie dell’immagine)<br />
Questi parametri vengono elaborati dal software consentendo di procedere all’analisi quantitativa e<br />
quindi, la scelta dei valori da attribuire è fondamentale e può risultare estremamente variabile a<br />
seconda delle condizioni sperimentali adottate. Le misure necessarie a determinare l’entità del<br />
danno genotossico subito vengono effettuate su n. 50 immagini prese random tra le 100 immagini<br />
cellule non ghost.<br />
Sulla base di queste misure vengono calcolate:
% di DNA migrato<br />
= (densità coda X area coda) / [(densità coda X area coda) + densità <strong>test</strong>a X area <strong>test</strong>a)] X 100<br />
Tail moment<br />
% DNA migrato X lunghezza coda (tail)<br />
Tail moment Olive<br />
%DNA migrato × distanza tra la <strong>test</strong>a e il centro di massa del DNA nella coda<br />
Indice di danno<br />
Per calcolare questo indice (DI), le cellule vengono allocate in classi secondo la lunghezza della<br />
coda. Per calcolare il DI si somma il rapporto tra la percentuale di cellule appartenenti ad ogni<br />
classe ed il corrispettivo numero di classe.<br />
Esempio con 5 classi<br />
DI = (% cell classe 0 X 0) + (% cell classe 1 X 1) + (% cell classe 2 X 2) +(% cell classe 3 X 3) +<br />
(% cell classe 4 X 4)<br />
Dove 0 rappresenta la classe in cui sono presenti cellule non danneggiate e 4 la classe con<br />
maggior danno. Il DI risulta essere un parametro risulta essere un parametro riassuntivo che<br />
quantifica l’effetto genotossico medio subito dal gruppo d’individui preso in esame. Il range entro<br />
cui può variare il valore di DI va da 0 a 400 . Un valore di DI=0 indica che non c’è danno<br />
genotossico, mentre un valore di 400 indica il massimo livello di danno.<br />
Selezione e salvataggio delle immagini<br />
Le immagini vengono riprese con un obiettivo ad un ingrandimento 40x, utilizzando una telecamera<br />
collegata ad un computer. Per le analisi dei parametri indicativi del danno genotossico vengono<br />
solitamente analizzate cinquanta immagini per campione prese random su cento cellule contate in<br />
un’area ben visibile del vetrino, in modo da rappresentare oggettivamente la situazione del<br />
campione esaminato, escludendo come detto precedentemente dalle conte le cellule ghost. Il metodo<br />
di salvataggio random è stato eseguito a partire da matrici numeriche che individuano cinquanta<br />
numeri casuali su 100 totali riferiti alle cellule presenti sul vetrino mediante un programma di<br />
statistica.<br />
La valutazione quantitativa dei dati è stata realizzata mediante il programma informatico <strong>Comet</strong><br />
Imager 1.2.14 (MetaSystems) che consente di rilevare istantaneamente diversi parametri<br />
fondamentali per valutare il danno genotossico
Il fondamento che sottende al programma risiede nel calcolo, da parte del software, della differenza<br />
di intensità di pixel tra un background (sfondo), che viene preso come riferimento, e l’intensità del<br />
campo intercettato dalla molecola di DNA. Fornendo arbitrariamente dei valori soglia di luminosità<br />
per le diverse porzioni di cui è costituita la cometa (<strong>test</strong>a, coda e area totale) l’interfaccia grafica<br />
consente di visualizzare immediatamente tali parametri.<br />
IL MICROSCOPIO IN FLUORESCENZA<br />
Questo tipo di microscopio è uno strumento adatto a rivelare strutture autofluorescenti (fluorescenza<br />
primaria) o rese fluorescenti con l’uso di fluorocromi (fluorescenza secondaria).<br />
Le sostanze autofluorescenti presenti nelle strutture biologiche emettono, solitamente, luce visibile<br />
quando vengono illuminate con luce ultravioletta che abbia una lunghezza d’onda di poco inferiore<br />
a 400 nm; la ricerca della fluorescenza può, comunque, farsi anche con un microscopio provvisto di<br />
una normale ottica, visto che l’ultravioletto con lunghezza d’onda al di sopra dei 350 nm è<br />
trasmesso bene anche dai comuni obiettivi.<br />
La microscopia in fluorescenza si basa sulla tecnica della doppia filtrazione: la sorgente luminosa è<br />
costituita da una lampada a vapori di mercurio o da una lampada ad arco voltaico poiché queste<br />
emettono luce ricca di radiazioni ultraviolette; la luce emessa viene fatta passare attraverso un filtro<br />
d’eccitazione che trattiene tutte la radiazioni al di fuori di quelle ultraviolette. Davanti all’oculare vi<br />
è un altro filtro detto filtro di sbarramento che arresta tutte le radiazioni ultraviolette non assorbite<br />
dal preparato e lascia passare quelle di lunghezza d’onda più elevata.<br />
Una sostanza fluorescente assorbe radiazioni ultraviolette e passa in uno stato eccitato e quando<br />
torna allo stato basale perde energia che riemette sottoforma di luce; grazie a questi filtri le sostanze<br />
fluorescenti appaiono colorate su un fondo nero.<br />
Un esempio di fluorescenza è costituito proprio dal colorante che stato adoperato durante le analisi<br />
sui celomociti: il DAPI viene eccitato nell’UV vicino a 365 nm ed emette nel campo spettrale del<br />
blu-violetto; tale marcatura è adottata per rendere visibili i nuclei cellulari ed in particolare i<br />
cromosomi.