Apri file allegato (risultatiricerca.pdf) - Cra
Apri file allegato (risultatiricerca.pdf) - Cra
Apri file allegato (risultatiricerca.pdf) - Cra
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Progetto PRAL 2003/14<br />
Impiego di lieviti con particolari proprietà enologiche,<br />
selezionati nella Regione Lazio, per il miglioramento<br />
della qualità dei vini.<br />
RISULTATI DELLA RICERCA<br />
ENC - Velletri
IndIce<br />
2<br />
Sommario.................................................................................................................................. pag. 3<br />
Aspetti metodologici e tecnologici........................................................................................... pag. 5<br />
Aspetti fermentativi............................................................................................................... pag. 35<br />
Nuovi approcci per la tipizzazione molecolare di lieviti di interesse enologico................ pag. 43
SOMMARIO<br />
Il presente progetto è il frutto di una collaborazione tra CRA - Unità di ricerca per le produzioni enologiche<br />
dell’Italia centrale – VELLETRI (già Istituto Sperimentale per l’Enologia), e il Dipartimento di<br />
Biologia Cellulare e dello Sviluppo (BCS) dell’Università “Sapienza” di Roma.<br />
Tale collaborazione, già sperimentata con successo negli anni passati, si giova delle competenze complementari<br />
sulla fermentazione sviluppate dai due gruppi di ricerca coinvolti, nonché della diversa tipologia<br />
di strumentazione presente nei laboratori dei due Enti.<br />
Il gruppo coordinato dal Dr. Gaetano Ciolfi ha maturato una lunga esperienza principalmente sugli<br />
aspetti metabolici e tecnologici della fermentazione mentre il gruppo coordinato dal Prof. Claudio Falcone<br />
si occupa prevalentemente dello studio genetico e molecolare dei lieviti vinari.<br />
Lo scopo principale di questa collaborazione è quello di approfondire da un lato l’effetto della composizione<br />
dei mosti e delle condizioni di fermentazione sulla qualità del vino e, dall’altro, di migliorare le<br />
tecniche di identificazione dei lieviti per comprendere il ruolo di ceppi specifici nel processo di vinificazione.<br />
Presso il CRA sono state effettuate prove di fermentazione in presenza/assenza di ossigeno, azoto e<br />
calcio pantotenato, utilizzando due differenti ceppi di lievito e uve con diverso grado di maturazione,<br />
allo scopo di verificare la possibilità di indurre produzioni elevate di composti responsabili della composizione<br />
chimica ed organolettica dei vini, quali acidi organici, acidi grassi, esteri e glicerina. Su tutte le<br />
prove sono state eseguite a completamento della fase di fermentazione analisi chimico-fisiche, sensoriali<br />
e statistiche dei vini ottenuti.<br />
Le prove sperimentali presso il CRA, come si evince dalla trattazione, hanno confermato come l’impiego<br />
del lievito S6U (ibrido con caratteristiche fenotipiche riferibili alla razza fisiologica uvarum) sia<br />
da preferire in ogni fermentazione e questo perché esprime al meglio la tipicità del vino per i seguenti<br />
motivi:<br />
contribuisce a mantenere alto il valore di acidità totale e questo rappresenta una garanzia di stabilità<br />
strutturale del vino;<br />
produce, in ogni condizione, valori di glicerina più elevati, quindi il vino assume connotati di corposità<br />
che esaltano il rapporto con il territorio;<br />
una minore produzione di solfiti agevola un razionale impiego a fine fermentazione e determina una<br />
migliore compatibilità ambientale.<br />
Da un punto di vista dei trattamenti al mosto è risultato che:<br />
l’impiego di ossigeno nel corso della fermentazione risulta ininfluente ai fini del risultato metabolico<br />
del lievito;<br />
l’impiego di azoto va limitato soltanto ai casi di effettivo impoverimento del mezzo, casi rarissimi nelle<br />
condizioni di una razionale enotecnica che non deve prevedere eccessi di chiarifica. Spesso, infatti, si<br />
tende ad addizionare azoto ammoniacale nell’intento di prevenire rallentamenti o arresti di fermentazione<br />
che sono la conseguenza della mancata rimozione di inibitori e la causa di trattamenti deproteinizzanti<br />
troppo spinti. Al riguardo si evidenzia come l’impiego di azoto ammoniacale deprima le qualità<br />
tipiche dell’uva poiché rallenta il metabolismo degli aminoacidi e peptidi del mezzo; ne consegue che<br />
la maggiore tipicità del prodotto va perseguita attraverso opportune tecniche colturali volte proprio alla<br />
migliore espressione del metabolismo variatale.<br />
Impiegando lieviti in purezza o con inoculo scalare, si riscontra che nelle prove scalari i principali metaboliti<br />
sono presenti in concentrazioni inferiori rispetto alle fermentazioni in purezza. Per i motivi discussi<br />
successivamente nel testo, appare evidente come la condotta delle fermentazioni debba essere operata<br />
da un solo lievito al fine di poter ottenere il migliore risultato metabolico prevedibile e che, nel corso di<br />
3
fermentazioni scalari, il risultato metabolico complessivo non può essere considerato come il rafforzativo<br />
delle singole peculiarità ma, bensì, come l’appiattimento delle specifiche tendenze metaboliche.<br />
Questo fatto appare importante soprattutto quando si vogliono esaltare le qualità compositive del mosto<br />
di partenza, quindi delle uve e dell’ambiente di provenienza.<br />
Infine, recenti risultati di Berovic e Herga (2007) hanno indicato che un inoculo di lievito sottoposto a<br />
shock termico è in grado di produrre un incremento del 74% di glicerina nel corso della fermentazione<br />
alcolica. Data l’importanza delle implicazioni di tali risultati, abbiamo voluto verificare la loro validità<br />
mediante prove sperimentali effettuate nelle medesime condizioni operative descritte dagli Autori.<br />
I nostri risultati, ottenuti anche utilizzando dosi di lievito inoculo differenti, non hanno però indicato<br />
alcuna variazione nella concentrazione di glicerolo a fine fermentazione.<br />
Presso il Dipartimento BCS è stato sviluppato un nuovo sistema molecolare per l’identificazione dei<br />
lieviti vinari basato sulla presenza dei geni che codificano per le alcool deidrogenasi (ADH). Il sistema<br />
ha il vantaggio di presentare un doppio controllo in quanto consente di combinare l’analisi del DNA amplificato<br />
di ciascun gene e dei relativi frammenti di restrizione (RFLP) con il rilevamento delle attività<br />
enzimatiche (zimogramma) ADH presenti in ciascun ceppo.<br />
I ceppi di lievito analizzati, isolati prevalentemente dall’uva, dai mosti e dal vino, provengono dalle<br />
collezioni del CRA di Velletri e del Dipartimento di Biologia Vegetale dell’Università di Perugia.<br />
Nel lievito S. cerevisiae, il sistema ADH è costituito da quattro geni altamente conservati (ADH1, 2, 3 e<br />
5) che codificano per attività enzimatiche che sono fondamentali per la formazione dell’etanolo a partire<br />
dagli zuccheri presenti nei mosti.<br />
La conoscenza delle sequenze nucleotidiche del ceppo di S. cerevisiae utilizzato come controllo ha permesso<br />
di disegnare coppie di primers specifici per l’amplificazione di ciascuno dei quattro geni ADH.<br />
Questa tecnica ha permesso di ottenere frammenti di DNA di taglia diversa specifici per ciascun gene.<br />
L’amplificazione è stata effettuata anche su tutti e quattro i geni contemporaneamente mediante PCR<br />
multiplex allo scopo di ottenere più velocemente un’impronta molecolare dei ceppi in esame.<br />
La digestione dei prodotti di PCR ottenuti con Sau3AI, un enzima di restrizione che riconosce le sequenze<br />
GATC, e la successiva separazione dei frammenti su gel, ci ha permesso di ottenere un polimorfismo<br />
di restrizione più dettagliato e specifico per ciascun lievito analizzato.<br />
Per una successiva verifica della validità del metodo, a queste tecniche basate sul DNA è stata affiancata<br />
l’analisi delle attività enzimatiche ADH codificate dai singoli geni. Questa tecnica, da noi messa a punto<br />
su minigel e che non richiede pertanto un tempo eccessivo, consiste nella separazione elettroforetica<br />
degli isozimi ADH presenti negli estratti proteici dei lieviti che vengono poi visualizzate mediante una<br />
specifica colorazione per attività.<br />
In tal modo è stato possibile definire per ogni ceppo analizzato uno specifico zimogramma delle attività<br />
ADH che, confrontato con l’analisi del DNA, ha potuto confermare la presenza/assenza dei rispettivi<br />
geni.<br />
Di conseguenza, il sistema combinato DNA enzima potrebbe consentire di seguire con precisione le<br />
percentuali d’impianto dei vari ceppi durante la fermentazione.<br />
Il Coordinatore del progetto<br />
Prof. Claudio Falcone<br />
4
cRA-Unità di ricerca per le produzioni enologiche dell’Italia centrale Velletri<br />
Regione Lazio, Progetto PRAL 2003/14:<br />
Impiego di lieviti con particolari proprietà enologiche, selezionati nella Regione Lazio, per il miglioramento<br />
della qualità dei vini.<br />
ASPETTI METABOLICI E TECNOLOGICI<br />
Favale Stefano, Paolo Pietromarchi, Domenico Tiberi, Alberto Cedroni, Aldo Garofolo, Gaetano Ciolfi<br />
Premessa<br />
Nelle varie fasi che si susseguono durante il processo tecnologico della vinificazione, quella della fermentazione<br />
alcolica è sicuramente una degli aspetti più sentiti nel mondo enologico, proprio perchè è<br />
durante questo processo biochimico che si determinano le caratteristiche compositive ed organolettiche<br />
dei vini.<br />
Considerato l’interesse rivolto a questo argomento dall’industria enologica, la ricerca scientifica è da<br />
tempo impegnata ad affrontare le problematiche legate al biochimismo cellulare del lievito, oltre ad<br />
approfondire le conoscenze sugli aspetti che possono indurre anomalie quali arresti di fermentazione o<br />
fermentazioni stentate.<br />
Nonostante i numerosi progressi realizzati in cantina (controllo della temperatura, ecc.), si può considerare<br />
che la gestione della fermentazione è ancora lungi dall’essere ottimizzata. In effetti, un dato
fondamentale in enologia è raramente preso in considerazione, ed in modo impreciso: la variabilità<br />
della materia prima. Il monitoraggio in linea della cinetica fermentativa (per ora ancora una utopia) può<br />
servire non solo a migliorare il controllo dell’andamento delle fermentazioni, ma anche, e soprattutto, a<br />
“pilotarne” il controllo.<br />
Questa nozione di pilotaggio consiste nell’adattare gli interventi (temperatura, aggiunte di nutrienti etc.)<br />
in funzione dello svolgimento della fermentazione. A breve o medio termine, consisterà anche in anticipare,<br />
grazie ad una predizione (modellizzazione) dell’andamento fermentativo e nel prendere in considerazione<br />
non solo i criteri tecnologici (completamento delle fermentazioni, consumo di frigorie…)<br />
ma anche criteri più qualitativi.<br />
È ormai dimostrato, dalla letteratura, come alcuni elementi costituiscano veri e propri fattori limitanti<br />
lo sviluppo e il metabolismo del lievito, in particolare: l’ossigeno risulta essere necessario ai lieviti<br />
per sintetizzare acidi grassi e steroli nella fase di crescita aerobica, l’azoto (sotto forma assimilabile) è<br />
necessario alla crescita cellulare dei lieviti e calcio pantotenato, responsabile della sintesi di Acetil-coenzima<br />
A per un corretto impiego di acetato di derivazione intracellulare.<br />
Sebbene la fermentazione alcolica si svolga in un ambiente anaerobico, è ormai dimostrato come il ruolo<br />
dell’ossigeno nei mosti influenzi la produzione di numerosi composti e contribuisca alla completezza<br />
gusto-olfattiva dei vini; fino ad oggi, però, l’importanza di questo elemento è stata valutata soprattutto<br />
per ciò che attiene all’incidenza sulla frazione fenolica del mosto e poco si sa sulla funzione di questo<br />
elemento sul metabolismo cellulare in condizione di fermentazione anaerobica.<br />
Il ruolo dell’ossigeno è generalmente favorevole alla qualità dei vini, in modo particolare nella vinificazione<br />
in rossi, anche se è necessario che dosi e modalità d’impiego siano strettamente controllate. Diverse<br />
e recenti tecniche di vinificazione prevedono la somministrazione ragionata dell’ossigeno durante le<br />
fasi che susseguono nella trasformazione da uva a vino anche in condizioni di iperossiggenazione.<br />
La microssigenazione, durante la fase di maturazione e affinamento dei vini, o al contrario, le vinificazioni<br />
in riduzione, eseguite cercando di limitare al minimo il contatto dei mosti e dei vini con l’ossigeno,<br />
dimostrano l’importanza che riveste questo elemento in enologia.<br />
È perciò necessario rapportare queste tecniche sempre al tipo di uva oggetto di lavorazione in considerazione<br />
della differente risposta legata alla composizione analitica del mosto.<br />
Uve aromatiche (ad esempio moscato ) o con alto contenuto di precursori aromatici (tra cui si può annoverare<br />
anche la Malvasia del Lazio) possono essere trattate sia con tecniche in riduzione sia in ossidazione.<br />
Per uve che possiedono un basso contenuto aromatico, viene preferita in vinificazione in riduzione,<br />
al fine di cercare di mantenere questa dotazione altrimenti compromessa con ossigenazione.<br />
Uve dal sapore neutro, che apportano ai conseguenti vini profumi e aromi derivanti dalla sola fermentazione<br />
alcolica, sono generalmente trattate con techiche ossidative, che contribuiscono a una migliore<br />
stabilità del vino e ad un uso ridotto di solfiti.<br />
Le principali esperienze del ruolo dell’ossigeno nella fermentazione vinaria furono eseguite da Riberau-<br />
Gayon e da Sablayrolles, i quali, oltre a constatare il ruolo fondamentale che riveste nella sintesi lipidica<br />
e nella formazione di grandi quantità di steroli e acidi grassi, determinarono che la quantità di ossigeno<br />
necessaria al corretto svolgimento di questo processo sia da considerarsi tra i 5 e 10 mL/L di ossigeno,<br />
somministrato nella fase esponenziale di crescita cellulare del lievito (circa due giorni dopo l’inoculo).<br />
Si deve a Moutonet e ad altri ricercatori di Montpellier i primi studi sulla microssigenazione, tecnica nata<br />
dall’intuizione di ricreare condizioni redox in un mosto o in un vino, vinificato in serbatoio in acciaio<br />
inox, simili a quelle che si verificano in una barrique. Si è accertato che l’apporto di ossigeno in fase di<br />
affinamento in una barrique varia da 0,6 a 3 mL/L/mese in funzione della tipologia di legno utilizzato e<br />
dal grado di permeazione delle doghe, che diminuisce con il tempo di utilizzo (Ferrarini et al., 2001).<br />
Alcuni studiosi riportano come mosti fermentati con lieviti Saccharomyces cerevisiae, in assenza di<br />
ossigeno iniziale, producano a fine fermentazione vini con più basse concentrazioni di alcoli superiori ed<br />
esteri, mentre mosti addizionati di ossigeno presentano più alti contenuti di questi composti. In presenza
di ossigeno iniziale , però, è più elevato il contenuto in alcoli superiori a scapito degli esteri, per cui il<br />
miglior rapporti tra questi due composti induce a pensare che il non impiego di ossigeno iniziale possa<br />
incrementare le proprietà sensoriali dei vini ottenuti (Valero, et al., 2002).<br />
Altre ricerche hanno indagato sull’influenza che determina l’addizione di ossigeno durante la fermentazione<br />
sugli steroli contenuti nelle fecce (lisi o scorse) di lievito e la reattività delle stesse nei confronti<br />
dell’ossigeno. Studi condotti da Caroline Fornairon-Bonnefond (2003) hanno investigato sulla potenziale<br />
relazione tra ossigeno aggiunto a ceppi di lievito enologici commerciali durante la fase di fermentazione<br />
alcolica e l’interazione tra fecce di lievito e ossigeno. Sulla base di queste indagini, aggiunte di<br />
bassi ed eccessivi contenuti di ossigeno, rispettivamente di (7 mg/L) e (37 mg/L), alla fine della crescita<br />
cellulare, sono stati comparati in termini di ripercussioni sull’attività di consumo dell’ossigeno delle<br />
corrispondenti fecce di lievito.<br />
Da ciò è emerso che la somministrazione di ossigeno da parte delle cellule di lievito durante la fermentazione<br />
ha un’influenza positiva sulla cinetica di fermentativa, incrementando al tempo stesso la formazione<br />
di biomassa delle cellule. Si è altresì osservato che i tassi di consumo di ossigeno e la capacità<br />
di consumo da parte delle fecce di lievito, diminuisce quando l’ossigeno viene somministrato durante<br />
la fermentazione. Contemporaneamente si è registrato un incremento della sintesi dell’ergosterolo e la<br />
degradazione degli steroli ossigeno dipendenti. Tale degradazione avviene quando l’ossigeno è somministrato<br />
in dosi eccessive. Sulla base di questi studi risulta fondamentale avere un controllo diretto dell’ossigenazione<br />
dei mosti durante la FA sia per ottimizzare la cinetica fermentativa, sia per controllare<br />
la reattività che hanno le fecce di lievito nei confronti dell’ossigeno.<br />
Diversi studi hanno evidenziato come il contenuto di azoto presente nei mosti contribuiscano alla qualità<br />
compositiva e sensoriali del vino. Mosti che presentano bassi contenuti di azoto prontamente assimilabile,<br />
fondamentale per la crescita cellulare dei lieviti e di conseguenza del vigore fermentativo,<br />
vanno incontro a rischi di arresti fermentativi, cinetiche di fermentazione stentate o lente, favorendo<br />
la produzione di tioli non desiderati (es. idrogeno solforato) e alcoli superiori, con basse produzioni di<br />
esteri e acidi grassi. Di contro, alti contenuti di azoto assimilabile, oltre a determinare vigorose fermentazioni,<br />
favoriscono la formazione di etil acetato, acido acetico e acidità volatile (Bell S., Henschke P.,<br />
2005). Altri studi, svolti presso l’INRA di Montpellier e cordinati da Jean Marie Sabrayrolles, hanno<br />
evidenziato che la disponibilità di azoto assimilabile non ha influenza sul completo svolgimento della<br />
fermentazione (esaurimento degli zuccheri presenti), ma che tale dotazione influenzi la velocità di avvio<br />
della fermentazione, i tempi in cui questa raggiunge il massimo consumo degli zuccheri e sull’altezza<br />
del picco di massima velocità di fermentazione (intesa come quantità di zuccheri consumata, o di CO2<br />
sviluppata, nell’unità di tempo).<br />
Alcune ricerche hanno approfondito gli aspetti e dimostrato anche le interazioni che avvengono in mosti<br />
sintetici tra azoto assimilabile e acido pantotenico presenti in dosi variabili. In mezzi sintetici contenenti<br />
250 μg/L la produzione di idrogeno solforato (H2S) diminuisce da 480 μg e 420 μg a 4-6 e 80 μg<br />
rispettivamente quando il contenuto in azoto assimilabile è incrementato da 60 a 250 mg/L. al contrario<br />
il contenuto di H2S viene incrementato quando all’aumento di azoto prontamente assimilabile coincide<br />
un basso valore di acido pantotenico (Wang et al., 2003).
Scopo del lavoro<br />
Dalla disamina delle acquisizioni si sono volute approfondire le conoscenze circa la possibilità di indurre<br />
produzioni elevate, durante la fase di fermentazione alcolica, di alcuni dei composti responsabili della<br />
composizione chimica ed organolettica dei vini, quali acidi organici, acidi grassi, esteri e glicerina.<br />
A tal fine sono state allestite e condotte presso il CRA-Unità di ricerca per le produzioni enologiche<br />
dell’Italia centrale (già Istituto Sperimentale per l’Enologia) una serie di prove di fermentazione analizzando<br />
l’interazione che si registra nel mezzo utilizzando due differenti ceppi di lieviti enologici isolati<br />
presso il CRA-ENC, in presenza o assenza, di ossigeno, azoto e calcio pantotenato, su un mosto da<br />
Malvasia puntinata (o del Lazio) (foto 1 e 2) ottenuto da uve raccolte a maturità fisiologica ma con uno<br />
stato sanitario differente. Le uve provenivano dal vigneto sperimentale presso l’unità di ricerca sede del<br />
Centro Dimostrativo Regionale ARSIAL e da essa condotto (foto3).<br />
Tutte le fermentazioni sono state condotte a 25°C fino allo svolgimento di un grado alcolico del 4%, per<br />
poi concludere la FA ad una temperatura costante di 18°C.<br />
Su tutte le prove oggetto di studio sono state eseguite a completamento della fase di fermentazione analisi<br />
chimico-fisiche, sensoriali e statistiche dei vini ottenuti.<br />
Foto 1
Foto 2<br />
Foto 3
Materiali e metodi<br />
La prova sperimentale è stata eseguita presso il CRA-ENC Unità di ricerca per le produzioni enologiche<br />
dell’Italia centrale di Velletri. É stata impiegata uva Malvasia del Lazio, raccolta manualmente in due<br />
masse distinte: la prima massa, denominata MQ (Malvasia di Qualità) è stata effettuata sottoponendo le<br />
uve a cernita manuale, scartando i grappoli in non perfetto stato sanitario; la seconda massa, denominata<br />
MS (Malvasia Standard), è stata effettuata simulando una raccolta meccanizzata, quindi raccogliendo<br />
tutti i grappoli presenti sulle piante, anche quelli in non perfetto stato sanitario.<br />
Per ciascuna delle masse di uva, di circa 1500 kg cadauna, si è seguito lo stesso protocollo di vinificazione<br />
in bianco, che ha previsto nelle prime fasi di lavorazione le seguenti operazioni: diraspo-pigiatura,<br />
pressatura e solfitazione omogenea del mosto (50 mg/L), chiarificazione statica (senza ausilio di additivi)<br />
per 24 ore a 8°C. Trascorso tale tempo è stata spillata una massa omogenea di 900L, per ciascuna<br />
prova, e ripartita in 10 fermentini in acciaio inox AISI 316 termocondizionati.<br />
Su ciascun fermentino è stata avviata la fermentazione alcolica utilizzando due distinti ceppi di lievito<br />
isolati presso il CRA-ENC, lievito Saccharomyces cerevisiae r.f. uvarum S6U e lievito Saccharomyces<br />
cerevisiae AT1. I lieviti sono stati scelti in virtù delle loro caratteristiche metaboliche le più compatibili<br />
con la tipologia di vini dell’areale laziale.<br />
Le condizioni operative sui fermentini, uguali per entrambe le prove (MQ e MS), hanno previsto condizioni<br />
differenti di fermentazione alcolica in presenza o assenza di ossigeno, azoto e calcio pantotenato,<br />
e sono di seguito riassunte nello schema riportato in Tabella 1.<br />
Tutte le prove oggetto di studio, a fine fermentazione alcolica, sono state sottoposte ad analisi chimiche<br />
e fisiche, inoltre, per ogni prova si sono eseguiti trattamenti di chiarifica, stabilizzazione tartarica e proteica,<br />
filtrazione ed infine avviate alla fase di imbottigliamento.<br />
Dopo circa 3 mesi dal loro confezionamento in bottiglia, tutti i vini sono stati sottoposti ad esame organolettico<br />
e sensoriale.<br />
Le prove sono state allestite presso la cantina sperimentale del CRA-Unità di ricerca per le produzioni<br />
enologiche dell’Italia centrale di Velletri impiegando un impianto pilota (foto 4) dimensionato per effettuare<br />
fermentazioni sperimentali, impianto finanziato totalmente con fondi regionali attraverso convenzioni<br />
e progetti PRAL (2000/44, 2002/59, 2003/22) In foto 5 si evidenzia il particolare strumentale del<br />
microossigenatore.<br />
Foto 4<br />
10
Foto 5<br />
11
Schema operativo<br />
N° fermentino Lievito Ossigeno Azoto Calcio Pantotenato<br />
1 AT1 NO SI SI<br />
2 S6U NO SI SI<br />
3 AT1 NO NO NO<br />
4 S6U NO NO NO<br />
5 AT1 NO SI NO<br />
6 S6U NO SI NO<br />
7 AT1 SI NO NO<br />
8 S6U SI NO NO<br />
9 AT1 SI SI NO<br />
10 S6U SI SI NO<br />
Lievito: le dosi di inoculo utilizzate sono state per il lievito S6U di 20 g/hL (peso secco) e di lievito AT1<br />
in dose di 2 Milioni cellule/m L sotto forma di mosto di avviamento.<br />
Il lievito S6U, isolato nell’areale laziale, per le sue qualità metaboliche e tecnologiche viene prodotto<br />
industrialmente dalla società Lallemad-Lalvin e distribuito in tutte le aree enologiche del Pianeta. Questo<br />
lievito ha ottenuto un espresso riconoscimento da studiosi di tutto il mondo; parimenti il Centro per la<br />
Sperimentazione in Vitivinicoltura di Verona e l’Università degli studi di Verona lo hanno indicato<br />
come il miglior lievito per la produzione di vini in Valpolicella. Si tratta di un lievito ibrido naturale con<br />
caratteristiche fenotipiche della razza S. uvarum (Tosi,Zapparoli,2005).<br />
Il lievito AT1, isolato anch’esso nell’areale laziale è uno dei migliori ceppi della razza fisiologica<br />
cerevisiae ed è stato preferito per le sue qualità aromatiche e metaboliche.<br />
Ossigeno: quattro prove sono state trattate fornendo ossigeno (Rivoira S.p.A.) in dose complessiva di<br />
2,5 ml/L per die, somministrato mediante microssigenatore (ditta Tecnal) ad intervalli regolari di 30<br />
minuti nell’arco delle 24 ore.<br />
Azoto assimilabile: sulla base delle analisi eseguite dopo pigiadiraspatura, pressatura e omogeneizzazione<br />
della massa, è stato aggiunto azoto prontamente assimilabile, sotto forma di solfato (50%) e fosfato di<br />
ammonio (50%), fino a raggiungere un contenuto nel mosto complessivo di 237 mg/L ed aggiunto in un<br />
unica somministrazione all’inizio della fermentazione.<br />
Calcio Pantotenato: sui fermentini interessati è stato fornito calcio pantotenato in dose di 1 mg/L e<br />
somministrato in unica soluzione all’inizio della fermentazione.<br />
Analisi chimiche: sulle tutte le prove oggetto di studio sono state eseguite analisi chimico-fisiche<br />
secondo le metodiche ufficiali riportate sulla G.U. delle Comunità Europee L.272 del 3/10/1990.<br />
Le analisi dei composti volatili sono state eseguite secondo i metodi Giannotti S., Di Stefano R. (1991)<br />
e Di Stefano R. (1991).<br />
Analisi statistiche: tutti i dati ottenuti dalle analisi chimicho-fisiche sono stati trattati con Test ANOVA<br />
(α = 0.05) .<br />
Analisi Sensoriali: a circa tre mesi dopo il loro confezionamento in bottiglia, i vini ottenuti dalle prove<br />
MQ e MS sono stati sottoposti ad esame organolettico utilizzando il Test di Kramer (o dell’ordimanento)<br />
attraverso il quale il panel di degustatori è stato chiamato ad esprimere un giudizio di gradevolezza<br />
complessivo, ordinando i vini in ordine crescente di gradimento.<br />
12
Risultati delle prove sperimentali<br />
Di seguito vengono riportate le principali analisi chimico-fisiche dei mosti di partenza, ci sono differenze<br />
significative, la prova MS evidenzia un mosto proveniente da uve con raccolta posticipata, lo si deduce<br />
dalla concentrazione zuccherina (20,43 % per MQ contro, 22,8 % per MS), dalla acidità titolabile in<br />
valore superiore alla MQ, dal contenuto in APA a livello inferiore. Purtroppo nella prova MS si evidenzia<br />
un contenuto in acidità volatile elevato (0,92 g/L a fronte dello 0,16 per la prova MQ), questo fatto<br />
dimostra come la sanità delle uve era alquanto compromessa. Per un certo verso, la cosa è stata voluta<br />
e programmata proprio al fine di valutare l’eventuale incidenza dell’acido acetico sul metabolismo del<br />
lievito ma anche per individuare eventuali differenze dovute alla diversa tipologia di azoto presente;<br />
infatti, con lo svilupparsi della muffa grigia la sua crescita impone l’idrolisi di parte del contenuto<br />
proteico dell’acino e conseguente consumo di parte dell’azoto aminoacidico dello stesso. A riprova di<br />
ciò, le analisi evidenziano come l’APA presente nel mosto MS sia inferiore a quello in MQ. Nell’allestire<br />
le prove, quindi, quella su mosto MS conterrà un quantitativo di azoto ammoniacale superiore al mosto<br />
MS tale, però, da pareggiare il valore finale di APA.<br />
Analisi dei mosti di partenza<br />
PROVA MQ (Tabella 1)<br />
Zuccheri 20,43<br />
pH 3,37<br />
Ac. Titolabile 6,15<br />
APA* (mg/L) 187<br />
SO2 totale 58<br />
Ac. Volatile 0,16<br />
densità 20°C 1,0801<br />
*Azoto ammoniacale, per le prove che lo prevedevano, è stato addizionato fino a raggiungere valore di 237 mg/L: 150<br />
mg/L sotto forma di fosfato e 150 mg/L di solfato.<br />
PROVA MS (Tabella 2)<br />
Zuccheri 22.8<br />
pH 3,44<br />
Ac. Titolabile 7,27<br />
APA* (mg/L) 159<br />
SO2 totale (mg/L) 58<br />
Ac. Volatile 0,92<br />
densità 20°C 1,0925<br />
* Azoto ammoniacale, per le prove che lo prevedevano, è stato addizionato fino a raggiungere 237mg/L : 234mg/L<br />
sotto forma di fosfato e 234 mg/L di solfato.<br />
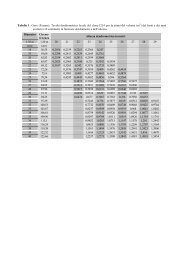
Di seguito sono riportati i dati relativi alle analisi chimico-fisiche dei vini (tabella 3 e 4) ottenuti nonché<br />
le elaborazioni statistiche anche dei composti volatili (dalla tabella 5 a 18).<br />
In tabella 19 vengono riportate le principali significatività statisticamente accertate indicando con<br />
il segno più e meno il valore maggiore e il minore in termini assoluti; per alcuni parametri, ritenuti<br />
ugualmente importanti si è voluto sottolineare il significato del valore riscontrato pur non essendo,<br />
questo, statisticamente significativo. Tali valori sono stati indicati con un cerchietto.<br />
13
ANALISI DEI VINI PROVA MQ (Tabella 3)<br />
analisi 1 2 3 4 5 6 7 8 9 10<br />
Alcol % vol 11,75 11,56 11,65 11,59 11,7 11,16 11,65 11,38 11,68 11,45<br />
densità 20°C 0,99280 0,99330 0,99275 0,9931 0,9927 0,99415 0,99275 0,99345 0,99285 0,9935<br />
estratto totale<br />
g/L<br />
14<br />
21,6 22,4 21,3 21,9 21,3 23,2 21,3 22,2 21,5 22,6<br />
pH 3,38 3,32 3,4 3,35 3,32 3,23 3,4 3,33 3,33 3,28<br />
acidità volatile<br />
g/L<br />
acidità titolabile<br />
g/L<br />
0,17 0,19 0,21 0,14 0,14 0,16 0,17 0,18 0,18 0,17<br />
6,07 6,90 5,92 6,9 6,15 7,65 6,11 7,27 6,26 7,2<br />
SO 2 totale mg/L 37,76 27,52 33,92 23,04 31,36 16 37,76 20,48 32 20,48<br />
l dominante<br />
(P.O. 1cm)<br />
luminosità y%<br />
(P.O. 1cm)<br />
saturazione P%<br />
(P.O. 1cm)<br />
abs 420 nm<br />
(P.O. 1cm)<br />
flavani vanillina<br />
mg/L di (+)- cat.<br />
polifenoli totali<br />
mg/L di (+)- cat.<br />
acidi ICT Acido<br />
caffeico mg/L<br />
574,224 574,703 574,884 576,002 574,682 576,570 574,172 575,196 574,510 575,972<br />
98,63 96,52 96,05 95,44 95,99 94,85 96,74 95,48 96,32 95,14<br />
5,63 5,15 5,53 5,21 5,96 5,98 5,59 6,15 5,55 6,04<br />
0,077 0,074 0,081 0,081 0,084 0,09 0,081 0,091 0,081 0,089<br />
38,97 48,85 55,25 50,02 64,56 41,29 50,02 51,76 43,04 55,83<br />
177,18 184,64 183,52 173,45 173,07 195,45 190,60 185,75 180,91 180,91<br />
34,67 34,33 35,44 35,44 36,11 33,78 36,67 35,56 36,22 36,00<br />
acido malico g/L 2,34 2,67 2,42 2,61 2,34 2,66 2,37 2,66 2,42 2,69<br />
acido lattico g/L 0,01 0,01 0,02 0,03 0,01 0,03 0,01 0,02 0,02 0,02<br />
acetaldeide<br />
mg/L<br />
12 23 12 18 9 21 12 19 12 15<br />
glicerina g/L 4,8 6,1 5,1 6,1 5,5 6,7 5,4 6,5 5,4 6,4
ANALISI DEI VINI PROVA MS (Tabella 4)<br />
analisi 1 2 3 4 5 6 7 8 9 10<br />
Alcol % vol 13,60 13,48 13,53 13,61 13,37 13,47 13,41 13,58 13,52 13,49<br />
densità 20°C 0,99445 0,99340 0,99445 0,9934 0,99595 0,9937 0,99555 0,99335 0,9948 0,99365<br />
estratto totale<br />
g/L<br />
estratto ridotto<br />
g/L<br />
31,5 28,4 31,3 28,8 34,6 29,1 33,8 28,6 32,2 29,1<br />
26,8 27,23 27,41<br />
zuccheri g/L 7,8 7,57 5,79<br />
pH 3,48 3,36 3,53 3,45 3,48 3,35 3,53 3,44 3,47 3,33<br />
acidità<br />
volatile g/L<br />
acidità<br />
titolabile g/L<br />
SO 2 libera<br />
mg/L<br />
SO 2 totale<br />
mg/L<br />
0,60 0,56 0,74 0,61 0,59 0,58 0,66 0,62 0,6 0,58<br />
6,66 7,47 6,45 7,37 6,45 7,67 6,45 7,35 6,45 7,83<br />
1,92 2,11 2,37 2,18 1,54 1,28 1,28 1,28 1,92 1,92<br />
36,48 36,48 33,92 39,04 33,28 26,88 38,4 30,4 39,68 24,96<br />
ceneri g/L 3,02 2,89 2,9 2,87 3,11 3,1 2,92 2,89 3,06 3,07<br />
alcalinità delle<br />
ceneri meq/L<br />
l dominante<br />
(P.O. 1cm)<br />
luminosità y%<br />
(P.O. 1cm)<br />
saturazione<br />
P% (P.O.<br />
1cm)<br />
abs 420 nm<br />
(P.O. 1cm)<br />
flavani<br />
vanillina mg/L<br />
di (+)- cat.<br />
polifenoli<br />
totali mg/L di<br />
(+)- cat.<br />
acidi ICT<br />
Acido caffeico<br />
mg/L<br />
31,44 31,12 35,5 34,66 31,2 30,4 36,68 36,3 31,16 30,44<br />
575,784 578,721 577,452 578,325 575,859 577,742 576,473 577,965 576,482 578,281<br />
88,66 77,49 84,65 77,10 87,60 80,79 86,50 78,72 86,18 80,39<br />
10,75 18,89 14,85 20,20 11,29 16,59 12,65 17,74 12,59 16,81<br />
0,188 0,316 0,241 0,337 0,198 0,284 0,217 0,304 0,217 0,281<br />
29,66 33,73 31,41 32,57 36,06 29,08 27,34 36,06 28,50 32,57<br />
199,56 195,08 208,88 198,06 202,17 189,11 209,63 210,00 196,20 192,10<br />
35,56 38,44 37,11 38,78 36,00 37,00 36,67 40,78 34,33 39,00<br />
1
ANALISI DEI VINI PROVA MS (Tabella 4)<br />
analisi 1 2 3 4 5 6 7 8 9 10<br />
acido tartarico<br />
g/L<br />
acido malico<br />
g/L<br />
acido lattico<br />
g/L<br />
acetaldeide<br />
mg/L<br />
1<br />
2,10 2,25 2,04 2,18 2,13 2,21 1,98 2,09 1,96 2,21<br />
1,93 2,28 2,01 2,42 1,83 2,18 2,07 2,46 1,97 2,37<br />
0,07 0,04 0,04 0,05 0,13 0,17 0,06 0,06 0,13 0,12<br />
34 19 29 22 30 19 34 21 33 18<br />
glicerina g/L 6,1 7,6 6,6 7,2 6,8 7,9 7 7,5 6,9 8,1<br />
ANALISI STATISTICA DEI COMPOSTI VOLATILI (MQ+MS) (Tabella 5)<br />
UVA<br />
MQ MS<br />
Numero di dati 20 10 10<br />
media dev.st. media dev.st.<br />
isoamil acetato ** 4161 1626 1285 698<br />
esil acetato ** 309 113 87 40<br />
2-fenil acetato ns 797 368 619 256<br />
S Acetati ** 5266 1988 1996 591<br />
Acido acetico (g/L) ** 0,171 0,021 0,614 0,052<br />
(S Acetati/Ac. Acetico) x 10 -3 ** 31 11 3 1<br />
etil C6 ** 790 126 372 193<br />
etil C8 ** 963 184 450 215<br />
etil C10 ** 276 67 129 60<br />
S Esteri etilici ** 2030 374 951 463<br />
C6 ** 4860 676 1990 859<br />
C8 ** 9606 1457 3714 1685<br />
C10 ** 3066 561 1386 492<br />
S Acidi grassi ** 17532 2664 7090 2998<br />
S Esteri etilici/S Acidi grassi ** 0,115 0,007 0,131 0,013<br />
C4 ** 124 24 60 33<br />
C12 ** 121 33 52 29<br />
alcol isoamilico ** 140647 16411 106292 14639<br />
1-pentanolo ** 35 6 43 5<br />
esanolo ns 1515 214 1402 75<br />
alcol benzilico ** 37 34 10 7
ANALISI STATISTICA DEI COMPOSTI VOLATILI (MQ+MS) (Tabella 5)<br />
UVA<br />
2-feniletanolo ns 31435 8601 27011 8593<br />
etil lattato ns 288 152 531 347<br />
etil-3-OH-butirrato ** 93 35 41 44<br />
benzaldeide ns 29 10 28 36<br />
dietil succinato ns 60 25 56 13<br />
3-metil-tiopropanolo ** 131 33 80 50<br />
etil-4-OH-butirrato ns 733 332 1497 1137<br />
N-(3-metil-butilacetamide) ** 153 26 1001 671<br />
monoetilsuccinato ns 894 1136 338 113<br />
Alcol % vol ** 11,56 0,18 13,51 0,08<br />
densità 20°C ** 0,99314 0,00047 0,99427 0,00094<br />
estratto totale g/L ** 21,9 0,7 30,7 2,3<br />
pH ** 3,33 0,05 3,44 0,07<br />
acidità volatile g/L ** 0,17 0,02 0,61 0,05<br />
acidità titolabile g/L ns 6,64 0,61 7,02 0,57<br />
SO 2 totale mg/L ns 28 8 34 5<br />
l dominante (P.O. 1cm) ** 575,09 0,82 577,31 1,08<br />
luminosità y% (P.O. 1cm) ** 96,12 1,07 82,81 4,38<br />
saturazione P% (P.O. 1cm) ** 5,68 0,34 15,24 3,30<br />
abs 420 nm (P.O. 1cm) ** 0,083 0,006 0,258 0,053<br />
flavani vanillina mg/L di (+)- cat. ** 50 8 32 3<br />
polifenoli totali mg/L di (+)- cat. ** 183 7 200 7<br />
acidi ICT Acido caffeico mg/L ** 35,4 0,9 37,4 1,9<br />
acido malico g/L ** 2,5 0,2 2,2 0,2<br />
acido lattico g/L ** 0,02 0,01 0,09 0,05<br />
acetaldeide mg/L ** 15,3 4,7 25,9 6,7<br />
glicerina g/L ** 5,8 0,6 7,2 0,6<br />
1
LIEVITO (Tabella 6)<br />
PROVA MQ+MS S6U AT1<br />
Numero di dati 20 10 10<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 2957 1366 2489 2394<br />
esil acetato ns 205 114 191 170<br />
2-fenil acetato ** 540 248 875 308<br />
Acetati ns 3708 1655 3555 2737<br />
Acido acetico (g/L) ns 0,379 0,223 0,406 0,249<br />
( Acetati/Ac. Acetico) x 10-3 ns 17 15 17 18<br />
etil C6 ns 675 159 487 324<br />
etil C8 ns 817 224 596 386<br />
etil C10 ns 229 73 176 115<br />
Esteri etilici ns 1721 453 1259 823<br />
C6 ns 3871 1258 2979 1935<br />
C8 ns 7613 2677 5707 3881<br />
C10 ns 2446 792 2006 1179<br />
Acidi grassi ns 13931 4719 10691 6969<br />
Esteri etilici/ Acidi grassi ns 0,127 0,015 0,119 0,008<br />
C4 ns 109 31 75 47<br />
C12 ns 77 49 96 45<br />
alcol isoamilico ns 125814 19680 121125 27199<br />
1-pentanolo ns 40 5 38 8<br />
esanolo ns 1464 146 1453 193<br />
alcol benzilico ns 30 32 17 22<br />
2-feniletanolo ns 28628 8075 29817 9628<br />
etil lattato ns 420 256 399 333<br />
etil-3-OH-butirrato ** 92 24 42 52<br />
benzaldeide ns 22 14 34 33<br />
dietil succinato ns 60 13 55 25<br />
3-metil-tiopropanolo ns 97 55 115 43<br />
etil-4-OH-butirrato ** 1734 929 496 107<br />
N-(3-metil-butilacetamide) ns 841 736 312 391<br />
monoetilsuccinato ns 566 298 665 1175<br />
Alcol % vol ns 12,48 1,11 12,59 0,95<br />
densità 20°C ns 0,99350 0,00028 0,99391 0,00128<br />
estratto totale g/L ns 25,6 3,4 27,0 6,0<br />
pH ** 3,34 0,07 3,43 0,08<br />
acidità volatile g/L ns 0,38 0,22 0,41 0,25<br />
acidità titolabile g/L ** 7,36 0,31 6,30 0,23<br />
SO2 totale mg/L ** 27 7 35 3<br />
dominante (P.O. 1cm) ** 576,95 1,44 575,45 1,12<br />
luminosità y% (P.O. 1cm) ns 87,19 8,82 91,73 5,43<br />
saturazione P% (P.O. 1cm) ns 11,88 6,59 9,04 3,72<br />
abs 420 nm (P.O. 1cm) ns 0,195 0,117 0,147 0,071<br />
flavani vanillina mg/L di (+)- cat. ns 41 10 40 13<br />
polifenoli totali mg/L di (+)- cat. ns 190 10 192 13<br />
acidi ICT Acido caffeico mg/L ns 36,9 2,3 35,9 0,9<br />
acido malico g/L ** 2,5 0,2 2,2 0,2<br />
acido lattico g/L ns 0,06 0,05 0,05 0,05<br />
acetaldeide mg/L ns 19,5 2,3 21,7 11,0<br />
glicerina g/L ** 7,0 0,7 6,0 0,8<br />
1
(Tabella 7)<br />
PROVA (MQ+MS) NO<br />
OSSIGENO<br />
SI<br />
Numero di dati 20 12 8<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 2755 2051 2674 1821<br />
esil acetato ns 202 152 191 131<br />
2-fenil acetato ns 672 309 762 355<br />
S Acetati ns 3629 2398 3634 2034<br />
Acido acetico (g/L) ns 0,391 0,237 0,395 0,236<br />
(S Acetati/Ac. Acetico) x 10-3 ns 17 17 17 15<br />
etil C6 ns 572 286 596 254<br />
etil C8 ns 688 352 734 309<br />
etil C10 ns 202 111 203 81<br />
S Esteri etilici ns 1462 746 1533 640<br />
C6 ns 3364 1751 3517 1608<br />
C8 ns 6548 3579 6827 3317<br />
C10 ns 2191 1125 2279 858<br />
S Acidi grassi ns 12103 6437 12623 5768<br />
S Esteri etilici/S Acidi grassi ns 0,122 0,014 0,124 0,012<br />
C4 ns 94 50 89 32<br />
C12 ns 90 48 80 47<br />
alcol isoamilico ns 119821 22088 128942 25320<br />
1-pentanolo ns 39 7 39 6<br />
esanolo ns 1436 180 1492 150<br />
alcol benzilico ns 22 30 25 25<br />
2-feniletanolo ns 27082 7747 32434 9491<br />
etil lattato ns 450 351 349 162<br />
etil-3-OH-butirrato ns 63 46 73 51<br />
benzaldeide ns 31 32 24 13<br />
dietil succinato ns 54 23 63 12<br />
3-metil-tiopropanolo ns 99 42 116 58<br />
etil-4-OH-butirrato ns 1035 880 1234 989<br />
N-(3-metil-butilacetamide) ns 568 623 590 695<br />
monoetilsuccinato ns 714 1052 469 340<br />
Alcol % vol ns 12,54 1,03 12,52 1,05<br />
densità 20°C ns 0,99368 0,00094 0,99374 0,00096<br />
estratto totale g/L ns 26,3 4,8 26,4 5,1<br />
pH ns 3,39 0,08 3,39 0,09<br />
acidità volatile g/L ns 0,39 0,24 0,40 0,24<br />
acidità titolabile g/L ns 6,81 0,62 6,87 0,62<br />
SO totale mg/L 2<br />
l dominante (P.O. 1cm)<br />
ns<br />
ns<br />
31<br />
576,25<br />
7<br />
1,52<br />
31<br />
576,13<br />
8<br />
1,49<br />
luminosità y% (P.O. 1cm) ns 89,48 7,88 89,43 7,42<br />
saturazione P% (P.O. 1cm) ns 10,50 5,78 10,39 5,19<br />
abs 420 nm (P.O. 1cm) ns 0,171 0,103 0,170 0,095<br />
flavani vanillina mg/L di (+)- cat. ns 41 11 41 11<br />
polifenoli totali mg/L di (+)- cat. ns 190 12 193 12<br />
acidi ICT Acido caffeico mg/L ns 36,1 1,5 36,9 2,0<br />
acido malico g/L ns 2,3 0,3 2,4 0,3<br />
acido lattico g/L ns 0,05 0,05 0,06 0,05<br />
acetaldeide mg/L ns 20,7 7,6 20,5 8,6<br />
glicerina g/L ns 6,4 1,0 6,7 0,9<br />
1
(Tabella 8)<br />
PROVA (MQ+MS) AZOTO<br />
SI NO<br />
Numero di dati 20 12 8<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 3070 2218 2203 1297<br />
esil acetato ns 224 154 158 116<br />
2-fenil acetato ns 660 332 780 313<br />
S Acetati ns 3958 2585 3141 1487<br />
Acido acetico (g/L) ns 0,377 0,218 0,416 0,261<br />
(S Acetati/Ac. Acetico) x 10-3 ns 19 19 14 12<br />
etil C6 ns 579 272 584 277<br />
etil C8 ns 691 340 729 330<br />
etil C10 ns 196 104 212 94<br />
S Esteri etilici ns 1467 712 1525 698<br />
C6 ns 3410 1698 3448 1700<br />
C8 ns 6571 3468 6794 3499<br />
C10 ns 2184 1045 2289 1004<br />
S Acidi grassi ns 12164 6189 12531 6187<br />
S Esteri etilici/S Acidi grassi ns 0,122 0,013 0,125 0,012<br />
C4 ns 95 40 88 48<br />
C12 ns 75 40 103 52<br />
alcol isoamilico ns 116759 24589 133535 17937<br />
1-pentanolo ns 41 7 36 5<br />
esanolo ns 1434 185 1495 137<br />
alcol benzilico ns 29 30 15 23<br />
2-feniletanolo ** 23191 4517 38270 4006<br />
etil lattato ** 524 324 239 75<br />
etil-3-OH-butirrato ns 69 48 64 48<br />
benzaldeide ns 22 12 38 37<br />
dietil succinato ns 61 21 54 18<br />
3-metil-tiopropanolo ** 82 48 141 23<br />
etil-4-OH-butirrato ns 944 697 1371 1154<br />
N-(3-metil-butilacetamide) ns 483 638 717 646<br />
monoetilsuccinato ns 658 1059 552 356<br />
Alcol % vol ns 12,52 1,02 12,55 1,06<br />
densità 20°C ns 0,99377 0,00094 0,99360 0,00095<br />
estratto totale g/L ns 26,5 4,9 26,2 5,1<br />
pH ns 3,36 0,08 3,43 0,07<br />
acidità volatile g/L ns 0,38 0,22 0,42 0,26<br />
acidità titolabile g/L ns 6,90 0,64 6,73 0,57<br />
SO2 totale mg/L ns 30 7 32 7<br />
l dominante (P.O. 1cm) ns 576,13 1,50 576,31 1,52<br />
luminosità y% (P.O. 1cm) ns 89,88 7,37 88,83 8,15<br />
saturazione P% (P.O. 1cm) ns 10,10 5,12 10,99 6,14<br />
abs 420 nm (P.O. 1cm) ns 0,165 0,093 0,179 0,109<br />
flavani vanillina mg/L di (+)- cat. ns 40 11 42 11<br />
polifenoli totali mg/L di (+)- cat. ns 189 9 195 14<br />
acidi ICT Acido caffeico mg/L ns 36,0 1,6 37,1 1,9<br />
acido malico g/L ns 2,3 0,3 2,4 0,2<br />
acido lattico g/L ns 0,06 0,06 0,04 0,02<br />
acetaldeide mg/L ns 20,4 8,3 20,9 7,6<br />
glicerina g/L ns 6,5 1,0 6,4 0,8<br />
20
(Tabella 9)<br />
PROVA (MQ+MS) CaPANTOTENATO<br />
SI NO<br />
Numero di dati 20 4 16<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 3478 2804 2534 1694<br />
esil acetato ns 263 204 181 124<br />
2-fenil acetato ns 686 327 713 331<br />
S Acetati ns 4428 3179 3432 1978<br />
Acido acetico (g/L) ns 0,380 0,232 0,396 0,238<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 21 23 16 15<br />
etil C6 ns 619 356 572 253<br />
etil C8 ns 760 432 693 313<br />
etil C10 ns 229 138 196 89<br />
S Esteri etilici ns 1608 924 1461 652<br />
C6 ns 3756 2177 3342 1574<br />
C8 ns 7340 4394 6490 3246<br />
C10 ns 2518 1447 2153 910<br />
S Acidi grassi ns 13613 8007 11985 5710<br />
S Esteri etilici/S Acidi grassi ns 0,118 0,011 0,124 0,013<br />
C4 ns 108 51 88 41<br />
C12 ns 83 40 87 49<br />
alcol isoamilico ns 107010 14288 127584 23504<br />
1-pentanolo ns 41 7 38 7<br />
esanolo ns 1324 117 1492 162<br />
alcol benzilico ns 29 37 22 26<br />
2-feniletanolo ** 20637 1203 31369 8387<br />
etil lattato ns 341 91 427 320<br />
etil-3-OH-butirrato ns 53 39 70 49<br />
benzaldeide ns 21 16 30 27<br />
dietil succinato ns 52 8 59 22<br />
3-metil-tiopropanolo ns 72 21 114 50<br />
etil-4-OH-butirrato ns 842 580 1183 972<br />
N-(3-metil-butilacetamide) ns 462 668 606 646<br />
monoetilsuccinato ns 381 111 674 929<br />
Alcol % vol ns 12,60 1,09 12,52 1,02<br />
densità 20°C ns 0,99349 0,00069 0,99376 0,00099<br />
estratto totale g/L ns 26,0 4,8 26,4 5,0<br />
pH ns 3,39 0,07 3,39 0,09<br />
acidità volatile g/L ns 0,38 0,23 0,40 0,24<br />
acidità titolabile g/L ns 6,78 0,58 6,84 0,63<br />
SO 2 totale mg/L ns 35 5 30 7<br />
l dominante (P.O. 1cm) ns 575,86 2,02 576,29 1,37<br />
luminosità y% (P.O. 1cm) ns 90,32 9,57 89,25 7,26<br />
saturazione P% (P.O. 1cm) ns 10,11 6,38 10,54 5,37<br />
abs 420 nm (P.O. 1cm) ns 0,164 0,115 0,172 0,096<br />
flavani vanillina mg/L di (+)- cat. ns 38 8 42 12<br />
polifenoli totali mg/L di (+)- cat. ns 189 10 192 12<br />
acidi ICT Acido caffeico mg/L ns 35,8 1,9 36,6 1,8<br />
acido malico g/L ns 2,3 0,3 2,3 0,3<br />
acido lattico g/L ns 0,03 0,03 0,06 0,05<br />
acetaldeide mg/L ns 22,0 9,2 20,3 7,7<br />
glicerina g/L ns 6,2 1,1 6,6 0,9<br />
21
ANALISI STATISTICA DEI COMPOSTI VOLATILI (Tabella 10)<br />
PROVA MQ LIEVITO<br />
S6U AT1<br />
Numero di dati 10 5 5<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 4025 1159 4296 2135<br />
esil acetato ns 303 69 315 155<br />
2-fenil acetato ns 646 316 948 385<br />
S Acetati ns 4974 1458 5559 2561<br />
Acido acetico (g/L) ns 0,168 0,019 0,174 0,025<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 30 9 32 14<br />
etil C6 ns 799 135 782 132<br />
etil C8 ns 991 180 936 205<br />
etil C10 ns 278 71 274 72<br />
S Esteri etilici ns 2068 384 1991 404<br />
C6 ns 4957 777 4763 635<br />
C8 ns 9973 1427 9239 1549<br />
C10 ns 3128 441 3004 709<br />
S Acidi grassi ns 18058 2640 17006 2882<br />
S Esteri etilici/S Acidi grassi ns 0,114 0,006 0,117 0,008<br />
C4 ns 131 27 116 19<br />
C12 ns 113 39 129 29<br />
alcol isoamilico ns 138713 17747 142581 16782<br />
1-pentanolo ** 39 6 31 2<br />
esanolo ns 1545 173 1484 266<br />
alcol benzilico ns 47 39 26 29<br />
2-feniletanolo ns 30608 8924 32261 9224<br />
etil lattato ns 317 78 260 209<br />
etil-3-OH-butirrato ns 102 29 84 41<br />
benzaldeide ns 33 1 24 14<br />
dietil succinato ns 59 16 61 35<br />
3-metil-tiopropanolo ns 128 36 134 33<br />
etil-4-OH-butirrato ** 983 285 482 99<br />
N-(3-metil-butilacetamide) ns 148 16 158 35<br />
monoetilsuccinato ns 717 374 1070 1638<br />
Alcol % vol ** 11,43 0,17 11,69 0,04<br />
densità 20°C ** 0,99350 0,00040 0,99277 0,00006<br />
estratto totale g/L ** 22,5 0,5 21,4 0,1<br />
pH ** 3,30 0,05 3,37 0,04<br />
acidità volatile g/L ns 0,17 0,02 0,17 0,03<br />
acidità titolabile g/L ** 7,18 0,31 6,10 0,12<br />
SO 2 totale mg/L ** 22 4 35 3<br />
l dominante (P.O. 1cm) ** 575,69 0,74 574,49 0,30<br />
luminosità y% (P.O. 1cm) ns 95,49 0,63 96,75 1,09<br />
saturazione P% (P.O. 1cm) ns 5,71 0,48 5,65 0,17<br />
abs 420 nm (P.O. 1cm) ns 0,085 0,007 0,081 0,002<br />
flavani vanillina mg/L di (+)- cat. ns 50 5 50 10<br />
polifenoli totali mg/L di (+)- cat. ns 184 8 181 7<br />
acidi ICT Acido caffeico mg/L ns 35,0 0,9 35,8 0,8<br />
acido malico g/L ** 2,7 0,0 2,4 0,0<br />
acido lattico g/L ns 0,02 0,01 0,01 0,01<br />
acetaldeide mg/L ** 19,2 3,0 11,4 1,3<br />
glicerina g/L ** 6,4 0,3 5,2 0,3<br />
22
(Tabella 11)<br />
PROVA MQ OSSIGENO<br />
NO SI<br />
Numero di dati 10 6 4<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 4196 1945 4108 1271<br />
esil acetato ns 315 136 300 87<br />
2-fenil acetato ns 775 381 831 403<br />
S Acetati ns 5285 2378 5239 1561<br />
Acido acetico (g/L) ns 0,168 0,028 0,175 0,006<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 31 14 30 9<br />
etil C6 ns 787 153 796 93<br />
etil C8 ns 944 227 992 119<br />
etil C10 ns 281 82 267 47<br />
S Esteri etilici ns 2012 459 2055 258<br />
C6 ns 4826 833 4912 459<br />
C8 ns 9518 1813 9739 921<br />
C10 ns 3092 709 3027 318<br />
S Acidi grassi ns 17435 3324 17678 1682<br />
S Esteri etilici/S Acidi grassi ns 0,115 0,007 0,116 0,008<br />
C4 ns 129 29 116 10<br />
C12 ns 127 38 110 27<br />
alcol isoamilico ns 135342 16853 148603 13923<br />
1-pentanolo ns 34 8 36 4<br />
esanolo ns 1470 242 1581 174<br />
alcol benzilico ns 38 37 35 35<br />
2-feniletanolo ns 28675 6996 35574 10112<br />
etil lattato ns 296 180 278 123<br />
etil-3-OH-butirrato ns 85 37 106 31<br />
benzaldeide ns 32 2 24 16<br />
dietil succinato ns 58 32 63 15<br />
3-metil-tiopropanolo ns 120 33 148 27<br />
etil-4-OH-butirrato ns 650 268 856 422<br />
N-(3-metil-butilacetamide) ns 159 28 143 23<br />
monoetilsuccinato ns 1083 1446 609 455<br />
Alcol % vol ns 11,57 0,21 11,54 0,15<br />
densità 20°C ns 0,99313 0,00055 0,99314 0,00039<br />
estratto totale g/L ns 22,0 0,7 21,9 0,6<br />
pH ns 3,33 0,06 3,34 0,05<br />
acidità volatile g/L ns 0,17 0,03 0,18 0,01<br />
acidità titolabile g/L ns 6,60 0,67 6,71 0,61<br />
SO 2 totale mg/L ns 28 8 28 9<br />
l dominante (P.O. 1cm) ns 575,18 0,90 574,96 0,80<br />
luminosità y% (P.O. 1cm) ns 96,25 1,30 95,92 0,74<br />
saturazione P% (P.O. 1cm) ns 5,58 0,35 5,83 0,31<br />
abs 420 nm (P.O. 1cm) ns 0,081 0,006 0,086 0,005<br />
flavani vanillina mg/L di (+)- cat. ns 50 9 50 5<br />
polifenoli totali mg/L di (+)- cat. ns 181 9 185 5<br />
acidi ICT Acido caffeico mg/L ** 35,0 0,9 36,1 0,5<br />
acido malico g/L ns 2,5 0,2 2,5 0,2<br />
acido lattico g/L ns 0,02 0,01 0,02 0,01<br />
acetaldeide mg/L ns 15,8 5,6 14,5 3,3<br />
glicerina g/L ns 5,7 0,7 5,9 0,6<br />
23
(Tabella 12)<br />
PROVA MQ Tabella 12 AZOTO<br />
SI NO<br />
Numero di dati 10 6 4<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 4771 1886 3245 367<br />
esil acetato ns 342 136 259 46<br />
2-fenil acetato ns 767 410 842 350<br />
S Acetati ns 5880 2379 4346 741<br />
Acido acetico (g/L) ns 0,168 0,017 0,175 0,029<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 34 14 25 4<br />
etil C6 ns 787 156 796 83<br />
etil C8 ns 951 233 982 101<br />
etil C10 ns 275 80 277 53<br />
S Esteri etilici ns 2013 467 2055 235<br />
C6 ns 4841 875 4889 310<br />
C8 ns 9511 1870 9750 702<br />
C10 ns 3043 729 3100 233<br />
S Acidi grassi ns 17394 3440 17739 1212<br />
S Esteri etilici/S Acidi grassi ns 0,115 0,007 0,116 0,007<br />
C4 ns 126 18 120 33<br />
C12 ns 106 23 143 37<br />
alcol isoamilico ns 136738 16855 146511 16063<br />
1-pentanolo ns 36 7 33 5<br />
esanolo ns 1480 262 1566 133<br />
alcol benzilico ns 46 35 22 32<br />
2-feniletanolo ** 25871 5008 39779 5037<br />
etil lattato ns 337 166 215 107<br />
etil-3-OH-butirrato ns 93 36 94 38<br />
benzaldeide ns 32 2 24 16<br />
dietil succinato ns 65 28 53 22<br />
3-metil-tiopropanolo ns 119 32 149 29<br />
etil-4-OH-butirrato ns 665 260 833 442<br />
N-(3-metil-butilacetamide) ns 142 23 170 22<br />
monoetilsuccinato ns 997 1473 739 447<br />
Alcol % vol ns 11,55 0,22 11,57 0,13<br />
densità 20°C ns 0,99322 0,00055 0,99301 0,00034<br />
estratto totale g/L ns 22,1 0,7 21,7 0,5<br />
pH ns 3,31 0,05 3,37 0,04<br />
acidità volatile g/L ns 0,17 0,02 0,18 0,03<br />
acidità titolabile g/L ns 6,71 0,65 6,55 0,64<br />
SO 2 totale mg/L ns 28 8 29 8<br />
l dominante (P.O. 1cm) ns 575,11 0,93 575,06 0,76<br />
luminosità y% (P.O. 1cm) ns 96,24 1,34 95,93 0,61<br />
saturazione P% (P.O. 1cm) ns 5,72 0,34 5,62 0,39<br />
abs 420 nm (P.O. 1cm) ns 0,083 0,006 0,084 0,005<br />
flavani vanillina mg/L di (+)- cat. ns 49 10 52 2<br />
polifenoli totali mg/L di (+)- cat. ns 182 8 183 7<br />
acidi ICT Acido caffeico mg/L ns 35,2 1,1 35,8 0,6<br />
acido malico g/L ns 2,5 0,2 2,5 0,1<br />
acido lattico g/L ns 0,02 0,01 0,02 0,01<br />
acetaldeide mg/L ns 15,3 5,5 15,3 3,8<br />
glicerina g/L ns 5,8 0,7 5,8 0,6<br />
24
(Tabella 13)<br />
PROVA MQ CaPANTOTENATO<br />
SI NO<br />
Numero di dati 10 2 8<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 5713 1758 3773 1448<br />
esil acetato ns 430 114 278 97<br />
2-fenil acetato ns 783 410 800 388<br />
S Acetati ns 6925 2281 4852 1832<br />
Acido acetico (g/L) ns 0,180 0,014 0,169 0,023<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 39 16 29 10<br />
etil C6 ns 901 37 763 126<br />
etil C8 ns 1111 22 926 189<br />
etil C10 ns 343 40 259 63<br />
S Esteri etilici ns 2355 99 1948 375<br />
C6 ns 5561 47 4685 642<br />
C8 ns 11010 56 9255 1422<br />
C10 ns 3728 323 2900 482<br />
S Acidi grassi ns 20299 332 16840 2525<br />
S Esteri etilici/S Acidi grassi ns 0,116 0,003 0,115 0,007<br />
C4 ns 144 7 118 24<br />
C12 ns 106 46 124 33<br />
alcol isoamilico ** 118832 1811 146100 13260<br />
1-pentanolo ns 40 12 34 4<br />
esanolo ns 1305 198 1567 194<br />
alcol benzilico ns 45 54 34 33<br />
2-feniletanolo ns 21269 1635 33976 7604<br />
etil lattato ns 276 87 292 169<br />
etil-3-OH-butirrato ns 67 26 100 35<br />
benzaldeide ns 33 0 28 11<br />
dietil succinato ns 52 10 62 28<br />
3-metil-tiopropanolo ** 84 2 143 25<br />
etil-4-OH-butirrato ns 637 363 757 346<br />
N-(3-metil-butilacetamide) ns 130 15 158 26<br />
monoetilsuccinato ns 399 134 1017 1253<br />
Alcol % vol ns 11,66 0,13 11,53 0,19<br />
densità 20°C ns 0,99305 0,00035 0,99316 0,00051<br />
estratto totale g/L ns 22,0 0,6 21,9 0,7<br />
pH ns 3,35 0,04 3,33 0,06<br />
acidità volatile g/L ns 0,18 0,01 0,17 0,02<br />
acidità titolabile g/L ns 6,49 0,59 6,68 0,65<br />
SO 2 totale mg/L ns 33 7 27 8<br />
l dominante (P.O. 1cm) ns 574,46 0,34 575,25 0,85<br />
luminosità y% (P.O. 1cm) ** 97,57 1,50 95,75 0,63<br />
saturazione P% (P.O. 1cm) ns 5,39 0,34 5,75 0,33<br />
abs 420 nm (P.O. 1cm) ** 0,076 0,002 0,085 0,004<br />
flavani vanillina mg/L di (+)- cat. ns 44 7 51 7<br />
polifenoli totali mg/L di (+)- cat. ns 181 5 183 8<br />
acidi ICT Acido caffeico mg/L ns 34,5 0,2 35,7 0,9<br />
acido malico g/L ns 2,5 0,2 2,5 0,1<br />
acido lattico g/L ns 0,01 0,00 0,02 0,01<br />
acetaldeide mg/L ns 17,5 7,8 14,8 4,2<br />
glicerina g/L ns 5,5 0,9 5,9 0,6<br />
2
(Tabella 14)<br />
PROVA MS LIEVITO<br />
S6U AT1<br />
Numero di dati 10 5 5<br />
media dev.st. media dev.st.<br />
isoamil acetato ** 1890 92 681 417<br />
esil acetato ns 107 16 67 48<br />
2-fenil acetato ** 435 102 802 230<br />
S Acetati ** 2442 172 1550 509<br />
Acido acetico (g/L) ns 0,590 0,024 0,638 0,063<br />
(S Acetati/Ac. Acetico) x 10 -3 ** 4 0 2 1<br />
etil C6 ** 552 26 193 47<br />
etil C8 ** 643 71 256 68<br />
etil C10 ** 180 30 78 27<br />
S Esteri etilici ** 1375 120 527 136<br />
C6 ** 2786 113 1194 252<br />
C8 ** 5254 403 2174 543<br />
C10 ** 1765 238 1007 361<br />
S Acidi grassi ** 9804 740 4375 1122<br />
S Esteri etilici/S Acidi grassi ** 0,140 0,007 0,121 0,009<br />
C4 ** 87 13 34 21<br />
C12 ns 41 24 63 31<br />
alcol isoamilico ns 112915 11854 99669 15231<br />
1-pentanolo ns 40 2 45 6<br />
esanolo ns 1383 36 1422 102<br />
alcol benzilico ns 12 7 8 8<br />
2-feniletanolo ns 26648 7569 27374 10418<br />
etil lattato ns 524 338 538 396<br />
etil-3-OH-butirrato ** 81 13 0 0<br />
benzaldeide ns 11 11 44 45<br />
dietil succinato ns 62 11 49 11<br />
3-metil-tiopropanolo ns 66 54 95 46<br />
etil-4-OH-butirrato ** 2485 672 510 124<br />
N-(3-metil-butilacetamide) ** 1535 130 467 533<br />
monoetilsuccinato ** 416 60 260 101<br />
Alcol % vol ns 13,53 0,06 13,49 0,09<br />
densità 20°C ** 0,99350 0,00016 0,99504 0,00068<br />
estratto totale g/L ** 28,8 0,3 32,7 1,5<br />
pH ** 3,39 0,06 3,50 0,03<br />
acidità volatile g/L ns 0,59 0,02 0,64 0,06<br />
acidità titolabile g/L ** 7,54 0,21 6,49 0,09<br />
SO 2 totale mg/L ns 32 6 36 3<br />
l dominante (P.O. 1cm) ** 578,21 0,37 576,41 0,67<br />
luminosità y% (P.O. 1cm) ** 78,90 1,66 86,72 1,51<br />
saturazione P% (P.O. 1cm) ** 18,04 1,51 12,43 1,59<br />
abs 420 nm (P.O. 1cm) ** 0,304 0,023 0,212 0,020<br />
flavani vanillina mg/L di (+)- cat. ns 33 3 31 3<br />
polifenoli totali mg/L di (+)- cat. ns 197 8 203 6<br />
acidi ICT Acido caffeico mg/L ** 38,8 1,4 35,9 1,1<br />
acido malico g/L ** 2,3 0,1 2,0 0,1<br />
acido lattico g/L ns 0,09 0,06 0,09 0,04<br />
acetaldeide mg/L ** 19,8 1,6 32,0 2,3<br />
glicerina g/L ** 7,7 0,4 6,7 0,4<br />
2
(Tabella 15)<br />
PROVA MS OSSIGENO<br />
NO SI<br />
Numero di dati 10 6 4<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 1315 701 1241 799<br />
esil acetato ns 90 49 82 27<br />
2-fenil acetato ns 568 198 694 345<br />
S Acetati ns 1974 644 2030 593<br />
Acido acetico (g/L) ns 0,613 0,064 0,615 0,034<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 3 1 3 1<br />
etil C6 ns 357 214 395 184<br />
etil C8 ns 432 251 476 177<br />
etil C10 ns 122 71 139 47<br />
S Esteri etilici ns 911 533 1010 402<br />
C6 ns 1902 960 2122 798<br />
C8 ns 3579 1930 3916 1488<br />
C10 ns 1289 578 1531 351<br />
S Acidi grassi ns 6770 3446 7569 2582<br />
S Esteri etilici/S Acidi grassi ns 0,130 0,015 0,131 0,011<br />
C4 ns 59 40 63 21<br />
C12 ns 53 17 50 45<br />
alcol isoamilico ns 104300 14530 109280 16469<br />
1-pentanolo ns 43 5 42 6<br />
esanolo ns 1401 97 1404 33<br />
alcol benzilico ns 7 8 15 2<br />
2-feniletanolo ns 25490 8776 29294 9034<br />
etil lattato ns 604 426 421 180<br />
etil-3-OH-butirrato ns 41 46 40 46<br />
benzaldeide ns 30 47 24 10<br />
dietil succinato ns 51 12 63 11<br />
3-metil-tiopropanolo ns 79 43 83 66<br />
etil-4-OH-butirrato ns 1421 1129 1613 1312<br />
N-(3-metil-butilacetamide) ns 976 673 1038 771<br />
monoetilsuccinato ns 344 129 329 102<br />
Alcol % vol ns 13,51 0,09 13,50 0,07<br />
densità 20°C ns 0,99423 0,00097 0,99434 0,00102<br />
estratto totale g/L ns 30,6 2,4 30,9 2,5<br />
pH ns 3,44 0,07 3,44 0,08<br />
acidità volatile g/L ns 0,61 0,06 0,62 0,03<br />
acidità titolabile g/L ns 7,01 0,55 7,02 0,69<br />
SO 2 totale mg/L ns 34 4 33 7<br />
l dominante (P.O. 1cm) ns 577,31 1,24 577,30 0,96<br />
luminosità y% (P.O. 1cm) ns 82,72 5,01 82,95 3,97<br />
saturazione P% (P.O. 1cm) ns 15,43 3,88 14,94 2,72<br />
abs 420 nm (P.O. 1cm) ns 0,261 0,062 0,255 0,045<br />
flavani vanillina mg/L di (+)- cat. ns 32 3 31 4<br />
polifenoli totali mg/L di (+)- cat. ns 199 7 202 9<br />
acidi ICT Acido caffeico mg/L ns 37,1 1,3 37,7 2,8<br />
acido malico g/L ns 2,1 0,2 2,2 0,2<br />
acido lattico g/L ns 0,08 0,05 0,09 0,04<br />
acetaldeide mg/L ns 25,5 6,3 26,5 8,2<br />
glicerina g/L ns 7,0 0,7 7,4 0,6<br />
2
PROVA MS AZOTO<br />
SI NO<br />
Numero di dati 10 6 4<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 1368 562 1161 948<br />
esil acetato ** 107 23 57 43<br />
2-fenil acetato ns 553 217 717 311<br />
S Acetati ns 2036 424 1936 860<br />
Acido acetico (g/L) ** 0,585 0,015 0,658 0,059<br />
(S Acetati/Ac. Acetico) x 10-3 (Tabella 16)<br />
ns 3 1 3 2<br />
etil C6 ns 372 187 373 230<br />
etil C8 ns 432 194 477 272<br />
etil C10 ns 117 47 147 80<br />
S Esteri etilici ns 921 428 996 578<br />
C6 ns 1979 813 2007 1054<br />
C8 ns 3631 1491 3839 2185<br />
C10 ns 1325 317 1477 736<br />
S Acidi grassi ns 6935 2607 7323 3939<br />
S Esteri etilici/S Acidi grassi ns 0,129 0,015 0,134 0,009<br />
C4 ns 64 30 56 40<br />
C12 ns 44 27 64 31<br />
alcol isoamilico ** 96781 9386 120560 6612<br />
1-pentanolo ** 45 5 39 1<br />
esanolo ns 1388 41 1424 114<br />
alcol benzilico ns 12 6 7 9<br />
2-feniletanolo ** 20511 1603 36761 2449<br />
etil lattato ** 710 347 263 17<br />
etil-3-OH-butirrato ns 45 49 35 40<br />
benzaldeide ns 12 10 51 49<br />
dietil succinato ns 56 10 54 17<br />
3-metil-tiopropanolo ** 46 26 133 16<br />
etil-4-OH-butirrato ns 1223 903 1909 1462<br />
N-(3-metil-butilacetamide) ns 825 784 1265 415<br />
monoetilsuccinato ns 320 143 364 51<br />
Alcol % vol ns 13,49 0,07 13,53 0,09<br />
densità 20°C ns 0,99433 0,00096 0,99419 0,00104<br />
estratto totale g/L ns 30,8 2,4 30,6 2,4<br />
pH ns 3,41 0,07 3,49 0,05<br />
acidità volatile g/L ** 0,59 0,02 0,66 0,06<br />
acidità titolabile g/L ns 7,09 0,64 6,91 0,53<br />
SO totale mg/L 2<br />
l dominante (P.O. 1cm)<br />
ns<br />
ns<br />
33<br />
577,14<br />
6<br />
1,27<br />
35<br />
577,55<br />
4<br />
0,80<br />
luminosità y% (P.O. 1cm) ns 83,52 4,55 81,74 4,54<br />
saturazione P% (P.O. 1cm) ns 14,49 3,38 16,36 3,30<br />
abs 420 nm (P.O. 1cm) ns 0,247 0,053 0,275 0,055<br />
flavani vanillina mg/L di (+)- cat. ns 32 3 32 4<br />
polifenoli totali mg/L di (+)- cat. ** 196 5 207 6<br />
acidi ICT Acido caffeico mg/L ns 36,7 1,8 38,3 1,9<br />
acido malico g/L ns 2,1 0,2 2,2 0,2<br />
acido lattico g/L ** 0,11 0,05 0,05 0,01<br />
acetaldeide mg/L ns 25,5 7,6 26,5 6,1<br />
glicerina g/L ns 7,2 0,8 7,1 0,4<br />
2
(Tabella 17)<br />
PROVA MS CaPANTOTENATO<br />
SI NO<br />
Numero di dati 10 2 8<br />
media dev.st. media dev.st.<br />
isoamil acetato ns 1244 731 1296 741<br />
esil acetato ns 97 25 84 44<br />
2-fenil acetato ns 590 339 626 260<br />
S Acetati ns 1931 417 2012 650<br />
Acido acetico (g/L) ns 0,580 0,028 0,623 0,054<br />
(S Acetati/Ac. Acetico) x 10 -3 ns 3 1 3 1<br />
etil C6 ns 337 247 381 196<br />
etil C8 ns 409 255 460 222<br />
etil C10 ns 116 64 132 63<br />
S Esteri etilici ns 862 566 973 477<br />
C6 ns 1950 1088 2000 882<br />
C8 ns 3669 2009 3725 1753<br />
C10 ns 1308 567 1406 513<br />
S Acidi grassi ns 6927 3664 7130 3103<br />
S Esteri etilici/S Acidi grassi ns 0,120 0,018 0,133 0,011<br />
C4 ns 72 51 58 31<br />
C12 ns 59 19 50 32<br />
alcol isoamilico ns 95187 7079 109069 14978<br />
1-pentanolo ns 43 5 43 5<br />
esanolo ns 1342 19 1417 77<br />
alcol benzilico ns 13 4 9 8<br />
2-feniletanolo ns 20004 261 28763 8798<br />
etil lattato ns 407 8 562 386<br />
etil-3-OH-butirrato ns 39 56 41 45<br />
benzaldeide ns 9 12 32 38<br />
dietil succinato ns 52 10 57 14<br />
3-metil-tiopropanolo ns 60 27 85 54<br />
etil-4-OH-butirrato ns 1048 841 1610 1220<br />
N-(3-metil-butilacetamide) ns 793 948 1053 660<br />
monoetilsuccinato ns 363 134 331 117<br />
Alcol % vol ns 13,54 0,08 13,50 0,08<br />
densità 20°C ns 0,99393 0,00074 0,99436 0,00100<br />
estratto totale g/L ns 30,0 2,2 30,9 2,4<br />
pH ns 3,42 0,08 3,45 0,07<br />
acidità volatile g/L ns 0,58 0,03 0,62 0,05<br />
acidità titolabile g/L ns 7,07 0,57 7,00 0,61<br />
SO 2 totale mg/L ns 36 0 33 6<br />
l dominante (P.O. 1cm) ns 577,25 2,08 577,32 0,93<br />
luminosità y% (P.O. 1cm) ns 83,08 7,90 82,74 3,97<br />
saturazione P% (P.O. 1cm) ns 14,82 5,76 15,34 3,04<br />
abs 420 nm (P.O. 1cm) ns 0,252 0,091 0,260 0,049<br />
flavani vanillina mg/L di (+)- cat. ns 32 3 32 3<br />
polifenoli totali mg/L di (+)- cat. ns 197 3 201 8<br />
acidi ICT Acido caffeico mg/L ns 37,0 2,0 37,5 2,0<br />
acido malico g/L ns 2,1 0,2 2,2 0,2<br />
acido lattico g/L ns 0,06 0,02 0,10 0,05<br />
acetaldeide mg/L ns 26,5 10,6 25,8 6,5<br />
glicerina g/L ns 6,9 1,1 7,3 0,5<br />
2
(Tabella 18)<br />
SCHEMA RIASSUNTIVO DELLE SIGNIFICATIVITA’ STATISTICAMENTE ACCERTATE<br />
Mosto di<br />
Calcio<br />
Composti<br />
Lievito Ossigeno Azoto<br />
partenza<br />
Pantotenato<br />
30<br />
MQ MS uvarum cerevisiae si no si no si no<br />
2-fenil acetato n.s. n.s. + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
∑ Acetati + - + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
(∑ Acetati/Ac.<br />
Acetico)x10 -3 - + + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
∑ esteri etilici + - + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
∑ Acidi grassi + - + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
(∑ esteri etilici/acidi<br />
grassi)<br />
- + + - n.s. n.s. n.s. n.s. n.s. n.s.<br />
2-feniletanolo n.s. n.s. n.s. n.s. n.s. n.s. - - -<br />
etil-3-OH-butirrato + - + + - - n.s. n.s. n.s. n.s. n.s. n.s.<br />
etil-4-OH-butirrato n.s. n.s. + + - - n.s. n.s. n.s. n.s. n.s. n.s.<br />
anidride solforosa<br />
totale<br />
+ +<br />
+<br />
n.s. n.s. - - + + n.s. n.s. n.s. n.s. n.s. n.s.<br />
acidità titolabile n.s. n.s. + + + - - - n.s. n.s. n.s. n.s. n.s. n.s.<br />
acido malico + - + + + - - - n.s. n.s. n.s. n.s. n.s. n.s.<br />
acido acetico - + - + n.s. n.s. n.s. n.s. n.s. n.s.<br />
glicerina - + + + + - - - n.s. n.s. n.s. n.s. n.s. n.s.<br />
Legenda colori: ● = generale (MQ+MS); ● = MQ (Malvasia di Qualità); ● = MS (malvasia<br />
Standard);<br />
Legenda valori: + = maggiore produttore; - = minore produttore; = statisticamente non<br />
significativo , tendenza concordante.
Figura n. 1<br />
31
commento dei risultati<br />
Analizzando la letteratura riguardante il controllo del metabolismo del lievito, appare evidente come la<br />
stessa ci conceda una notevole quantità di prove in cui la visione d’assieme è sempre molto limitata e i<br />
trattamenti, effettuati in condizioni particolari, spesso risultano difficilmente riproducibili. Il significato<br />
di queste prove, dunque, può essere ricondotto al valore di tendenza metabolica, appare, però, difficile<br />
individuare la dinamica dei fenomeni biochimici che interessano il metabolismo della cellula del lievito<br />
nel corso della fermentazione.<br />
Infatti, nonostante i numerosi progressi realizzati in cantina (controllo della temperatura, ecc.), si può<br />
considerare che la gestione della fermentazione è ancora lungi dall’essere ottimizzata. In effetti, un dato<br />
fondamentale in enologia è raramente preso in considerazione, ed in modo impreciso: la variabilità<br />
della materia prima.Il monitoraggio in linea della cinetica fermentativa (per ora ancora una utopia) può<br />
servire non solo a migliorare il controllo dell’andamento delle fermentazioni, ma anche, e soprattutto, a<br />
“pilotarne” il controllo. Questa nozione di pilotaggio consiste nell’adattare gli interventi (temperatura,<br />
aggiunte di nutrienti …) in funzione dello svolgimento della fermentazione. A breve o medio termine,<br />
consisterà anche in anticipare, grazie ad una predizione (modellizzazione) dell’andamento fermentativo<br />
e nel prendere in considerazione non solo i criteri tecnologici (completamento delle fermentazioni,<br />
consumo di frigorie…) ma anche criteri più qualitativi.<br />
Come riportato in premessa, abbiamo notizie precise sulla funzione dell’azoto come acceleratore<br />
del metabolismo cellulare e dell’accresciuto assorbimento e metabolismo degli zuccheri, come pure<br />
dell’azione dell’ossigeno sulla futura probabile evoluzione della componente polifenolica del mezzo,<br />
dell’azione del calcio-pantotenato quale regolatore, in caso di carenza, del processo di biosintesi delle<br />
molecole a partire da acetato. Abbiamo pure ben chiare le differenze metaboliche legate alle due tipologie<br />
di metabolismo riconducibili all’espressione fenotipica “uvarum” e a quello di tipo “cerevisiae”(Garof<br />
olo,Ciolfi, Lo Scalzo,1995).<br />
Nel caso della presente indagine, si è voluto allestire un esperimento complesso, impiegando mezzi<br />
differenti e trattamenti differenti al fine di individuare le rispondenze metaboliche che potessero<br />
comportare una più puntuale considerazione sull’impiego di lieviti in riferimento alla tipologia di vino<br />
laziale soprattutto per ciò che attiene alla componente fissa (acidità) e aromatica di fermentazione,<br />
ovvero per quella componente che caratterizza la corposità, la persistenza la finezza delle sensazioni<br />
olfatto-gustative.<br />
Nello specifico, un obiettivo importante è stato quello di valutare il significato della presenza di glicerina<br />
e di come fosse possibile ottenere il massimo della sua espressione nei vini.<br />
I due tipi di mosto oggetto della sperimentazione MS e MQ , si tratta della stessa uva in differenti<br />
condizioni di stato in cui l’elemento discriminante è dato dal diverso contenuto in acido acetico iniziale<br />
(acidità volatile pari a 0,16 per MQ e 0,92 per MS), ed è questo il principale fattore di regolamentazione<br />
della sintesi dei composti metabolici.<br />
Da un punto di vista statistico, il test di significatività è stato applicato su tutti i trattamenti per evidenziare<br />
l’incidenza del mezzo (MQ,MS) tabella 5, l’incidenza del lievito (uvarum, cerevisiae) tabella 6, quindi<br />
rispettivamente di ossigeno tabella 7, azoto tabella 8, calcio-pantotenato tabella 9.<br />
I parametri statisticamente significati, infatti, risultano essere per la prova (MQ) una più consistente<br />
presenza di acetati, esteri etilici, acidi grassi, etil-3-OH-butirrato, acido malico.<br />
Per contro la seconda serie (MS) fa registrare differenze significative positive in merito agli indici di<br />
esterificazione, acetaldeide e glicerina.<br />
Questo diverso comportamento metabolico risulta facilmente riconducibile alla presenza, nel mezzo, di<br />
elevata concentrazione di acido acetico; questo, infatti, nel corso della fermentazione viene riassorbito<br />
dalla cellula come dimostra la sua concentrazione finale e va ad interferire con acetato di derivazione<br />
mitocondriale (fig.1). Elemento significativo è una maggiore concentrazione in glicerolo, è un fatto,<br />
32
questo, importante e da tenere in considerazione quando viene programmata la vendemmia.<br />
Dal punto di vista dei trattamenti, l’impiego di ossigeno nel corso della vinificazione non comporta alcun<br />
evento metabolico statisticamente significativo e, pertanto, non trova alcuna giustificazione pratica dal<br />
punto di vista metabolico per il lievito.<br />
In effetti la sintesi dei grassi di cui si era ipotizzato essere influenzata dall’ossigeno è regolata dal buon<br />
utilizzo di acetato intracellulare a sua volta mediato da micronutrienti di natura proteica che il lievito non<br />
è in grado di sintetizzare in anaerobiosi ma che è presente nel mosto fresco.<br />
L’impiego di Ca-pantotenato, può avere un effetto metabolico statisticamente significativo soltanto per<br />
la sintesi di 2-feniletanolo nel senso che la sua presenza comporta una minore produzione.<br />
Il fatto trova una giustificazione in quanto la disponibilità di una migliore utilizzazione di acetato<br />
intracellulare comporta un minor metabolismo di aminoacidi aromatici. Considerato che non è auspicabile<br />
una minore presenza di 2-feniletanolo nel mezzo, il Ca-pantotenato può essere impiegato soltanto in<br />
presenza di una evidente carenza.<br />
Una maggiore disponibilità di azoto sotto forma ammoniacale, quindi di immediata utilizzazione, comporta<br />
significativamente soltanto una minore produzione di 2-feniletanolo e parallelamente di acido acetico;<br />
infatti, la disponibilità di azoto prontamente assimilabile, da un lato comporta un minor metabolismo degli<br />
aminoacidi aromatici, dall’altro, un migliore utilizzo di acetato intracellulare soprattutto di derivazione<br />
mitocondriale venendo a ridursi quello di origine aminoacidico. Dai parametri riscontrati, si evidenzia,<br />
comunque, che pur non essendo significativa la differenza, il 2-feniletanolo in termini assoluti registra<br />
valori più bassi la dove è minore il contenuto in APA azoto facilmente assimilabile; in tal caso abbiamo<br />
una minori disponibilità aminoacidica così come prevedibile per la tesi<br />
MS. Per quest’ultima prova, infatti, la condizione di minore sanità delle<br />
uve ha comportato anche una minore disponibilità aminoacidica.<br />
Anche questo risultato evidenzia come l’impiego di azoto ammoniacale in<br />
fermentazione debba essere limitato soltanto ai casi di effettiva carenza;<br />
deficit azotati nei mosti naturali che non abbiano subito trattamenti<br />
di chiarifica spinti non hanno ragione di essere ed è bene ricordare,<br />
peraltro, che eccedere in trattamenti di chiarifica può comportare gravi<br />
problemi di fermentazione e produzioni eccessive di acido acetico per un<br />
impoverimento del mezzo delle frazioni azotate a peso molecolare basso<br />
quali gli aminoacidi e i piccoli peptidi assimilabili dal lievito.<br />
Prove sperimentali, infatti, hanno dimostrato che un eccessivo<br />
impoverimento della frazione azotata può causare rallentamenti ed arresti<br />
di fermentazione e il fenomeno è legato soprattutto all’asportazione di<br />
micronutrienti proteici responsabili del controllo metabolico della cellula,<br />
micronutrienti che, in condizioni di anaerobiosi, il lievito non è in grado di<br />
sintetizzare.<br />
E’ vero che la somministrazione di azoto ammoniacale comporta una<br />
accelerazione del metabolismo degli zuccheri e quindi della fermentazione,<br />
a questo fatto, però, non corrisponde un metabolismo di migliore qualità nel<br />
precostituire un vino ottimale e rispettoso dell’ambiente di produzione.<br />
Vediamo, ora, i riscontri metabolici statisticamente significativi quando<br />
mettiamo a confronto i due lieviti nell’insieme delle prove e riscontriamo<br />
che cerevisiae si caratterizza per la maggiore produzione di acetati, solfiti,<br />
acidità volatile, così come nelle aspettative, mentre uvarum si caratterizza<br />
per una maggiore produzione di etile-3-OH- butirrato, acido malico, ma<br />
anche fa registrare un valore di acidità titolabile superiore e di glicerina<br />
dell’ordine di 1 g/L e anche più. Questi fati evidenziano il vantaggio<br />
33
compositivo di un fermentato da uvarum piuttosto che da cerevisiae soprattutto in relazione ad una<br />
componente acidica di maggiore complessità e di glicerina che conferisce corposità e rotondità.<br />
Per quanto riguarda la seconda serie di prove, in aggiunta alla significatività di cui ai metabolici elencati<br />
per la prima prova, constatiamo, per uvarum, una maggiore produzione di esteri, acidi grassi e relativi<br />
rapporti di esterificazione. Del perché di questo comportamento rispetto alla prima serie risiede in una<br />
maggiore disponibilità di acetato intracellulare di cui si è parlato precedentemente.<br />
Alla fine del ciclo produttivo, i vini finiti sono stati sottoposti all’analisi sensoriale .<br />
Nel sottoporre i vini a questa analisi si è voluto valutare se tra i campioni oggetto di studio ci fossero<br />
delle differenze e quali risultassero i più apprezzati.<br />
E’ stato così possibile confrontare l’aspetto globale di ciascun vino (aspetto visivo, olfattivo e gustativo)<br />
e sull’ eventuale gradimento da parte del consumatore. A tale riguardo è stato utilizzato il test di Kramer<br />
o test dell’ordinamento, il quale prevede che i degustatori siano chiamati a ordinare in successione<br />
decrescente, dal più gradito al meno gradito, tutti i campioni sottoposti ad analisi.<br />
Il panel era formato da 12 degustatori esperti ai quali sono stati sottoposti i campioni in forma anonima,<br />
ed è stato chiesto loro di ordinare secondo la metodica già descritta tali campioni. Le analisi dei risultati<br />
sono state poi elaborate utilizzando la tabella del test di Kramer (Ubigli, 2004). Dall’elaborazione di tali<br />
dati è emerso che i campioni che hanno riscosso maggior gradimento, presentano differenze sensoriali<br />
statisticamente significative:<br />
Prova MQ<br />
Al primo posto il vino n°2 (ottenuto dal trattamento con lievito S6U, senza aggiunta di ossigeno e con<br />
aggiunta di azoto e calcio pantotenato);<br />
al secondo posto il vino n°5 (ottenuto dal trattamento con lievito AT1, senza aggiunta di ossigeno e calcio<br />
pantotenato, con aggiunta di azoto).<br />
Prova MS<br />
Al primo posto il vino n°5 (ottenuto dal trattamento con lievito AT1, senza aggiunta di ossigeno e calcio<br />
pantotenato, con aggiunta di azoto);<br />
al secondo posto il vino n°4 (ottenuto dal trattamento con lievito S6U, senza aggiunta di ossigeno, calcio<br />
pantotenato e azoto).<br />
Nel corso delle prove, come si evince dalla trattazione, abbiamo rilevato un elevato numero di parametri<br />
che vengono proposti per una analisi più particolare da opera del tecnico o dello studioso. Volendo<br />
fornire un giudizio sintetico e riepilogativo, si può affermare come il lievito S6U sia da preferire in ogni<br />
fermentazione e questo perché maggiormente rispondente alla tipicità del vino per i seguenti motivi:<br />
- contribuisce a mantenere alto il valore di acidità totale e questo rappresenta una garanzia di<br />
stabilità strutturale del vino;<br />
- produce, in ogni condizione, valori di glicerina più elevati, quindi il vino assume connotati di<br />
corposità che esaltano il rapporto con il territorio;<br />
- una minore produzione di solfiti agevola un razionale impiego a fine fermentazione e determina<br />
una migliore compatibilità ambientale.<br />
Da un punto di vista dei trattamenti si evidenzia che:<br />
- l’impiego di ossigeno nel corso della fermentazione risulta ininfluente ai fini del risultato<br />
metabolico della cellula di lievito;<br />
- l’impiego di azoto va limitato soltanto ai casi di effettivo impoverimento del mezzo, casi rarissimi<br />
nelle condizioni di una razionale enotecnica che non deve prevedere eccessi di chiarifica. Spesso,<br />
infatti si tende ad addizionare azoto ammoniacale nell’intendo di prevenire rallentamenti o arresti<br />
di fermentazione. In realtà questi accidenti o sono conseguenza di inibitori non rimossi o sono la<br />
causa di trattamenti deproteinizzanti troppo spinti. Al riguardo si evidenzia come l’impiego di azoto<br />
ammoniacale deprima le qualità tipiche dell’uva poiché rallenta il metabolismo degli aminoacidi<br />
e peptidi del mezzo; ne consegue che la maggiore tipicità del prodotto va perseguita attraverso<br />
opportune tecniche colturali volte proprio alla migliore espressione del metabolismo variatale.<br />
34
Aspetti fermentativi:<br />
FERMENTAZIONI SCALARI CON IMPIEGO DI DUE CEPPI SACCHAROMYCES CEREVISIAEE<br />
CON CARATTERISTICHE METABOLICHE DIFFERENTI.<br />
Introduzione<br />
Il ruolo che i lieviti enologici svolgono nel corso della fermentazione alcolica è sicuramente<br />
fondamentale per la buona riuscita della stessa e dei prodotti metabolici che vengono elaborati a seguito<br />
della trasformazione degli zuccheri in alcol; prodotti, responsabili delle caratteristiche organolettiche e<br />
sensoriali dei vini ottenuti.<br />
Certamente l’utilizzo di ceppi di lievito selezionati ad uso enologico, possono contribuire a dare<br />
un’impronta al vino e alla sua definizione qualitativa, anche se l’apporto primario nella composizione<br />
enochimica del vino rimane quello dato dal vitigno e dalla qualità dell’uva.<br />
Negli ultimi tempi la ricerca ha posto una grande attenzione alla selezione e studio dei diversi ceppi<br />
di lievito aventi caratteristiche enologiche, anche in funzione dei metaboliti che essi sono in grado di<br />
produrre nel corso della loro applicazione in fermentazione.<br />
Questo lavoro di ricerca ha avuto come fine quello testare e verificare la possibilità di indurre la<br />
produzione di elevati quantitativi di metaboliti nel corso della fermentazione alcolica impiegando lieviti<br />
differenti per tipologia di metabolismo ipotizzando una interazione tale da consentire il rafforzamento<br />
delle reciproche peculiarità.<br />
Infatti, numerose sono state le prove sperimentali in tal senso impiegando, però, lieviti di specie diverse.<br />
Fra le tante prove eseguite si segnalano i risultati di Kurita (2008); l’Autore ha effettuato prove con<br />
l’impiego, in associazione, di Saccharomyces cerevisiae e Pichia anomala. Il risultato metabolico ha<br />
consentito di appurare come l’attività di sintesi di acetati è risultata potenziata in virtù della migliore<br />
predisposizione metabolica da parte di Picchia legata ad una attività esterasica cellulare di livello<br />
superiore.<br />
Per questo sono stati utilizzati due ceppi di lievito Saccharomyces cerevisiae: S6U, ibrido naturale con<br />
fenotipo della razza fisiologica uvarum e AT1 della razza cerevisie.<br />
Il primo si caratterizza per una elevata produzione di acidi grassi, glicerina, feniletanolo, migliore<br />
capacità esterosintetasi; il secondo per una elevata produzione di acetati.<br />
Uno dei parametri maggiormente significativi è rappresentato dal contenuto in glicerolo di un vino; anche<br />
su questo composto si sono concentrate attenzioni e studi volti ad esaltarne l’espressione metabolica.<br />
Materiali e metodi<br />
La prova è stata condotta presso il CRA-Unità di ricerca per le produzioni enologiche dell’Italia centrale<br />
(CRA-ENC) con sede in Velletri (Roma).<br />
Per l’eseguimento di questa ricerca è stata utilizzata uva di Malvasia del Lazio, raccolta a maturità<br />
fisiologica in data 02/10/07 e conferita nei locali della cantina sperimentale del CRA-ENC. Il raccolto,<br />
di circa 100 kg, è stato sottoposto alle operazioni di vinificazione che hanno contemplato in sequenza la<br />
fase di pigiadiraspatura e pressatura soffice, quest’ultima eseguita con idropressa a pressione crescente<br />
fino a 1bar. Sulla massa è stata fatta aggiunta di anidride solforosa in dose di 50 mg/L. Di seguito il<br />
mosto ha subito la fase di chiarifica prefermentativa, eseguita a temperatura di 6°C per 24 h senza ausilio<br />
di coadiuvanti di chiarifica.<br />
Le caratteristiche chimiche del mosto, dopo le fasi preliminari di pigiadiraspatura e pressatura, sono di<br />
seguito riportate in tabella 1.<br />
3
Analisi sul mosto di partenza (Tabella 1)<br />
Analisi sul mosto di partenza<br />
Zuccheri % 20,08<br />
pH 3,38<br />
Ac. Titolabile (g/L) 5,85<br />
APA (mg/L) 187<br />
Densità 21°C 1,0764<br />
Ac. Volatile (g/L) 0,16<br />
Trascorso tale tempo è stata eseguita la spillatura del mosto limpido e dopo omogeneizzazione della<br />
massa ottenuta, si è proceduto a ripartire 4 litri di mosto negli 8 fermentini oggetto di studio, della<br />
capacità di 5 litri cadauno.<br />
Le prove sono state contrassegnate e inoculate con lieviti selezionati seguendo lo schema riportato in<br />
tabella 2.<br />
Classificazione delle prove oggetto di studio (Tabella 2)<br />
Fermentino sigla lievito dose modalità prova<br />
1 1 S6U TQ S6U 20 g/hL prova in purezza<br />
2 1 BIS S6U TQ S6U 20 g/hL prova in purezza<br />
3 2 AT1 TQ AT1 80 ml del mosto di avviamento prova in purezza<br />
4 2 BIS AT1 TQ AT1 80 ml del mosto di avviamento prova in purezza<br />
5 3 S6U SCAL S6U 20 g/hL prova a ferm. scalare avviata con S6U<br />
6 3 BIS S6U SCAL S6U 20 g/hL prova a ferm. scalare avviata con S6U<br />
7 4 AT1 SCAL AT1 80 ml del mosto di avviamento prova a ferm. scalare avviata con AT1<br />
8 4 BIS AT1 SCAL AT1 80 ml del mosto di avviamento prova a ferm. scalare avviata con AT1<br />
La fase di fermentazione alcolica è stata avviata utilizzando 2 ceppi di lievito diversi, lievito S6U allo<br />
stato secco e lievito AT1 nelle dosi di 2,5 Milioni di cellule/mL circa.<br />
Per ciascuna prova, eseguita in doppio, è stato seguito un protocollo di vinificazione che ha previsto una<br />
gestione della temperatura controllata di vinificazione nel seguente modo: dall’inoculo del lievito fino<br />
al raggiungimento di un gradiente alcolico nel mosto di 4% vol. la temperatura di fermentazione è stata<br />
mantenuta costante a 25°C; quindi la temperatura è stata portata a 18°C fino alla svinatura.<br />
Le fermentazioni delle prove 1 S6U TQ, 1 BIS S6U TQ, 2 AT1 TQ, 2 BIS AT1 TQ, sono state condotte<br />
rispettivamente dai lieviti S6U e AT1 in purezza.<br />
Le prove 3 S6U SCAL e 3 BIS S6U SCAL sono state avviate alla fermentazione utilizzando lievito S6U.<br />
Al raggiungimento di 4 gradi alcolici il mosto è stato filtrato sterilmente (con cartuccia filtrante di 0,45<br />
micron e sotto cappa sterile) e di seguito reinoculato con il lievito AT1.<br />
Stesso procedimento è stato seguito per le prove 4 AT1 SCAL e 4 BIS AT1 SCAL, inoculate inizialmente<br />
con lievito AT1 e dopo aver raggiunto tenore alcolico di 4% vol. sono state filtrate sterilmente e reinoculate<br />
con lievito S6U.<br />
Su tutte le prove sono state eseguite analisi chimico-fisiche, secondo metodo ufficiale (Gazzetta Ufficiale<br />
delle Comunità europee L272/90 e Reg. CEE 2676/90), analisi dei composti volatili (Gianotti S., Di<br />
Stefano R., 1991). Le elaborazioni statistiche sono state eseguite utilizzando ANOVA semplice e Test<br />
di Tukey.<br />
3
Analisi chimico-fisiche sui vini (Tabella 3)<br />
analisi<br />
1 S6U<br />
TQ<br />
1 BIS S6U<br />
TQ<br />
2 AT1<br />
TQ<br />
2 BIS<br />
AT1 TQ<br />
3 S6U<br />
TQ<br />
3 BIS S6U<br />
TQ<br />
4 AT1<br />
TQ<br />
4 BIS<br />
AT1 TQ<br />
Alcol % vol 10,95 11,12 10,65 11,03 9,43 10,12 9,79 9,42<br />
densità 20°C 0,99700 0,99405 0,99555 0,9945 1,00350 0,99950 1,0014 1,00435<br />
estratto totale g/L 30,1 22,9 25,4 23,9 42,2 34,1 38 44,4<br />
estratto ridotto g/L 23,5 22,8 20 21,3 19,8 23,19 20,1 20,3<br />
zuccheri g/L 7,6 1,1 6,4 3,6 23,4 11,91 18,9 25,1<br />
pH 3,42 3,42 3,43 3,43 3,45 3,29 3,46 3,46<br />
acidità volatile g/L 0,32 0,28 0,2 0,19 0,70 0,34 0,76 0,7<br />
acidità titolabile g/L 6,60 6,75 6,18 6,3 5,64 6,80 5,79 5,88<br />
SO 2 totale mg/L 22,40 23,68 32 28,16 20,48 12,80 25,6 21,11<br />
l dominante (P.O.<br />
1cm)<br />
luminosità y% (P.O.<br />
1cm)<br />
saturazione P% (P.O.<br />
1cm)<br />
575,611 574,853 574,279 574,468 574,923 575,402 574,104 574,011<br />
96,16 96,80 97,27 97,11 96,36 95,48 97,17 96,94<br />
5,04 5,00 5,20 5,00 5,23 6,06 6,24 6,34<br />
abs 420 nm (P.O. 1cm) 0,071 0,071 0,075 0,072 0,085 0,097 0,089 0,092<br />
flavani vanillina mg/L di<br />
(+)- cat.<br />
polifenoli totali mg/L di<br />
(+)- cat.<br />
acidi ICT Acido caffeico<br />
mg/L<br />
54,67 52,93 47,11 51,76 26,75 25,59 31,99 30,24<br />
168,22 164,87 182,40 178,67 167,48 168,04 171,95 181,84<br />
33,67 33,89 34,33 34,78 44,33 47,56 45,56 45,89<br />
acido malico g/L 2,39 2,57 2,36 2,37 0 0,61 0 0<br />
acido lattico g/L 0,03 0,02 0,03 0,01 1,77 0,03 1,91 1,92<br />
acetaldeide mg/L 12 11 20 19 50 58 62 61<br />
glicerina g/L 5,6 5,8 4,8 5 5,3 5,7 5,6 5,8<br />
3
Analisi dei composti volatili (Tabella 4 )<br />
COMPOSTI VOLATILI 1S6U TQ* 2AT1 TQ* 3S6U SCAL* 4AT1SCAL*<br />
isoamil acetato 3576 8244 1715 2155<br />
esil acetato 356 580 235 335<br />
2-fenil acetato 585 1984 427 643<br />
S Acetati 4517 10808 2377 3134<br />
Acido acetico (g/L) 0,30 0,20 0,52 0,73<br />
(S Acetati/Ac. Acetico) x 10 -3 15,19 55,61 5,50 4,32<br />
etil C6 695 859 418 452<br />
etil C8 959 875 514 505<br />
etil C10 199 159 158 172<br />
S Esteri etilici 1854 1893 1091 1129<br />
C6 4877 4426 3542 3021<br />
C8 10042 8841 7505 6816<br />
C10 2333 1895 2321 2271<br />
S Acidi grassi 17252 15161 13369 12108<br />
S Esteri etilici/S Acidi grassi 0,11 0,12 0,08 0,09<br />
C4 75 101 59 79<br />
C12 50 120 68 98<br />
alcol isoamilico 110539 120876 116090 110319<br />
1-pentanolo 36 30 32 30<br />
esanolo 1278 894 1162 1066<br />
alcol benzilico 66 9 26 35<br />
2-feniletanolo 29900 36950 27005 30972<br />
etil lattato 209 132 2103 5558<br />
acetoino 10 11 21 nd<br />
etil-3-OH-butirrato 31 28 33 34<br />
benzaldeide 26 21 25 24<br />
g-butirrolattone 15 16 14 nd<br />
dietil succinato 63 36 247 580<br />
3-metil-tiopropanolo 103 115 114 127<br />
etil-4-OH-butirrato 1870 582 401 588<br />
N-(3-metil-butilacetamide) 117 134 133 192<br />
monoetilsuccinato 720 198 6852 14752<br />
Nota: I dati riportati in tabella rappresentano la media ottenuta dalle due ripetizioni eseguite per ogni prova.<br />
(*) le prove 1S6U TQ e 2AT1 TQ sono state condotte utilizzando i ceppi di lievito indicati in purezza mentre le prove<br />
3 S6U SCAL e 4 AT1 SCAL sono state condotte dai rispettivi lieviti (fino al raggiungimento di 4 % alcol) ed in seguito<br />
reinoculate rispettivamente con AT1 e S6U così come descritto in materiali e metodi.<br />
3
Analisi statistica dei composti volatili (ANOVA a una via a=0,05) (Tabella 5)<br />
Risultati ANOVA a una via (a=0,05)<br />
LSD: lettera uguale gruppi omogenei 1S6u 2At1 3S6U SCAL 4At1 SCAL<br />
isoamil acetato ** a b a a<br />
esil acetato ** a b c a<br />
2-fenil acetato ** a b a a<br />
S Acetati ** a b a a<br />
Acido acetico (g/L) ** a a a,b b<br />
(S Acetati/Ac. Acetico) x 10 -3 ** a b a a<br />
etil C6 ** a b c c<br />
etil C8 ** a a b b<br />
etil C10 ns<br />
S Esteri etilici ** a a b b<br />
C6 ** a a b b<br />
C8 ** a b c c<br />
C10 ns<br />
S Acidi grassi ** a b c c<br />
S Esteri etilici/S Acidi grassi ** a b c d<br />
C4 ns<br />
C12 ns<br />
alcol isoamilico ns<br />
1-pentanolo ns<br />
esanolo ** a b a,c c<br />
alcol benzilico ns<br />
2-feniletanolo ns<br />
etil lattato ** a a a b<br />
etil-3-OH-butirrato ns<br />
benzaldeide ns<br />
g-butirrolattone ns<br />
dietil succinato ** a a a,b b<br />
3-metil-tiopropanolo ns<br />
etil-4-OH-butirrato ** a b b b<br />
N-(3-metil-butilacetamide) ns<br />
monoetilsuccinato ns<br />
glicerina g/L ** a b a a<br />
3
Analisi statistica dei composti volatili (Test di Tukey) (Tabella 6)<br />
Risultati ANOVA a una via (a=0,05)<br />
Tukey: lettera uguale gruppi omogenei 1S6u 2At1 3S6u SCAL 4At1 SCAL<br />
isoamil acetato ** a b a a<br />
esil acetato ** a b a a<br />
2-fenil acetato ** a b a a<br />
S Acetati ** a b a a<br />
Acido acetico (g/L) ** a,b a a,b b<br />
(S Acetati/Ac. Acetico) x 10 -3 ** a b a a<br />
etil C6 ** a b c c<br />
etil C8 ** a a b b<br />
etil C10 ns<br />
S Esteri etilici ** a a b b<br />
C6 ** a a b b<br />
C8 ** a b c c<br />
C10 ns<br />
S Acidi grassi ** a a,b b,c c<br />
S Esteri etilici/S Acidi grassi ** a b c a,c<br />
C4 ns<br />
C12 ns<br />
alcol isoamilico ns<br />
1-pentanolo ns<br />
esanolo ** a b a a,b<br />
alcol benzilico ns<br />
2-feniletanolo ns<br />
etil lattato ** a a a,b b<br />
etil-3-OH-butirrato ns<br />
benzaldeide ns<br />
g-butirrolattone ns<br />
dietil succinato ** a a a,b b<br />
3-metil-tiopropanolo ns<br />
etil-4-OH-butirrato ** a b b b<br />
N-(3-metil-butilacetamide) ns<br />
monoetilsuccinato ns<br />
glicerina g/L ** a b a,b a<br />
40
Risultati e discussione<br />
In tabella 3 e 4 sono riportati i dati reali riscontrati nei vini; in tabella 4 e 5 vengono riportate le<br />
elaborazioni statistiche degli stessi.<br />
Dai risultati appare evidente come le caratteristiche metaboliche dei due lieviti in purezza risultino<br />
confermate in relazione alle aspettative; si pone l’accento sul fatto che la razza fisiologica cerevisiae<br />
produce maggiori quantitativi di acetati e minor contenuto in acidi grassi come pure un minor contenuto<br />
in glicerina.<br />
Nel caso di fermentazioni scalari, si evidenzia come i principali metaboliti si riscontrino in concentrazioni<br />
inferiori rispetto alle fermentazioni in purezza in quanto l’attività di riassorbimento cellulare comprime<br />
la sintesi dei composti metabolici e comprime, per conseguenza, anche la capacità esterosintetasi: questo<br />
fatto vale sia quando ad avviare la fermentazione sia la razza cerevisiae, sia con la razza uvarum , per<br />
contro i due fermentati tendono ad essere indistinti.<br />
Questo comportamento può essere dovuto in parte ad un impoverimento del livello nutrizionale del<br />
mosto, ma è soprattutto legato agli equilibri delle reazioni enzimatiche endocellulari quando, nella fase<br />
di crescita del lievito ad avvio della fermentazione, risulta prevalente l’assorbimento dei metaboliti dal<br />
mezzo.<br />
Per i motivi di cui abbiamo discusso, appare evidente come la condotta delle fermentazioni debba<br />
essere operata da un solo lievito al fine di poter ottenere il migliore risultato metabolico possibile e<br />
che, nel corso di fermentazioni scalari, il risultato metabolico complessivo non può essere considerato<br />
come il rafforzativo delle singole peculiarità ma, bensì, come l’appiattimento delle specifiche tendenze<br />
metaboliche.<br />
Questo fatto appare importante soprattutto quando si vogliono esaltare le qualità compositive del mosto<br />
di partenza, quindi delle uve e dell’ambiente di provenienza.<br />
Dall’analisi bibliografica si evince come, recentemente, Berovic e Herga (2007) asseriscono che un<br />
inoculo di lievito sottoposto a shock termico da 18°C a 45°C per 20 minuti raggiunti in 5 minuti, causa<br />
un incremento di glicerina nel corso della fermentazione alcolica del 74% .<br />
Questo risultato si conseguirebbe in quanto l’innalzamento termico determina, nella cellula, una abnorme<br />
espressione di triosofosfato isomerasi persistente durante la fermentazione a giudizio degli Autori; per<br />
conseguenza risulterebbe incrementata la conversione di diossiacetone fosfato in glicerolo.<br />
Per verificare tale ipotesi, abbiamo allestito diverse prove sperimentali nelle stesse condizioni operative<br />
dettate dagli Autori e impiegando anche dosi di lievito inoculo differenti a partire da quella impiegata<br />
nell’esperimento, sia allo stato secco che fresco senza riscontrare, però, alcuna variazione nella<br />
concentrazione di glicerolo a fine fermentazione e impiegando due stipiti di lievito differenti (AT1 allo<br />
stato fresco e S6U allo stato secco).<br />
41
Bibliografia<br />
- Amati, A., Arfelli, G., Castellari, M., Simoni, M. (2000). Effetto dell’ossigenazione controllata sulla frazione<br />
fenolica dei vini rossi. Industria delle bevande XXIX: 606-640<br />
Bell, S., Henschke, P. (2005). Implication of nitrogen nutrition. Australian Journal of Grape and Wine<br />
Research. 11, 242-295.<br />
- Autori vari, PRAL 2000/44 Identificazione e valorizzazione della biodiversità dei lieviti vinari. Università<br />
“La Sapienza” Dip. Biol. Cellulare e dello Sviluppo, Istituto Sperimentale Enologia Velletri, Regione Lazio,<br />
Assessorato per le Politiche dell’Agricoltura.<br />
- Berovic M., Herga M. (2007). Heat shock on Saccharomyces cerevisiae inoculum increases glycerol<br />
production in wine fermentation. Biotechnol Lett, 29:891-894.<br />
- Buescher, W.A., Siler, C.E., Morris, J.R., Threlfall, R.T., Main, G.L., Cone, G.C. (2001). High Alcohol Wine<br />
Production from Grape Juice Concentrates. Am. J. Enol. Vitic., 52:4:345-351.<br />
- Di Stefano, R. (1991). Proposal for a method of sample preparation for the determination of free and<br />
glucoside terpenes of grapes and wines. Bull.O.I.V., 64: 219- 223<br />
- Ferrarini, R., Zironi, R., Celotti, E., D’Andrea, E. (2001). Ruolo dell’ossigeno nei processi di vinificazione<br />
ed affinamento dei vini. L’Enologo 11:65-72<br />
- Fornairon-Bonnefond, C., Aguera, E., Deytiex, C., Sabroyrolles, J., Salmon, J. (2003). Impact of oxygen<br />
addition during enological fermentation on sterol content in yeast lees and their reactivity towards oxygen.<br />
Journal of Bioscience and Bioengineering. 95:5:496-503<br />
- Garofolo A.,Ciolfi G., Lo Scalzo R. (1995) Il controllo del metabolismo secondario del lievito. Bilogia<br />
Oggi, IX, n.1.<br />
- Gambon B., Monteil V:, Remize F., Camarasa C., Dequin S. (2006) Effects of GPD1 Overexpression in<br />
Saccharomyces cerevisiae Commercial Wine Yeast Strains Lacking ALD6 Genes. Appl. Environ Microbiol.,<br />
July; 72(7): 4688-4694.<br />
- Gazzetta Ufficiale delle Comunità Europee L272 del 3/10/90, Regolamento CEE n° 2676/90.<br />
Giannotti, S., Di Stefano, R. (1991) Metodo per la determinazione dei composti volatili di fermentazione.<br />
L’Enotecnico, 10, 61-64.<br />
- Guinard, J.X., Noble, A.C. (1986). Proposition d’une terminologie pour une description analytique de<br />
l’arÔme des vins. Sc. Alim. 6, 657-662<br />
- Miller, A.C., Wolff, S.R., Bisson, L.F., Ebeler, S.E. (2007) Yest Strain and Nitrogen Supplementation :<br />
Dynamics of Volatile Ester Production in Chardonnay Juice Fermentation. Am. J. Enol. Vitic. 58:4<br />
- Kurita O. (2008). Increase of acetate ester-hydrolysing esterase activity in mixed cultures of<br />
Saccharomyces cerevisiae and Pichia anomala. Journal of Applied Microbiology, 104, 105<br />
- Ribéreau–Gayon, P., Dubourdieu D., Donèche B., Lonvaud A. (1998). Trattato di Enologia vol. I<br />
Edagricole.<br />
- Ribéreau–Gayon, P., Dubourdieu D., Donèche B., Lonvaud A. (1998) Trattato di Enologia vol. II,<br />
Edagricole.<br />
- Salmon, J. (2006). Interaction between yeast, oxygen and polyphenols during alcoholic fermentation:<br />
Pratical implications. Food Science and Tecnology. 39:9:959-965.<br />
Schneider, V. (1998). Must Hyperoxigenation: A Review. Am. J. Vitic., Vol.49, 1:65-73<br />
- Tosi E, Zapparoli G. (2005) I lieviti ibridi impiegati in enologia:l’esempio del ceppo industriale S6U,<br />
ibrido naturale Saccharomyces cerevisiae x Saccharomyces uvarum, nella produzione di vino amarone della<br />
Valpolicella. www.infowine.com, rivista internet di viticoltura ed enologia, n. 11/2.<br />
- Ubigli, M. (2004). I profili del vino. Il Sole 24 ore-Edagricole.<br />
- Valero, E., Moyano, L., Millan, M.C., Medina, M., Ortega, J.M. (2002). Higher alcohols and ester production by<br />
Saccharomyces cerevisiae. Influence of the initial oxygenation of the grape must. Food Chemestry. 78:1:57-61.<br />
Wang, X.D., Bohlscheid, J.C., Edwards, C.G. (2003). Fermentative activity and production of volatile<br />
compounds by Saccharomyces grown in sintetic grape juice media deficent in assimilable nitrogen and/or<br />
panthotenic acid. Journal of Applied Microbiology. 94:349-359.<br />
42
nuovi approcci per la tipizzazione molecolare di lieviti di interesse<br />
enologico<br />
Responsabile: Prof. claudio Falcone *<br />
Partecipanti alla ricerca: dr.ssa Maria Luisa Sponziello<br />
* Prof. Claudio Falcone<br />
TEL: (39) 0649912278<br />
FAX: (39) 0649912256<br />
E-MAIL: claudio.falcone@uniroma1.it<br />
dr. Michele Saliola<br />
43
Tipizzazione molecolare di lieviti saccharomyces di interesse enologico<br />
PREMESSA<br />
L’identificazione della composizione della flora dei lieviti all’interno del mosto si rende necessaria<br />
per il miglioramento delle caratteristiche qualitative del vino. Tradizionalmente, l’identificazione e<br />
la caratterizzazione di specie di lievito e di specifici ceppi all’interno della stessa specie si basavano<br />
sull’analisi di tratti morfologici e soprattutto sulle loro caratteristiche fisiologiche specifiche.<br />
Queste caratteristiche sono però fortemente influenzate dalle condizioni di coltura e possono produrre<br />
risultati incerti e talvolta non corretti.<br />
Recentemente sono state sviluppate numerose tecniche molecolari innovative che costituiscono validi<br />
metodi alternativi in grado di mettere in risalto la diversità genetica dei ceppi (Kellis et al.,2003; Richard<br />
e Dujon 2006; Schuller et al., 2004). In tale ambito, l’amplificazione di sequenze di DNA specifiche<br />
tramite PCR è divenuto un metodo molecolare largamente utilizzato in quanto altamente riproducibile.<br />
A questa tecnica sono stati successivamente affiancati metodi di analisi più sensibili quali la RAPD<br />
(Random Amplification of Polymorphic DNA) (Quesada e Cenis, 1995), la RFLP (Restriction Fragment<br />
Length Polymorphism) (Guillamon et al.., 1998) e la AFLP (Amplified Fragment Length Polymorphism)<br />
(Azumi and Goto-Yamamoto, 2001).<br />
Negli anni più recenti tali tecniche sono state impiegate per lo studio della variabilità di sequenza di<br />
alcune regioni del genoma, soprattutto di quelle in cui sono localizzati i geni che codificano per gli RNA<br />
ribosomiali (rRNA). In particolare, sono stati analizzati i domini D1/D2 dei geni codificanti per il 26S<br />
rRNA (Laitila et al.., 2006) e le regioni interne spaziatrici trascritte (ITS) del cluster dei geni ribosomiali<br />
(26S, 18S e 5S) (Guillamon et al.., 1998; Granchi et al.., 1999; Esteve-Zarzoso et al.., 1999) .<br />
L’attenzione e stata rivolta anche allo studio del polimorfismo di singoli geni specifici conservati nei<br />
lieviti quali il 5S, Actina e Metionina 2 (Daniel e Meyer,2003; Antunovics et al.., 2005).<br />
Ad onor del vero, nessuno di questi metodi fino ad oggi si è rivelato in grado di garantire da solo risultati<br />
che consentano l’identificazione certa di una specie o di un ceppo di lievito.<br />
A queste tecniche si possono affiancare altre metodiche che però presentano lo svantaggio di essere<br />
più complesse e che possono richiedere costose apparecchiature, quali l’analisi del cariotipo mediante<br />
l’impiego della tecnica PFGE (Pulsed-Field Gel Electrophoresis) (Cardinali e Martini, 1994). Va<br />
menzionata infine l’analisi del DNA mitocondriale (mtDNA) che presenta una variabilità genetica<br />
intrinseca maggiore rispetto al DNA nucleare.<br />
Rimane pertanto importante identificare nuove regioni variabili del genoma che possano consentire<br />
l’identificazione certa dei ceppi a livello della loro specie e, possibilmente, mettere in evidenza le<br />
differenze all’interno della stessa specie.<br />
A tale scopo, si è cercato di mettere a punto un sistema discriminante basato sull’amplificazione dei geni<br />
ADH, presenti in tutti i lieviti, che codificano per attività alcool deidrogenasiche.<br />
I ceppi di lievito analizzati, isolati prevalentemente dall’uva, dai mosti e dal vino, sono stati forniti<br />
dall’Istituto Sperimentale per l’Enologia di Velletri (ora CRA-Unità di ricerca per le produzioni enologiche<br />
dell’Italia centrale Velletri), e dal Dipartimento di Biologia Vegetale dell’Università di Perugia.<br />
44
MESSA A PUNTO DI UN NUOVO CRITERIO DI IDENTIFICAZIONE MOLECOLARE<br />
AMPLIFICAZIONE DEL SISTEMA GENICO ADH<br />
Il metodo di screening genetico molecolare da noi utilizzato per discriminare i ceppi di lievito isolati<br />
dall’Istituto Sperimentale per l’Enologia di Velletri (ora CRA-Unità di ricerca per le produzioni<br />
enologiche dell’Italia centrale Velletri) si basa sull’analisi del sistema delle alcool deidrogenasi (ADH).<br />
Questo sistema è costituito da tre geni principali, chiamati ADH1, ADH2 e ADH3, che codificano per<br />
attività alcool deidrogenasiche coinvolte nel metabolismo dell’etanolo (Cyriacy 1975; 1979; Young<br />
e Pilgrim 1985). L’espressione dei geni che compongono il sistema delle alcool deidrogenasi viene<br />
regolata a livello trascrizionale, in funzione del tipo di fonte di carbonio disponibile per le cellule.<br />
In particolare i geni ADH1e ADH2 codificano rispettivamente per le proteine enzimatiche Adh1p e<br />
Adh2p, entrambe localizzate nel citoplasma. ADH1 viene espresso in modo semicostitutivo e viene<br />
indotto da glucosio. Il gene ADH2 codifica per un’attività responsabile dell’utilizzazione dell’etanolo<br />
accumulato durante la fermentazione e catalizza la conversione dell’etanolo ad acetaldeide, con<br />
concomitante riduzione del NAD + a NADH. L’espressione del gene ADH2 viene repressa in presenza di<br />
glucosio e indotta su fonti di carbonio respirabili, come etanolo e glicerolo.<br />
In S.cerevisiae esiste un terzo gene, ADH3, che codifica per un alcool deidrogenasi a localizzazione<br />
mitocondriale. La presenza di Adh3p aumenta di circa tre volte durante la crescita su glicerolo. L’isozima<br />
Adh3p partecipa ad un sistema navetta etanolo-acetaldeide capace di regolare l’equilibrio redox NAD + /<br />
NADH tra il citoplasma e il mitocondrio (Bakker et al., 2000).<br />
Esistono inoltre altri geni ADH, quali ADH5, che sembrano essere coinvolti nel metabolismo degli alcoli<br />
superiori (Dickinson et al., 2003).<br />
La scelta di questo sistema genico per il lavoro di caratterizzazione è stata effettuata principalmente per<br />
due motivi:<br />
- i geni ADH sono presenti in tutti i lieviti fermentativi in quanto necessari per la produzione di etanolo<br />
durante la vinificazione a partire dalle alte concentrazioni zuccherine presenti nei mosti;<br />
- i geni ADH mostrano tra loro un’alta omologia e potrebbero quindi costituire un buon substrato per<br />
analizzare le variazioni ceppo e/o specie dipendente nella sequenza del loro DNA .<br />
Nel nostro lavoro di caratterizzazione è stato analizzato il polimorfismo dei geni ADH1, ADH2,<br />
ADH3 e ADH5 mediante amplificazione per PCR utilizzando specifici DNA primers per ciascun gene.<br />
L’amplificazione dei geni ADH è stata condotta sia separatamente sui singoli geni (PCR) che utilizzando<br />
contemporaneamente le coppie di tutti i primers (vedi Tabella in Materiali e Metodi) relativi ai 4 geni<br />
nello stesso tubo di reazione (PCR-multiplex).<br />
Per ottenere un profilo più dettagliato del pattern dei DNA amplificati, questi sono stati sottoposti<br />
successivamente a digestione mediante Sau3AI, un enzima di restrizione che taglia con alta frequenza<br />
le molecole di DNA riconoscendo sequenze specifiche.<br />
Infine, abbiamo cercato di mettere in relazione l’assenza dell’amplificato dei singoli geni con la presenza/<br />
4
assenza del corrispondente enzima. A tale scopo, dopo estrazione delle proteine cellulari, le singole<br />
attività ADH sono state separate mediante elettroforesi su gel nativi di acrilamide e la loro presenza è<br />
stata confermata mediante un saggio di attività basato su una colorazione specifica.<br />
Per verificare la capacità discriminante del metodo di identificazione, l’analisi effettuata su ceppi vinari<br />
di lievito forniti dal CRA-Unità di ricerca per le produzioni enologiche dell’Italia centrale Velletri, è stata<br />
estesa a ceppi ottenuti dalla collezione del Dipartimento di Biologia Vegetale (DBVPG) dell’Università di<br />
Perugia, utilizzando il ceppo di laboratorio BY 4741 appartenente alla specie Saccharomyces cerevisiae<br />
come riferimento.<br />
4
Materiali e Metodi<br />
Ceppi, terreni e condizioni di coltura<br />
Le cellule di lievito sono state coltivate a 28°C in terreno YP liquido (1% estratto di lievito, 2% peptone)<br />
su agitatore rotante addizionato con Glucosio 1% .<br />
Tabella dei ceppi analizzati nel lavoro.<br />
* C-S6u deriva da un incrocio tra un ceppo di S.cerevisiae e un ceppo di S.uvarum<br />
CEPPO SIGLA GENERE E SPECIE PROVENIENZA<br />
BY 4741 WT Saccharomyces cerevisiae r.f. cerevisiae<br />
A-270 1 Saccharomyces cerevisiae r.f. uvarum<br />
B-S11c 2 Saccharomyces cerevisiae r.f. cerevisiae<br />
C-SbC2 3 Saccharomyces bayanus<br />
C-S6u* 4 Saccharomyces cerevisiae r.f. uvarum<br />
D-S16b 5 Saccharomyces bayanus<br />
E-AT1 6 Saccharomyces cerevisiae r.f. cerevisiae<br />
F-S12c 7 Saccharomyces cerevisiae r.f. cerevisiae<br />
DBVPG 1708 C2 Saccharomyces cerevisiae r.f. cerevisiae<br />
DBVPG 1180 U1 Saccharomyces cerevisiae r.f. uvarum<br />
DBVPG 1391 U2 Saccharomyces cerevisiae r.f. uvarum<br />
DBVPG 6032 B1 Saccharomyces bayanus r.f. bayanus<br />
DBVPG 6131 B2 Saccharomyces bayanus r.f. tubiformis<br />
DBVPG 1648 I2 Saccharomyces cerevisiae r.f. italicus<br />
DBVPG 1369 H2 Saccharomyces cerevisiae r.f. chevalieri<br />
DBVPG 1976 H3 Saccharomyces cerevisiae r.f. chevalieri<br />
Dipartimento Biologia Cellulare e<br />
dello Sviluppo<br />
ROMA<br />
CRA<br />
Unità di ricerca per le produzioni<br />
enologiche dell’Italia centrale<br />
VELLETRI<br />
Dipartimento di<br />
Biologia Vegetale<br />
PERUGIA<br />
4
Estrazione di DNA totale da lievito<br />
I ceppi sono stati inoculati in terreno liquido e fatti crescere fino ad una densità di 10 8 cellule/ml alla<br />
temperatura di 28°C sotto agitazione. Le cellule sono state raccolte mediante centrifugazione, lavate<br />
con TE (Tris EDTA), e trattate con tampone di estrazione (Triton X-100, SDS 1%, NaCl 100mM, TE<br />
pH 8). La sospensione è stata trattata con PCI (fenolo,/CHCl 3 /alcool isoamilico in rapporto 25:24:1<br />
rispettivamente) e le cellule sono state sottoposte a rottura meccanica con palline di vetro su vortex per<br />
4 minuti. Dopo aggiunta di 0,2 ml di TE e dopo centrifugazione è stata recuperata la fase acquosa ed il<br />
DNA è stato precipitato con l’aggiunta di tre volumi di etanolo 95°. Dopo centrifugazione e rimozione<br />
dell’etanolo il DNA veniva ridisciolto in TE+RNAasi per eliminare la contaminazione dovuta allo<br />
RNA.<br />
Amplificazione del DNA tramite PCR<br />
L’amplificazione è stata eseguita utilizzando il kit della TaKaRa SHUZO CO., LTD con le seguenti<br />
modalità:<br />
DNA 50ng<br />
MgCl 2 25mM<br />
Tampone PCRII 10X<br />
dNTP 50µM<br />
Oligo Forward 50pmole/l<br />
Oligo Reverse 50pmole/l<br />
Taq polimerasi 2,5U/l<br />
H 2 O dd Fino a volume di 50μl<br />
Le condizioni di tempo e temperatura delle reazioni erano le seguenti:<br />
DENATURAZIONE: 5 minuti 94°C<br />
30 CICLI<br />
· Denaturazione 30 secondi a 94°C<br />
· Ibridazione 30 secondi a 58°C<br />
· Allungamento 45 secondi a 72°C<br />
TERMINE ALLUNGAMENTO: 4 minuti a 72°C<br />
I prodotti di amplificazione sono stati controllati su gel di agarosio alla concentrazione del 1,2% . Il DNA<br />
è stato messo in evidenza mediante l’aggiunta al gel di agarosio di bromuro di etidio alla concentrazione<br />
finale di 0,5mg/ml e mediante illuminazione con raggi UV.<br />
4
SCHEMA DI AMPLIFICAZIONE DEI GENI AdH<br />
GENE Primers<br />
AdH1<br />
AdH2<br />
AdH3<br />
AdH5<br />
Diretto<br />
5’ ATCCCAGAAACTCAAAAAGGTG 3’<br />
Inverso<br />
5’ AGTGTCAACAACGTATCTACCA 3’<br />
Diretto<br />
5’ CAAGTTGGAGCATAAGGATATC 3’<br />
Inverso<br />
5’ AGTGTCAACAACGTATCTACCA 3’<br />
Diretto<br />
5’ ACGTCAACATTGTTCACCAGG 3’<br />
Inverso<br />
5’ AGTATCGACGACGTATCTACCC 3’<br />
Diretto<br />
5’ TGGCCATTTCAATTGAAATTTCC 3’<br />
Inverso<br />
5’ AGTCTCAACAACATATCTACCA 3’<br />
Taglia amplificato<br />
PCR<br />
Temperatura di<br />
ibridazione<br />
1.033 bp 58°C<br />
990 bp 58°C<br />
1.100bp 58°C<br />
876 bp 58°C<br />
Primers, dimensioni in paia di basi (bp) dei prodotti di PCR attesi e temperatura di ibridazione.<br />
4
PCR (Polymerase Chain Reaction)<br />
La PCR è una tecnica che prevede l’amplificazione di una sequenza di DNA di cui si conoscono gli estremi.<br />
Per realizzarla si ha bisogno di:<br />
- Sequenza da amplificare<br />
- nTP (nucleoclosidi tri fosfati, come ATP, cTP, GTP, TTP)<br />
- Primer (Sequenze complementarie agli estremi della sequenza da amplificare<br />
- TAQ (una polimerasi estratta da un termofilo, in grado di non denaturarsi ad alte temperature)<br />
- Buffer (i tamponi necessari per la reazione di elongazione)<br />
La PcR avviene in una serie di cicli composti da tre fasi:<br />
- nella prima abbiamo la separazione dei frammenti, fase che avviene ad alte temperature<br />
- una fase di Annealing, appaiamento, in cui i primer si appaiono a filamenti<br />
- a fase in cui la TAQ polimerasi sfruttando l’OH libero fornito dai primer, polimerizza usando come stampo la<br />
sequenza.<br />
Nel primo ciclo si ha una duplicazione dal primer fino alla fine del frammento, ma ne cicli successivi si ha la<br />
amplificazione della sola sequenza compreso tra i due primers.<br />
0
Digestione di molecole di DNA con endonucleasi di restrizione e loro analisi<br />
Per la digestione delle molecole di DNA è stata usata 1 unità di enzima per µg di DNA. La reazione<br />
di taglio è stata effettuata in una opportuna soluzione tampone specifica per l’ enzima Sau3AI) alla<br />
temperatura di 37°C .<br />
L’esito della digestione è stato controllato mediante elettroforesi su gel di agarosio alla concentrazione<br />
finale del 2%.<br />
La corsa elettroforetica è stata effettuata ad un voltaggio costante tra 50 e 150 Volts nel tampone TBE<br />
(Tris Base 89mM, acido borico 89mM, EDTA pH 8,3 2mM).<br />
I frammenti di DNA prodotti sono stati messi in evidenza mediante l’aggiunta al gel di agarosio di<br />
bromuro di etidio alla concentrazione finale di 0,5 mg/ml.<br />
Estrazione di proteine totali di lievito<br />
Le cellule provenienti da una precoltura contenente glucosio 2%, vengono seminate in tubi batteriologici<br />
sterili contenenti 5 ml di terreno YP oppure in 20 ml di terreno minimo in beute, supplementato con<br />
le opportune fonti di carbonio. Dopo crescita fino alla fase tardo-esponenziale, le cellule vengono<br />
centrifugate per 10 minuti a 3000 rpm a 4 °C e risospese in 180 µl di soluzione contenente TE 1X (<br />
Tris-EDTA pH 7.4) e Triton-X100 allo 0.1% per ogni 0,1g di cellule. La rottura della parete cellulare<br />
viene effettuata meccanicamente per agitazione della sospensione di cellule su vortex, dopo aggiunta di<br />
sferette di vetro del diametro di 0.5mm. Tale trattamento dura circa 10 minuti e l’avvenuta rottura viene<br />
verificata al microscopio ottico. I campioni vengono quindi centrifugati per 5 minuti a 14000 rpm per<br />
eliminare il pellet cellulare e il supernatante recuperato viene centrifugato per altri 5 minuti a 15000 rpm<br />
permettendo la separazione di una fase solubile.<br />
La quantità delle proteine totali presenti nei campioni in esame viene determinata mediante un saggio<br />
colorimetrico alla lunghezza d’onda di 595 nanometri utilizzando il reattivo Bradford (Coomassie<br />
Brillant Blu G250 0,01%, etanolo 4,7%, acido fosforico 8,5%) (Bradford, 1976).<br />
Separazione elettroforetica delle proteine in condizioni non denaturanti<br />
Le proteine degli estratti cellulari sono state separate sulla base alla carica elettrica posseduta mediante<br />
elettroforesi in condizioni non denaturanti su gel di poliacrilamide al 5%. Il tampone impiegato nella<br />
corsa elettroforetica è così composto: Tris base 25 mM, glicina 192 mM, in acqua bidistillata. Sono stati<br />
caricati su ogni pozzetto del gel circa 10 µg di proteine totali di ciascun campione diluito in un volume<br />
finale di 8-15µl di una soluzione contenente Tris-HCl pH 6.8 50 mM, glicerolo 25%, ß-mercaptoetanolo<br />
100mM e blu di bromofenolo come tracciante. La corsa elettroforetica è stata effettuata a 4°C per circa<br />
1 ora ad un amperaggio costante di 25mA in un apparato per elettroforesi BioRad Mini protean II.<br />
Colorazione degli enzimi ADH mediante saggi di colorazione per attività<br />
L’attività alcool deidrogenasica (ADH) è stata evidenziata incubando il gel per 10-15 minuti a temperatura<br />
ambiente in 5 ml di una soluzione contenente: 10mg di NAD + , 0,4 mg di fenazina metasolfato (PMS) e<br />
1 mg di Sali di blu di nitro tetrazolio (NTB) e 15 µl di etanolo 95%.<br />
L’attività enzimatica è stata rilevata mediante la formazione specifica di bande di colore viola-blu nelle<br />
regioni del gel in cui è migrata l’attività.<br />
Il saggio è basto su reazioni di ossidoriduzione catalizzate dagli enzimi stessi. La colorazione è dovuta<br />
alla riduzione del sale di tetrazolio, accettore finale degli elettroni nella reazione innescata dall’enzima.<br />
1
RISULTATI<br />
Analisi degli amplificati del sistema genico AdH<br />
L’analisi degli amplificati dei geni ADH condotta su ceppi ottenuti dalle collezioni del CRA di Velletri<br />
e del DBVPG è riportata in Figura 1.<br />
L’analisi è stata eseguita da tre a cinque volte per ciascun ceppo.<br />
Come si può osservare, utilizzando primers specifici per i singoli geni ADH, si ottengono i rispettivi<br />
amplificati che mostrano migrazioni tra loro diverse mediante gel-elettroforesi.<br />
Nel ceppo 2 (S.cerevisiae B-S11c) della collezione di Velletri, il gene ADH2 mostra più prodotti di<br />
amplificazione che tendono a scomparire quando vengono amplificati contemporaneamente tutti<br />
e quattro i geni (Figura 1a). Per tale motivo, sui ceppi della collezione di Perugia è stata utilizzata<br />
direttamente quest’ultimo tipo di tecnica (Figura 1b).<br />
La mancata amplificazione di un singolo gene può essere interpretata come indice dell’assenza del gene<br />
stesso.<br />
I risultati, riassunti nella Tabella 1, sono esposti qui di seguito.<br />
- Nel ceppo di riferimento di S.cerevisiae sono presenti gli amplificati di tutti i geni saggiati.<br />
Dal confronto degli altri ceppi con questo, si può osservare che:<br />
- ADH1, che codifica il principale enzima responsabile dell’attività fermentativa, è presente in tutti i<br />
ceppi di tutte le specie saggiate appartenenti a entrambe le collezioni.<br />
Inoltre, la taglia del DNA amplificato per PCR rimane la stessa in tutti i casi.<br />
- ADH2, nella collezione di Velletri, è presente negli uvarum mentre è del tutto assente nel ceppo di<br />
S.cerevisiae E-AT1 e nei bayanus C-SbC2 e D-S16b.<br />
Quest’ultimo risultato non si riscontra nei bayanus B1 e B2 della collezione di Perugia nei quali<br />
l’amplificato ADH2 è presente e di taglia attesa, così come in tutti gli altri ceppi saggiati di questa<br />
collezione.<br />
- ADH3 è presente in tutti i cerevisiae di entrambe le collezioni ma mostra una presenza variabile nelle<br />
altre specie analizzate. Infatti, per quanto riguarda i ceppi classificati come uvarum, l’amplificato è<br />
presente nel ceppo C-S6u della collezione di Velletri e mostra bande di taglia diversa nel ceppo A-270.<br />
Nel caso degli uvarum della collezione di Perugia, l’amplificato è presente nel ceppo U1 mentre è del<br />
tutto assente nel ceppo U2.<br />
Per quanto riguarda la specie bayanus, l’amplificato ADH3 è presente nei ceppi C-SbC2 e D-S16b della<br />
collezione di Velletri e assente nei ceppi B1 e B2 della collezione di Perugia.<br />
- ADH5 è presente in tutti i ceppi di tutte le specie saggiate appartenenti ad entrambe le collezioni.<br />
2
Digestione degli amplificati del sistema genico AdH ottenuti per PCR<br />
Per ottenere un pattern di identificazione molecolare più affidabile, i prodotti di PCR dei geni ADH sono<br />
stati sottoposti a restrizione utilizzando Sau3AI, un enzima di restrizione che taglia con alta frequenza il<br />
DNA specifico per la sequenza GATC.<br />
Questo approccio consente di evidenziare più in dettaglio il polimorfismo di ciascun ceppo.<br />
L’analisi è stata effettuata dapprima sul ceppo di laboratorio di riferimento BY4741 (Fig.2) e<br />
successivamente sui ceppi della collezione di Velletri (Fig.3) e di Perugia (Fig.4).<br />
Come si può vedere, la digestione degli amplificati genici, ottenuti sia singolarmente che insieme dal<br />
ceppo di controllo BY4741, ha fornito una serie di frammenti di restrizione caratteristici di ciascun gene<br />
e concordi con la loro sequenza nucleotidica.<br />
Il pattern RFLP che si ottiene sembra essere caratteristico per ciascun ceppo in quanto questi differiscono<br />
tra loro per la dimensione di alcuni frammenti e nel loro numero, coerentemente con il numero di geni<br />
amplificati in ciascun ceppo.<br />
Per quanto riguarda la collezione di Perugia, il ceppo C2 di S. cerevisiae mostra un pattern di restrizione<br />
identico al cerevisiae di controllo, a conferma dell’affidabilità della tecnica.<br />
Con piccole differenze, questo pattern si osserva sia nel ceppo di italicus (I2) che nei due ceppi di<br />
chevalieri (H2, H3) che, notoriamente, sono sinonimi di cerevisiae.<br />
Un diverso profilo è risultato comune per i ceppi U2, classificato nella collezione di Perugia come S.<br />
uvarum, e i ceppi B1 e B2 di bayanus. Dal momento che avevamo precedentemente osservato che nel<br />
ceppo U2 non è presente l’amplificato del gene ADH3, peculiarità mostrata anche dai ceppi di bayanus<br />
della stessa collezione, possiamo ipotizzare che la classificazione di questo ceppo sia stata erroneamente<br />
attribuita alla specie uvarum.<br />
Un discorso simile può essere fatto per il ceppo U1 di uvarum che mostra un pattern di restrizione più<br />
simile al ceppo H3 di chevalieri e al C2 di cerevisiae.<br />
Analisi del pattern proteico delle alcool deidrogenasi<br />
L’assenza in un determinato ceppo di lievito dell’amplificato di un gene della taglia attesa può essere<br />
dovuta alla mancanza del gene stesso o al riarrangiamento della regione codificante del gene.<br />
Per verificare che all’assenza dell’amplificato corrispondesse effettivamente l’assenza del gene, abbiamo<br />
cercato di stabilire una relazione con la presenza/assenza del corrispondente enzima.<br />
A tale scopo, dopo rottura delle cellule ed estrazione delle proteine cellulari, le singole attività ADH<br />
sono state separate mediante elettroforesi su gel nativi di acrilamide e la loro presenza è stata messa in<br />
evidenza mediante un saggio di attività per colorazione specifica.<br />
I risultati di questa analisi sui ceppi della collezione di Velletri hanno mostrato, che all’assenza degli<br />
amplificati ADH2 e ADH3 corrisponde effettivamente la mancanza delle corrispondenti attività<br />
enzimatiche (Figura 5a). E’ interessante notare che i ceppi 1 e 4 (uvarum) mostrano un pattern enzimatico<br />
3
sovrapponibile ma comunque nettamente diverso da quello osservato nei ceppi della specie cerevisiae<br />
e bayanus.<br />
Per quanto riguarda i ceppi della collezione di Perugia, questi mostrano tutti dei profili enzimatici identici<br />
tra loro e con i cerevisiae e bayanus della collezione di Velletri.<br />
Fanno eccezione i ceppi B1 e B2 di bayanus e U2 di uvarum che mostrano un profilo simile tra loro<br />
e pertanto, come già sottolineato sulla base dell’analisi degli RFLP, sembrano appartenere alla stessa<br />
specie.<br />
Inoltre, il loro zimogramma ADH è parzialmente sovrapponibile a quello osservato negli uvarum della<br />
collezione di Velletri.<br />
Nella Tabella 2 è riassunta in modo schematico la relazione tra l’assenza dell’amplificato dei singoli<br />
geni con la presenza/assenza del corrispondente enzima.<br />
4
FIGURE E TABELLE<br />
a) b)<br />
Figura 1.<br />
a) Amplificazione mediante PCR dei geni ADH nel ceppo di riferimento BY 4741 e nei ceppi di<br />
lievito della collezione di Velletri. Sono indicati con 1, 2, 3 e 5 rispettivamente gli amplificati dei geni<br />
ADH1/2/3/5; con T gli amplificati totali dei quattro geni ottenuti mediante PCR-multiplex.<br />
b) Amplificazione mediante PCR-multiplex dei geni ADH nei ceppi di lievito della collezione di<br />
Perugia.<br />
M indica i marcatori di peso molecolare.
Tabella 1. Riassunto schematico della presenza/assenza degli amplificati corrispettivi ai geni ADH nei<br />
ceppi di lievito delle collezioni di Velletri e di Perugia.<br />
* L’asterisco indica la presenza di un amplificato che mostra una migrazione diversa da quella osservata<br />
nel ceppo di riferimento o la presenza di amplificati multipli per lo stesso gene.
Figura 2. Profilo di restrizione dei DNA amplificati dei geni ADH ottenuti dal ceppo<br />
di laboratorio di riferimento BY 4741.<br />
Figura 3. Profilo di restrizione ottenuto con l’enzima Sau3AI degli amplificati ADH<br />
dei ceppi della collezione di Velletri. Le frecce indicano la dimensione dei frammenti<br />
del ceppo di controllo.
.<br />
1000<br />
700<br />
500<br />
400<br />
200<br />
100<br />
DI G E ST I ONE Sau3A I<br />
C E PPI DE L L A C OL L E Z I ONE DI PE R UG I A<br />
M B 1 H 2 B 2 H 3 I 2 U1 U2 C 2 W T M<br />
Figura 4. Profilo di restrizione ottenuto con l’enzima Sau3AI degli amplificati dei geni ADH ottenuti<br />
dai ceppi della collezione di Perugia.
a)<br />
b)<br />
Figura 5. Profilo elettroforetico delle alcool deidrogenasi (ADH) nei ceppi delle collezioni di Velletri<br />
(a) e di Perugia (b).
Tabella 2. Riassunto schematico della correlazione tra presenza/assenza degli amplificati relativi ai<br />
singoli geni ADH e le rispettive attività enzimatiche nei ceppi di lievito delle collezioni di Velletri e<br />
di Perugia. La presenza dell’ attività Adh5p non è rilevabile con questo tipo di colorazione (N.D.).<br />
0
CONCLUSIONI<br />
Per una migliore identificazione e tracciabilità dei lieviti appartenenti al genere Saccharomyces, è stato<br />
messo a punto un nuovo approccio enzimatico-molecolare basato sull’analisi delle alcool deidrogenasi<br />
(ADH), un sistema genico che risulta essere altamente conservato nei lieviti nel corso dell’evoluzione.<br />
Ai fini dello studio della variabilità tra le varie specie, il sistema ADH presenta il doppio vantaggio di poter<br />
esser analizzato sia a livello del DNA dei geni che lo costituiscono che dei loro prodotti enzimatici.<br />
Infatti, da quanto scaturisce dalla nostra indagine, utilizzando primers basati sulle sequenze note dei<br />
geni ADH del ceppo di S. cerevisiae di controllo si possono ottenere frammenti di DNA di taglia diversa<br />
specifici per ciascun gene. Allo scopo di ottenere più velocemente un’impronta molecolare dei ceppi<br />
in esame, è possibile effettuare l’amplificazione di tutti e quattro i geni contemporaneamente mediante<br />
PCR multiplex.<br />
Inoltre, la successiva digestione dei prodotti di PCR con l’enzima Sau3AI consente di ottenere un<br />
polimorfismo di restrizione più dettagliato per ciascun lievito da analizzare.<br />
Una volta rilevata la presenza/assenza dei singoli geni ADH, è possibile procedere alla conferma dei<br />
risultati ottenuti sulla base dell’analisi del DNA mediante confronto con quelli ottenuti dallo studio delle<br />
attività enzimatiche ADH codificate dai singoli geni.<br />
Infatti, l’analisi degli zimogrammi ADH ottenuti nell’ambito del presente progetto per ciascun ceppo ha<br />
permesso di confermare che:<br />
a) l’assenza dell’amplificato di uno specifico gene è sempre associata alla mancanza del rispettivo<br />
enzima, a conferma che i primers utilizzati sono altamente specifici per ciascun gene.<br />
b) la presenza/assenza degli enzimi ADH in un determinato ceppo ben si correla con il polimorfismo<br />
di restrizione del relativo DNA.<br />
Riassumendo i risultati, l’analisi combinata DNA-enzima suggerisce che i ceppi di chevalieri e italicus<br />
della collezione di Perugia mostrano la presenza di tutti i geni ADH e, pertanto, possono essere<br />
considerati delle varietà di cerevisiae. Al contrario, i ceppi B1 e B2 (S.bayanus) e U2 (S.uvarum)<br />
della stessa collezione risultano privi del gene ADH3. Inoltre, questi tre ceppi presentano un profilo<br />
RFLP e uno zimogramma tra loro sovrapponibili ma molto diversi da quelli delle altre specie di lieviti<br />
analizzati. Questi dati suggeriscono che B1, B2 e U2, classificati sulla base delle loro caratteristiche<br />
fisio-morfologiche in specie diverse del genere Saccharomyces, possono invece appartenere alla stessa<br />
variante di specie.<br />
E’ interessante inoltre sottolineare che il pattern enzimatico del ceppo A-270 di uvarum della collezione<br />
di Velletri, privo del gene ADH3, è sovrapponibile con quello dei ceppi B1, B2 e U2 della collezione di<br />
Perugia.<br />
Al contrario, il ceppo C-S6u uvarum della collezione di Velletri mostra uno zimogramma che somiglia<br />
in parte a quello al ceppo A-270 uvarum e in parte a quello dei cerevisiae var. bayanus della stessa<br />
collezione.<br />
Questo dato conferma la capacità discriminante del nostro metodo dal momento che C-S6u, classificato<br />
1
come uvarum sulla base della proprietà di fermentare il raffinosio, è il prodotto di un incrocio tra due<br />
ceppi appartenenti rispettivamente alle specie uvarum e cerevisiae,.<br />
Per quanto riguarda i possibili sviluppi di questa tecnica, resta la necessità di ottenere una migliore<br />
definizione dei pattern di restrizione degli amplificati ottimizzando le condizioni di digestione del DNA,<br />
la separazione dei frammenti e mediante l’eventuale impiego di altri enzimi di restrizione.<br />
Questi miglioramenti consentirebbero di eliminare le incertezze dovute a digestioni parziali del DNA e<br />
alla sovrapposizione nella corsa elettroforetica dei frammenti di taglia simile.<br />
Sarà interessante infine il confronto, effettuato sugli stessi ceppi, di questo metodo con altri sistemi<br />
molecolari oggi disponibili per la tipizzazione dei lieviti vinari.<br />
In conclusione, l’impiego dell’analisi combinata DNA-enzima del sistema genico ADH può costituire<br />
sin da oggi un approccio innovativo per determinare le percentuali d’impianto dei ceppi starter e le<br />
eventuali contaminazioni dei mosti da parte di lieviti indigeni durante la fermentazione.<br />
2
BIBLIOGRAFIA<br />
1. Antunovics Z., Irinyl L., and Sipiczki M. 2005. Combined application of methods to taxonomic<br />
identification of Saccharomyces strains in fermenting Botrytized grape must. J. Appl. Microbiol. 98:<br />
971-979.<br />
2. M., and Goto-Yamamoto N. 2001. AFLP analysis of type strains and laboratory and industrial strains<br />
of Saccharomyces sensu stricto and its application to phenetic clustering. Yeast 18: 1145-1154.<br />
3. Bakker B.M., Bro C., Kotter P., Luttik M. A., van Dijken J.P. and Pronk J.T. 2000. The mitochondrial<br />
alcohol dehydrogenase Adh3p is involved in a redox shuttle in Saccharomyces cerevisiae. J. Bacteriol.<br />
182: 4730-4737.<br />
4. Cardinali G., and Martini A. 1994. Electrophoretic karyotypes of authentic strains of the sensu stricto<br />
group of the genus Saccharomyces. International journal of systematic bacteriology 44: 791-797.<br />
5. Ciriacy, M. 1975. Genetics of alcohol dehydrogenase in Saccharomyces cerevisiae I. Isolation of ADH<br />
mutants. Mutat. Res. 29: 315-325.<br />
6. Ciriacy, M. 1979. Isolation and characterization of further cis and trans-acting regulatory elements<br />
involved in the synthesis of glucose repressible alcohol dehydrogenase (ADHII). Mol. Gen. Genet. 176:<br />
427-431.<br />
7. Daniel H.-M., Meyer W. 2003. Evaluation of ribosomal RNA and actin gene sequences for the<br />
identification of ascomycetous yeasts. Int. J. Food Microbiol. 86: 61-78.<br />
8. Dickinson J. R., Salgado L. E. J., and Hewlins M. J. E. 2003. The catabolism of amino acids to long<br />
chain and complex alcohols in Saccharomyces cerevisiae. J. Biol. Chem. 278: 8028-8034.<br />
9. Esteve-Zarzoso B., Belloch C., Uruburu F., and Querol A. 1999. Identification of of yeasts by RFLP<br />
analysis of the 5.8 S rRNA gene and the two internal transcribed spacers. Int. J. Syst. Bacteriol. 49: 329-337.<br />
10. Granchi L., Bosco M., Messini A., and Vincenzini M. 1999. Rapid detection and quantification of<br />
yeast species during spontaneous wine fermentation by PCR-RFLP analysis of the rRNA ITS region. J.<br />
Appl. Microbiol. 87: 949-956.<br />
11. Guillamon J. M., Sabaté J., Barrio E., Cano J., and Querol A. 1998. Rapid identification of wine<br />
yeast species based on RFLP analysis of the ribosomal internal transcribed spacer ( ITS) region. Arch.<br />
Microbiol.169: 387-392.<br />
12. Kellis M., Patterson N., Endrizzi M., Birren B., and Lander E. S. 2003. Sequencing and comparison<br />
of yeast species to identify genes and regulatory elements. Nature 423: 241-254.<br />
13. Laitila A., Wilhelmson A., Kotaviita E., Olkku J., Home S., and Jovonen R. 2006. Yeasts in an<br />
industrial malting ecosystem. J. Ind. Microbiol. Biotechnol. 33: 953-966.<br />
14. Quesada M., and Cenis J.L. 1995. Use of random amplified polymorphic DNA (RAPD-PCR) in the<br />
characterisation of wine yeasts. Am. J. Enol. Vitic. 46: 204-208.<br />
15. Richard G. F., and Dujon B. 2000. Molecular evolution of minisatellites in hemiascomycetous yeasts.<br />
Mol. Biol. Evol. 23: 189-202.<br />
16. Schuller D, Valero E., Dequin S., and Casal M. 2004. Survey of molecular methods for the typing of<br />
wine yeast strains. FEMS Microbiol. Lett. 231: 19-26.<br />
17. Young E.T., and Pilgrim D. 1985. Isolation and sequence of ADH3, a nuclear gene encoding the mitochondrial<br />
isozyme of alcohol dehydrogenase in Saccharomyces cerevisiae. Mol. Cell Biol. 5: 3024-3034.<br />
3