Via biogenetica del mevalonato - Farmaciaunina2.it
Via biogenetica del mevalonato - Farmaciaunina2.it
Via biogenetica del mevalonato - Farmaciaunina2.it
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
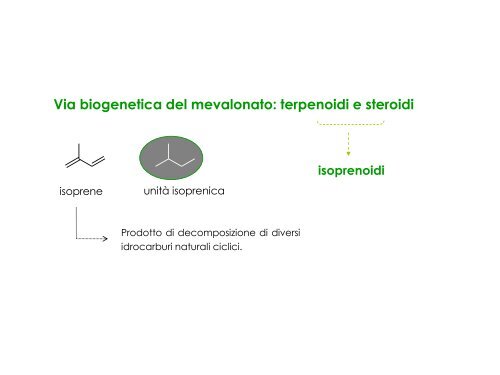
<strong>Via</strong> <strong>biogenetica</strong> <strong>del</strong> <strong>mevalonato</strong>: terpenoidi e steroidi<br />
isoprene unità isoprenica<br />
Prodotto di decomposizione di diversi<br />
idrocarburi naturali ciclici.<br />
isoprenoidi
ACIDO MEVALONICO<br />
OPP<br />
isopentenil PP<br />
(IPP) (C 5)<br />
unità isopreniche biologicamente attive<br />
OPP<br />
dimetilallil PP<br />
(DMAPP) (C5) IPP IPP IPP<br />
MONOTERPENI SESQUITERPENI<br />
DITERPENI SESTERTERPENI<br />
C C 10 15 C20 C25<br />
x 2<br />
EMITERPENI<br />
C 5<br />
TRITERPENI STEROIDI<br />
C 30<br />
x 2<br />
TETRATERPENI<br />
C40 C 18-C 30
REGOLA ISOPRENICA<br />
coda<br />
testa<br />
geraniolo<br />
farnesolo<br />
geranilgeraniolo<br />
Le strutture dei terpeni sono in accordo con la teoria che essi sono<br />
sintetizzati mediante l’unione di unità isopreniche, di solito unite in<br />
maniera testa-coda (Ruzicka, 1953) .<br />
OH<br />
OH<br />
OH<br />
testa<br />
estremità ramificata<br />
testa<br />
coda<br />
isoprene<br />
coda<br />
estremità non ramificata<br />
OH<br />
mentolo bisabolene
squalene<br />
fitene<br />
Squalene e fitene presentano un legame<br />
coda-coda al centro <strong>del</strong>la molecola
Nella biosintesi <strong>del</strong>l’acido mevalonico vengono utilizzate tre molecole di acetil-CoA.<br />
O<br />
H<br />
SCoA<br />
O<br />
SCoA<br />
condensazione<br />
di Claisen<br />
acetil-CoA<br />
EnzSH<br />
H O<br />
O<br />
SCoA<br />
acetoacetil-CoA<br />
O<br />
S-Enz<br />
condensazione<br />
aldolica<br />
O<br />
C<br />
Enz-S<br />
O<br />
C<br />
HO<br />
L’inibizione farmacologica <strong>del</strong>l’enzima coinvolto è un mezzo per regolare la biosintesi<br />
di <strong>mevalonato</strong> ed, in ultimo, <strong>del</strong> colesterolo (meccanismo azione <strong>del</strong>le Statine).<br />
O<br />
O<br />
OH<br />
mevanolattone<br />
HO<br />
NADPH<br />
HO<br />
OH<br />
acido mevaldico<br />
O<br />
O<br />
OH<br />
acido mevalonico<br />
(MVA)<br />
O<br />
OH<br />
HO<br />
O<br />
OH O<br />
H 2O<br />
OH O<br />
OH OH<br />
H<br />
SCoA<br />
SCoA<br />
-idrossi--metilglutaril-CoA<br />
HMG-CoA<br />
reduttasi<br />
NADPH<br />
SCoA<br />
acido mevaldico<br />
tioemiacetale<br />
+ EnzSH
Il composto MVA a sei atomi di carbonio viene trasformato nelle unità isopreniche fosforilate C5<br />
mediante una serie di reazioni che iniziano con la fosforilazione <strong>del</strong>l’alcool primario.<br />
HOOC<br />
fosforilazione<br />
H<br />
O<br />
O<br />
O<br />
OH<br />
OH<br />
acido mevalonico<br />
(MVA)<br />
OH<br />
2 ATP<br />
HO<br />
O<br />
P<br />
OH<br />
O ADP<br />
OPP<br />
ATP<br />
-CO 2<br />
decarbossilazione-eliminazione mediata<br />
da una precedente fosforilazione <strong>del</strong>la<br />
funzione alcolica terziaria e formazione di<br />
un miglior gruppo uscente<br />
H<br />
H R<br />
H S<br />
OPP<br />
isomerasi<br />
IPP DMAPP<br />
OPP<br />
L’IPP viene isomerizzato a DMAPP da un enzima<br />
isomerasi che rimuove stereospecificamente il protone<br />
pro-R.
EMITERPENI<br />
In natura sono relativamente rari e l’esempio più importante è proprio l’isoprene, un composto<br />
volatile presente in diversi tipi di alberi e che si forma per perdita di un protone dal catione allilico.<br />
OPP<br />
H 2C<br />
H<br />
coinvolto in<br />
H 2C<br />
produzione<br />
<strong>del</strong>l’ozono<br />
Blue Mountains<br />
formazione di aerosol che<br />
causano la diffusione <strong>del</strong>la<br />
luce solare
monoterpeni<br />
DMAPP<br />
OPP<br />
prenil trasferasi<br />
S N1<br />
elettrofilo reattivo, buon<br />
agente alchilante<br />
E<br />
OPP<br />
H R H S IPP<br />
OPP<br />
nucleofilo<br />
=<br />
H R<br />
geranil PP<br />
(GPP)<br />
H S<br />
OPP<br />
OPP
(Z)<br />
OPP<br />
Geranil PP<br />
OPP<br />
Il linalilPP (LPP) e il nerilPP (NPP) sono isomeri <strong>del</strong> GPP. È<br />
probabile che essi si formino per ionizzazione a catione<br />
allilico <strong>del</strong> geranilPP.<br />
Neril PP<br />
- OPP<br />
OPP<br />
OPP<br />
Linalil PP<br />
il singolo legame in LPP<br />
consente la rotazione<br />
- OPP
citronellolo<br />
(olio di rosa)<br />
geraniolo<br />
(olio di geranio)<br />
linalolo<br />
(olio di coriandolo)<br />
nerolo<br />
(olio di rosa<br />
OH<br />
OH<br />
OH<br />
GPP<br />
OPP<br />
linalil PP<br />
LPP<br />
OPP<br />
OH OPP<br />
O<br />
neril PP<br />
NPP<br />
O<br />
geraniale<br />
(olio di limone)<br />
O<br />
citronellale<br />
(olio di citronella)<br />
-mircene<br />
(infiorescenze <strong>del</strong> luppolo)<br />
nerale<br />
(olio di limone)<br />
Il geranil PP e i suoi isomeri linalil<br />
PP e neril PP, in seguito a<br />
modificazioni relativamente<br />
semplici danno origine ad una<br />
serie di monoterpeni lineari<br />
componenti di oli volatili,<br />
largamente utilizzati nella<br />
produzione di aromi e profumi.<br />
I composti che ne derivano possono essere<br />
idrocarburi, alcoli, aldeidi o anche esteri,<br />
specialmente acetati.
La varietà di monoterpeni che si riscontrano in natura<br />
viene considerevolmente aumentata dalla possibilità<br />
che avvengano reazioni di ciclizzazione che possono<br />
portare alla formazione di sistemi monociclici e biciclici.<br />
OPP<br />
- OPP<br />
monoterpeni monociclici<br />
LPP catione mentile<br />
-terpinile<br />
Gli enzimi monoterpene ciclasi accettano tutti e tre i<br />
difosfati (GPP, LPP e NPP) e, sembra, abbiano sia la<br />
H2O - H<br />
capacità di isomerizzarli che di ciclizzarli.<br />
È conveniente considerare la specie coinvolta nella<br />
ciclizzazione come un catione allilico <strong>del</strong>ocalizzato,<br />
fortemente legato all’anione difosfato.<br />
La formazione <strong>del</strong> legame che ne consegue avviene<br />
grazie alla vicinanza degli elettroni <strong>del</strong> doppio<br />
legame.<br />
HO<br />
-terpineolo<br />
olio di pino<br />
limonene<br />
olio di limone
MENTANO<br />
I sistemi enzimatici controllano il<br />
ripiegamento <strong>del</strong>la molecola di<br />
substrato definendo la<br />
stereochimica <strong>del</strong> prodotto finale<br />
odore limoni<br />
(-)-limonene (+)-limonene<br />
odore arance<br />
(-)-mentolo<br />
O<br />
(-)-mentone<br />
-terpinene<br />
O<br />
O<br />
OH<br />
OH<br />
(-)-carvone (+)-isomentone (+)-neomentolo<br />
OH<br />
p-cimene timolo carvacrolo<br />
OH
catione mentile<br />
-terpinile<br />
shift 1,3 di idruro<br />
Il catione mentile, sebbene sia terziario, può essere<br />
convertito mediante una migrazione 1,3 di uno ione<br />
idruro, in un catione allilico che è favorevolmente<br />
stabilizzato per risonanza.<br />
H<br />
H<br />
catione fellandrile<br />
- H - H<br />
-fellandrene -fellandrene
Dall’intermedio mentanico possono generarsi anche composti biciclici<br />
catione tujile<br />
H<br />
I processi di riarrangiamento non riguardano<br />
solo la migrazione di metili, ma anche di<br />
legami carbonio-carbonio.<br />
shift 1,2 di idruro<br />
H<br />
catione pinile<br />
shift 1,2 di alchile<br />
catione bornile<br />
shift 1,2 di alchile<br />
catione isofanchile<br />
carbocatione 2° carbocatione 3°<br />
catione fenchile
canfora<br />
O ox<br />
Borneolo<br />
OH<br />
antisettico e antipruriginoso topico<br />
Cinnamonum camphora<br />
ciclizzazione<br />
H 2O<br />
catione bornile<br />
ciclizzazione<br />
catione mentile\-terpinile<br />
acqua raggia<br />
catione pinile<br />
-H +<br />
-pinene<br />
trementina<br />
-H +<br />
luce, O 2<br />
HO<br />
-pinene<br />
HO<br />
sobrerolo<br />
sobrepin
PINANO<br />
FENCANO<br />
CANFANO<br />
=<br />
= =<br />
=<br />
2,6,6-trimetilbiciclo[3.1.1]eptano<br />
2,2,3-trimetilbiciclo[2.2.1]eptano<br />
1,7,7-trimetilbiciclo[2.2.1]eptano<br />
monoterpeni biciclici<br />
-pinene<br />
canfene<br />
-pinene<br />
OH O<br />
borneolo canfora
=<br />
ISOCANFANO<br />
CARANO<br />
TUIANO<br />
1,3,3-trimetillbiciclo[2.2.1]eptano<br />
3,7,7-trimetilbiciclo[4.1.0]eptano<br />
1-isopropil-4-metilbiciclo[3.1.0]esano<br />
OH O<br />
fencolo fencone<br />
O<br />
car-3-ene car-4-ene<br />
O<br />
tuione umbellone
Gli olii essenziali sono in genere miscele di composti volatili che si<br />
ottengono dalle droghe per estrazione in corrente di vapore e che<br />
sono in genere responsabili <strong>del</strong>l’aroma <strong>del</strong>le piante che li producono.<br />
Da tempo vengono usati sia in campo cosmetico ed alimentare per il<br />
loro aroma, sia in campo farmacologico per le loro attività<br />
antisettiche, disinfettanti e antielmintiche.<br />
Nome Pianta Droga Componenti principali<br />
Trementina Pinus essudato - e -pinene<br />
Citronella Cymbopogon winterianus foglie citronellale<br />
Canfora Cinnamomum camphora foglie e tronco canfora, eucaliptolo<br />
Limone Citrus limon corteccia limonene e citrale<br />
Garofano Eugenia caryophyllata chiodi eugenolo<br />
Menta Mentha piperita pianta mentolo<br />
Chenopodio Chenopodium ambrosioides pianta ascaridolo<br />
Olii essenziali<br />
Lavanda Lavandula vera fiori linalolo e linalile acetato
Olio Componente Uso<br />
Canfora Canfone<br />
Eucalipto Eucaliptolo<br />
Pino Acetato di bornile e limonene<br />
Ginepro Terpinen-4-olo<br />
O<br />
O<br />
O<br />
OH<br />
O<br />
Cardiotonico<br />
Espettorante<br />
Espettorante<br />
Diuretico
monoterpeni irregolari monoterpeni non concordanti con<br />
il regolare meccanismo di accoppiamento testa-coda<br />
OPP<br />
1<br />
H<br />
OPP<br />
OPP<br />
1. addizione elettrofila, formazione di un carbocatione terziario;<br />
2. Perdita di un protone e sintesi <strong>del</strong>l’anello ciclopropanico;<br />
3. Idrolisi <strong>del</strong>l’estere fosfato ed ossidazione<br />
2<br />
3<br />
Compositae<br />
COOH<br />
acido crisantemico
attività insetticida / paralizzante<br />
% di piretrine nell’estratto: 25-50<br />
azione: sistema nervoso degli insetti<br />
stabilità: poche ore<br />
piretrina I<br />
piretrina II<br />
cinerina I<br />
cinerina II<br />
jasmolina I<br />
jasmolina II<br />
R 1 O<br />
R 1<br />
Me<br />
O<br />
COOMe<br />
Me<br />
COOMe<br />
Me<br />
COOMe<br />
O<br />
R 2<br />
HC CH 2<br />
HC CH 2<br />
Me<br />
COOMe<br />
Et<br />
Et<br />
R 2<br />
piretrine (Chrysanthemum cinerariaefolium)<br />
attivo vs afidi, acari, cimici, lepidotteri, coleotteri, zanzare, mosche e tarme<br />
Dall'estratto dei fiori di piretro, che contiene il 25% di principi attivi<br />
MeOOC<br />
acido piretrico<br />
C<br />
O<br />
OH<br />
I fiori sono raccolti prima <strong>del</strong>la completa<br />
sbocciatura e sottoposti ad estrazione<br />
la polvere insetticida, ottenuta dai capolini polverizzati ed<br />
essiccati dei fiori, prende comunemente il nome di piretro.<br />
Il crisantemo è una pianta erbacea perenne originaria <strong>del</strong>l’Iran e diffusasi poi in varie parti <strong>del</strong> nostro pianeta.
Le porzioni alcoliche <strong>del</strong>le piretrine (piretrolone, jasmolone e<br />
cinerolone) è possibile derivino da acidi grassi ciclizzati e modificati<br />
HO<br />
O<br />
acido -linolenico<br />
piretrolone<br />
HO<br />
COOH COOH<br />
O<br />
O<br />
sistema di segnalazione<br />
in risposta a ferimento o<br />
infezione microbica<br />
jasmolone<br />
-ossidazione<br />
decarbossilazione<br />
COOH<br />
O<br />
acido jasmonico<br />
O<br />
HO<br />
O<br />
cinerolone<br />
COOH<br />
HO<br />
O<br />
jasmolone
6 7<br />
5<br />
8<br />
4<br />
1 2<br />
iridano<br />
9 10<br />
3<br />
attrattore sessuale ed<br />
eccitante dei gatti<br />
IRIDOIDI<br />
Lo scheletro <strong>del</strong>l’iridano è di origine monoterpenica e contiene<br />
generalmente un anello ciclopentanico fuso ad un eterociclo ossigenato.<br />
iridoidi<br />
H<br />
H<br />
O<br />
O<br />
nepetalattone<br />
O<br />
secoiridoidi<br />
DIFESA<br />
antiinfiammatoria, antalgica,<br />
antireumatica, spasmolitica,<br />
antiallergica, ipotensiva<br />
Iridomyrmex
Lo scheletro <strong>del</strong>l’iridano può essere razionalizzato come formantesi dal catione nerile<br />
H<br />
H
OH O<br />
ox<br />
H<br />
O<br />
H<br />
H<br />
iridodiale<br />
O<br />
O<br />
Il sistema iridoide deriva dal geraniolo<br />
Attacco nucleofilo di uno ione idruro sulla dialdeide che si forma a partire dal geraniolo<br />
H<br />
H<br />
O<br />
OH<br />
iridodiale<br />
forma enolica forma<br />
emiacetalica<br />
H<br />
H<br />
O<br />
O H
H<br />
H<br />
O<br />
O<br />
iridodiale<br />
O<br />
H<br />
O<br />
O<br />
H<br />
O<br />
[O]<br />
OH<br />
dalla loganina, per rottura di un legame carbonio-carbonio,<br />
si ottiene la secologanina (un secoiridoide).<br />
H<br />
O<br />
H<br />
O<br />
O<br />
iridotriale<br />
H OPP<br />
O H<br />
OH<br />
H<br />
O<br />
O<br />
O<br />
H<br />
O<br />
Ossidazione e<br />
esterificazione<br />
Ossidazione<br />
H<br />
O<br />
OH<br />
HO<br />
glucosilazione<br />
forma emiacetalica<br />
H<br />
O<br />
secologanina loganina<br />
O<br />
Ossidazione e<br />
fosforilazione<br />
H<br />
O<br />
OGlc
Harpagophytum procumbens Artiglio <strong>del</strong> diavolo<br />
La droga rappresentata dalla radice secondaria<br />
tuberizzata contiene glucosidi iridoidi nella % <strong>del</strong>lo<br />
0.5-3%.<br />
glicoside iridoide, esterificato con acido cinnamico<br />
costituisce circa l’80% degli iridoidi <strong>del</strong>la pianta<br />
attività antinfiammatoria, antireumatica<br />
effetti digestivi, antiaritmici, ipotensivi<br />
Africa meridionale - habitat naturale savane e<br />
foreste decidue.<br />
O<br />
HO OH<br />
O<br />
H<br />
HO<br />
O<br />
O<br />
OH<br />
OH<br />
OH<br />
O<br />
arpagoside<br />
Titolo F.U.: non meno <strong>del</strong> 1,2 % di glicoiridoidi totali espressi come arpagoside.
Valeriana officinalis<br />
O<br />
O<br />
O O<br />
O<br />
0,4-2%<br />
O<br />
O<br />
O O<br />
H<br />
O<br />
H<br />
O O<br />
acido acetico<br />
valtrato<br />
H<br />
O O<br />
diidrovaltrato<br />
acido isovalerianico (3-metilbutirrico)<br />
O<br />
O<br />
O O<br />
O<br />
VALEPOTRIATI da Valeriana officinalis<br />
La valeriana è nota per sue proprietà ipnotiche e sedative<br />
H<br />
O O<br />
O<br />
O<br />
O<br />
droga: rizoma, radice e stolone<br />
O O<br />
H<br />
O O<br />
isovaltrato acevaltrato<br />
riduzione 90% degli iridoidi totali <strong>del</strong>la droga<br />
OAc<br />
0.5-1% valepotriati<br />
(esteri epossi- iridoidi)<br />
instabili data la loro struttura epossidica<br />
il titolo diminuisce con l’immagazzinamento e la lavorazione<br />
Gli iridoidi sono presenti nella droga fresca o in quella<br />
essiccata a temperatura inferiore ai 49°C.
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
H<br />
O O<br />
CHO<br />
O<br />
citotossicità<br />
O<br />
O<br />
O<br />
O<br />
O<br />
valtrato isovaltrato<br />
O<br />
O<br />
H<br />
O O<br />
baldrinale omobaldrinale<br />
responsabili di attività sedativa<br />
H<br />
CHO<br />
O<br />
COOH<br />
O<br />
Attività: tranquillante per<br />
alleviare tensione nervosa,<br />
ansia, insonnia<br />
Durante l’essiccamento e la conservazione il<br />
valepotriato può decomporsi<br />
sesquiterpeni<br />
acido valerenico valeranone alcaloidi <strong>del</strong>la Valeriana R = H, OH<br />
R<br />
N<br />
OH
Olea europea (ulivo) 5-6% secoiridoidi<br />
L’oleuropeina (Panizzi, 1960) è un glucoside<br />
amaro presente sia nelle drupe che nelle<br />
foglie<br />
diverse attività biologiche<br />
antiossidante<br />
antiipertensiva<br />
batteriostatica<br />
dilatatrice <strong>del</strong>le coronarie<br />
spasmolitica<br />
vasodilatatrice<br />
HO<br />
HO<br />
O<br />
HO<br />
O<br />
OH<br />
OH<br />
O<br />
H<br />
OH<br />
O<br />
O
SESQUITERPENI<br />
L’addizione di un’ulteriore unità C 5 IPP al<br />
geranil PP, in un prolungamento<br />
<strong>del</strong>l’enzima preniltrasferasi porta alla sintesi<br />
di FPP, precursore fondamentale dei<br />
sesquiterpeni.<br />
Da FPP può dar origine ad una serie di<br />
sesquiterpeni lineari o ciclici.<br />
Il numero dei possibili modi di ciclizzazione<br />
aumenta con l’aumentare <strong>del</strong>la lunghezza<br />
<strong>del</strong>la catena e <strong>del</strong> numero dei doppi<br />
legami e in virtù <strong>del</strong>la geometria dei doppi<br />
legame.<br />
GPP<br />
OPP<br />
H R<br />
IPP<br />
farnesil PP<br />
(FPP)<br />
H S<br />
HR<br />
OPP<br />
HS<br />
OPP<br />
OPP
E,E - FPP<br />
E,Z - FPP<br />
OPP<br />
OPP<br />
catione E,E - farnesile<br />
Il doppio legame più vicino al gruppo di fosfato può assumere configurazione E o Z attraverso<br />
una ionizzazione (analogo a quanto visto per il geraniolo).<br />
catione E,Z - farnesile<br />
le reazioni standard dei carbocationi forniscono una spiegazione razionale <strong>del</strong>la maggior parte dei comuni<br />
scheletri carboniosi che si incontrano in questa classe.
catione E,E - farnesile<br />
catione germacrile<br />
catione umulile<br />
H<br />
H<br />
catione cariofillile<br />
H<br />
catione guaile<br />
catione eudesmile
H<br />
shift 1,3 di idruro<br />
catione cis-germacrile<br />
catione cis-umulile<br />
catione cadinile<br />
catione E,Z - farnesile<br />
catione bisabolile<br />
catione carotile
PARTENIO o TANACETO o camomilla bastarda<br />
(Tanacetum parthenium o Chrysanthemum parthenium )<br />
catione E,E-farnesile<br />
catione germacrile<br />
- H<br />
O O<br />
germacrene<br />
Erba amara vera, Matricale, Amareggiola<br />
O<br />
O O<br />
funzione lattonica ,-insatura<br />
partenolide<br />
medicina tradizionale → trattamento di febbre, cefalea, dolori articolari, dismenorrea, come<br />
emmenagogo ,e per favorire l'espulsione <strong>del</strong>la placenta.<br />
collutorio e antisettico per uso esterno per ferite e contusioni<br />
famiglia Compositae (genere Asteraceae)<br />
La droga (foglie di colore verde-giallastro) è raccolta prima <strong>del</strong>la<br />
fioritura (giugno-luglio)<br />
O<br />
germacranolide
Nella fitoterapia moderna è principalmente usato nella profilassi <strong>del</strong>l'emicrania<br />
1. inibisce la fosfolipasi A 2, con conseguente inibizione<br />
<strong>del</strong>la sintesi <strong>del</strong>le prostaglandine e dei leucotrieni;<br />
2. inibisce l’aggregazione piastrinica ed il rilascio di<br />
mediatori flogogeni quali istamina e seratonina.<br />
<br />
Efficacia <strong>del</strong>la droga nel trattamento <strong>del</strong>l’emicrania,<br />
<strong>del</strong> dolore di denti e dei dolori mestruali<br />
partenolide (~ 1% nelle foglie secche) → inibizione <strong>del</strong>la crescita di linee cellulari tumorali in vitro<br />
O<br />
O<br />
H<br />
O<br />
S R<br />
O<br />
O<br />
O<br />
S R<br />
L’attività biologica sembra connessa alla<br />
capacità di alchilare gruppi tiolici. Questa<br />
reazione è responsabile anche di tossicità ed<br />
effetti allergici provocati da questo composto<br />
ed altri strutturalmente correlati<br />
Il tanaceto è controindicato in individui allergici alla camomilla e alle altre Asteraceae; un uso prolungato può<br />
causare perdita <strong>del</strong>la sensazione gustativa, ulcere <strong>del</strong>la bocca, flatulenza e diarrea.
catione E,Z-farnesile<br />
Matricaria chamomilla<br />
La neutralizzazione <strong>del</strong> catione bisabolile con<br />
acqua porta all’-bisabololo
Camomilla tedesca (Matricaria recutita o Matricaria chamomilla)<br />
Spasmolitico nei disturbi gastrointestinali<br />
Trattamento di infiammazioni <strong>del</strong>la cute e <strong>del</strong> cavo orale<br />
Emolliente e protettivo<br />
La droga è costituita dai capolini (10 -17 mm<br />
diametro), raccolti in maggio-luglio, seccati disposti su<br />
telai in strati sottili, in luogo ombroso e ben aerato o in<br />
essiccatoi.<br />
pianta erbacea annuale eretta alta 30-50 cm<br />
La droga contiene 0.25-1% di olio essenziale e<br />
flavonoidi<br />
-bisabololo (10-25%);<br />
bisabololo ossido A e B (10-25%)<br />
camazulene (0 -15%)
Azuleni – sesquiterpeni instabili dal colore blu. Oli incolori con odore gradevole<br />
camazulene<br />
catione germacrile<br />
-CO 2<br />
HOOC<br />
H<br />
acido camazulen carbossilico<br />
-AcOH<br />
- 2 H 2O<br />
calore<br />
possiede azione ormonosimile di tipo gonadotropo, attività antiallergica e<br />
antinfiammatoria determinata dalla capacità di ridurre la produzione di istamina<br />
H<br />
catione guaile<br />
HO<br />
H<br />
O<br />
ox<br />
matricina<br />
O<br />
H<br />
OAc
Camomilla romana (Anthemis nobilis)<br />
pianta erbacea perenne alta 15-40 cm<br />
Proprietà stomachiche (coadiuvante <strong>del</strong>la digestione)<br />
Proprietà antispasmodiche<br />
Proprietà antibatteriche<br />
famiglia Compositae (genere Asteraceae)<br />
La droga, costituita dai capolini sferici di colore bianco-giallognolo (8 -20 mm diametro), è<br />
raccolta da giugno a settembre.<br />
in tracce<br />
La droga contiene 0.4-1.5% olio essenziale<br />
Sedativo nei disturbi <strong>del</strong> sonno<br />
Blande proprietà antisettiche e antiinfiammatorie
H<br />
catione cis-germacrile<br />
shift 1,3 di idruro<br />
Juniperus communis<br />
Famiglia Cupressacee<br />
H<br />
H<br />
catione cadinile<br />
H<br />
H<br />
-cadinene<br />
H<br />
da bacche di ginepro<br />
Gin<br />
stimolante <strong>del</strong>la circolazione cutanea<br />
aromatizzanti, diuretiche, antisettiche, balsamiche
Lo scheletro <strong>del</strong> cadinino è il punto di partenza per<br />
modificazioni che portano all’artemisinina, un componente<br />
antimalarico da Artemisia annua (assenzio annuo o dolce)<br />
O<br />
O<br />
O<br />
O<br />
H<br />
O<br />
H<br />
artemisinina<br />
riduzione<br />
lattone sesquiterpenico<br />
con insolito legame perossidico<br />
O<br />
O<br />
O<br />
Schizontocida utilizzato nel trattamento di febbri e malaria. La quantità di principio attivo è<br />
relativamente bassa (0.06-0.16%). La molecola è instabile in condizioni acide e stabili in alcali<br />
O<br />
O<br />
O<br />
Meccanismo d’azione: ossidante <strong>del</strong>le membrane <strong>del</strong> parassita.<br />
O<br />
H<br />
HO H<br />
H<br />
diidroartemisinina<br />
lattolo<br />
usato per la semisintesi di analoghi<br />
O<br />
O<br />
H<br />
HOOC O<br />
H<br />
acido artesunico<br />
H<br />
HOOC<br />
utilizzati come sali sodici<br />
famiglia Compositae<br />
O<br />
O<br />
O<br />
O<br />
O<br />
H<br />
H<br />
acido artelinico<br />
H
Il gossipolo è un sesquiterpene dimerico <strong>del</strong>le gemme floreali acerbe e nei semi <strong>del</strong>la pianta<br />
di cotone (Gossypium sp.)<br />
catione cadinile<br />
ox<br />
OH CHO<br />
emigossipolo<br />
OH<br />
OH<br />
ossidazione r adicalica<br />
L’uso culinario <strong>del</strong>l’olio ha indirizzato la<br />
ricerca verso piccole popolazioni ove si<br />
registrava una natalità significativamente<br />
inferiore alla norma.<br />
O CHO<br />
HO<br />
HO<br />
OH<br />
OH<br />
CHO OH<br />
gossipolo<br />
OH CHO<br />
O CHO<br />
OH<br />
OH<br />
OH<br />
OH<br />
accoppiamento radicalico<br />
Il gossipolo agisce su alcuni enzimi dei mitocondri degli spermatozoi e sulla produzione di questi ultimi.<br />
anticoncezionale maschile (Cina), con valori di sterilizzazione temporanea e reversibile fino al<br />
98% ed oltre dovuti al blocco <strong>del</strong>la formazione degli spermi
HO<br />
OH<br />
HO CHO<br />
HO<br />
OHC<br />
OH<br />
OH<br />
HO<br />
HO<br />
CHO<br />
(+)-gossipolo (-)-gossipolo<br />
Esiste in due forme atropoisomeriche (conformeri che possono essere separati come specie<br />
chimiche distinte e che originano da un impedimento rotazionale intorno al legame semplice)<br />
Solo l’isomero (-) è attivo come anticoncezionale, mentre la forma (+) è tossica.<br />
gossipolo<br />
OH<br />
HO<br />
OHC<br />
OH<br />
OH
L’ormone di crescita <strong>del</strong>le piante, acido abscissico, che accelera la caduta <strong>del</strong>le foglie e<br />
induce la quiescenza dei germogli è anch’esso un sesquiterpene.<br />
O<br />
HO<br />
farnesolo<br />
piante<br />
OH<br />
O<br />
OH<br />
COOH<br />
funghi<br />
H<br />
H<br />
O<br />
OH<br />
OH<br />
nei funghi precursore è il farnesolo<br />
Le piante ottengono il loro fabbisogno da carotenoidi come la violaxantina<br />
OH
Diterpeni<br />
Terpeni altamente ubiquitari a 20 atomi di carbonio (4 unità isopreniche).<br />
GGPP sintasi<br />
Le modificazioni che intervengono nelle<br />
ultime tappe biosintetiche portano ad<br />
una grande varietà di complesse<br />
strutture chimiche, comprendenti<br />
composti aciclici, composti bi-, tri e<br />
tetraciclici, oltre a composti con anelli<br />
addizionali che possono andare<br />
incontro a processi di fusione o<br />
aromatizzazione.
Strutture acicliche<br />
Strutture macrocicliche<br />
taxani, dafnani e cembrani<br />
Strutture bicicliche<br />
labdani e clerodani<br />
Strutture tricicliche<br />
pimarani e abietani<br />
Strutture tetracicliche<br />
kaurani, beyerani, giberelline, stemarani, afidicoline
catena lipofila <strong>del</strong>le clorofille o <strong>del</strong>la vitamina K1<br />
H<br />
H<br />
labdano<br />
OH<br />
fitolo retinolo<br />
HOOC<br />
H<br />
H<br />
acido abietico<br />
H<br />
H<br />
OH<br />
OH<br />
acido ent-7-idrossikaurenoico<br />
acido resinico a ruolo protettivo, contenuto nell’essudato di alberi (es. conifere)
Taxolo da Taxus ssp.<br />
O<br />
NH<br />
OH<br />
O<br />
O<br />
9 centri chirali<br />
paclitaxel<br />
(taxolo)<br />
specie provenienza % tassolo<br />
HO<br />
O<br />
T. brevifolia USA Corteccia 0,02%<br />
T. baccata Europa Corteccia 0,008%<br />
Rami 0,0006%<br />
Foglie 0,003%<br />
T. cuspidata Giappone Foglie 0,006%<br />
Corteccia 0,003%<br />
Legno 0,002%<br />
T. media Europa, USA Foglie 0,002%<br />
O<br />
O<br />
O<br />
O<br />
O<br />
O<br />
H<br />
OH<br />
O<br />
anticanceroso<br />
nucleo tassano
Lo scheletro tassanico deriva da GGPP attraverso un meccanismo carbocationico a tre successive ciclizzazioni.<br />
La catena laterale <strong>del</strong> taxolo, che contiene anelli aromatici, deriva dallo shikimato via fenilalanina.
precursore <strong>del</strong> tassolo dalle foglie <strong>del</strong> Tasso<br />
Il tassolo o paclitaxel (Taxol®) è una molecola importante per il<br />
trattamento di alcune forme di cancro che non rispondono ad altri<br />
rimedi farmacologici (ad es. tumori alle ovaie, sperimentazione<br />
clinica contro i tumori metastatici <strong>del</strong>la mammella).<br />
Il fabbisogno di tassolo a livello mondiale è molto elevato (negli<br />
USA si aggira tra i 100 e 200 Kg l’anno). Per ottenerne un solo<br />
grammo occorre decorticare 3 alberi vecchi di 100 anni (che poi<br />
muoiono).<br />
Il tassolo è un antimitotico; si lega ai microtubuli, promuovendo il<br />
loro assemblaggio dalla tubulina e impedendone la<br />
depolimerizzazione durante la divisione cellulare.<br />
I gruppi funzionali responsabili <strong>del</strong>l’attività sono l’anello ossietanico<br />
e la catena laterale esterea
Le giberelline sono un gruppo di ormoni <strong>del</strong>la<br />
crescita nelle piante superiori. Sono presenti<br />
soprattutto nei semi, ma in tracce anche in altri tessuti<br />
vegetali, spesso in forma coniugata di glicosidi.<br />
In Giappone era nota una malattia che faceva crescere in altezza le piante di riso e che ne impediva la<br />
produzione di semi ( la malattia <strong>del</strong>la" Piantina sciocca“).<br />
I patologi vegetali scoprirono che l'altezza <strong>del</strong>le piante era dovuta alla secrezione chimica di un fungo che<br />
infettava le piante alte. Il composto responsabile fu isolato da filtrati di coltura <strong>del</strong> fungo e gli venne dato il nome<br />
di gibberellina, dal nome <strong>del</strong> fungo Gibberella fujikuroi.
H<br />
GGPP<br />
H<br />
OPP<br />
OPP<br />
protonazione <strong>del</strong> doppio legame con formazione di un carbocatione terziario<br />
ciclizzazioni concertate<br />
reazioni ossidative<br />
HOOC<br />
H<br />
H<br />
H<br />
H<br />
copalil PP<br />
H<br />
ent-kaurene<br />
H<br />
OH<br />
acido ent-7-idrossikaurenoico<br />
perdita <strong>del</strong> difosfato e formazione <strong>del</strong> catione allilico<br />
ciclizzazione per attacco <strong>del</strong> doppio legame al catione<br />
H<br />
H<br />
H<br />
shift 1,2 di alchile<br />
eliminazione <strong>del</strong> protone e formazione <strong>del</strong>l'alchene<br />
H<br />
H<br />
HO<br />
OC<br />
O<br />
H<br />
H<br />
H<br />
COOH<br />
H<br />
OH<br />
acido giberellico, GA 3<br />
H<br />
ciclizzazione per attacco <strong>del</strong><br />
doppio legame al catione
Il ginkgo è dato dalle foglie di Ginkgo biloba, pianta considerata un fossile vivente<br />
Estratti per uso farmacologico:<br />
24% glicosidi flavonoidici<br />
6% lattoni terpenoidici<br />
copalil PP<br />
La presenza di tali costituenti fa <strong>del</strong>la droga un rimedio contro le malattie cerebrovascolari e la demenza senile.<br />
Azione: migliora la circolazione periferica e cerebrovascolare<br />
?<br />
Foglie essiccate<br />
0,1-0,25% lattoni terpenici<br />
I ginkgolidi diterpenici sono presenti nella droga<br />
(foglie essiccate) con flavonoli (quercetina e<br />
kaempferolo).<br />
- azione antagonista verso il PAF (Platelet Activating Factor), mediatore intracellulare nei processi di<br />
aggregazione piastrinica, formazione di trombo, reazioni infiammatorie;<br />
- azione di regolazione sulla circolazione e di opposizione ai radicali liberi rallentando i fenomeni di ossidazione, e<br />
contrastando gli effetti <strong>del</strong>lo stress fisico e mentale
squalene<br />
sintasi<br />
FPP<br />
H<br />
H<br />
H<br />
PPO<br />
H<br />
OPP<br />
OPP<br />
presqualene PP<br />
NADPH<br />
neutralizzazione carbocatione ad opera di idruro<br />
FPP<br />
addizione elettrofila<br />
eliminazione difosfato e<br />
formazione di un carbocatione 1°<br />
squalene<br />
H<br />
H<br />
H<br />
triterpeni<br />
eliminazione protone e formazione<br />
<strong>del</strong>l’anello ciclopropanico<br />
sintesi alchene e carbocatione allilico<br />
shift 1,2 di alchile<br />
Formazione di un anello<br />
ciclobutanico e carbocatione 2°
La struttura tetraciclica si forma con una sequenza concertata di ciclizzazioni, mediate da carbocationi<br />
protonazione epossido ed<br />
apertura <strong>del</strong>l’anello<br />
addizione elettrofila<br />
addizione elettrofila<br />
addizione elettrofila<br />
addizione elettrofila
La stereochimica nel catione protosterile è controllata dal tipo di ripiegamento che la molecola<br />
assume sulla superficie <strong>del</strong>l’enzima.
Nel sistema anulare i gruppi che migrano sono posti in trans l’uno rispetto all’altro ossia un gruppo entra mentre<br />
l’altro esce dalla parte opposta <strong>del</strong>lo stereocentro. Questo provoca un’inversione <strong>del</strong>la configurazione ad ogni<br />
centro interessato. Poiché non c’è nessun gruppo trans a migrare sul C-9, la reazione termina con la perdita <strong>del</strong><br />
protone H-9.
Nel caso in cui il protone H-9 non è perso, esso migra sul carbonio C-8<br />
dando origine ad un intermedio carbocationico al C-9 che è, a sua<br />
volta, neutralizzato per perdita di un protone dal metile C-10 e<br />
formazione di un anello ciclopropanico
HO<br />
H<br />
shift 1,2 di un alchile<br />
HO<br />
H<br />
H<br />
H<br />
catione dammaranile<br />
H<br />
H<br />
H<br />
catione baccarenile<br />
H 2O<br />
HO<br />
HO<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
OH<br />
H<br />
dammarenedioli<br />
H<br />
catione lupenile<br />
- H<br />
HO<br />
resina Dammar<br />
famiglia Dipterocarpaceae<br />
H<br />
H<br />
H<br />
lupeolo<br />
da Lupinus luteus, Leguminosae<br />
H
HO<br />
HO<br />
H<br />
H<br />
H<br />
catione lupenile<br />
H<br />
H<br />
H<br />
taraxasterolo<br />
H<br />
H<br />
espansione d'anello<br />
- H<br />
HO<br />
HO<br />
H<br />
H<br />
H<br />
H<br />
catione oleanile<br />
H<br />
H<br />
H H<br />
H<br />
H<br />
shift 1,2 di metile<br />
H<br />
H<br />
H<br />
catione taraxasterile<br />
due shift 1,2 di idruro<br />
tre<br />
- H +<br />
HO<br />
shift 1,2 di idruro<br />
- H +<br />
HO<br />
H<br />
H<br />
H<br />
-amirina<br />
H<br />
H<br />
H<br />
-amirina
HO<br />
3<br />
24<br />
1<br />
18<br />
11<br />
13<br />
25 26<br />
9 14<br />
10<br />
A B<br />
5<br />
7<br />
27<br />
19<br />
17<br />
scheletro pentaciclico triterpenoidico<br />
30<br />
D<br />
E<br />
16<br />
29<br />
21<br />
22<br />
28<br />
Saponine<br />
Glicosidi che anche a concentrazioni basse<br />
inducono la formazione di schiuma in<br />
soluzione acquosa, poiché hanno proprietà<br />
tensioattive e sono simili ai saponi.<br />
piante usate per il<br />
lavaggio <strong>del</strong> bucato<br />
HO<br />
Uomo: dopo somministrazione orale sono<br />
assorbite dall’intestino solo in piccola quantità,<br />
non tossica.<br />
emolisi degli eritrociti<br />
H<br />
H<br />
animali: disturbi digestivi per ruminanti; tossiche<br />
per insetti e molluschi<br />
HO<br />
23<br />
siti di ossidazione <strong>del</strong>la -amirina<br />
H<br />
H<br />
CHO<br />
11<br />
H<br />
acido quillaico<br />
COOH<br />
OH<br />
H<br />
30<br />
16<br />
28<br />
aglicone saponinico<br />
(sapogenina) da Quillaja
Saponine triterpeniche<br />
Irritazione <strong>del</strong>la mucosa gastrica che per azione riflessa<br />
determina un aumento <strong>del</strong>la secrezione bronchiale.<br />
attività espettorante<br />
In piccole quantità stimolano la secrezione di muco<br />
bronchiale fluido facilitando l’espettorazione e la<br />
prevenzione <strong>del</strong>la tosse.<br />
A contatto con il muco, essendo capaci di abbassare<br />
la tensione superficiale, rendono questo più fluido e<br />
facilmente eliminabile.
HOOC<br />
HO<br />
HO<br />
HOOC<br />
HO HO<br />
Droga costituita dalle<br />
radici o dagli stoloni<br />
acido D-glucuronico<br />
O<br />
OH<br />
O<br />
O<br />
O<br />
O<br />
H<br />
H<br />
CHO<br />
acido glicirrizico<br />
~ 150 volte più dolce <strong>del</strong> saccarosio<br />
HOOC<br />
Liquirizia (Glycyrrhiza glabra)<br />
H<br />
acido glicirretico<br />
GlcO<br />
O<br />
O<br />
liquiritina<br />
OH<br />
GlcO<br />
Recenti studi hanno dimostrato che l’acido<br />
glicirretinico inibisce a livello gastrico la 15-idrossi<br />
prostaglandindeidrogenasi e l’enzima 11--<br />
idrossisteroidodeidrogenasi, consentendo un<br />
accumulo di prostanoidi citoprotettivi.<br />
OH<br />
O<br />
isoliquiritina<br />
Se assunta in elevate quantità e per un periodo lungo può modificare il metabolismo dei<br />
carboidrati e dei minerali; provoca inoltre ritenzione di acqua, per il suo effetto antidiuretico,<br />
ipopotassiemia ed ipertensione.<br />
È usata come aromatizzante e in campo alimentare e in<br />
campo farmaceutico. Per le sue proprietà tensioattive può<br />
facilitare l’assorbimento di farmaci scarsamente assorbiti come<br />
gli antrachinoni. Possiede proprietà espettoranti, emollienti ed<br />
antiflogistiche.<br />
OH
Ginseng (Panax ginseng)<br />
droga = radici<br />
adattogeno – aiuta l’organismo<br />
ad adattarsi allo stress,<br />
migliorando il vigore e il grado di<br />
concentrazione ed esplicando<br />
un effetto ricostituente.<br />
Stimola la fagocitosi <strong>del</strong> sistema<br />
reticoloendoteliale e la<br />
produzione di anticorpi<br />
migliorando le funzioni<br />
immunitarie.<br />
Ai ginsesosidi sono ascrivibili<br />
proprietà nootrope: migliora la<br />
memoria e i processi di<br />
apprendimento.<br />
Hanno effetto free radical<br />
scavengers.<br />
HO<br />
HO<br />
3<br />
H<br />
H<br />
H<br />
H<br />
OH<br />
OH<br />
H<br />
panaxadiolo<br />
6<br />
20<br />
OH<br />
H<br />
panaxatriolo<br />
O<br />
O<br />
H<br />
H<br />
R 1O<br />
H<br />
H<br />
OH<br />
H<br />
ginsenosidi<br />
ginsenoside R b-1<br />
ginsenoside R b-2<br />
ginsenoside R c<br />
ginsenoside R d<br />
HO<br />
H<br />
H<br />
OR 1<br />
R 1<br />
OR 2<br />
H<br />
Glc1-2Glc-<br />
Glc1-2Glc-<br />
Glc1-2Glc-<br />
Glc1-2Glc-<br />
OH<br />
H<br />
ginsenosidi<br />
ginsenoside R e<br />
ginsenoside R f<br />
ginsenoside R g-1<br />
ginsenoside R g-2<br />
OR2<br />
H<br />
R 2<br />
Rha1-2Glc-<br />
Glc1-2Glc-<br />
Glc<br />
Rha1-2Glc-<br />
-Glc1-6Glc<br />
-Ara p1-6Glc<br />
-Ara f1-6Glc<br />
Glc<br />
R 1 R2<br />
Glc<br />
H<br />
Glc<br />
H
iancospino (Crataegus laevigata)<br />
CH3<br />
HO<br />
H<br />
H3C CH3 H3C<br />
CH3<br />
acido ursolico<br />
CH 3<br />
CH 3<br />
COOH<br />
Il fitocomplesso ottenuto da biancospino è utile nelle fasi iniziali <strong>del</strong>l’insufficienza coronarica e<br />
nelle cardiopatie associate alla senilità.<br />
L’acido ursolico ha azione coronodilatatrice. I flavonoidi modulano il movimento <strong>del</strong> calcio<br />
intracellulare e le procianidine hanno un’azione protettiva sull’endotelio vascolare, per la loro<br />
attività antiossidante.<br />
fiori e frutti<br />
HO O<br />
OH<br />
O<br />
HO O<br />
Nel complesso ne deriva un’azione inotropa positiva, senza aumento <strong>del</strong> consumo di ossigeno<br />
da parte <strong>del</strong> muscolo cardiaco, associata ad un’azione cronotropa negativa.<br />
OH<br />
OH<br />
OH<br />
OH<br />
OH<br />
quercetina epicatechina<br />
OH<br />
OH
squalene sintasi<br />
GGPP<br />
H<br />
PPO<br />
addizione elettrof ila<br />
H<br />
H<br />
H<br />
H<br />
prefitene PP<br />
OPP<br />
OPP<br />
shif t 1,2 di un alchile<br />
H H<br />
GGPP<br />
H<br />
H<br />
tetraterpeni<br />
eliminazione <strong>del</strong> protone e f ormazione di un anello ciclopropanico<br />
eliminazione <strong>del</strong> dif osf ato e formazione di un catione primario<br />
scissione <strong>del</strong> legame<br />
f ormazione <strong>del</strong>l'alchene e <strong>del</strong> catione allilico
H<br />
l'eliminazione <strong>del</strong> protone<br />
por ta alla f or mazione <strong>del</strong>l'alchene<br />
ciclizzazione possibile → doppio legame<br />
non coniugato presente alle due<br />
estremità <strong>del</strong>la molecola<br />
H<br />
Z-fitene<br />
licopene<br />
Il sistema trienico previene ogni ciclizzazione<br />
sequenza di reazioni di isomer izzazione<br />
nelle piante e nei f unghi è isomerizzato anche<br />
il doppio legame centrale da Z ad E<br />
configurazione tutto-trans
HO<br />
O<br />
-carotene<br />
-carotene<br />
zeaxantina<br />
violaxantina<br />
-carotene<br />
O<br />
OH<br />
L’esteso sistema di elettroni <br />
conferisce il colore ai carotenoidi e<br />
contribuisce alla pigmentazione di<br />
colore giallo, arancio e rosso nei tessuti<br />
<strong>del</strong>le piante.<br />
pigmenti accessori nella fotosintesi<br />
fotoprotezione
scissione centrale con formazione di<br />
due molecole di retinale<br />
retinale retinale<br />
retinolo retinolo<br />
(vitamina (vitamina A1) A1)<br />
OO<br />
OH OH<br />
aa bb<br />
carotene carotene<br />
aa bb<br />
scissione acentrica con formazione<br />
di una molecola di retinale<br />
accorciamento ossidativo <strong>del</strong>la catena<br />
Insaturazione che estende la coniugazione<br />
COOH COOH<br />
MeO<br />
acido retinoico acitretina<br />
deidroretinolo<br />
deidroretinolo<br />
(vitamina (vitamina A2) A2)<br />
OH OH<br />
OO<br />
Derivati sintetici utili nella cura di acne<br />
vulgaris, eczema e psoriasi. Agiscono<br />
riducendo il livelli di deidroretinolo e<br />
modificando la cheratinizzazione <strong>del</strong>la<br />
cute.
metaboliti dei carotenoidi…vitamine <strong>del</strong> gruppo A<br />
isomerizzazione<br />
enzimatica trans-cis<br />
retinolo<br />
(vitamina A 1)<br />
retinale<br />
11-cis-retinale<br />
NADP +<br />
E<br />
11 Z<br />
H O<br />
OH<br />
O<br />
Liposolubile<br />
Idrolisi <strong>del</strong>la base di Schiff<br />
H<br />
H2N<br />
opsina<br />
Deficienza: disturbi <strong>del</strong>la visione<br />
Eccesso: tossicità (perdita di capelli, emicrania,<br />
annebbiamento <strong>del</strong>la vista).<br />
rodopsina<br />
formazione di una base di Schiff con il<br />
gruppo amminico <strong>del</strong>la opsina<br />
H N H<br />
H<br />
N H<br />
opsina<br />
opsina<br />
l’assorbimento di luce ripristina la configurazione<br />
trans <strong>del</strong> doppio legame 11,12
steroidi<br />
composti naturali con struttura chimica da un nucleo<br />
ciclopentanoperidrofenantrene comprendente 3 anelli<br />
cicloesanici (A, B, C) fusi nell’arrangiamento non lineare e un<br />
anello ciclopentanico (D)<br />
fenantrene peridrofenantrene<br />
zoosteroli<br />
fitosteroli<br />
micosteroli<br />
asterosteroli<br />
steroli<br />
acidi biliari<br />
origine funzione<br />
ormoni surrenalici e sessuali<br />
glicosidi cardioattivi<br />
A<br />
B<br />
C<br />
D
La nomenclatura degli steroidi è basata su una serie di idrocarburi capostipiti<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
ESTRANO<br />
H<br />
H<br />
H<br />
H<br />
COLESTANO<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
ANDROSTRANO<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
PREGNANO<br />
H<br />
H<br />
H<br />
H<br />
COLANO<br />
H<br />
H<br />
ERGOSTANO CAMPESTANO<br />
STIGMASTANO PORIFERASTANO LANOSTANO CICLOARTANO<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H
Lo scheletro degli steroidi mostra quattro anelli fusi secondo una stereochimica particolare. Tutti e<br />
tre gli anelli a sei termini possono adottare la conformazione a sedia esente da tensione.<br />
tr ans<br />
cis<br />
HO<br />
HO<br />
2<br />
3<br />
1<br />
10<br />
5<br />
H<br />
H<br />
H<br />
H<br />
R<br />
Steroide trans A, B<br />
H<br />
11<br />
9<br />
H<br />
12<br />
H<br />
H<br />
Steroide cis A, B<br />
7<br />
17<br />
R<br />
15<br />
H<br />
19<br />
H<br />
5<br />
CH 3<br />
CH 3<br />
H<br />
appiattimento <strong>del</strong>la molecola<br />
H<br />
H<br />
H<br />
CH 3<br />
CH 3<br />
R<br />
R<br />
H<br />
H<br />
Gli steroidi possono presentare la fusione<br />
cis degli anelli A e B oppure quella trans.<br />
La sostituzione equatoriale è generalmente favorita per ragioni di ordine sterico<br />
5-steroidi<br />
5-steroidi
modificazione <strong>del</strong> numero di atomi di carbonio <strong>del</strong>lo scheletro<br />
Steroli = composti tetraciclici con una catena laterale di almeno otto carboni<br />
Steroidi = la catena laterale è stata parzialmente o totalmente degradata
Nei vertebrati il lanosterolo è<br />
convertito in colesterolo,<br />
precursore di numerosi steroidi.<br />
Demetilazione in C14 e C4: il processo di demetilazione in C4 avviene attraverso l’azione di una<br />
ossidasi che trasforma il metile in posizione in acido carbossilico (→ → decarbossilazione)<br />
4<br />
HO HO<br />
HOOC<br />
HO<br />
HO<br />
lanosterolo<br />
NAD +<br />
NADPH<br />
O<br />
O<br />
il meccanismo si ripete permettendo<br />
l'eliminazione <strong>del</strong> metile inizialmente in <br />
O<br />
O H<br />
+ H<br />
HO<br />
O<br />
O<br />
H<br />
H<br />
H<br />
colesterolo
Demetilazione in C14 e C4: il processo di demetilazione in C14 non avviene per<br />
decarbossilazione<br />
14<br />
15
Riduzione <strong>del</strong> D 24 : Una reduttasi NADPH dipendente opera l’addizione di idrogeno. In realtà un<br />
idruro dal NADPH si addiziona al C-25 mentre il protone H-24 viene dall’acqua.<br />
9<br />
5 B<br />
H 6<br />
H<br />
H<br />
H<br />
O<br />
H<br />
24<br />
H<br />
25<br />
H<br />
Isomerizzazione <strong>del</strong> D 8 a D 5 : molto probabilmente avviene come ultimo stadio<br />
isomerizzazione allilica<br />
H<br />
9<br />
5 H<br />
H 6<br />
D 8 D 7<br />
NADP<br />
H H<br />
25<br />
24<br />
deidrogenazione<br />
9<br />
5 H<br />
H H<br />
I protoni addizionati al C-9 e al C-8 provengono dall’acqua, al C-7 dal NADPH<br />
H<br />
6<br />
H<br />
H<br />
idrogenazione<br />
NADPH<br />
D 5,7 D 5<br />
5<br />
9<br />
6<br />
H<br />
H<br />
H
Il colesterolo è il principale sterolo animale<br />
HO<br />
H<br />
H<br />
5-colesten-3-olo<br />
H<br />
colesterolo<br />
Il livello di colesterolo nel sangue umano è in relazione<br />
all’insorgenza di malattie cardiovascolari.<br />
Il deposito di colesterolo, esteri <strong>del</strong> colesterolo ed altri lipidi lungo le pareti arteriose causa<br />
aterosclerosi, un indurimento ed un restringimento <strong>del</strong>le arterie che costituisce un aumento<br />
<strong>del</strong> rischio di formazione di coaguli di sangue e, quindi, di trombosi.<br />
evitare cibi ricchi di colesterolo es uova<br />
ridurre cibi ricchi in grassi animali<br />
uomo 70 kg ~ 140 mg colesterolo<br />
costituente <strong>del</strong>le membrane cellulari<br />
Tutte le cellule di mammifero sintetizzano colesterolo; il<br />
fegato ne sintetizza più <strong>del</strong>l’80%.<br />
La biosintesi <strong>del</strong> colesterolo è inibita mediante utilizzo di statine, inibitori specifici <strong>del</strong>la via<br />
<strong>biogenetica</strong> <strong>del</strong> <strong>mevalonato</strong>
HO<br />
Acidi Biliari<br />
Sono acidi steroidei a 24 atomi di carbonio che si trovano in forma di sali nella bile e<br />
nell’intestino per emulsionare i grassi e facilitare la digestione. Questi agiscono come detergenti<br />
in virtù <strong>del</strong> loro nucleo steroideo, relativamente poco polare, e <strong>del</strong>la catena laterale polare<br />
che contiene una funzione carbossilica generalmente legata ad una glicina o a una taurina.<br />
<br />
3<br />
Gli acidi biliari sono presenti nella bile di mammiferi<br />
- solubilizzano il colesterolo nella bile;<br />
- facilitano l’assorbimento dei grassi <strong>del</strong>la dieta.<br />
10<br />
H<br />
5<br />
H<br />
H<br />
OH<br />
acido ursodeossicolico<br />
7<br />
H<br />
H<br />
H<br />
COLANO<br />
Il fegato sintetizza più <strong>del</strong>l’80% di colesterolo che trasforma in acidi biliari.<br />
COOH<br />
HO<br />
H<br />
12<br />
O COOH<br />
OH<br />
H<br />
H<br />
O<br />
acido deidrocolico<br />
giunzione cis<br />
H<br />
HO OH<br />
H<br />
acidocolico<br />
COOH
Questi composti si formano nel fegato a partire dal colesterolo attraverso una catena ossidativa<br />
che elimina dalla catena laterale tre atomi di carbonio.<br />
I sali biliari possono poi essere riassorbiti ed immagazzinati nella cistifellea, oppure essere escreti<br />
dal corpo. Questa è la principale via di eliminazione <strong>del</strong> colesterolo in eccesso.<br />
HO<br />
CH 3<br />
H<br />
OH<br />
H<br />
H<br />
Glicocolato sodico<br />
C<br />
H 3<br />
CH 3<br />
H<br />
OH<br />
H<br />
HO<br />
O<br />
NH<br />
CH 3<br />
H<br />
H<br />
CO 2 Na<br />
OH<br />
H<br />
C<br />
H 3<br />
CH 3<br />
H<br />
OH<br />
L’incapacità di rimuovere il colesterolo attraverso gli acidi biliari e la loro escrezione è uno dei<br />
fattori che contribuiscono all’insorgenza di patologie come l’aterosclerosi e la calcolosi biliare.<br />
H<br />
l’acido colico viene trovato come glicolato<br />
di sodio e taurocolato di sodio<br />
O<br />
NH<br />
taurocolato sodico<br />
SO 3 Na
HO HO<br />
lanosterolo<br />
demetilazione<br />
desmosterolo<br />
trasposizione <strong>del</strong> doppio legame endociclico<br />
presenza di un numero di carboni superiore a 27<br />
i carboni in catena laterale non<br />
hanno origine isoprenica,<br />
derivano dalla SAM<br />
HO<br />
HO<br />
SAM<br />
H<br />
H<br />
fitosteroli
fitosteroli<br />
insaturazione al C-22 mai riscontrata in animali<br />
piante<br />
HO<br />
olio di semi di soia<br />
HO<br />
funghi<br />
stigmasterolo<br />
ergosterolo<br />
HO<br />
HO<br />
analogo 24 etil <strong>del</strong> colesterolo<br />
piante<br />
-sitosterolo<br />
campesterolo<br />
piante<br />
HO<br />
HO<br />
alghe brune<br />
fucosterolo<br />
24-metilenelofenolo<br />
analogo 24 metil <strong>del</strong> colesterolo<br />
E
Ormoni sessuali<br />
Il testosterone e l’androsterone sono gli ormoni sessuali maschili più importanti (androgeni).<br />
Sintetizzati nel testicolo dal colesterolo.<br />
O<br />
H<br />
H<br />
H<br />
testosterone<br />
OH<br />
effetto protidoanabolico<br />
HO<br />
H<br />
H<br />
H<br />
androsterone<br />
O scheletro <strong>del</strong>l’androstano<br />
mancanza di catena laterale in C-17<br />
1. Nelle prime fasi <strong>del</strong>la vita embrionale gli androgeni indirizzano<br />
le strutture genitali in senso maschile;<br />
2. In età puberale determinano la crescita <strong>del</strong>l’apparato<br />
genitale; successivamente ne assicurano la funzionalità<br />
spermatogenesi e mascolinizzazione dei caratteri secondari
O<br />
H<br />
H<br />
H<br />
testosterone<br />
OH<br />
O O<br />
La trasformazione <strong>del</strong> testosterone in estrogeni<br />
è legata all’aromatizzazione <strong>del</strong>l’anello A<br />
COOH<br />
aromatasi<br />
HO<br />
H<br />
O HO<br />
H<br />
estradiolo<br />
H<br />
OH
estrogeni<br />
nel 1935 da ovaie di scrofe<br />
L’estradiolo è il metabolita più importante farmacologicamente. Nelle urine si ritrovano solo livelli<br />
molto bassi , mentre consistenti sono i meno attivi estrone ed estriolo.<br />
L’estrone è stato isolato anche da semi di melograno e palma da dattero.<br />
In gravidanza i livelli aumentano di circa 50 volte<br />
bloccano l’ovulazione<br />
fu isolato nel 1929 dall’urina di una donna incinta<br />
contraccettivi nella terapia contro la carenza ormonale (disordini metruali)<br />
Integratori utili a bloccare la formazione di androgeni (cancro alla prostata)<br />
scheletro <strong>del</strong>l’estrano a 18 atomi di<br />
carbonio mancante <strong>del</strong> metile in C-10<br />
Sintetizzati nell’ovario dal testosterone.<br />
alcuni carcinomi (carcinoma alla mammella) hanno una crescita dipendente dalle riserve di estrogeni.
Progestinici (progestine o gestogeni)<br />
Ormoni sessuali utili alla preparazione utero all’impianto <strong>del</strong>l’uovo fertilizzato in gravidanza<br />
unico metabolita naturale<br />
scheletro <strong>del</strong> pregnano C21<br />
O<br />
H<br />
H<br />
H<br />
progesterone<br />
O<br />
O<br />
R1<br />
R 2<br />
H<br />
H<br />
HO<br />
H<br />
etisterone<br />
secreto dal corpo luteo in seguito al rilascio di un ovulo.<br />
durante la gravidanza, previene ulteriori ovulazioni e rilassa l’utero<br />
trattamento di disordini mestruali / contraccettivi.<br />
O<br />
H<br />
H<br />
H<br />
O<br />
OAc<br />
medrossiprogesterone acetato<br />
in assenza di gravidanza, la diminuzione dei livelli di progesterone causa cedimento<br />
<strong>del</strong>l’endometrio uterino e le mestruazioni
Ormoni adrenocorticali<br />
Gli ormoni <strong>del</strong>la corteccia surrenale o adrenocorticali sono secreti dai surreni, piccole ghiandole<br />
situate in prossimità <strong>del</strong>la porzione superiore dei reni.<br />
scheletro pregnanico C21 emiacetale<br />
mineralcorticoidi – controllano il turgore dei tessuti regolando<br />
l’equilibrio salino <strong>del</strong>le cellule – mantenimento <strong>del</strong> bilancio<br />
elettrolitico<br />
glucocorticoidi – partecipano alla regolazione <strong>del</strong> metabolismo <strong>del</strong><br />
glucosio (sintesi dei carboidrati e deposito di glicogeno nel fegato) e<br />
al controllo <strong>del</strong>l’infiammazione.<br />
OH<br />
inibizione <strong>del</strong>la fosfolipasi A 2<br />
O<br />
3<br />
11<br />
OH<br />
H<br />
H<br />
H<br />
20<br />
idrocortisone<br />
21<br />
O<br />
OH<br />
O<br />
O<br />
H<br />
H<br />
OH<br />
H<br />
aldosterone<br />
OH<br />
O
O<br />
O<br />
17-idrossiprogesterone<br />
progesterone<br />
17<br />
O 2<br />
NADPH<br />
O<br />
OH<br />
O<br />
O 2<br />
NADPH<br />
O 2<br />
NADPH<br />
O<br />
O<br />
HO<br />
21<br />
HO<br />
O<br />
OH<br />
21<br />
desossicorticosterone<br />
O 2<br />
NADPH<br />
O<br />
O<br />
O 2<br />
NADPH<br />
O<br />
HO<br />
11<br />
idrocortisone<br />
HO<br />
HO O<br />
HO<br />
corticosterone<br />
OH<br />
O<br />
O<br />
cortisone<br />
HO O<br />
HO<br />
CHO<br />
HO<br />
13<br />
O<br />
aldosterone<br />
O<br />
OH<br />
O
HO<br />
Ecdisoni – steroidi polari assunti dagli insetti con la dieta importanti<br />
nella loro muta consentendo lo sviluppo larvale e la metamorfosi.<br />
-sitosterolo<br />
HO<br />
7-deidrocolesterolo<br />
Biosintetizzati dagli insetti a partire da steroli<br />
comuni come sitosterolo<br />
Giunzione A/B cis;<br />
2 OH β, 14 OH ;<br />
Funzione D 7 -6-cheto.<br />
HO<br />
HO<br />
H<br />
H O<br />
OH<br />
R OH<br />
R = H, ecdisone<br />
R = OH, -ecdisone<br />
OH
Hanno proprietà biologiche simili alle saponine<br />
triterpenoidiche ma sono meno diffuse.<br />
Le sapogenine sono steroli a 27 atomi di carbonio<br />
La dioscina è stata isolata da<br />
specie di Dioscorea (patate<br />
dolci)<br />
HO<br />
O<br />
HO<br />
L-Rha<br />
OH<br />
HO<br />
O<br />
HO<br />
HO<br />
D-glc<br />
Saponine steroidee<br />
OH<br />
O<br />
O<br />
O<br />
OH<br />
O<br />
dioscina<br />
H<br />
H<br />
spirochetale al C-22<br />
H<br />
H<br />
H<br />
O<br />
O<br />
diosgenina<br />
La funzione spirochetalica è originata dalla catena laterale <strong>del</strong> colesterolo attraverso una<br />
serie di reazioni di ossigenazione<br />
3
O<br />
Glicosidi cardioattivi<br />
costituiti da una genina (aglicone) di natura steroidea<br />
legata in posizione 3 ad una catena saccaridica (da 1 a<br />
4 monosaccaridi) e in posizione 17 ad un anello lattonico<br />
a 5 o a 6 atomi di carbonio.<br />
17<br />
O<br />
O<br />
CARDENOLIDE<br />
Eterosidi che per idrolisi liberano la genina dalla componente gliconica<br />
H<br />
H<br />
H<br />
OH<br />
O<br />
17<br />
R<br />
O<br />
responsabile <strong>del</strong>l’azione farmacologica<br />
meno rappresentati nel<br />
regno vegetale, si ritrovano<br />
soprattutto nel veleno dei<br />
rospi <strong>del</strong> genere Bufo<br />
O<br />
O<br />
BUFADIENOLIDE<br />
influenzano caratteristiche<br />
farmacocinetiche quali<br />
l’assorbimento, l’emivita ed<br />
il metabolismo
Ai fini <strong>del</strong>l’attività biologica riveste una notevole importanza la stereochimica di questi composti:<br />
1. Giunzione cis fra gli anelli A/B e C/D;<br />
2. Orientamento degli ossidrili in posizione C3 e C14,<br />
3. Funzione lattonica ,-insatura in C-17;<br />
4. Presenza di una componente gliconica in C-3 che ha la funzione di aumentare la solubilità in<br />
acqua di questi composti e quindi la capacità di legarsi al muscolo cardiaco.<br />
Sono stati caratterizzati circa venti zuccheri<br />
differenti che, a parte il D-glucosio, sono costituiti<br />
da<br />
6-desossi-esosi e 2,6-dideossi-esosi.<br />
O<br />
H<br />
H<br />
H<br />
14<br />
OH<br />
O<br />
17<br />
R<br />
O
Glicosidi digitalici da foglie essiccate di Digitalis purpurea e lanata<br />
Digitalis purpurea<br />
HO HO<br />
OH<br />
- giunzione cis tra gli anelli A/B e C/D<br />
- gruppi -OH in C-3 e C-14 sono orientati<br />
- funzione lattonica ,-insatura in C-17<br />
O<br />
OH<br />
O<br />
OH<br />
O<br />
O<br />
OH<br />
O<br />
O<br />
R = H digitossina<br />
R = OH gitossina<br />
R = O 2CH gitalossina<br />
R = H purpureaglicoside A<br />
R = OH purpureaglicoside B<br />
R = O 2CH glucogitalossina<br />
OH<br />
O<br />
O<br />
H<br />
H<br />
H<br />
OH<br />
O<br />
16<br />
R<br />
O<br />
R = H digitossigenina<br />
R = OH gitossigenina<br />
R = O 2CH gitalossigenina
La catena laterale <strong>del</strong> colesterolo è degradata a gruppo acetilico<br />
HO<br />
O<br />
O<br />
H<br />
H H<br />
H<br />
H H<br />
H<br />
H<br />
O<br />
O 2<br />
NADPH<br />
NADPH<br />
ossidrilazione in C14<br />
inversione di configurazione<br />
H<br />
H OH<br />
O<br />
O<br />
H<br />
H H<br />
OH OH<br />
O<br />
O 2 NADPH<br />
ossidazione a stadi a carico dei carboni<br />
C22 e C20 e successiva rottura <strong>del</strong> legame<br />
ossidrilazione in C21<br />
O<br />
ossidazione/riduzione<br />
H<br />
H<br />
H OH<br />
OH<br />
O<br />
HO<br />
H OH<br />
O O<br />
H<br />
H H<br />
O
HOOC<br />
O<br />
O<br />
O<br />
O<br />
SCoA<br />
H<br />
H<br />
H OH<br />
H<br />
H<br />
H OH<br />
O<br />
bufalina<br />
OH<br />
O<br />
O<br />
O<br />
SCoA<br />
O<br />
H<br />
H<br />
H OH<br />
O<br />
digitossigenina<br />
La formazione <strong>del</strong> sistema lattonico, prevede l’addizione di una unità<br />
di acetilCoA o di una unità di ossalacetato probabilmente con un<br />
meccanismo di tipo addizione aldolica.<br />
O
inotropa positiva<br />
aumento <strong>del</strong>la forza di contrattilità durante i periodi di<br />
diminuita funzionalità ventricolare sinistra<br />
cronotropa negativa<br />
aumento <strong>del</strong>l’eccitabilità <strong>del</strong> miocardio<br />
dromotropa negativa<br />
diminuzione <strong>del</strong>la velocità di conduzione <strong>del</strong>l’impulso e<br />
conseguente aumento <strong>del</strong> periodo refrattario<br />
La digitale è tossica e si accumula facilmente; provoca gravi aritmie, vomito e dolori addominali.
HO HO<br />
OH<br />
O<br />
OH<br />
O<br />
OH<br />
O<br />
O<br />
OH<br />
O<br />
O<br />
R = H digitossina<br />
R = OH gitossina<br />
R = O 2CH gitalossina<br />
R = H purpureaglicoside A<br />
R = OH purpureaglicoside B<br />
R = O 2CH glucogitalossina<br />
OH<br />
O<br />
O<br />
H<br />
H<br />
H<br />
OH<br />
O<br />
R<br />
O<br />
R = H digitossigenina<br />
R = OH gitossigenina<br />
R = O 2CH gitalossigenina<br />
I glicosidi digitalici digitossina, gitossina e gitalossina si ottengono durante l’essiccamento per<br />
degradazione enzimatica di glicosidi primari.<br />
La concentrazione totale dei glicosidi secondari varia in rapporto alla specie di digitale usata<br />
e, dopo il raccolto, in base ai metodi di trattamento e conservazione.<br />
I glicosidi digitalici condividono effetti identici sul miocardio. Le differenze risiedono nella<br />
diversa emivita, durata d’azione e grado di assorbimento orale.
La digossina, unico agente nell’impiego clinico in larga scala, è un<br />
agente inotropo positivo<br />
Gli inotropi positivi sono quei<br />
farmaci che aumentano la<br />
contrattilità <strong>del</strong> miocardio durante i<br />
periodi di diminuita funzionalità<br />
ventricolare sinistra. Essi sono<br />
utilizzati quando la forza di<br />
contrazione cardiaca è ridotta ed il<br />
ventricolo sinistro non può espellere<br />
il sangue secondo le necessità<br />
metaboliche <strong>del</strong>l’organismo <br />
INSUFFICIENZA CARDIACA<br />
HO<br />
OH<br />
I glicosidi cardioattivi determinano un aumento <strong>del</strong>la contrattilità cardiaca aumentando la<br />
disponibilità di calcio intracellulare e la reattività di questo con le proteine contrattili<br />
O<br />
O<br />
OH<br />
inibizione <strong>del</strong>la pompa Na + /K +<br />
O<br />
O<br />
OH<br />
O<br />
O<br />
H<br />
H<br />
OH<br />
H<br />
OH<br />
O<br />
O
Glicosidi cardioattivi<br />
(Strophamtus spp.)<br />
HO<br />
HO<br />
Lo strofanto è una pianta arbustiva<br />
lianosa dai cui semi si estraggono le<br />
strofantine. Le tre principali strofantine<br />
hanno struttura di tipo cardenolidico.<br />
La droga è un cardiotonico di tipo<br />
digitalico ad azione pronta e fugace.<br />
OH<br />
O<br />
OH<br />
O<br />
D-Glc HO<br />
HO<br />
OH<br />
D-Glc<br />
strofantoside K<br />
HO<br />
O<br />
O<br />
OH<br />
O<br />
O<br />
O<br />
OMe<br />
D-cimarosio<br />
-strofantina K<br />
OH<br />
HO<br />
HO HO<br />
OH<br />
H<br />
H<br />
O<br />
cimarina<br />
OH<br />
O<br />
H<br />
O<br />
ouabaina<br />
(strofantina G)<br />
H<br />
H<br />
OH<br />
strofantina<br />
O<br />
R<br />
O
Glicosidi cardioattivi<br />
(Scilla maritima)<br />
Il bulbo è il solo responsabile<br />
<strong>del</strong>l'attività <strong>del</strong>la pianta. È piriforme, e<br />
può raggiungere anche i 30 cm di<br />
diametro ed il suo peso può<br />
raggiungere i 3 o 4 kg.<br />
La polvere <strong>del</strong>la droga è giallastra,<br />
inodore, di sapore acre ed amara,<br />
ed è caratterizzata soprattutto dalla<br />
presenza di ossalato di calcio<br />
Cardiotonico di tipo digitalico. Possiede inoltre<br />
azione diuretica ed espettorante<br />
OH<br />
H<br />
H<br />
OH<br />
HO O<br />
O<br />
O<br />
HO scillarenina<br />
OH HO<br />
OH<br />
HO<br />
HO<br />
OH<br />
O<br />
OH<br />
scillarenina A<br />
O<br />
HO<br />
OH<br />
glucoscilliroside<br />
O<br />
OH<br />
O<br />
proscillaridina A<br />
O<br />
scilliroside<br />
H<br />
OH<br />
OH<br />
O<br />
O<br />
OAc<br />
scillirosidina<br />
O<br />
O