J - Appunti esami Farmacia e CTF
J - Appunti esami Farmacia e CTF
J - Appunti esami Farmacia e CTF
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Metodi Fisici in Chimica Organica - NMR<br />
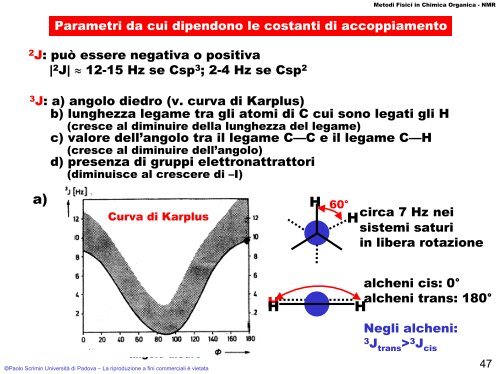
Parametri da cui dipendono le costanti di accoppiamento<br />
2 J: può essere negativa o positiva<br />
| 2 J| ≈ 12-15 Hz se Csp 3 ; 2-4 Hz se Csp 2<br />
3 J: a) angolo diedro (v. curva di Karplus)<br />
b) lunghezza legame tra gli atomi di C cui sono legati gli H<br />
(cresce al diminuire della lunghezza del legame)<br />
c) valore dell’angolo tra il legame C—C e il legame C—H<br />
(cresce al diminuire dell’angolo)<br />
d) presenza di gruppi elettronattrattori<br />
(diminuisce al crescere di –I)<br />
a)<br />
Curva di Karplus<br />
angolo diedro<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
H<br />
H<br />
60°<br />
circa 7 Hz nei<br />
H<br />
sistemi saturi<br />
in libera rotazione<br />
alcheni cis: 0°<br />
alcheni trans: 180°<br />
H<br />
Negli alcheni:<br />
3 Jtrans > 3 J cis<br />
47
Metodi Fisici in Chimica Organica - NMR<br />
4J: si osserva solo nei sistemi insaturi o nei sistemi saturi rigidi<br />
(non in rotazione) tra atomi separati da 4 legami disposti nello<br />
spazio a W o M; può essere negativa o positiva, il valore<br />
assoluto è 0-3 Hz<br />
4 Jcis<br />
4 Jtrans<br />
| 4 J trans | = 1,33 Hz<br />
| 4 J cis | = 1,75 Hz<br />
| 4 J trans | > | 4 J cis |<br />
5 J: raramente si osserva nei sistemi aromatici (H in para); 0-1 Hz<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
48
7,5 Hz è un tipico<br />
valore di una J tra<br />
protoni legati a due<br />
atomi di carbonio<br />
adiacenti in un sistema<br />
in libera rotazione<br />
Metodi Fisici in Chimica Organica - NMR<br />
Le linee tratteggiate rappresentano i chemical shifts dei due gruppi<br />
di protoni; la separazione tra le linee di ciascun multipletto misurata<br />
in Hz rappresenta la costante di accoppiamento; poichè il CH 3 e il<br />
CH 2 sono accoppiati fra di loro le costanti sono uguali come pure la<br />
distanza tra le linee in ambedue i multipletti<br />
49<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata
C 4H 6O 2 U=2<br />
non è indicato un singoletto<br />
a δ=12 di integrale 1H<br />
dq<br />
dq<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
dd<br />
Metodi Fisici in Chimica Organica - NMR<br />
50
C 4H 8Cl 2 U=0<br />
sestetto<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
t<br />
q<br />
d<br />
Metodi Fisici in Chimica Organica - NMR<br />
51
C 5H 9OCl U=1<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
t<br />
t<br />
q<br />
Metodi Fisici in Chimica Organica - NMR<br />
t<br />
52
C 3H 7NO 2 U=1<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
Metodi Fisici in Chimica Organica - NMR<br />
53
Spettri del primo e del secondo ordine<br />
Metodi Fisici in Chimica Organica - NMR<br />
La molteplicità dei segnali di gruppi di protoni dovuti all’accoppiamento<br />
con altri protoni ed illustrata nei due casi di pp. 41 e 42 è rispettata solo<br />
nel caso di sistemi del primo ordine.<br />
Un sistema di due gruppi di protoni che accoppiano fra di loro è del primo<br />
ordine se:<br />
∆ω<br />
J<br />
≥ 10 dove ∆ω rappresenta la differenza di frequenza di<br />
risonanza tra i due gruppi di protoni (misurata in Hz)<br />
e J è la costante di accoppiamento<br />
Nel caso in cui ∆ω/J
ω<br />
ω<br />
ω<br />
δ A<br />
δ A<br />
δ A<br />
δ A<br />
δ A<br />
δ A<br />
δ A<br />
δ A =<br />
δ B<br />
δ B<br />
δ B<br />
δ B<br />
δ B<br />
δ B<br />
δ B<br />
δ X<br />
Metodi Fisici in Chimica Organica - NMR<br />
Questa serie di spettri<br />
rappresenta che cosa si<br />
osserva quando l’accoppiamento<br />
tra due protoni passa da<br />
una situazione del 1° ordine<br />
(primo spettro in alto) ad una<br />
di secondo ordine. Dall’alto<br />
in basso si è variato il chemical<br />
shift dei due protoni mantenendo<br />
invariata la loro costante di<br />
accoppiamento. Nell’ultimo<br />
spettro i chemical shifts<br />
coincidono.<br />
Per convenzione i protoni<br />
del primo spettro (1° ordine)<br />
sono chiamati AX (due lettere<br />
lontane dell’alfabeto) mentre<br />
quelli degli spettri successivi<br />
(2° ordine) sono chiamati AB<br />
(due lettere vicine dell’alfabeto)<br />
I protoni dell’ultimo spettro<br />
avendo identico chemical shift<br />
sono chiamati A 2<br />
55
2° ordine<br />
AB<br />
1° ordine<br />
AX<br />
J J<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
J<br />
J<br />
Metodi Fisici in Chimica Organica - NMR<br />
Passando da uno spettro del<br />
1° ordine ad uno del 2° ordine<br />
le intensità delle linee di ciascun<br />
doppietto non sono più uguali.<br />
Le linee centrali crescono mentre<br />
quelle laterali calano.<br />
Inoltre il chemical shift di ciascun<br />
protone non è più al centro della<br />
coppia di righe ma si sposta verso<br />
quella più alta.<br />
La costante di accoppiamento<br />
rimane la distanza (in Hz) tra i<br />
due segnali<br />
Analogamente agli spettri del<br />
2° ordine che coinvolgono due<br />
protoni (AB) si potranno avere<br />
spettri che coinvolgono più<br />
protoni (ABC, A 2 B ecc..).<br />
Questi spettri sono molto più<br />
complicati da analizzare di uno<br />
spettro di tipo AB.<br />
56
Metodi Fisici in Chimica Organica - NMR<br />
In generale la notazione che usa le lettere dell’alfabeto per indicare i protoni<br />
porta alla seguente classificazione dei sistemi del PRIMO ORDINE nei quali<br />
un protone (A) accoppia con uno o più protoni (o altri nuclei come negli ultimi<br />
due esempi) con una (sistemi AX n ) o due (sistemi AX n M y ) costanti di<br />
accoppiamento<br />
s d t q dd<br />
td dt tt<br />
Possiamo ora estendere la notazione “alfabetica” per definire una coppia<br />
di protoni che non siano magneticamente equivalenti pur avendo lo stesso<br />
chemical shift (vuol dire cioè che non hanno la stessa costante di<br />
accoppiamento con tutti i nuclei con i quali accoppiano)<br />
X X<br />
X<br />
HA HA' HA HA' Questi sistemi vengono chiamati<br />
AA’BB’<br />
HB HB' HB HB' (X e Y sono due sostituenti<br />
qualsiasi)<br />
57<br />
Y
Metodi Fisici in Chimica Organica - NMR<br />
La parte vinilica dei protoni dello stirene è un sistema AMX<br />
con tre J: J AX , J AM e J MX<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
58
δ AA’<br />
δ AA’<br />
δ AA’<br />
δBB’ δAA’ δBB’ Metodi Fisici in Chimica Organica - NMR<br />
Un sistema del 2* ordine di tipo AA’BB’ è molto complicato ma è caratterizzato<br />
da un elemento di simmetria costituito dal piano ortogonale che taglia a metà<br />
il multipletto<br />
δ BB’<br />
In molti casi il sistema è “apparentemente” semplice in quanto si vedono<br />
solo 4 segnali più intensi (qui marcati con un pallino) che lo rendono simile<br />
ad un sistema AB 59<br />
δ BB’
C 8H 10O 2<br />
U=4<br />
Sistema AA’BB’<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
Metodi Fisici in Chimica Organica - NMR<br />
60
NMR e chiralità<br />
Metodi Fisici in Chimica Organica - NMR<br />
Per sostituzione di uno di questi due H<br />
con un gruppo diverso si ottengono due<br />
enantiomeri: i due H sono enantiotopici<br />
Per sostituzione di uno di questi due H<br />
con un gruppo diverso si ottengono due<br />
diastereoisomeri: i due H sono diastereotopici<br />
Due protoni (o gruppi di protoni) enantiotopici hanno lo stesso intorno<br />
magnetico (= stesso δ) mentre due protoni (o gruppi di protoni)<br />
diastereotopici hanno intorno magnetico diverso (e quindi δ diverso)<br />
Ovviamente in quest’ultimo caso può capitare che casualmente i due δ siano uguali 61
Metodi Fisici in Chimica Organica - NMR<br />
La conseguenza è che gli spettri NMR di due enantiomeri (in un<br />
solvente achirale) sono identici mentre gli spettri NMR di due<br />
diastereoisomeri sono diversi l’uno dall’altro: non si può quindi<br />
conoscere in questo modo qual’è l’eccesso enantiomerico di un<br />
composto chirale<br />
Per sapere se due protoni (o gruppi di protoni) sono enantiotopici<br />
o distereotopici basta verificare se esiste un elemento di simmetria<br />
che li trasforma uno nell’altro. Una molecola può avere un elemento di<br />
simmetria ciononostante presentare protoni diastereotopici.<br />
In una molecola chirale (priva di elementi di simmetria) tutte le<br />
coppie di protoni (o di gruppi di protoni) legate allo stesso atomo di<br />
carbonio sono diastereotopiche.<br />
La molecola<br />
H H<br />
H<br />
non possiede<br />
alcun elemento<br />
di simmetria (c’è<br />
CH3 OH<br />
un carbonio<br />
asimmetrico):<br />
i due H sono<br />
diastereotopici<br />
H<br />
H<br />
H<br />
CH 3<br />
Ar<br />
OH<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
H<br />
H 3C<br />
CH 3 CH 2<br />
H<br />
H H H<br />
Ar<br />
H H<br />
CH 3<br />
CH 3<br />
H<br />
La molecola<br />
possiede un<br />
piano di<br />
simmetria ma<br />
questo non<br />
converte i due H<br />
l’uno nell’altro<br />
(non esiste un<br />
piano di<br />
simmetria che<br />
biseca l’angolo<br />
formato da<br />
H—C---H) 62
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
protoni<br />
diastereotopici:<br />
hanno δ diverso<br />
e, ovviamente,<br />
si vede l’accoppiamento<br />
tra di<br />
loro<br />
sistema<br />
ABX 3<br />
d<br />
Metodi Fisici in Chimica Organica - NMR<br />
c<br />
63
Metodi Fisici in Chimica Organica - NMR<br />
Quali tra questi protoni sono enantiotopici e quali diastereotopici?<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
64
Metodi Fisici in Chimica Organica - NMR<br />
Come si può conoscere l’eccesso enantiomerico di una miscela<br />
di enantiomeri attraverso l’NMR?<br />
a) usando un solvente chirale<br />
b) aggiungendo alla soluzione un addittivo chirale che<br />
interagisca con il soluto (coppia ionica, legami ad H,<br />
reagente di shift –vedi più avanti-)<br />
c) trasformando gli enantiomeri in diastereoisomeri attraverso<br />
la formazione di un legame covalente con un reagente chirale<br />
H<br />
CH 3<br />
Cl<br />
racemo<br />
il metile sarà:<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
In un solvente achirale un doppietto<br />
in quanto non è possibile differenziare<br />
i due enantiomeri<br />
In un solvente chirale due doppietti,<br />
uno per ciascuno dei due enantiomeri<br />
(in quanto avranno chemical shift<br />
diverso)<br />
65
se il composto è racemo<br />
i due doppietti avranno<br />
lo stesso integrale (ee=0)<br />
H<br />
CH 3<br />
Cl<br />
(in solvente<br />
chirale)<br />
se il composto non è<br />
racemo i due doppietti<br />
avranno integrale diverso<br />
e l’eccesso enantiomerico<br />
può essere calcolato:<br />
differenza integrali<br />
ee% = x 100<br />
somma integrali<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
Metodi Fisici in Chimica Organica - NMR<br />
66
eagente di shift<br />
con quantità crescenti<br />
di reagente di shift<br />
senza reagente<br />
di shift<br />
Metodi Fisici in Chimica Organica - NMR<br />
Un reagente di shift è costituito da una molecola con un nucleo (in<br />
genere un metallo di transizione, un lantanide) che ha particolari<br />
proprietà dette paramagnetiche. Un nucleo paramagnetico<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
descherma i nuclei<br />
che gli sono vicini<br />
ma allarga anche<br />
il loro segnale in<br />
quanto ne altera i<br />
tempi di rilassamento.<br />
Va quindi usato<br />
in piccole quantità.<br />
Un reagente di shift<br />
chirale permette di<br />
separare i segnali di<br />
una coppia di<br />
enantiomeri e quindi<br />
di determinare<br />
l’eccesso enantiomerico.<br />
67
Metodi Fisici in Chimica Organica - NMR<br />
Esercizio sull’uso degli integrali nella determinazione del rapporto<br />
molare in miscele di composti.<br />
Supponiamo di avere una miscela di CHCl 3 e CH 2 Cl 2 : vogliamo<br />
conoscere la composizione molare mediante NMR<br />
10 mm<br />
7 6 5<br />
10 mm<br />
I due integrali sono uguali ma il<br />
cloroformio ha un solo protone<br />
mentre il diclorometano ne ha due!<br />
integrale di A/protoni A<br />
Rapporto molare=<br />
integrale di B/protoni B<br />
Nel nostro caso i due integrali misurano 10 mm; il rapporto è:<br />
10/1 : 10/2 cioè 2:1.<br />
Il cloroformio è il doppio del diclorometano<br />
©Paolo Scrimin Università di Padova – La riproduzione a fini commerciali è vietata<br />
68