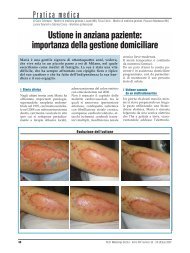
Contro il dolore acuto*.(1) - Passoni Editore
Contro il dolore acuto*.(1) - Passoni Editore
Contro il dolore acuto*.(1) - Passoni Editore
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
Depositato presso AIFA in data 22/10/2010<br />
(1)<br />
<strong>Contro</strong> <strong>il</strong> <strong>dolore</strong> acuto *.<br />
Brufen 600 mg<br />
Granulato effervescente ad azione rapida . (2)<br />
NUOVA CONFEZIONE<br />
E NUOVA BUSTINA<br />
* In caso di: emicrania e cefalea; <strong>dolore</strong><br />
post-estrazione e dopo interventi<br />
odontostomatologici; dismenorrea;<br />
traumatologia accidentale e sportiva.<br />
Bibliografia: 1. Brufen – Riassunto delle Caratteristiche del Prodotto. 2. Sharma NK, et al.<br />
Prim Dent Care 1994; 1(1): 5-8. 3. Gazzetta Ufficiale. Suppl. ord. n. 180 – Serie generale n. 188<br />
del 13/08/2010. Modificazione all’autorizzazione in commercio del medicinale Brufen.<br />
BUSTINA ANCORA PIÙ COMODA (3)
1. DENOMINAZIONE DEL MEDICINALE<br />
BRUFEN ® 400 mg Compresse rivestite. BRUFEN ® 600 mg Compresse rivestite. BRUFEN ® 600 mg Granulato effervescente.<br />
2. COMPOSIZIONE QUALITATIVA E QUANTITATIVA<br />
• BRUFEN 400 mg Compresse rivestite. Una compressa contiene: Principio attivo: Ibuprofene 400 mg. • BRUFEN 600 mg Compresse rivestite. Una compressa contiene: Principio attivo:<br />
Ibuprofene 600 mg. • BRUFEN 600 mg Granulato effervescente. Una bustina contiene: Principio attivo: Ibuprofene 600 mg.<br />
3. FORMA FARMACEUTICA<br />
Compresse rivestite, granulato effervescente.<br />
RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO<br />
4. INFORMAZIONI CLINICHE. 4.1 Indicazioni terapeutiche. Come antireumatico in: • osteoartrosi in tutte le sue localizzazioni (artrosi cervicale, dorsale, lombare; artrosi della spalla,<br />
dell’anca, del ginocchio; artrosi diffusa, ecc.), periartrite scapolo-omerale, lombalgie, sciatalgie, radicolo-nevriti; fibrositi, tenosinoviti, miositi, traumatologia sportiva; artrite reumatoide, morbo<br />
di St<strong>il</strong>l. Come analgesico in forme dolorose di diversa ezio logia: • nella traumatologia accidentale e sportiva; • nella pratica dentistica, nei dolori post-estrazione e dopo interventi odontostomatologici;<br />
• in ostetricia: nel <strong>dolore</strong> post-episiotomico e post-partum; • in ginecologia: nella prevenzione e nel trattamento della dismenorrea; • in chirurgia: nel trattamento del <strong>dolore</strong> post-operatorio;<br />
• in oculistica: nel <strong>dolore</strong> post-operatorio e nelle forme do lo rose di varia eziologia; • in medicina generale: nel trattamento di emicrania e cefalea. 4.2 Posologia e modo di somministrazione.<br />
• Compresse da 400 mg: 2-4 compresse al giorno a giudizio del medico. • Compresse e granulato da 600 mg: 1-3 compresse al giorno a giudizio del medico. La dose massima<br />
giornaliera di BRUFEN non deve superare 1800 mg. In reumatologia, per migliorare la rigidità mattutina, la prima dose orale viene somministrata al risveglio del paziente; le dosi successive possono<br />
essere assunte ai pasti. In presenza di insufficienza renale l’eliminazione può essere ridotta e la posologia va di conseguenza adeguata. Nel trattamento di pazienti anziani la posologia deve essere<br />
attentamente stab<strong>il</strong>ita dal medico che dovrà valutare un’eventuale riduzione dei dosaggi sopra indicati. Gli effetti indesiderati possono essere minimizzati con l’uso della più bassa dose efficace per la<br />
più breve durata possib<strong>il</strong>e di trattamento che occorre per controllare i sintomi (vedere sezione 4.4). 4.3 <strong>Contro</strong>indicazioni. Ipersensib<strong>il</strong>ità al principio attivo o ad uno qualsiasi degli eccipienti. Poliposi<br />
nasale, angioedema. Insufficienza epatica o renale grave. Come per altri farmaci antinfiammatori non steroidei è opportuno non somministrare <strong>il</strong> prodotto a pazienti portatori di ulcera peptica grave o<br />
in fase attiva. Storia di emorragia gastrointestinale o perforazione relativa a precedenti trattamenti attivi o storia di emorragia/ulcera peptica ricorrente (due o più episodi distinti di dimostrata ulcerazione<br />
o sanguinamento). Severa insufficienza cardiaca. Terzo trimestre di gravidanza. 4.4 Avvertenze speciali e precauzioni d’impiego. L’uso di BRUFEN deve essere evitato in concomitanza di<br />
FANS, inclusi inibitori selettivi della COX-2. Gli effetti indesiderati possono essere minimizzati con l’uso della più bassa dose efficace per la più breve durata possib<strong>il</strong>e di trattamento che occorre per<br />
controllare i sintomi (vedere sezione 4.2 e i paragrafi sottostanti sui rischi gastrointestinali e cardiovascolari). Come per altri FANS, ibuprofene può mascherare segni di infezione. Anziani. I pazienti<br />
anziani hanno un aumento della frequenza di reazioni avverse ai FANS, specialmente emorragie e perforazioni gastrointestinali, che possono essere fatali (vedere sezione 4.2). Emorragia gastrointestinale,<br />
ulcerazione e perforazione. Durante <strong>il</strong> trattamento con tutti i FANS, in qualsiasi momento, con o senza sintomi di preavviso o precedente storia di gravi eventi gastrointestinali, sono state riportate<br />
emorragia gastrointestinale, ulcerazione e perforazione, che possono essere fatali. Negli anziani e in pazienti con storia di ulcera, soprattutto se complicata da emorragia o perforazione (vedere<br />
sezione 4.3), <strong>il</strong> rischio di emorragia gastrointestinale, ulcerazione o perforazione è più alto con dosi aumentate di FANS. Questi pazienti devono iniziare <strong>il</strong> trattamento con la più bassa dose disponib<strong>il</strong>e.<br />
L’uso concomitante di agenti protettori (misoprostolo o inibitori della pompa protonica) deve essere considerato per questi pazienti e anche per pazienti che assumono basse dosi di aspirina o altri<br />
farmaci che possono aumentare <strong>il</strong> rischio di eventi gastrointestinali (vedere sezione 4.5). Pazienti con storia di tossicità gastrointestinale, in particolare anziani, devono riferire qualsiasi sintomo gastrointestinale<br />
inusuale (soprattutto emorragia gastrointestinale) in particolare nelle fasi iniziali del trattamento. Cautela deve essere prestata ai pazienti che assumono farmaci concomitanti che potrebbero<br />
aumentare <strong>il</strong> rischio di ulcerazione o emorragia, come corticosteroidi orali, anticoagulanti come warfarin, inibitori selettivi del reuptake della serotonina o agenti antiaggreganti piastrinici come l’aspirina<br />
(vedere sezione 4.5). Quando si verifica emorragia o ulcerazione gastrointestinale in pazienti che assumono BRUFEN <strong>il</strong> trattamento deve essere sospeso. I FANS devono essere somministrati con<br />
cautela nei pazienti con una storia di malattia gastrointestinale (colite ulcerosa, morbo di Crohn) poiché tali condizioni possono essere esacerbate (vedere sezione 4.8). Effetti cardiovascolari e cerebrovascolari.<br />
Un adeguato monitoraggio ed opportune istruzioni sono necessarie nei pazienti con anamnesi positiva per ipertensione e/o insufficienza cardiaca congestizia da lieve a moderata poiché,<br />
in associazione al trattamento con i FANS, sono stati riscontrati ritenzione di liquidi ed edema. Studi clinici e dati epidemiologici suggeriscono che l’uso di ibuprofene, specialmente ad alti dosaggi (2400<br />
mg/die) e per trattamenti di lunga durata, può essere associato ad un modesto aumento del rischio di eventi trombotici arteriosi (p. es. infarto del miocardio o ictus). In generale, gli studi epidemiologici<br />
non suggeriscono che basse dosi di ibuprofene (p. es. ≤1200 mg/die) siano associate ad un aumentato rischio di infarto del miocardio. I pazienti con ipertensione non controllata, insufficienza<br />
cardiaca congestizia, cardiopatia ischemica accertata, malattia arteriosa periferica e/o malattia cerebrovascolare devono essere trattati con ibuprofene soltanto dopo attenta considerazione. Analoghe<br />
considerazioni devono essere effettuate prima di iniziare un trattamento di lunga durata in pazienti con fattori di rischio per eventi cardiovascolari (p. es. ipertensione, iperlipidemia, diabete mellito,<br />
fumo). Effetti dermatologici. Gravi reazioni cutanee alcune delle quali fatali, includenti dermatite esfoliativa, sindrome di Stevens-Johnson e necrolisi tossica epidermica, sono state riportate molto<br />
raramente in associazione con l’uso dei FANS (vedere sezione 4.8). Nelle prime fasi della terapia i pazienti sembrano essere a più alto rischio: l’insorgenza della reazione si verifica nella maggior parte<br />
dei casi entro <strong>il</strong> primo mese di trattamento. BRUFEN deve essere interrotto alla prima comparsa di rash cutaneo, lesioni della mucosa o qualsiasi altro segno di ipersensib<strong>il</strong>ità. L’uso, specie se prolungato,<br />
di prodotti per applicazione topica può dare origine a fenomeni di sensib<strong>il</strong>izzazione; ove ciò accada, occorre interrompere <strong>il</strong> trattamento e istituire una terapia idonea. Così pure se si manifestano<br />
disturbi visivi, segni persistenti di disfunzione epatica o manifestazioni sistemiche quali eosinof<strong>il</strong>ia, rash, ecc. Effetti renali. Quando si inizia un trattamento con ibuprofene deve essere prestata cautela<br />
ai pazienti con una disidratazione considerevole. L’ut<strong>il</strong>izzo a lungo termine di ibuprofene, come con altri FANS, ha portato a necrosi pap<strong>il</strong>lare renale ed altri cambiamenti patologici renali. È stata riscontrata<br />
tossicità renale in pazienti nei quali le prostaglandine renali hanno un ruolo compensatorio nel mantenimento della perfusione renale. La somministrazione di FANS in questi pazienti può<br />
comportare una riduzione dose-dipendente nella formazione delle prostaglandine e, come effetto secondario, nel flusso sanguigno renale <strong>il</strong> quale può portare velocemente in scompenso renale. I<br />
pazienti più a rischio di queste reazioni sono quelli con ridotte funzionalità renali, scompenso cardiaco, disfunzioni epatiche, anziani e tutti quei pazienti che prendono diuretici e ACE inibitori. La discontinuità<br />
della terapia con FANS solitamente viene seguita dal recupero dello stato di pretrattamento. In caso di impiego prolungato sorvegliare la funzionalità renale particolarmente in caso di lupus eritematoso<br />
diffuso. Disturbi respiratori. BRUFEN deve essere prescritto con cautela in quei soggetti che hanno manifestato broncospasmo, dopo l’impiego di aspirina o altri FANS, nonché in soggetti<br />
con anamnesi di emorragia o ulcera gastrointestinale, scompenso cardiaco, ipertensione, difetti di coagulazione. Funzionalità cardiaca, renale ed epatica ridotta. Particolare cautela deve essere<br />
adottata nel trattamento di pazienti con funzionalità cardiaca, epatica o renale fortemente ridotta. In tali pazienti è opportuno ricorrere al monitoraggio periodico dei parametri clinici e di laboratorio,<br />
specialmente in caso di trattamento prolungato. Essendosi r<strong>il</strong>evate alterazioni oculari nel corso di studi su animali con farmaci antinfiammatori non steroidei, si raccomanda, in caso di trattamenti<br />
prolungati, di effettuare periodici controlli oftalmologici. L’uso di BRUFEN (compresse – granulato), come di qualsiasi farmaco inibitore della sintesi delle prostaglandine e della ciclo-ossigenasi, è<br />
sconsigliato nelle donne che intendano iniziare una gravidanza. La somministrazione di BRUFEN (compresse – granulato ) dovrebbe essere sospesa nelle donne che hanno problemi di fert<strong>il</strong>ità o che<br />
sono sottoposte a indagini sulla fert<strong>il</strong>ità. Effetti ematici. Ibuprofene, come altri FANS, può inibire l’aggregazione piastrinica e ha dato evidenza di prolungare <strong>il</strong> tempo di sanguinamento in soggetti<br />
sani. Meningite asettica. In rare occasioni in pazienti in trattamento con ibuprofene è stata osservata meningite asettica. Sebbene è più probab<strong>il</strong>e che possa succedere in pazienti con lupus<br />
eritematoso sistemico e patologie del tessuto connettivo collegate, è stato riscontrato in pazienti i quali non manifestavano patologie croniche concomitanti. BRUFEN compresse contiene lattosio.<br />
I pazienti affetti da rari problemi ereditari di intolleranza al galattosio, da deficit di lattasi o da malassorbimento di glucosio-galattosio non devono assumere questo medicinale. BRUFEN<br />
granulato contiene saccarosio. I pazienti affetti da rari problemi ereditari di intolleranza al fruttosio, da deficit di sucrasi-isomaltasi o da malassorbimento di glucosio-galattosio non devono assumere<br />
questo medicinale. 4.5 Interazioni con altri medicinali e altre forme di interazione. Il vastissimo impiego di ibuprofene in tutto <strong>il</strong> mondo non ha dato luogo a segnalazioni di effetti interattivi.<br />
Diuretici, ACE inibitori e antagonisti dell’angiotensina II: i FANS possono ridurre l’effetto dei diuretici e di altri farmaci antipertensivi. In alcuni pazienti con funzione renale compromessa (per<br />
esempio pazienti disidratati o pazienti anziani con funzione renale compromessa) la co-somministrazione di un ACE inibitore o di un antagonista dell’angiotensina II e di agenti che inibiscono <strong>il</strong> sistema<br />
della ciclo-ossigenasi può portare ad un ulteriore deterioramento della funzione renale, che comprende una possib<strong>il</strong>e insufficienza renale acuta, generalmente reversib<strong>il</strong>e. Queste interazioni<br />
devono essere considerate in pazienti che assumono BRUFEN in concomitanza con ACE inibitori o antagonisti dell’angiotensina II. Quindi, la combinazione deve essere somministrata con cautela,<br />
specialmente nei pazienti anziani. I pazienti devono essere adeguatamente idratati e deve essere preso in considerazione <strong>il</strong> monitoraggio della funzione renale dopo l’inizio della terapia concomitante.<br />
È comunque opportuno monitorare i pazienti in trattamento con cumarinici e non associare ibuprofene con aspirina o altri FANS. Dati sperimentali indicano che l’ibuprofene può inibire
gli effetti dell’acido acet<strong>il</strong>salic<strong>il</strong>ico a basse dosi sull’aggregazione piastrinica quando i farmaci sono somministrati in concomitanza. Tuttavia, l’esiguità dei dati e le incertezze relative alla loro applicazione<br />
alla situazione clinica non permettono di trarre delle conclusioni definitive per l’uso continuativo di ibuprofene; sembra che non vi siano effetti clinicamente r<strong>il</strong>evanti dall’uso occasionale dell’ibuprofene<br />
(vedere sezione 5.1). La contemporanea somministrazione di litio e FANS provoca aumento dei livelli plasmatici di litio. Metotrexato: i FANS possono diminuire l’eliminazione del metotrexato.<br />
Aminoglicosidi: i FANS possono diminuire l’escrezione degli aminoglicosidi. Glicosidi cardiaci: i FANS possono esacerbare lo scompenso cardiaco, ridurre <strong>il</strong> tasso della f<strong>il</strong>trazione glomerulare e aumentare<br />
i livelli dei glicosidi cardiaci. Ciclosporine: aumentano <strong>il</strong> rischio di nefrotossicità con i FANS. Inibitori della COX-2 e altri FANS: l’uso concomitante con altri FANS, incluso inibitori selettivi<br />
della ciclo-ossigenasi-2, deve essere evitato per potenziale effetto additivo. Estratti vegetali: Ginkgo B<strong>il</strong>oba può aumentare <strong>il</strong> rischio di sanguinamento in associazione a FANS. Mifepristone: i FANS<br />
non possono essere assunti per 8-12 giorni dopo la somministrazione di mifepristone poiché i FANS possono ridurne l’effetto. Antibiotici chinolonici: dati su animali indicano che i FANS possono<br />
aumentare <strong>il</strong> rischio di convulsioni associate con antibiotici chinolonici. I pazienti che prendono FANS e chinoloni possono avere un aumentato rischio di sv<strong>il</strong>uppare convulsioni. Tacrolimus: possib<strong>il</strong>e<br />
aumento del rischio di nefrotossicità quando i FANS vengono somministrati con tacrolimus. Zidovudina: aumento del rischio di tossicità ematica in caso di co-somministrazione con FANS. C’è evidenza<br />
di un aumento del rischio di emartrosi e di ematoma in pazienti emof<strong>il</strong>iaci affetti da HIV in contemporaneo trattamento con zidovudina ed altri FANS. Corticosteroidi: aumento del rischio di ulcerazione<br />
o emorragia gastrointestinale (vedere sezione 4.4). Anticoagulanti: i FANS possono aumentare gli effetti degli anticoagulanti, come <strong>il</strong> warfarin (vedere sezione 4.4). Agenti antiaggreganti e<br />
inibitori selettivi del reuptake della serotonina (SSRIs): aumento del rischio di emorragia gastrointestinale (vedere sezione 4.4). 4.6 Gravidanza e allattamento. Nelle donne in stato di gravidanza<br />
e durante l’allattamento <strong>il</strong> prodotto va somministrato solo nel caso di assoluta necessità, sotto diretto controllo medico. Gravidanza. L’inibizione della sintesi di prostaglandine può interessare negativamente<br />
la gravidanza e/o lo sv<strong>il</strong>uppo embrio/fetale. Risultati di studi epidemiologici suggeriscono un aumentato rischio di aborto e di malformazione cardiaca e di gastroschisi dopo l’uso di un inibitore<br />
della sintesi delle prostaglandine nelle prime fasi della gravidanza. Il rischio assoluto di malformazioni cardiache aumentava da meno dell’1% fino a circa l’1,5%. È stato ritenuto che <strong>il</strong> rischio aumenta<br />
con la dose e la durata della terapia. Negli animali, la somministrazione di inibitori della sintesi di prostaglandine ha mostrato di provocare un aumento della perdita di pre e post-impianto e di<br />
mortalità embrione-fetale. Inoltre, un aumento di incidenza di varie malformazioni, inclusa quella cardiovascolare, è stato riportato in animali a cui erano stati somministrati inibitori di sintesi<br />
delle prostaglandine, durante <strong>il</strong> periodo organogenetico. Durante <strong>il</strong> primo e <strong>il</strong> secondo trimestre di gravidanza, BRUFEN non deve essere somministrato se non in casi strettamente necessari. Se<br />
BRUFEN è usato da una donna in attesa di concepimento o durante <strong>il</strong> primo e secondo trimestre di gravidanza, la dose e la durata del trattamento devono essere mantenute le più basse possib<strong>il</strong>i.<br />
Durante <strong>il</strong> terzo trimestre di gravidanza, tutti gli inibitori della sintesi di prostaglandine possono esporre <strong>il</strong> feto a: • tossicità cardiopolmonare (con chiusura prematura del dotto arterioso e<br />
ipertensione polmonare); • disfunzione renale, che può progredire in insufficienza renale con oligo-idroamnios; la madre e <strong>il</strong> neonato, alla fine della gravidanza, a: • possib<strong>il</strong>e prolungamento del<br />
tempo di sanguinamento, ed effetto antiaggregante che può occorrere anche a dosi molto basse; • inibizione delle contrazioni uterine risultanti in ritardo o prolungamento del travaglio.<br />
Conseguentemente BRUFEN è controindicato durante <strong>il</strong> terzo trimestre di gravidanza. 4.7 Effetti sulla capacità di guidare veicoli e sull’uso di macchinari. Non interferisce sulla capacità<br />
di guidare veicoli e sull’uso di macchinari. 4.8 Effetti indesiderati. L’esteso impiego di ibuprofene ha evidenziato una limitata incidenza di effetti indesiderati. Le segnalazioni più frequenti sono<br />
state quelle relative a rash cutanei, usualmente risoltisi rapidamente con la cessazione della terapia. Sono stati segnalati inoltre casi di dispepsia e, in pazienti particolarmente sensib<strong>il</strong>i, isolati casi di<br />
enterorragia, ulcera gastroduodenale anche perforata, melena. Gastrointestinali: gli eventi avversi più comunemente osservati sono di natura gastrointestinale. Possono verificarsi ulcere peptiche,<br />
perforazione o emorragia gastrointestinale, a volte fatale, in particolare negli anziani (vedere sezione 4.4). Molto raramente sono state osservate pancreatiti. Dopo somministrazione di BRUFEN sono<br />
stati riportati: nausea, vomito, diarrea, flatulenza, costipazione, dispepsia, <strong>dolore</strong> addominale, melena, ematemesi, stomatiti ulcerative, esacerbazione di colite e morbo di Crohn (vedere sezione 4.4).<br />
Meno frequentemente sono state osservate gastriti. In associazione al trattamento con FANS sono stati riportati edema, ipertensione e insufficienza cardiaca. Studi clinici e dati epidemiologici suggeriscono<br />
che l’uso di ibuprofene, specialmente ad alti dosaggi (2400 mg/die) e per trattamenti di lunga durata, può essere associato ad un modesto aumento del rischio di eventi trombotici arteriosi (p.<br />
es. infarto del miocardio o ictus) (vedere sezione 4.4). Sono stati infine riportati: broncospasmo e alcuni casi di trombocitopenia, neutropenia, agranulocitosi aplastica, anemia emolitica, riduzione<br />
dell’emoglobina e dell’ematocrito, disturbi del SNC (depressione, confusione, vertigine, cefalea, tinnito, parestesia, sonnolenza, neurite ottica ecc.), nefropatia tossica in varie forme, incluso nefrite interstiziale,<br />
sindrome nefrotica, insufficienza renale in pazienti con funzionalità compromessa, insufficienza cardiaca congestizia, ipertensione, funzione epatica anormale, insufficienza epatica, epatite<br />
e ittero. Con alcuni antinfiammatori non steroidei ad uso topico cutaneo o transdermico, derivati dell’acido propionico, sono state segnalate reazioni avverse cutanee con eritema, prurito, irritazione,<br />
sensazione di calore o bruciore e dermatiti da contatto. Reazioni bollose includenti sindrome di Stevens-Johnson e necrolisi tossica epidermica (molto raramente). Sono possib<strong>il</strong>i reazioni di fotosensib<strong>il</strong>ità.<br />
4.9 Sovradosaggio. I sintomi più comuni sono: nausea, vomito, vertigine, convulsioni, perdita della coscienza e depressione del SNC e del sistema respiratorio. Meno frequentemente: cefalea,<br />
tinnito, depressione del sistema nervoso centrale e convulsioni. Il sovradosaggio acuto generalmente viene ben tollerato quando non sono stati somministrati altri farmaci. In caso di sovradosaggio è<br />
indicata la lavanda gastrica e la correzione degli elettroliti ematici. Non esiste un antidoto specifico per ibuprofene.<br />
5. PROPRIETÀ FARMACOLOGICHE. 5.1 Proprietà farmacodinamiche. Categoria farmacoterapeutica: Farmaci antinfiammatori non steroidei – derivati dell’acido propionico. Codice ATC:<br />
M01AE01. Ibuprofene è un analgesico-antinfiammatorio di sintesi, dotato inoltre di spiccata attività antipiretica. Chimicamente è <strong>il</strong> capostipite dei derivati fen<strong>il</strong>propionici. L’attività analgesica è di tipo<br />
non narcotico ed è 8-30 volte superiore a quella dell’acido acet<strong>il</strong>salic<strong>il</strong>ico. Ibuprofene è un potente inibitore della sintesi prostaglandinica ed esercita la sua attività inibendone la sintesi perifericamente.<br />
Dati sperimentali indicano che l’ibuprofene può inibire gli effetti dell’acido acet<strong>il</strong>salic<strong>il</strong>ico a basse dosi sull’aggregazione piastrinica quando i farmaci sono somministrati in concomitanza. In uno studio,<br />
dopo la somministrazione di una singola dose di 400 mg di ibuprofene, assunto entro 8 ore prima o dopo 30 minuti dalla somministrazione di acido acet<strong>il</strong>salic<strong>il</strong>ico (81 mg), si è verificata una diminuzione<br />
dell’effetto dell’acido acet<strong>il</strong>salic<strong>il</strong>ico sulla formazione di trombossano e sull’aggregazione piastrinica. Tuttavia, l’esiguità dei dati e le incertezze relative alla loro applicazione alla situazione clinica non<br />
permettono di trarre delle conclusioni definitive per l’uso continuativo di ibuprofene; sembra che non vi siano effetti clinicamente r<strong>il</strong>evanti dall’uso occasionale dell’ibuprofene. 5.2 Proprietà farmacocinetiche.<br />
Ibuprofene è ben assorbito dopo somministrazione orale e rettale; assunto a stomaco vuoto produce nell’uomo livelli sierici massimi dopo circa 45 minuti. La somministrazione di pari dosi<br />
precedute da ingestione di cibo ha rivelato un assorbimento più lento e <strong>il</strong> raggiungimento dei livelli massimi in un periodo di tempo compreso entro un minimo di un’ora e mezza e un massimo di tre ore.<br />
L’escrezione è rapida e i livelli sierici non mostrano segni di accumulo. Il 44% di una dose di ibuprofene viene recuperata nelle urine sotto forma di due metaboliti farmacologicamente inerti e <strong>il</strong> 20%<br />
sotto forma di farmaco come tale. Nell’animale, dal 16% al 38% della dose giornaliera viene escreto nelle feci, e dal 38% al 70% nelle urine. 5.3 Dati preclinici di sicurezza. Le prove tossicologiche<br />
sulle diverse specie animali, per diverse vie di somministrazione, hanno dimostrato che ibuprofene è ben tollerato (la DL 50 nel topo albino è di 800 mg/kg per os; mentre nel ratto, sempre per os, è di<br />
1600 mg/kg). Va però notato che la somministrazione di FANS a ratte gravide può determinare restrizione del dotto arterioso fetale. Non vi sono ulteriori informazioni su dati preclinici oltre a quelle già<br />
riportate in altre parti di questo Riassunto delle Caratteristiche del Prodotto (vedere sezione 4.6).<br />
6. INFORMAZIONI FARMACEUTICHE. 6.1 Elenco degli eccipienti. • BRUFEN 400 mg e 600 mg Compresse. Cellulosa microcristallina, croscarmellosio sodico, idrossiprop<strong>il</strong>met<strong>il</strong>cellulosa,<br />
lattosio, laur<strong>il</strong>solfato sodico, magnesio stearato, Opaspray M-1-7111B Bianco, s<strong>il</strong>ice colloidale anidra, talco. • BRUFEN 600 mg Granulato. Acido malico, aroma arancia, povidone, saccarosio,<br />
sodio bicarbonato, sodio carbonato anidro, sodio laur<strong>il</strong>solfato, sodio saccarinato. 6.2 Incompatib<strong>il</strong>ità. Non sono note incompatib<strong>il</strong>ità chimico-fisiche di ibuprofene verso altri composti. 6.3 Validità.<br />
Compresse: 3 anni. Granulato: 2 anni. 6.4 Precauzioni particolari per la conservazione. BRUFEN 600 mg Granulato va conservato a temperatura non superiore a 25 °C. 6.5 Natura e contenuto<br />
del contenitore. Compresse. • Astuccio contenente 30 compresse da 400 mg in blister (PVC/Alu). • Astuccio contenente 30 compresse da 600 mg in blister (PVC/Alu). Granulato.<br />
• Astuccio contenente 10 bustine (carta/politene/alluminio/politene) di granulato da 600 mg. • Astuccio contenente 30 bustine (carta/politene/alluminio/politene) di granulato da 600 mg.<br />
6.6 Precauzioni particolari per lo smaltimento. Nessuna.<br />
7. TITOLARE DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO<br />
ABBOTT S.r.l. – 04011 Campoverde (LT)<br />
8. NUMERO DELL’AUTORIZZAZIONE ALL’IMMISSIONE IN COMMERCIO<br />
• 30 compresse da 400 mg in blister PVC/Alu, A.I.C.: n. 022593204 • 30 compresse da 600 mg in blister PVC/Alu, A.I.C.: n. 022593216 • 10 bustine di granulato da 600 mg, A.I.C.: n. 022593178<br />
• 30 bustine di granulato da 600 mg, A.I.C.: n. 022593103<br />
9. DATA DI PRIMA AUTORIZZAZIONE/RINNOVO DELL’AUTORIZZAZIONE<br />
• 30 compresse da 400 mg in blister PVC/Alu: 09.06.2006 • 30 compresse da 600 mg in blister PVC/Alu: 09.06.2006 • 10 bustine di granulato da 600 mg: 20.12.1999 • 30 bustine di granulato<br />
da 600 mg: 01.06.1990. Rinnovo autorizzazione: 01.06.2010<br />
10. DATA DI REVISIONE DEL TESTO<br />
Determinazione AIFA del 19 luglio 2010<br />
BRUFEN 30 Compresse rivestite 400 mg € 4.64 CLASSE A (66) RR<br />
BRUFEN 30 Compresse rivestite 600 mg € 6.77 CLASSE A (66) RR<br />
BRUFEN Granulato effervescente – 30 bustine 600 mg € 7.50 CLASSE A (66) RR