Nukleinsavak és egyéb természetes anyagok - Szerves Kémiai ...
Nukleinsavak és egyéb természetes anyagok - Szerves Kémiai ...
Nukleinsavak és egyéb természetes anyagok - Szerves Kémiai ...
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
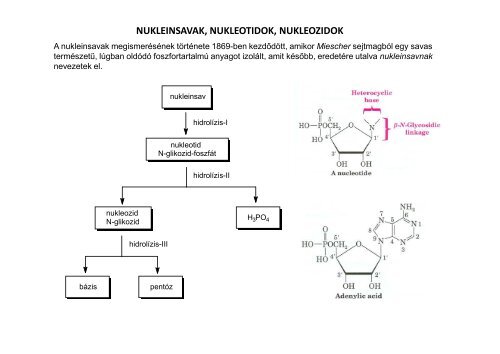
A NUKLEINSAVAK ELSŐDLEGES SZERKEZETEA nukleinsavak nukleotidokból épülnek fel úgy, hogy a polinukleotid láncban a pentózok 5’ <strong>és</strong> 3’ hidroxilcsoportjafoszforsavdi<strong>és</strong>zter-köt<strong>és</strong>sel kapcsolódik össze.5'-láncvégHOH 2 CON5 , 5 ,OHOP3 ,OORnukleotidegységekH 2 CONcukor-foszfátláncOHO3 ,OPOH 2 CORNOHOP5 , 5 ,3 ,OROH 2 C3 ,HOORN3'-láncvég<strong>Nukleinsavak</strong> szerkezete. DNS: R = H, RNS: R = OH
A DNS MÁSODLAGOS SZERKEZETEErwin Chargaff (1905-2002)Chargaff-szabályok 1950A különböző eredetű DNS-molekulák hidrolizátumában a purinbázisok (adenin <strong>és</strong> guanidin) molárismennyisége mindig azonos a pirimidinbázisokéval (timin <strong>és</strong> citozin), sőt további szabályosság, hogy az adeninmennyisége a timinével, valamint a guanin mennyisége a citozinéval azonos.A + G = T + CA = T G = CWatson <strong>és</strong> Crick 1953-ban felismerték a DNS kettős hélix szerkezetét, ami megoldotta a DNS önreprodukciójánakkérd<strong>és</strong>ét.H 3 COHHNNHNHONN H N NN H N NNN C1 , NN C 1 ,1 , COCO H N1 , H1,1 nm 1,1 nmtimin (T) adenin (A) citozin (C) guanin (G)James D. Watson(1928-)Francis Crick(1916-2004)
A DNS kettős hélixehelix-1GATAGGCACCAhelix-2CTATCCGTGGThelix-1pentóz-foszfát láncG CA TT AA TCG CC GA TC GGT AATC GG C2,0 nmhelix-212345678910113,4 nmkomplementerbázispárok
A DNS HARMADLAGOS SZERKEZETE ÉS BIOLÓGIAI FUNKCIÓJAAz emberi DNS – a teljes humán genom – közel 6 millió kb-ból épül fel <strong>és</strong> teljes hossza eléri a 2 m-t.A szabályos kettős helix term<strong>és</strong>zetesen meghajlik, összetekeredik <strong>és</strong> ezt tekintjük a harmadlagos szerkezetnek.A DNS-molekula szervezettségének a legmagasabb szintje a kromoszóma, ami már fehérjéket is tartalmaz aDNS mellett.A teljes DNS lánc egy-egy rövidebb szakaszát tekintjük géneknek, a gének sorrendjét pedig genetikaitérképnek nevezzük. Az élő sejt osztódással szaporodik. Az osztódáskor a kettős hélix szétcsavarodik <strong>és</strong>mindegyik szál mellé egy vele komplementer másik szál szintetizálódik. Ezt a folyamatot szemikonzervatívreplikációnak nevezzük.CATAGGCAGTATCCGTC GA TT AA TG CG CC GA Trégi újC GA TT AA TG CG CC GA Túj régiA DNS-molekula három egymást követő nukleotidjának sorrendje (triplett) kódol egy bizonyos aminosavat.A DNS tehát tárolja <strong>és</strong> az új sejtnek átadja a fehérjeszintézishez szükséges genetikai információt.
AZ RNS TÉRSZERKEZETE ÉS BIOLÓGIAI SZEREPEA DNS a sejtmagban található, a fehérjeszintézis viszont a sejtplazmában játszódik le. A fehérjeszintézisfeladatát az RNS-molekulák látják el. Egyetlen sejten belül többféle RNS található, melyek funkcióik szerintkülönböztethetők meg.A hírvivő (messenger) RNS (mRNS) közvetíti a DNS-ben kódolt genetikai információt, a riboszomális RNS(rRNS) a fehérjeszintézis helyszínéül szolgál, a transzfer RNS (tRNS) pedig szállítja az aminosavakat aszintézis helyére. Ennek megfelelően a szerkezetük is különböző. Az mRNS csak egy szálat tartalmaz, amirea DNS-molekuláról átmásolja a fehérjeszintézis tervrajzát – az aminosavsorrendet. Az rRNS szerkezete aglobuláris fehérjékhez hasonló. A szabályos kettős helix szakaszokban az uracil is bázispárt alkothat azadeninnel. A rendezett szakaszokat egyszálú rendezetlen r<strong>és</strong>zek követik. A tRNS a legkisebb nukleinsavmolekula, mintegy 75–90 nukleotidegységből épül fel. Szerkezetét az ún. lóhere modellel szokták ábrázolni.O NH 2O C CH Renzimmelkapcsolódóhurokriboszómávalkapcsolódóhurokantikodon hurok
A láncvégen az aminosav kapcsolódik a tRNS-hez, az egyik hurok az enzimmel, a másik a riboszómával kapcsolja össze anukleinsavat. A harmadik hurok az ún. antikodon hurok, amelyen a három bázis sorrendje komplementere a vezérlőRNS aminosavat kódoló triplettjének. A kodon <strong>és</strong> az antikodon összekapcsolódásával az aminosavak a megfelelősorrendben jutnak a fehérjeszintézis színhelyére, a riboszóma RNS-be.Nukleotid konenzimekAdenozin-5’-trifoszfát (ATP) <strong>és</strong> adenozin-5’-difoszfát (ADP)Az adenozin-5’-trifoszfát (ATP) <strong>és</strong> az adenozin-5’-difoszfát (ADP) az élő szervezet energiagazdálkodásábanmeghatározó szerepet betöltő nukleotid koenzim két formája.Az ATP minden élő sejtben előfordul <strong>és</strong> miközben önmaga ADP-vé alakul, miközben 30 kJ mol –1 energiaszabadul fel.HOOPOHOOPOHOOPOHOH 2 CHOONNOHadenozin-5'-trifoszfát (ATP)NH 2NNenergiatermelőfolyamatokADPenergiafelhasználófolyamatok+ H 2 O -H 2 OATPHOOP OOHOP OOHH 2 CONNNH 2NN+ H 3 PO 4A kémiai energia az ATP nagyenergiájú savanhidridköt<strong>és</strong>eibenraktározódik.HOOHadenozin-5'-difoszfát (ADP)
Nikotinamid-adenin-dinukleotid (NAD + )NH 2NCONH 2OO CH 2OPOOPOH 2 CONNNNOOHHOOHHOOHnikotinamid-adenin-dinukleotid (NAD )HHNH 2NOOCONH 2O CH 2 O P O POH 2 CONNNNOHOHHOOHHOOHredukált nikotinamid-adenin-dinukleotid (NADH)Az oxidált <strong>és</strong> redukált formák egyensúlyi rendszert alkotnak, melynek biológiai szerepe a hidrogénátvitel:HoxidálandómolekulaNADtermékoxidációenzim-Ienzim-IIredukciótermékNADHredukálandómolekula
Koenzim-A (CoA)Ugyancsak az élő szervezetben lejátszódó reakciókat, mégpedig acetilez<strong>és</strong>eket katalizáló enzim koenzimje a CoA.NH 2RSCH 2 CH 2NHOCCH 2 CH 2 NHOCOHCHCH 3C CH 2OOPOOPOH 2 CONNNNCH 3OHOHkoenzim-AR = HOHOOHacetilkoenzim-AR = CH 3CAz acilez<strong>és</strong>i reakciót a folyamat során képződő acetilkoenzim-A végzi, ami igen reaktív tio<strong>és</strong>zter típusú vegyület.
IZOPRÉNVÁZAS VEGYÜLETEKA növényvilágban nagyon gyakoriak azok a szénvegyületek, amelyeknek szénváza két vagy többizoprénegységet foglal magában. Az ötszénatomos izoprénváz nagyszámú <strong>és</strong> igen változatos szerkezetű<strong>és</strong> biológiai hatású vegyület építőegysége. Ezek a vegyületek két csoportra oszthatók, mégpedig aterpenoidokra, a karotinoidokra <strong>és</strong> a szteroidokra.TERPENOIDOKA terpenoidok körében alapvegyületeknek tekinthetők a névadó terpének. Ezekre a szénhidrogénekre a (C 5H 8) náltalános összegképlet jellemző, ahol n=2 vagy ennél nagyobb szám.Terpének csoportosításaNévÖsszegképletIzoprénr<strong>és</strong>zekszáma, nMonoterpének C 10 H 16 2Szeszkviterpének C 15 H 24 3Diterpének C 20 H 32 4Szesterterpének C 25 H 40 5Triterpének C 30 H 48 6Tetraterpének C 40 H 64 8Politerpének (C 5 H 8 ) n n > 8A terpén nevet korábban csak C 10 H 16 összegképletű vegyületekre alkalmazták, utalva a terpentinre(fenyőgyanta latinul terebenthinum), mely 95%-ban tartalmaz vizgőzzel illó C 10 H 16 összegképletű szénhidrogéneket.CH 2CHCCH 3CH2fej H 2 CCCHláb H 2 CCH 2CHCH 2fejlábCH 3 C CH 3izoprén mircén egyszerűsítettvonalábra
A terpenoidok bioszintéziseszénhidrátH 3 CH 2 CCOHCH 2CH 2OHenzimH 2 CCH 3C CH 2CH 2OPPHOOC3,5-dihidroxi-3-metilvaleriánsavmevalonsavizopentenil-pirofoszfátIPPCH 3 CH+ H- H3enzim C CH 2 OPP CH 3 C CH 2 H 3 C CHCH 2OPPDMAPPCH 3CH- OPPH 3 CCCH 2+H 2 CCH 3C CH 2CH 2OPPpreniltranszferáz-HIPPOPPHgeranil-pirofoszfát
Geranil-pirofoszfát átalakulásaCH 2OPPCH 2CH 2H- OPPHHgeranil-pirofoszfátH 2 O- OPP-HrotációCH 2 OHHH 2 OHHHCH 2 OH-HCH 2CH 2geraniol(E-izomer)nerol(Z-izomer)Ad EAd E-H-Hα-pinén-HH 3 C CH 3limonénβ-pinén
Terpenoidok előfordulása, elnevez<strong>és</strong>e <strong>és</strong> fontosabb képviselőiCHOOCHOOHocimenOcimum basilicum(bazsalikom)citral-a citral-bCitrus limonum(citrom)mentolMentha piperita(borsmenta)karvonCarvum carvi(kömény)OCOOHszabinenJuniperus sabina(nehézszagú boróka)kámforCinnamomum camphora(kámforfa)zingiberenZingiber officinale(gyömbér)abietinsavPicea abies(lucfenyő)
A politerpének közül nagy gyakorlati jelentőséggel bír a kaucsuk. A brazíliai kaucsukfa (Hevea brasiliensis)tejnedvéből nyerhető poliizoprén a gumigyártás alapanyaga. A kaucsuk nagy rugalmassága a cisz geometriájúolefin köt<strong>és</strong>eknek köszönhető zegzugos szerkezettel magyarázható.H 3 CCH 2CCHCH 2 CH 2C CH 3 CCH 2 CH 2C CHH 3 CHCH 2 CH 2H 3 CCCCH 2Hazonossági periódusvulkanizáció
KAROTINOIDOKA karotinoidok zsírban oldódó term<strong>és</strong>zetes eredetű pigmentek. A vegyületcsalád neve a sárgarépából(Daucus carota) izolált pigmentre, a karotinra utal.Ugyancsak hasonló szerkezete van a paradicsom (Lycopersicum esculentum) piros színanyagának a likopinnak.likopin
Az emberi <strong>és</strong> állati szervezetek nem képesek szintetizálni a karotinoidokat, így e létfontosságú vegyületekhezcsak a táplálék útján juthatnak. A β-karotinnak A-vitaminhatása van, mivel a szervezetben enzim hatására2 mol retinol (A-vitamin) képződik belőle.dioxigenázβ-karotin 2CH 2OHSZTEROIDOKretinol (A-vitamin)A szteroidok a term<strong>és</strong>zetes szénvegyületek egyik leginkább figyelemre méltóbb csoportját alkotják, mivel fontosszerepet játszanak az életfolyamatokban <strong>és</strong> nélkülözhetetlenek a gyógyításban. A szteroid név a vegyületcsoportlegrégebben izolált tagjára a koleszterinre utal, amit epekőből (görögül khole=epe, sztereosz=szilárd)nyertek ki.A SZTEROIDOK SZERKEZETEValamennyi szteroidmolekulára jellemző az ún. szteroid alapváz, ami kémiai szerkezetére nézve perhidro-1,2-ciklopentanofenantrén. Stereos = szilárd
2) ErgoszterinHO19105CH 3H697HH 3 CCH 3H CH 3CH 3CH 3hνH657HH 3 CCH 3H CH 3CH 3CH 3H19CH 2HOergoszterinergokalciferol (D 2 -vitamin)3) epesavak: kolsavCH 3CH 3HOHH14COOHOHCH 3CH 3 HCOOHH5HRHOHHHROHkolsav R = OHdezoxikolsav R = H
4) Szívre ható glikozidok <strong>és</strong> varangymérgekA csoport valamennyi tagja 5β,14β-androsztán alapvázat tartalmaz.OOHOCH 3 CH 3 CH 3OOOOOOH OH OHOCH 3CH 3 HH HHhidr./ HdigitoxinOOHOCH 3CH 3 HHHH+ 3HOCH 3OHOOHHOCH 3HdigitoxigeninHCH 3H 3 CHOOHtöbb lép<strong>és</strong>CH 3digitoxóz5) SzteroidszaponinokA szaponinok hatgyűrűs alapvázat tartalmazó glikozidok, melyeknek jellegzetes szerkezeti eleme a spiroketálgyűrűr<strong>és</strong>z. Dioszgenin a dioszcin aglikonja.OH 3 CCH 3CCH 3 HHHOdioszcindioszgeninprogeszteron
Szteroid hormonokA szteroid hormonok egy r<strong>és</strong>ze a nemi funkciókat szabályozza – ezek a nemi hormonok, más r<strong>és</strong>zük pedig aszervezet anyagcseréjét (cukor- <strong>és</strong> sóháztartás) befolyásolják – ezeket az előfordulásukra utalva mellékvesekéreg-hormonoknak(vagy kortikosztereoidoknak) nevezzük.A női nemi hormonok egy r<strong>és</strong>ze (ösztrogének) a másodlagos nemi jelleg kialakulásáért felelősek – ezek azösztradiol, ösztriol <strong>és</strong> az ösztron. Közös jellemzőjük, hogy az A-gyűrű mindhárom vegyületben aromás.A női nemi hormonok másik csoportját a terhesség fenntartását biztosító gesztagének alkotják, melyeknekegyetlen term<strong>és</strong>zetes képviselője a progeszteron.CH 3R 1 R 2CH 3OHHHHHHHOHOR 1 = OH R 2 = H ösztradiolR 1 = OH R 2 = OH ösztratriolösztronA férfi nemi hormonok (androgének) közé a másodlagos nemi jelleg kialakulásáért felelős tesztoszteron <strong>és</strong>annak átalakulásával képződő androszteron tartozik.CH 3OHCH 3OCH 3HCH 3HHHHHOtesztoszteronHOHandroszteron
A mellékvese nagy számú kortikoszteroidot termel. Közülük a kortizolt szintetikusan is előállítják, ez ahidrokortizon, amely gyulladáscsökkentő hatású szer. Néhány szintetikus szteroid hasonló hatást mutat, ilyenpéldául a prednizolon.CH 2 OHCH 2 OHHOCH 3HCH C 3OOHOCH 3HCH C 3OOHHHHHOkortizol(hidrokortizon)OprednizolonFLAVONOIDOKA flavonoid összefoglaló névvel az 1,3-difenilpropán-vázú (C 6–C 3–C 6) O-heterociklusos vegyületek mellett az1,1-difenilpropán-vázú neoflavanoidokat <strong>és</strong> az 1,2-difenilpropán-vázú izoflavonoidokat jelöljük.1O231212flavonoid váz3Oneoflavonoid váz3Oizoflavonoid váz
A term<strong>és</strong>zetből izolált flavanoidok száma manapság meghaladja a négyezret. Jelenlétük szinte valamennyinövényi szervben kimutatható. Különösen nagy mennyiségben találhatók flavanoidok a fiatal növényir<strong>és</strong>zekben, így rügyekben, friss hajtásokban, virágokban, sőt term<strong>és</strong>ekben is.Ez a tény arra utal, hogy a flavonoidok jelentős szerepet játszanak a növényi sejtek működ<strong>és</strong>ében. Ezzelösszhangban a vegyületcsalád elnevez<strong>és</strong>e is növényi eredetű, ugyanis a primulák levelén <strong>és</strong> szárán fellelhető,élénk sárga színű, finom lisztes flavon bevonatról kapták nevüket (latinul sárga=flavus). A flavon bevonat 2-fenilkromon molekulaszerkezetet jelent.67584OO1flavon32 , 5 423 ,1 , 66 , 4 ,7O85 ,12H-kromén32Okromán675 48O14H-kroménO32Oizokromán675841izokroménO32OOkumarinOOkromonOizokumarinOPrimula vulgariskankalinOO2-kromanon(dihidrokumarin)Okromiliumsó(benzpiriliumsó)O4-kromanon(dihidrokromon)XOOizokromanon(dihidroizokumarin)OizobenzpiriliumsóX
A KROMON ÉS SZÁRMAZÉKAI•A kromon szintéziseOOOOCH 3 HCOOEtNaOEtOH -EtOH2-hidroxiacetofenonOCHOOOH- H 2 OOkromon•2-Fenilkromon származékok szintéziseOOHCH 3+CHO1.) KOH/EtOH2.) H5 ,6 ,4 , 3 , 2,OαOHβ 26534OH / MeOH vagyNaOAc / MeOH(E)-2'-hidroxikalkonONBS/hυCCl 4HBrO H2-(R/S)-flavononkat / H 2OOMg / HClflavonMeOH2Hox.OHflaván(2-fenilkromán)10% NaOHOClOflavilium-klorid2-fenil-4-hidroxi-4H-kromén
•3-Fenilkromon származékok szintézise (izoflavonoidok)OOHTl(ONO 2 ) 3MeOHOHOβαCH(OMe) 22'-hidroxikalkondimetilacetál formaOOH / MeOHvagy NaOMeMeOHOOMeMeOHOvegyes acetál formaizoflavonOOOPhPhPhOCH OMeOMeOOMeO OMeNa
kat./H 2AcOH, 24 o COizoflavánOOizoflavonNaBH 4 / MeOH24 o COHi-Bu 2 AlHTHF / 70 o COOizoflavanonkat./H 2MeOH, 24 o COcisz/transz 3-fenil-4-hidroxikrománMnO 2CH 2 Cl 2 , 24 o CHOHOHHHOHOH 2 OHOOOOH231A4H11OB11aO56aC6Hpterokarpán10D798Cisz gyűrűanelláció(6aR*,11aR*) relatív konfiguráció
FLAVONOIDOK BIOLÓGIAI JELENTŐSÉGE ÉS FONTOSABB SZÁRMAZÉKAIKA term<strong>és</strong>zet színpompája kémiai alapokon nyugvó biológiai jelzőrendszer: a növényvilág színváltozásait azantocianidinek pH-függő reverzibilis szerkezetváltozása okozza.OHOHOHNaOAc ( HCl)OHHOOOHHClHOOOHClcianidin-kloridpiros (pH = 3)OHOOHH 2 OHClOHHOOOHOHOHH 2 OHOOOHOHpszeudobázisszíntelen (pH = 8)OHOHanhidrobázisibolya (pH = 8)OOHHOOONaHClNaClNaOHH 2 Ofenolátkék (pH = 11)O
A flavonoidok gyógyászati alkalmazására elsőként Szent-Györgyi Albert hívta fel a figyelmet a C-vitaminfelfedez<strong>és</strong>e (1933) kapcsán.OHOOHOORP vitaminR 1 OOHOR 2HOOOHcitrinheszperidineriodiktiolOHR 1 R 2β-D-rutinozilHOMeHkvercetinrutinOHRHβ-D-rutinozil (Rutascorbin R )6753 COOH4 2C 5 H 11arachidonil gyök5-ciklooxigenázCOOHC 5 H 11arachidonsavORpolifenoxi gyökOHRpolifenolHOHOHHOCH 2 OHOOC-vitamin(L-aszkorbinsav)HOCH 2 OHOOL-aszkorbin gyökOHOH
CH 3CH 3H CH3H CH3CH 3HOCH 3O CH 3CH 3E-vitamin (α-tokoferol)Helytelen táplálkozás során hiánya a reprodukciós képesség csökken<strong>és</strong>ét, valamint izomsorvadást okoz.Erős antioxidáns, miáltal könnyű oxidálhatósága révén a szabadgyököket (pl. O 2 , • OH, L • , LOO • ahol L = lipid)az alábbi módon redukálja.CH 3CH 3HOOCH 3CH 3CH 3ORCH 3CH 3ORCH 3LLHα-tokoferolα-tokoferil-gyökR = C 16 H 33H 2 OHCH 3CH 3OO OHCH 3RCH 3α-tokoferol-kinon
ALKALOIDOKAzokat a nitrogéntartalmú növényi bázisokat, amelyek pontosan körülírt fiziológiás hatással bírnak alkaloidoknaknevezzük. Az első alkaloidot 1805-ben Sertürner izolálta ópiumból, <strong>és</strong> biológiai hatására utalva morfinnak(Morpheus az álom istene) nevezte el.Csoportosítás: 1) bioszintézis szerint: proto- (meszkalin), pseudo- (szteroid) <strong>és</strong> valódi alkaloidok2) eredet szerint: mák, dohány alkaloidok3) bioszintézis kiinduló aminokarbonsavja szerint: ornitin, lizin, fenilalanin, tirozin, triptofán, stb)-Ornitinből képződő alkaloidokH 2 NCH 2 CH 2 dekarb.CH 2CH -CO 2H 2 N COOH H 2 NCH 2 CH 2CH 2CH 2H 2 Ndezamin.OCH 2CH 2CH CH 2H 2 NAd N + ENornitinputreszcin4-aminobutiraldehidCOOH∆ 1 -pirrolin(Schiff-bázis)Atropos; görög mitológiában a végzetHárom asszonyának legidősebb tagjaAz élet fonalának elvágójaN-metilez<strong>és</strong>(metionin)NCH 3H 3 C CH 2 COOHCOacetecetsavH 3 CNNCH 3COOHOtropánvázNN-CO 2CH 3H 3 CNCOOHOH 3 CNNN CH 3nikotinOHCH 2O C CHOatropinCOOCH 3O CkokainO
-Tirozinból képződő alkaloidokA mákfélék (Papaveraceae) családjába tartozó növényekben a tirozinból többféle vázrendszer alakulhat ki,melyek többsége izokinolin gyűrűt tartalmaz.A bioszintézis kulcsintermedierje a dopamin <strong>és</strong> a p-hidroxifenil-acetaldehid Manninch-kondenzációjávalkeletkező (S)-norkoklaurin, amely több lép<strong>és</strong>ben (R)-retikulinná alakul.1. -CO 22. ox.HONH 2COOHHOdopaminNH 2Mannich-kond.HOHOHNH1. -CO 22. ox. dezam.OCHHOp-hidroxi-fenil-acetaldehidHO(S)-nor-koklaurinH 3 COH 3 COH 3 COHOHNCH 3HOHHOtirozintebaino <strong>és</strong> p kapcs.ox.N CH 3OHNCH 3H 3 COH 3 COH 3 COOH(R)-retikulinOHH 3 COHOH 3 COH 3 COH 3 COmeszkalinCH 2 -CH 2 -NH 2HOOmorfinNCH 3HOOkodeinNCH 3
A morfin káros mellékhatásai (hozzászokás, eufória stb.) ellenére a mai gyógyászatnak is nélkülözhetetlenfájdalomcsillapítója. A morfin tömény savas (HCl, H 3PO 4, CH 3SO 2OH) közegben történő hevít<strong>és</strong>e vízveszt<strong>és</strong>seljáró morfinán → aporfin vázátrendeződ<strong>és</strong>hez vezet. A képződő apomorfint korábban hánytatószerkéntalkalmazták, a legutóbbi időben az impotencia gyógyszereként került forgalomba.OHH 3 CNOH /∆-H 2 OH 3 CNHOHOHOHmorfinapomorfinA máknövény benzilizokinolin-vázas alkaloidjai közül a gyógyászatban a papaverin <strong>és</strong> származékai, mintsimaizomgörcsoldók kerülnek alkalmazásra. A hazai gyógyszeripar nagy mennyiségben állított elő szintetikusanpapaverint – az eljárás kulcslép<strong>és</strong>e a megfelelően szubsztituált acilezett β-feniletilamin Bischler–Napieralski-félegyűrűzárása, ami kloroformos oldatban foszforil-kloriddal valósítható meg (Földi, 1930).H 3 COH 3 CO43H 3 CH 3 COOCNHH 3 CON1 2H 3 CNCH 2OCH 3POCl 3 /CHCl 3-2H 2 OCH 2OCH 3dehidrogénez<strong>és</strong>CH 2OCH 3OCH 3OCH 33,4-dihidropapaverinOCH 3papaverinNo-Spa ® néven kerül napjainkban is forgalomba a papaverin 3,4-dihidro származéka, melyben a négymetoxicsoport helyett etoxicsoportok találhatók.
Triptofánból képződő alkaloidokA ma ismert alkaloidok többsége indolvázattartalmaz, <strong>és</strong> triptofánból képződik.triptofánCOOHNH 2NOHH COOOCH 3 COszekologanin- H 2 O- CO 2Glük3NHHOCH 3 CON HOOGlük3β: vinkozid3α: sztriktozidinHHH 3 COHOHNNNHONNNOOH 3 COOCCH 2 CH 3 HHkinin sztrichnin vinkaminEtOOCNHNvinpocetin (Cavinton)
Az ún. anyarozsalkaloidok (ergotalkaloid)-ból nyert lizergsav dietilamidja az LSD.RNHHCNCH 3HONHergotaminergometrinlúgoshidrolízisH 5 C 2H 5 C 2NHCONCH 3HHOHCO8 NCH 3HNNHHlizergsavdietilamid (LSD)lizergsav (8β-H)izolizergsav (8α-H)
ANTIBIOTIKUMOKA mikroorganizmusok szimbiózisa régóta ismeretes, melynek során kiválasztott anyagcseretermékeik által amikroorganizmusok elősegítik egymás életműköd<strong>és</strong>ét. Az ellentétes folyamatot antibiózisnak nevezzük.A klasszikus megfogalmazás szerint (Ward 1889, Waksman 1944) az antibiotikum elnevez<strong>és</strong>t olyan, többnyiremikroorganizmusok által termelt <strong>anyagok</strong>ra vonatkoztatva használjuk, melyek gátolják más, hasonló szervezetekszaporodását vagy elpusztítják azokat.Az antibiotikumok szerkezete nagyon változatos képet mutat. Funkciós csoportjaik, valamint gyűrűrendszerükalapján az alábbi csoportokba sorolhatók:•β-laktám antibiotikumok: penicillinek, kefalosporinok, monobaktámok,•aminosav, peptid típusú antibiotikumok,•glikozid típusú antibiotikumok: aminoglikozidok, nem polién makrolidok, polién makrolidok,•policiklusos antibiotikumok,•spirociklusos antibiotikumokE vegyületcsaládnak a gyógyászatban rendkívül fontos szerepe van, amit az is mutat, hogy napjainkban a világ gyógyszerforgalmánakközel 30%-át az antibiotikumok teszik ki. A forgalomban lévő antibiotikumok mintegy 60%-a β-laktám-gyűrűttartalmaz, amely más heterociklussal vagy karbociklussal alkothat kondenzált gyűrűrendszert.β-LAKTÁM ANTIBIOTIKUMOKA β-laktám antibiotikumok közös szerkezeti elemükről a négytagú gyűrűs savamidról kapták nevüket.A β-laktám-gyűrű szisztematikus neve: azetidin-2-on, mely a penicillinek esetében tiazolidinnel, mígkefalosporinoknál 2,3-dihidrotiazinnal kondenzált formában található. Az előbbi esetben penámvázról, azutóbbiban pedig kefámvázról beszélünk. A heterociklusos vegyületek nevezéktanát a β-laktám antibiotikumokesetében ritkán alkalmazzák. Helyette a penámvázat 1-tia-heptámnak, a kefámvázat pedig 1-tia-oktámnaknevezik.11SSONHO765N423O67 8N5423azetidin-2-onβ-laktám váz1-tia-heptámpenám-váz1-tia-oktámkefám-váz
PenicillinekA gyógyászatban elsőként alkalmazott antibiotikum a penicillin volt, melynek antibiotikus hatását 1929-benFleming a Penicillium notatum pen<strong>és</strong>zgombával végzett kísérletei közben figyelte meg. A gomba által termelthatóanyag, a penicillin izolálása nagy nehézségekbe ütközött, <strong>és</strong> ez jelentősen hátráltatta e vegyületnekgyógyszerré történő kifejleszt<strong>és</strong>ét. A nehézséget az okozta, hogy a penicillin nagyon érzékeny savas <strong>és</strong> lúgosbehatásokra, sőt már vizes közegben szobahőmérsékleten is hidrolitikus bomlást szenved, ami a tiazolidin-gyűrű<strong>és</strong> különösen a β-laktám-gyűrű reaktivitásával függ össze.ROCH H CH 3NH S CH 3RONCOOHHnév2 H 2 Obenzil-penicillinCH 2(G-penicillin)CH 3 CH 2 CH CH CH 2O CH 2fenoximetil-penicillin(V-penicillin)pent-2-én-1-il-penicillin(F-penicillin)ROCONH CH C HOCOHpenaldsav- CO 213.9. ábra. Fontosabb penicillinszármazékokROCNH CH 2 CpenilloaldehidO+HHS CH 3H 2 NCH 3COOHH2,2-dimetil-D-ciszteinpenicillaminA penicillin savas jellegű vegyület <strong>és</strong> ennek köszönhető, hogy sikerült Na-só formájában izolálni. A bomlástermékekvizsgálatából kiderült, hogy a pen<strong>és</strong>zgomba egyidejűleg különféle penicillineket termel, melyekegymástól az ábrán feltüntetett R-csoportjukban térnek el (13.9. ábra). Ennek megfelelően az elnevez<strong>és</strong>benaz egyes penicillineket a csoport neve szerint különböztetjük meg egymástól.A Gram-pozitív baktériumok szaporodását gátló term<strong>és</strong>zetes penicillinek gyógyászati felhasználását korlátozza,hogy a baktériumok által termelt β-laktamáz (penicilliáz) enzim felnyitja a penicillin β-laktám-gyűrűjét, ezáltalaz antibiotikum elveszti hatását, így a baktériumok az antibiotikummal szemben rezisztenssé válnak.
ROCH H CH 3NH S CH 3ONCOOHHβ-laktamáz enzimH 2 OROCH H CH 3NH S CH 3HOOCHNpenicillosavCOOHHEz a gyógyászati szempontból kedvezőtlen tulajdonság csökkenthető azáltal, hogy az acilamino-oldalláncacilcsoportját (R–CO) változtatjuk. A penicillinszármazékok hatásukat a baktériumok sejtfalszintézisénekgátlásával fejtik ki. Ugyanis a sejtfal kialakulásának kulcslép<strong>és</strong>e a glikopeptid-láncok közötti peptid típsúkeresztköt<strong>és</strong>ek létrejötte. Ezt gátolják a penicillinek azáltal, hogy a peptidköt<strong>és</strong> kialakulásához szükségestranszpeptidáz enzim egyik szerin egységének hidroxil csoportját β-laktám-gyűrűjük felnyílása közben acilezik.NH 2+glikopeptid-láncROCH H CH 3NH S CH 3ONCOOHHROCH H CH 3NH S CH 3NH C N HCOOHO HA penicillinek előállításaBioszintetikus (fermentációs) eljárásA term<strong>és</strong>zetes penicillineket biotechnológiai úton, mélykultúrás teny<strong>és</strong>zetben fermentációval állítják elő. Iparitermel<strong>és</strong>re legalkalmasabbnak bizonyult a Penicillium chrysogenum pen<strong>és</strong>zgomba, melynek táptalajáhozadagolt karbonsavakkal (prekurzorokkal) befolyásolni lehet a bioszintézis irányát, azaz változtatni tudjuk azR-csoportot. A prekurzorokat a gomba felhasználja a bioszintézis során – így például fenilecetsav adagolássala G-penicillin, míg például fenoxiecetsav hozzáadásával a V-penicillin termel<strong>és</strong>e fokozódik.Félszintetikus penicillinek előállításaA term<strong>és</strong>ztes penicillinek alkalmazhatóságát bomlékonyságuk <strong>és</strong> a kórokozókban kialakuló rezisztenciakorlátozza. Ezeket a hátrányokat a félszintetikus penicillinek előállításával lehet csökkenteni. A módszer lényegeaz, hogy a G-penicillinből a penicillin-aciláz enzim felhasználásával fermentációs technikával 6-aminopenicillánsavat(6-APS) állítanak elő, majd ehhez kémiai eljárásokkal olyan oldalláncokat kapcsolnak, melyeka β-laktám-gyűrű β-laktamáz enzimekkel szembeni ellenállóképességét fokozzák. Ezen oldalláncok beépít<strong>és</strong>étazonban bioszintetikusan nem lehet megoldani.
CH 2OCH H CH 3NH S CH 3ONCOOHHpenicillin-acilázH 2 O, pH: 7,5H H CH 3H S2 N CH 3ONCOOHH+COOHCH 2RCOCl+G-penicillinH H CH 3H S2 N CH 3NOCOOHH6-aminopenicillánsav(6-APS)NaHCO 3 /H 2 O- HCl6-aminopenicillánsav(6-APS)ROCH H CH 3NH S CH 3ONkloxacillinfenilecetsavÍgy például, a 6-aminopenicillánsavból (6-APS-ból) 3-(2-klórfenil)-5-metilizoxazol-4-karbonilkloridot használvaacilezőszerként a β-laktamáz-stabil, saválló <strong>és</strong> jól felszívódó származékát, a kloxacillint nyerték.ClCOOHHR =N324O CH 3Kefalosporinok1Elsőként Brotzu (1945) figyelt fel arra, hogy a Cephalosporium acremonium nevű gomba antibiotikus hatásúanyagot termel. Az ötvenes években több hatóanyagot is sikerült izolálni, melyek közül a kefalosporin-C voltaz egyik legjelentősebb.NH 3OOH HCC NH SOONCOOHOAckefalosporin-C
Az 1-tia-okt-3-em vázat tartalmazó kefalosporin-C antibiotikus hatása jóllehet gyengébb, mint a penicillineké,de a β-laktám-gyűrűt hasító penicillináz enzimmel szemben viszont sokkal ellenállóbb. Ezt a stabilitást jólérzékelteti az a tény, hogy a kefalosporin-C oldallánca kémiai módszerekkel le is hasítható, így egyszerűennyerhető a félszintetikus kefalosporin előállításának alapvegyülete a 7-aminokefalosporánsav (7-ACS) <strong>és</strong> a7-amino-3-dezacetoxikefalosporánsav (7-ADCS).H 2 N H H Skémiai hasításkefalosporin-CN ROCOOH7-aminokefalosporánsav R = OAc7-amino-3-dezacetoxikefalosporánsav R = HFélszintetikus kefalosporinokA 7-ACS <strong>és</strong> 7-ADCS-ből kiindulva különféle acilez<strong>és</strong>i módszerekkel hatékony <strong>és</strong> előnyös tulajdonságúfélszintetikus kefalosporinokat állítanak elő. A kefalosporinok β-laktám-gyűrűjének stabilitása lehetővé tesziolyan szájon át szedhető, gyomorból felszívódó k<strong>és</strong>zítmények – például a cefamandol – előállítását, melyekellenállnak a β-laktamáz enzimnek is.OHCOHN HONSSN NNNHCOOHCH 3cefamandolmódosítási lehetőségek a kefámvázonβ-laktamáz inhibitorAmpicilinnel- Unasyn
Monociklusos β-laktámok (monobaktámok)A monobaktámok abban különböznek az előzőekben tárgyalt antibiotikumoktól, hogy vázrendszerükmonociklusként tartalmazza a β-laktám-gyűrűt <strong>és</strong> nem gombák, hanem baktériumok anyagcseretermékeikéntképződnek. E vegyületek további jellegzetessége, hogy az azetidin-2-on gyűrű nitrogénjéhez szulfonsavcsoport kapcsolódik. Az aztreonam nevű szintetikus k<strong>és</strong>zítmény a Gram-negatív baktériumok ellen hatékony.NOHCH 3H 3 NSNONHONHSOOOintravénasanpenicillin érzékenység eseténH 3 C CH 3COOHaztreonamAMINOSAV ÉS PEPTID TÍPUSÚ ANTIBIOTIKUMOKA streptomyces gombafajok anyagcseretermékei közül izolálták 1955-ben a cikloszerint (oxamycint), amiTBC-ellenes hatású. A cikloszerin izoxazolidon-gyűrűt tartalmaz, ami lúggal szemben nem érzékeny, de savashidrolízissel szerinre <strong>és</strong> hidroxilaminra bomlik.CH 2ONNH 2CHC OH 2 O, Hfőz<strong>és</strong>CH 2OHNH 2CHCOOH+H 2 NOHHcikloszerinD konfigurációszerin
Szintén a streptomyces fajok anyagcseretermékeiből izolálták 1947-ben a kloramfenikolt, amit Chlorocidnéven a szem<strong>és</strong>zetben <strong>és</strong> bőrgyógyászatban gyulladáscsökkentőként alkalmaznak. Ez volt az elsőantibiotikum, amit szintetikusan gyártottak. A vegyület a nor-Ψ-efedrin származékának tekinthető, <strong>és</strong> aterm<strong>és</strong>zetben előforduló vegyületeknél szokatlan módon nitrocsoportot tartalmaz.OO 2 N CH CH CH 2 OHOHNH C CHCl 2(R,R) izomer aktívFehérje szintézist gátlókloramfenikolA peptid típusú antibiotikumok egyik képviselője az immunszupresszív hatású cikloszporin-A, ami egytalajgomba anyagcsereterméke. A makrociklusos peptidet 11 aminosav építi fel.H 3 CH 3 CH 3 CCH 3HOH 3 C CH 3 O CH 3H 3 C NHNNNCH 3 O CH 3 OH 3 C CH 3OCH 3NOCH 3NHH O 3 CHNCH 3OOCH 3N CH 3ON CH 3OHNNCH 3 OH H 3 C CH 3 C CH 33cikloszporin-A
GLIKOZID TÍPUSÚ ANTIBIOTIKUMOKTöbb olyan antibiotikus hatású term<strong>és</strong>zetes anyagot ismerünk, ami egy vagy több szénhidrátmolekulát istartalmaz.AminoglikozidokA glikozid típusú antibiotikumok cukorkomponense egy vagy több aminocsoportot is tartalmazhat. Az ilyenvegyületeket cikliteknek is szokás nevezni, egyik fontos képviselőjük a TBC-terápiában alkalmazott sztreptomicin.E vegyületben a sztreptidin nevű ciklohexánvázas aglikon a sztreptobiózaminnal α-glikozidos köt<strong>és</strong>selkapcsolódik össze, ami az aminoglikozidok esetében igen gyakori. A diszacharid mindkét cukorkomponenseaz l-sorozatba tartozik.NH 2L-sztreptózN-metil-L-glükózaminC NHsztreptidinNHHOH 2 NCNHOHOHNHOOCHOH 3 COH OHO CH 2 OHOHONH CH 3sztreptobiózamin1944-ben izoláltákFehérje szintézis gátlósztreptomicin
Nem polién makrolid antibiotikumokA glikozid típusú antibiotikumok aglikonja tartalmazhat makrociklusos laktongyűrűt. Ezeket a vegyületeketmakrolid antibiotikumoknak nevezzük. A nem polién makrolidok jelentős képviselője az eritromicin-A. Evegyület aglikonját eritronolid-A-nak nevezik, amihez β-glikozidos köt<strong>és</strong>sel kapcsolódik a d-dezózamin <strong>és</strong>az l-kladinóz.H 3 COCBakteriális fehérjeszintézist gátoljaCH 3HOH 3 CCH 2OHH 3 COCH 3CH 3OHOHOOCH 3N CH 3CH 3D-dezózaminOCH 3OOCH 3CH 3OHL-kladinózeritronolid-AOCH 3eritromicin-AAz eritromicin-A savérzékenységét <strong>és</strong> más kedvezőtlen tulajdonságát a vegyület kémiai módosításával sikerültkiküszöbölni. Az így nyert félszintetikus eritromicin származékok Gram-pozitív <strong>és</strong> -negatív baktériumok ellenegyaránt hatékonyak.Légionárius betegség (legionellosis), diftéria (torokgyík) kezel<strong>és</strong>ére
Polién makrolid antibiotikumokStreptomyces törzsek anyagcseretermékeiből gombás fertőz<strong>és</strong>ek kezel<strong>és</strong>ére alkalmas vegyületeket is izoláltak.Ezek közé tartozik a nisztatin. A vegyület aglikonja egy 38-tagú makrolakton (nisztatinolid), ami akonjugált polién mellett egy gyűrűs ketál szerkezeti egységet is tartalmaz. A szénhidrát komponens ad-mikózamin.H 3 CCH 3HO O OH OH OHH 3 COnisztatinolidOHOHOOOHOOHCOOHOHCH 3OHNH 2D-mikózaminGombaellenes hatásúnisztatinPOLICIKLUSOS ANTIBIOTIKUMOKA policiklusos antibiotikumok alapvázát négy lineárisan kondenzált, többszörösen szubsztituált <strong>és</strong> r<strong>és</strong>zlegesenhidrált aromás gyűrű alkotja. A kondenzált gyűrűrendszerhez kapcsolódhat szénhidrát is, az ilyen típusúvegyületeket antraciklin-glikozid antibiotikumoknak nevezzük. Ezek a glikozidok figyelemreméltó rákelleneshatásúak. Legismertebb képviselőjük a daunomicin (daunorubicin), melyben a tetraciklusos aglikonhoz azl-daunózamin nevű cukor kapcsolódik.OOHOCH 3OHOCH 3 OOHOH 3 CNH 2OHOL-daunózamindaunomicin
A nem glikozid típusú tetraciklusos antibiotikumokat tetraciklineknek nevezzük. A gyógyászatban alkalmazott5-oxitetraciklint (Tetran ® ) streptomyces törzsből izolálták. Doxyciklin- malária megelőző kezel<strong>és</strong>H 3 C CH 3HO CH 3 OH H NOHOH O OH O54132OHCONH 2Fehérje szintézis gátlók5-oxitetraciklinA tetraciklinek amfoter vegyületek, erős savakkal <strong>és</strong> bázisokkal egyaránt kristályos sókat képeznek.SPIROCIKLUSOS ANTIBIOTIKUMOKGombaellenes hatású antibiotikum a Penicillium grizeofulvum által termelt grizeofulvin, ami grizánvázasvegyület. A spiro-szerkezet azáltal valósul meg, hogy a molekula 3-kumaranon-gyűrüt tartalmaz, amelynek2-helyzetű szénatomjához egy további gyűrű kapcsolódik.A grizeofulvin szerkezeti különlegessége, hogy aromás gyűrűjéhez klóratom is kapcsolódik. Klórtartalmúszerves vegyületek viszont igen ritkák a term<strong>és</strong>zetben. A molekula alapvázának, a grizánnak első szintézisétmagyar kutatók valósították meg.CH 3 CH3 OOOOOCH 3 OCH 3OClgrizeofulvinGombaellenes hatásúOgrizán