Aminosavak és fehérjék - Szerves Kémiai Tanszék
Aminosavak és fehérjék - Szerves Kémiai Tanszék
Aminosavak és fehérjék - Szerves Kémiai Tanszék
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
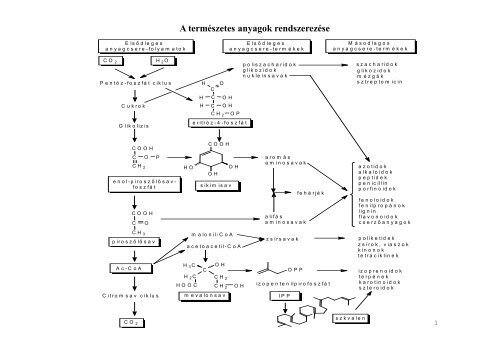
A term<strong>és</strong>zetes anyagok rendszerez<strong>és</strong>e<br />
E l s ő d l e g e s<br />
a n y a g c s e r e - f o l y a m a t o k<br />
C O 2<br />
C u k r o k<br />
G l i k o l i z i s<br />
H 2 O<br />
P e n t ó z - f o s z f á t c i k l u s<br />
H<br />
H<br />
H<br />
C<br />
C<br />
C<br />
O<br />
C H 2<br />
O H<br />
O H<br />
O P<br />
e r i t r ó z - 4 - f o s z f á t<br />
E l s ő d l e g e s<br />
a n y a g c s e r e - t e r m é k e k<br />
p o l i s z a c h a r i d o k<br />
g l i k o z i d o k<br />
n u k l e i n s a v a k<br />
M á s o d l a g o s<br />
a n y a g c s e r e - t e r m é k e k<br />
s z a c h a r i d o k<br />
g l i k o z i d o k<br />
m é z g á k<br />
s z t r e p t o m i c i n<br />
C O O H<br />
C O O H<br />
C O<br />
C H 2<br />
P<br />
e n o l - p ir o s z ő l ő s a v -<br />
f o s z f á t<br />
C O O H<br />
C<br />
O<br />
H O<br />
O H<br />
O H<br />
s i k i m i s a v<br />
a r o m á s<br />
a m i n o s a v a k<br />
a l i f á s<br />
a m i n o s a v a k<br />
f e h é r j é k<br />
a z o t i d o k<br />
a l k a l o i d o k<br />
p e p t i d e k<br />
p e n i c i l li n<br />
p o r f i n o i d o k<br />
f e n o l o i d o k<br />
f e n i l p r o p á n o k<br />
l i g n i n<br />
f l a v o n o i d o k<br />
c s e r z ő a n y a g o k<br />
C H 3<br />
p i r o s z ő l ő s a v<br />
m a l o n i l - C o A<br />
a c e t o a c e t i l - C o A<br />
z s í r s a v a k<br />
p o l i k e t i d e k<br />
z s í r o k , v i a s z o k<br />
k i n o n o k<br />
t e t r a c i k l i n e k<br />
A c - C o A<br />
C i t r o m s a v c i k l u s<br />
H 3 C O H<br />
C<br />
H 2 C C H 2<br />
H O O C C H 2 O H<br />
m e v a l o n s a v<br />
O P P<br />
i z o p e n t e n i l p i r o f o s z f á t<br />
I P P<br />
i z o p r e n o i d o k<br />
t e r p é n e k<br />
k a r o t i n o i d o k<br />
s z t e r o i d o k<br />
C O 2<br />
s z k v a l e n<br />
1
AMINOSAVAK, PEPTIDEK ÉS FEHÉRJÉK CSOPORTOSÍTÁSA ÉS NEVEZÉKTANA<br />
2
A <strong>fehérjék</strong> <strong>és</strong> peptidek teljes hidrolízisével mintegy 20-féle aminosav nyerhető. Ezek lehetnek:<br />
monoamino-monokarbonsavak<br />
monoamino-dikarbonsavak,<br />
második bázisos (amino- vagy guanidino-) aminokarbonsavak<br />
hidroxil-, szulfhidril-csoportot is tartalmazó aminokarbonsavak,<br />
izo- vagy heterociklusos szerkezetű r<strong>és</strong>zeket is magukban foglaló aminokarbonsavak.<br />
Fehérje tartalmú élelmiszerek<br />
3
Esszenciális aminosavak:<br />
fenilalanin, valin,<br />
treonin,, triptofán,<br />
izoleucin, metionin,<br />
leucin, lizin, hisztidin.<br />
4
Fehérjék, peptidek elnevez<strong>és</strong>e<br />
A szisztematikus nevük az N-terminális láncvégtől indulva az aminosavr<strong>és</strong>zek összefűz<strong>és</strong>ét<br />
jelenti. A névben használjuk az aminosavak rövidít<strong>és</strong>eit. Gyakran meg is számozzuk az<br />
aminosavr<strong>és</strong>zeket. A számozás az N-terminálison kezdődik. A term<strong>és</strong>zetben előforduló<br />
peptideknek <strong>és</strong> <strong>fehérjék</strong>nek is triviális nevük van.<br />
[–(Gly–Pro–X) n –<br />
kollagén<br />
5
AZ α-AMINOSAVAK FIZIKAI TULAJDONSÁGAI<br />
A savi erősséget a<br />
karboxilcsoportra vonatkozó<br />
disszociáció-exponenssel (pK 1<br />
), a<br />
bázisos erősséget pedig az<br />
ammóniumcsoport disszociációs<br />
k<strong>és</strong>zségeként egy savi disszociáció-<br />
exponenssel (pK 2 ) jellemezhetjük.<br />
Név Op. (°C) [α] D ( * ) pI pK 1 pK 2<br />
Glicin 292 5,97 2,34 9,60<br />
L-Alanin 297 +14,6 6,00 2,34 9,69<br />
L-Valin 315 +28,3 5,96 2,32 9,62<br />
L-Threonin 253 –15,2 6,16 2,71 9,62<br />
L-Prolin 222 –60,4 6,30 1,99 10,60<br />
* c=0,5-2,0 (5n HCl);<br />
pK p<br />
p 1<br />
+ K<br />
I =<br />
2<br />
2<br />
6
α-<strong>Aminosavak</strong> térszerkezete<br />
A Fischer-féle jelöl<strong>és</strong><br />
A term<strong>és</strong>zetben előforduló aminosavak túlnyomó többsége az L-sorba tartozik <strong>és</strong> (S)-abszolút konfigurációjú.<br />
Az L-cisztein esetén a C.I.P. szabály alapján a prioritási sorrend miatt nem az (S)-, hanem az (R)-konfiguráció<br />
adódik.<br />
H 3 N<br />
COO<br />
C H<br />
kétszeres<br />
csere<br />
HSCH 2<br />
3<br />
COO<br />
C NH 3<br />
CH 2 SH<br />
2<br />
H<br />
1<br />
4<br />
L-cisztein<br />
(R)-cisztein<br />
7
Az α-aminosavak előállítása<br />
α-Halogénkarbonsavakból aminálással<br />
Strecker szintézissel aldehidekből<br />
8
Hippursavból Erlenmeyer-féle azlakton szintézissel<br />
α-<strong>Aminosavak</strong> rezolválása<br />
Enzimekkel mint biokatalizátorokkal<br />
<strong>Aminosavak</strong> N-acetilszármazékainak<br />
racemátjai aciláz enzim jelenlétében úgy<br />
hidrolizálnak, hogy csak az (S)-<br />
konfigurációjú enantiomer szenved<br />
hidrolízist, mely az (R)-N-acetilaminosavtól<br />
könnyen elválasztható. Az aciláz enzim<br />
sert<strong>és</strong>veséből nyerhető.<br />
9
Diasztereomer sóképz<strong>és</strong>sel<br />
Először az aminosav amfoter jellegét, például benzoilcsoport beépül<strong>és</strong>ével megszüntetik. Az így nyert N-<br />
benzoilszármazékból molekvivalens mennyiségben vett optikailag tiszta bázissal [pl. (+)-brucin vagy (+)-<br />
sztrichnin] sót képeznek. Az így nyert diasztereomer sók 1:1 arányú keveréke frakcionált kristályosítással<br />
szétválasztható. A diasztereoegységes sókból a megfelelő konfigurációjú N-benzoilaminosav savas kezel<strong>és</strong>sel<br />
szabadítható fel, <strong>és</strong> végül a benzoilcsoport hidrolízissel hasítható le.<br />
R<br />
R<br />
sztrichnin R = H<br />
brucin R = OCH 3<br />
10
α-AMINOSAVAK KÉMIAI TULAJDONSÁGAI<br />
Aminocsoport reakciói<br />
Alkilez<strong>és</strong><br />
Acilez<strong>és</strong><br />
Cukorrépa<br />
Beta vulgaris<br />
11
Reakció salétromsavval<br />
Oxidáció<br />
Karboxilcsoport reakciói<br />
Észteresít<strong>és</strong><br />
12
Reakció ammóniával <strong>és</strong> hidrazinnal<br />
Reakció foszfor-pentakloriddal<br />
Amino- <strong>és</strong> karbonilcsoport együttes reakciói<br />
Komplex-képz<strong>és</strong><br />
13
Diketopiperazin-képz<strong>és</strong><br />
A legelső peptidszintézis Curtius (1888) azon megfigyel<strong>és</strong>én alapszik, hogy<br />
aminosav<strong>és</strong>zterek alkohol kilép<strong>és</strong>e közben diketopiperazin-származékokká alakulnak<br />
át, melyek híg lúggal vagy savval a megfelelő dipeptiddé hidrolizálhatók.<br />
ún. Leuchs-féle anhidridek<br />
Theodor Curtius<br />
1857-1928)<br />
Szintén a peptidszintéziseknél használják fel az aminosavakból klórhangyasav-metil-<strong>és</strong>zterrel szulfurilklorid<br />
jelenlétében nyerhető ún. Leuchs-féle anhidrideket. A molekulában ily módon kialakított<br />
karbonilcsoport egyr<strong>és</strong>zt az aminosav aminocsoportját maszkírozza, másr<strong>és</strong>zt a karbonilcsoport<br />
reaktivitását anhidridként fokozza.<br />
14
PEPTIDEK ÉS FEHÉRJÉK SZERKEZETE<br />
A peptidek primer szerkezének meghatározása<br />
A Sanger-féle módszer<br />
Frederick Sanger<br />
(1918)<br />
1958 Nobel-díj<br />
15
Az Edman-lebontás<br />
Pehr Victor Edman<br />
1916 — 1977<br />
16
A C-terminális aminosavr<strong>és</strong>z meghatározása<br />
A C-terminális aminosav lehasítására elterjedten használják a karboxipeptidáz enzimet is, amely csak a<br />
C-terminális aminosavat hasítja le az aminosavra jellemző sebességgel.<br />
A <strong>fehérjék</strong>ben <strong>és</strong> a peptidekben előforduló cisztein – a peptidköt<strong>és</strong> kialakítása mellett oldalláncának SHcsoportja<br />
révén – diszulfid köt<strong>és</strong> létesít<strong>és</strong>ére is képes. Ha a molekula csavarodása folytán két cisztein r<strong>és</strong>zlet<br />
egymás közelébe kerül, akkor közöttük oxidációval diszulfidhíd alakulhat ki.<br />
17
A peptidláncot alkotó aminosavak között hidrogénköt<strong>és</strong>ek, elektrosztatikus- <strong>és</strong> van der Waalskölcsönhatások<br />
is kialakulhatnak, amelyek többé-kev<strong>és</strong>bé rögzítik az alkotó aminosavak egymáshoz<br />
viszonyított térbeli helyzetét, azaz meghatározzák a peptidlánc konformációját. A hidrogénköt<strong>és</strong>ek révén<br />
kialakult szerkezetet másodlagos, az egyéb köt<strong>és</strong>ek kialakulásával létrejövőt pedig harmadlagos<br />
szerkezetnek nevezzük.<br />
18
Redőzött réteg (β-konformáció)<br />
α-hélix szerkezet<br />
Egy menetet 3-6 aminosavr<strong>és</strong>z alkot, <strong>és</strong> 5 menet<br />
után kerülnek tökéletesen azonos helyzetbe. Az α-<br />
hélix átmérője 10,5 Å, amely a legmegfelelőbb<br />
távolság a maximális van der Waals<br />
kölcsönhatásra.<br />
19
A fehérjeláncok hidrogénköt<strong>és</strong>sel erős kötegekké kapcsolódnak, míg az egyes rétegeket van der<br />
Waals kölcsönhatás tartja össze.<br />
20
Néhány fontosabb peptid<br />
Phalloidin<br />
α-amanitin<br />
Amanita phalloides<br />
gyilkos galóca<br />
Amanita muscaria<br />
légyölő galóca<br />
21
Pókháló szerkezete<br />
α-Hélix szerkezetű a fibrilláris <strong>fehérjék</strong> sorában tartozó keratin, amely a haj, szőr, gyapjú,<br />
toll fehérjéje<br />
Haj: 3-3 hélix tekeredik össze, háromszálú hélixet alkotva; ezek tovább rendeződnek, két<br />
háromszálú hélixet kilenc másik vesz körül, így stabilis, vastag kötegek jönnek létre,<br />
melyeket diszulfidhidak is összekapcsolnak, merevítenek.<br />
22
Tartós hullám (dauer) k<strong>és</strong>zít<strong>és</strong>e:<br />
24
PEPTIDEK SZINTÉZISE<br />
Elv:<br />
25
PEPTIDEK SZINTÉZISE<br />
Az amidköt<strong>és</strong> kialakítása az ún. oldat- <strong>és</strong> szilárdfázisú technika segítségével valósítható meg.<br />
Oldatfázisú eljárás<br />
H 3 N CH COO<br />
véd<strong>és</strong><br />
X<br />
HN CH COOH<br />
aktíválás<br />
X<br />
HN CH COY<br />
R 1 H 3 N CH COO<br />
R 1<br />
R 1<br />
kapcsolás<br />
X HN CH CO HN CH COOH + HY<br />
R 1<br />
R 2<br />
R 2 CH 2 HN CH 2 COOH<br />
H<br />
O<br />
O<br />
C<br />
Fmoc-Gly<br />
piperidin, DMF<br />
O<br />
CH 2<br />
O<br />
Ph CH 2 O C HN CH 2 COOH<br />
(CH 3 ) 3 C O C HN CH 2 COOH<br />
Cbz-Gly<br />
Boc-Gly<br />
kat./H 2<br />
CF 3 COOH<br />
- PhCH 3<br />
- CH 2 C(CH 3 ) 2<br />
O<br />
HO<br />
C<br />
HN CH 2 COOH<br />
-CO 2<br />
H 2 N CH 2 COOH<br />
glicin<br />
26
A karboxilcsoport aktiválása savklorid-, savazid-, aktív <strong>és</strong>zter- <strong>és</strong> vegyes anhidridcsoporttá történő átalakításuk<br />
útján érhető el. Aminocsoportjukon védett (pl. Cbz- vagy Boc-csoporttal) aminosavak diciklohexilkarbodiimid<br />
(DCC) jelenlétében közvetlenül is kapcsolhatók aminosav<strong>és</strong>zterekkel (pl. benzil<strong>és</strong>zterrel).<br />
Boc HN CH 2 COOH<br />
Boc-Gly<br />
DCC/DMF<br />
Boc<br />
HN CH 2 C<br />
O<br />
O<br />
C<br />
NH<br />
N<br />
CH 3<br />
H 2 N CH COOBn<br />
Boc HN CH 2 CONH CH COOBn +<br />
CH 3<br />
Boc-Gly-Ala-OBn<br />
NH C NH<br />
O<br />
diciklohexilkarbamid<br />
kat./H 2<br />
Boc HN CH 2 CONH CH COOH<br />
Boc-Gly-Ala-OH<br />
CH 3<br />
27
Merrifield-féle (Nobel-díj, 1984) szilárdfázisú peptidszintézis<br />
H 3 N CH COO + Cl CH 2 H 2 N CH COO CH 2<br />
R 1 R 1<br />
R 2<br />
Boc HN CH COOH<br />
DCC<br />
Merrifield-gyanta<br />
Boc HN CH CO<br />
R 2 HN CH COO<br />
R 1 CH 2<br />
vízmentes HF<br />
H 3 N CH CO HN CH COO<br />
R 2 R 1<br />
28