Koordinációs (komplex) vegyületek
Koordinációs (komplex) vegyületek
Koordinációs (komplex) vegyületek
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Koordinációs (<strong>komplex</strong>) vegyületek<br />
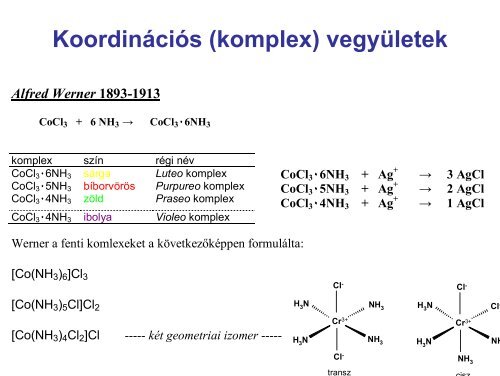
Alfred Werner 1893-1913<br />
CoCl 3 + 6 NH 3 → CoCl 3 ٠6NH 3<br />
<strong>komplex</strong> szín régi név<br />
CoCl 3 ٠6NH 3<br />
CoCl 3 ٠5NH 3<br />
CoCl 3 ٠4NH 3<br />
sárga<br />
bíborvörös<br />
zöld<br />
Luteo <strong>komplex</strong><br />
Purpureo <strong>komplex</strong><br />
Praseo <strong>komplex</strong><br />
CoCl 3 ٠4NH 3 ibolya Violeo <strong>komplex</strong><br />
CoCl 3 ٠6NH 3 + Ag + → 3 AgCl<br />
CoCl 3 ٠5NH 3 + Ag + → 2 AgCl<br />
CoCl 3 ٠4NH 3 + Ag + → 1 AgCl<br />
Werner a fenti komlexeket a következőképpen formulálta:<br />
[Co(NH 3 ) 6 ]Cl 3<br />
Cl -<br />
[Co(NH 3 ) 5 Cl]Cl 2<br />
[Co(NH 3 ) 4 Cl 2 ]Cl ----- két geometriai izomer -----<br />
H 3<br />
N<br />
H 3<br />
N<br />
NH 3<br />
Cr 3+ NH 3<br />
Cl -<br />
transz<br />
H 3<br />
N<br />
H 3<br />
N<br />
Cl - Cl -<br />
Cr 3+<br />
NH<br />
NH 3
A cisz (ibolya) izomer előállítása (1907):<br />
O<br />
O<br />
C<br />
H 3<br />
N<br />
O<br />
HCl<br />
H 3<br />
N<br />
Cl - Cl -<br />
Cr 3+<br />
H 3<br />
N<br />
Cr 3+ NH 3<br />
NH 3<br />
H 3<br />
N<br />
NH 3<br />
NH 3<br />
Optikai izoméria:<br />
Cl - Cl -<br />
Cl - Cr 3+<br />
NH 2<br />
NH 2<br />
H 2<br />
N<br />
Cl -<br />
H 2<br />
N<br />
H 2<br />
N<br />
Cr 3+ NH 2<br />
NH 2<br />
H 2<br />
N
1000 db átkristályosítás<br />
NH 3<br />
6+<br />
H 3 N<br />
H 3 N<br />
NH 3<br />
Co<br />
NH 3<br />
H<br />
O<br />
O<br />
H<br />
H 3 N<br />
Co<br />
NH 3<br />
HO NH 3<br />
OH<br />
Co<br />
OH<br />
HO<br />
Co<br />
NH 3<br />
H 3 N NH 3<br />
NH 3
Klasszikus, vagy úgynevezett Werner-<strong>komplex</strong> képződik, amikor egy Lewis-bázis (ligandum)<br />
kapcsolódik egy Lewis-savhoz (akceptor) „magános” elektronpáron keresztül.<br />
Donoratom<br />
Központi atom, koordinációs szám<br />
függ: ---- ligandum<br />
mérete és sajátsága<br />
---- központi atom<br />
méret, sajátosság, töltés<br />
Ligandumok típusai<br />
A koordinatív kötés kialakítása szempontjából A potenciális donoratomok száma szerint<br />
„magános” elektronpár donor egy-, két-, ….. fogú ligandum<br />
π-kötő elektronpár donor kelát <strong>komplex</strong>ek<br />
σ-kötő elektronpár donor<br />
n-donor<br />
π-donor<br />
σ-donor<br />
erős<br />
π-akceptor<br />
CO<br />
PF 3<br />
C 2 F 4<br />
O 2<br />
oxidatív addíció<br />
gyenge<br />
π-kölcsönhatás<br />
erős<br />
π-donor<br />
NH 3<br />
H - F -<br />
OR -<br />
C 2 H 4<br />
RHC=O<br />
H 2<br />
R 3 Si-H
Koordinációs szám és térszerkezet<br />
↓<br />
2 lineáris Pt(PCy 3 ) 2 8 dodekaéderes MoH 4 (PR 3 ) 4<br />
3 trigonális [HgI 3 ] 1-<br />
T-alakú [Rh(PPh 3 ) 3 ] 1+ négyzetes Zr(acac) 4<br />
antiprizma [TaF 8 ] 3-<br />
4 sík planáris [PtCl 4 ] 2-<br />
tetraéderes Ni(CO) 4 9 három oldalon<br />
fedett [ReH 9 ] 2-<br />
5 trigonális Fe(CO) 5 trigonális hasáb [Nd(H 2 O) 9 ] 3+<br />
bipiramis<br />
négyzetes [Co(CNPh) 5 ] 2+<br />
piramis VO(acac) 2<br />
6 oktaéderes Mo(CO) 6<br />
7 fedett oktaéderes<br />
[ReH(PR 3 ) 3 (NCCH 3 ) 3 ] 1+<br />
pentagonális<br />
bipiramis IrH 5 (PPh 3 ) 2
oméria <strong>komplex</strong> vegyületeknél<br />
Konstitúciós (konformációs) izoméria NiCl 2 {P(CH 2 Ph)Ph 2 } 2<br />
Geometriai (cisz-transz) izoméria<br />
Optikai izoméria<br />
Ionizációs izoméria [Co(NH 3 ) 5 (NO 3 )]SO 4 ↔ [Co(NH 3 ) 5 (SO 4 )]NO 3<br />
hidrátizoméria [Cr(H 2 O) 6 ]Cl 3 ↔ [CrCl(H 2 O) 5 ]Cl 2 ⋅H 2 O ↔ [CrCl 2 (H 2 O) 4 ]Cl⋅2H 2 O<br />
ibolya világoszöld sötétzöld<br />
Kötési izoméria [Pd(PPh 3 ) 2 (NCS) 2 ] ----- [Pd(PPh 3 ) 2 (SCN) 2 ]<br />
Koordinációs izoméria [Cu(NH 3 ) 4 ][PtCl 4 ] ----- [Pt(NH 3 ) 4 ][CuCl 4 ]<br />
Polimerizációs izoméria PtCl 2 (NH 3 ) 2 -------- [Pt(NH 3 ) 4 ][PtCl 4 ]<br />
[Pt(NH 3 ) 4 ][PtCl 3 (NH 3 )] 2<br />
[PtCl(NH 3 ) 3 ] 2 [PtCl 4 ]<br />
Ligandumizoméria [CoCl(en) 2 (NH 2 C 6 H 4 CH 3 )]Cl 2<br />
o-, m- vagy p-
eometriai izoméria<br />
B<br />
B<br />
B<br />
B<br />
B<br />
M<br />
A<br />
A<br />
M<br />
B<br />
A<br />
A<br />
M<br />
A<br />
A<br />
A<br />
A<br />
M<br />
B<br />
A<br />
A<br />
A<br />
M<br />
B<br />
B<br />
A<br />
A<br />
M<br />
B<br />
A<br />
A<br />
transz<br />
B<br />
A<br />
cisz<br />
B<br />
B<br />
transz<br />
A<br />
cisz<br />
A<br />
fac<br />
B<br />
mer
∆G (kJ/mol)<br />
Geometriai izoméria<br />
50<br />
25<br />
43,1<br />
34,5<br />
0<br />
10,1<br />
15,5<br />
Jelmagyarázat: oxigén hidrogén
Enantiomer pár<br />
Jelmagyarázat:<br />
szén<br />
oxigén<br />
nitrogén<br />
hidrogén<br />
króm
Optikai izoméria<br />
Jelmagyarázat: oxigén hidrogén
Komplex vegyületek optikai és mágneses tulajdonságai<br />
Függ: központi atomtól és ligandumtól<br />
Szín: HOMO→LUMO elektronátmenet.<br />
Mágneses tulajdonság: diamágneses --- paramágneses.<br />
Egy <strong>komplex</strong>ben lévő párosítatlan elektronok száma meghatározható:<br />
mágneses szuszceptibilitás mérése → effektív mágneses momentum (µ eff ) →<br />
árosítatlan elektronok száma:<br />
µ<br />
=<br />
0<br />
n(<br />
n +<br />
eff<br />
µ<br />
2)<br />
n= párosítatlan elektronok száma; µ 0 = Bohr magneton).
Kristálytér elmélet<br />
d- atompályák oktaéderes <strong>komplex</strong><br />
e g<br />
∆ O<br />
hipotetikus<br />
oktaéderes tér<br />
oktaéderes<br />
kristálytér<br />
t 2g<br />
E<br />
ion
Ni 2+ (d 8 )<br />
paramágneses ---- diamágneses<br />
d<br />
x -y<br />
2 2<br />
d d d<br />
xy yz xz<br />
∆ O<br />
d<br />
xy<br />
E<br />
d d<br />
x -y<br />
z<br />
2 2 2<br />
∆ O<br />
tetraéderes<br />
d<br />
z<br />
sík négyzetes<br />
2<br />
d d<br />
yz<br />
xz
kristálytér felhasadás nagysága függ:<br />
-------- központi atom sajátságaitól: egy perióduson belül kicsi, csoporton belül növekszik: 3d < 4d < 5d.<br />
-------- ligandum sajátságaitól<br />
növekszik: I - < Br - < Cl - < OH - < RCO - 2 < F - < H 2 O < SCN - < NH 3 < en < bipy < CN -<br />
(en= etiléndiamin, bipy= 2,2’-bipiridin).<br />
*<br />
e g<br />
∆<br />
O<br />
∆ O<br />
∆O<br />
t 2g<br />
E<br />
[FeF ]<br />
6 3- [Fe(H<br />
2<br />
O) ]<br />
6 3+<br />
[Fe(CN) ]<br />
6 3-<br />
vörös
*<br />
e g<br />
∆O<br />
∆<br />
O<br />
∆ O<br />
∆<br />
O<br />
∆O<br />
∆O<br />
E<br />
t 2g<br />
ibolyás-zöld zöld zöld rózsaszín színtelen kék<br />
[TiF 6 ] 3- [VF 6 ] 3- [CrF 6 ] 3- [MnF 6 ] 3- [FeF 6 ] 3- [CoF 6 ] 3-
olekulapálya elmélet<br />
1. csak az azonos szimmetriájú pályák kombinálódnak<br />
2. annál nagyobb a felhasadás, minél nagyobb az átfedés a két pálya között, azaz térben közel vannak<br />
3. annál nagyobb a felhasadás, minél közelebb van a pályák energiája
olekulapályák kialakulása: H 3 B + NH 3 → H 3 BNH 3<br />
E BH 3 NH 3
taéderes <strong>komplex</strong><br />
π-donor ligandumok<br />
3d<br />
4p<br />
4s<br />
∆O<br />
t 1u<br />
a 1g *<br />
*<br />
e g<br />
t 1u<br />
a 1g<br />
e g<br />
e g a 1g<br />
t 2g<br />
*<br />
t 1u<br />
E<br />
∆ O<br />
e g *<br />
t 2g<br />
∆ O<br />
π-akceptor ligandumok<br />
(viszont-koordináció)<br />
t 2g *<br />
t 2g<br />
*<br />
t 2g<br />
t 2<br />
M ML 6 db L<br />
t 2g<br />
E<br />
∆ O<br />
e g *<br />
t 2g<br />
∆ O<br />
t 2g
omplex vegyületek stabilitása<br />
lektroneutralitás elve és a viszont-koordináció<br />
A koordinatív kötés természetéből logikusan következik, hogy a stabilitásnak függenie kell: 1.) a<br />
özponti atom tulajdonságaitól, 2.) a központi atom és ligandum közti kölcsönhatástól, és 3.) a ligandum<br />
ulajdonságaitól.<br />
.) A központi atom és töltése.<br />
A stabilitása általában nagyobb, ha az oxidációs szám nagyobb. Pl. +3 és nem +2.<br />
Első átmenetifémsor esetén a stabilitás az Irwing-Williams-sorrendet követi, mely a kation sugarával<br />
ellentétes:<br />
Mn 2+ < Fe 2+ < Co 2+ < Ni 2+ < Cu 2+ > Zn 2+ erősen elektrosztatikus kötés.<br />
.) Összefüggés a központi atom és a donoratom (ligandum) között.<br />
puha és kemény ligandumok<br />
.) A ligandum típusa (donoratomok száma alapján).<br />
Kelátgyűrűk kialakulása.<br />
M(L-L) 3 + 6 L ↔ ML 6 + 3 L-L
Összefüggés a központi atom és a donoratom (ligandum) között.<br />
nos: elektrosztatikus kölcsönhatások<br />
ovalens: koordináció --- viszontkoordináció (HOMO-LUMO kölcsönhatás)<br />
eménység (η) és puhaság<br />
P=ionizációs energia és EA=elektron affinitás):<br />
η= (IP-EA)/2, S= 1/2η = 1/(IP-EA).<br />
Koopmans tétel alapján:<br />
η= (E LUMO – E HOMO )/2, S= 1/(E LUMO – E HOMO ).<br />
a η kicsi puha ligandumról, vagy központi atomról,<br />
a η nagy kemény ligandumról, vagy központi atomól<br />
eszélünk.<br />
LUMO<br />
HOMO<br />
E M L<br />
LUMO<br />
HOMO<br />
uha ligandum – puha központi atom → erős kovalens kölcsönhatás
A trans effektus.<br />
transz effektus: Cl - > NH 3<br />
Cl<br />
Cl<br />
-<br />
-<br />
Pt<br />
2+<br />
Cl<br />
Cl<br />
-<br />
-<br />
NH3<br />
Cl<br />
Cl<br />
-<br />
-<br />
Pt<br />
2+<br />
NH 3 Cl -<br />
NH 3<br />
Cl<br />
-<br />
Cl -<br />
Pt 2+<br />
NH3<br />
NH 3<br />
H N<br />
NH3<br />
3<br />
Pt 2+<br />
3<br />
NH3<br />
H N<br />
H N Cl<br />
Cl - Cl -<br />
3<br />
Pt 2+<br />
3<br />
NH3<br />
H N<br />
-<br />
H N<br />
3<br />
Pt 2+<br />
NH3<br />
Cl - Cl -
ffektív atomszám szabály és a 18 elektron szabály átmenetifémek esetén<br />
o = 27 Ag = 47 Pt = 78<br />
o 3+ = 24 Ag + = 46 Pt 4+ = 74<br />
1-<br />
NO 2 = 12 4 NH 3 = 8 6 Cl - = 12<br />
------------------------ -------------------------- ---------------------<br />
Co(NO 2 ) 6 ] 3- = 36 e - (Kr) [Ag(NH 3 ) 4 ] + = 54 e - (Xe) [PtCl 6 ] 2- = 86 e - (Rn)<br />
CoCl 4 ] 2- = 33 e - [Ag(NH 3 ) 2 ] + = 50 e - [PtCl 4 ] 2- = 84 e -<br />
Cr(NH 3 ) 6 ] 3+ = 33 e -<br />
Ni(NH 3 ) 6 ] 2+ = 38 e -<br />
-----------------------------------------------------<br />
Fe 8<br />
n-1)d, ns, np = 18 e - 2Cp 10<br />
Fe<br />
5 [V(CO) 6 ] - Fe 2+ 6<br />
r 6 Cr(CO) 6 2Cp 1- 12<br />
n 7 (OC) 5 Mn-Mn(CO) 5<br />
e 8 Fe(CO) 5<br />
o 9 (OC) 4 Co-Co(CO) 4 (OC) 3 Co(µ-CO) 2 Co(CO) 3<br />
i 10 Ni(CO) 4
Szerves ligandumok<br />
aptocitás: egy fématomhoz közvetlenül kapcsolódó szomszédos szénatomok száma<br />
a ligandumban.<br />
émkötési szám: a szerves csoporthoz egyidejűleg kötődő fématomok száma.<br />
1 , monohapto<br />
2 , dihapto<br />
3 , trihapto<br />
4 , tetrahapto<br />
5 , pentahapto<br />
6 , hexahapto<br />
7 , heptahapto<br />
8 , oktahapto<br />
alkil (-R), aril (-Ar), σ-allil (-CH 2 CH=CH 2 ), σ-etinil (-C≡CR),<br />
karbonil (CO), izonitril (CNR)<br />
alkén (R 2 C=CR 2 ), alkin (RC≡CR)<br />
π-allil<br />
konjugált dién, ciklobutadién-származékok<br />
dienil (ciklopentadienil-, cikloheptadienil-származékok)<br />
arén (benzol-), cikloheptatrién-, ciklookta-1,3,5-trién-származékok<br />
tropilium (cikloheptatrienil-származékok)<br />
ciklooktatetraén-származékok