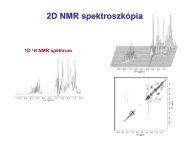
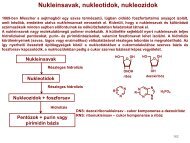
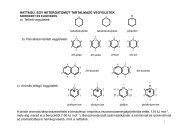
03 - Szerves Kémiai Tanszék
03 - Szerves Kémiai Tanszék
03 - Szerves Kémiai Tanszék
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Ha a ∆G° pozitív a termékek képződése az egyensúlyban nem kedvezményezett és az<br />
egyensúlyi állandó értéke kisebb, mint 1.<br />
Alacsony hőmérsékleten a T∆S tag kicsi, és a ∆H° tag fogja meghatározni a termékek képződését<br />
∆H° negativ→ negatív ∆G°<br />
Minél rendezetlenebb a rendszer, annál nagyobb az entrópiája. A pozitív entrópia változás negatív<br />
hozzájárulást ad ∆G°-hez és kedvező a termékek képződéséhez.<br />
E pot<br />
aktivált komplex<br />
10 -14 s<br />
Arrhenius egyenlet<br />
Eyring egyenlet<br />
A<br />
B<br />
aktiválási energia<br />
k =<br />
A<br />
E<br />
e −<br />
a /<br />
RT<br />
E a : aktiválási energia<br />
k: sebességi állandó<br />
A: konstans<br />
k<br />
=<br />
RT<br />
Nh<br />
e<br />
−∆G<br />
#<br />
/ RT<br />
r<br />
aktiválási szabadentalpia változás<br />
∆G# = ∆H# - T ∆S#<br />
Arrhenius féle aktiválási energia:<br />
Ea = ∆H# + RT<br />
Szobahőmérsékleten at RT tag kicsi és elhanyagolható.<br />
Ea ≅ ∆H#.<br />
18