12 - Szerves Kémiai Tanszék
12 - Szerves Kémiai Tanszék 12 - Szerves Kémiai Tanszék
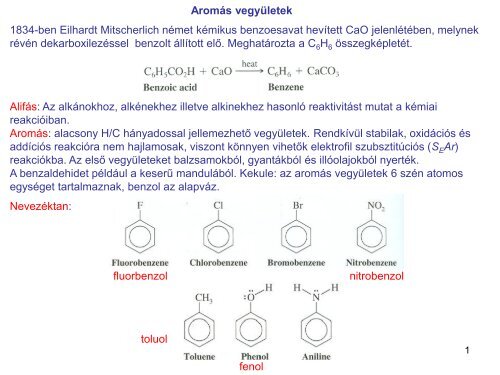
Aromás vegyületek 1834-ben Eilhardt Mitscherlich német kémikus benzoesavat hevített CaO jelenlétében, melynek révén dekarboxilezéssel benzolt állított elő. Meghatározta a C 6 H 6 összegképletét. Alifás: Az alkánokhoz, alkénekhez illetve alkinekhez hasonló reaktivitást mutat a kémiai reakcióiban. Aromás: alacsony H/C hányadossal jellemezhető vegyületek. Rendkívül stabilak, oxidációs és addíciós reakcióra nem hajlamosak, viszont könnyen vihetők elektrofil szubsztitúciós (S E Ar) reakciókba. Az első vegyületeket balzsamokból, gyantákból és illóolajokból nyerték. A benzaldehidet például a keserű mandulából. Kekule: az aromás vegyületek 6 szén atomos egységet tartalmaznak, benzol az alapváz. Nevezéktan: fluorbenzol nitrobenzol toluol fenol 1
- Page 2 and 3: Szerkezet Triviális név Szubsztit
- Page 4 and 5: Ha a C 6 H 5 csoportot szubsztituen
- Page 6: 1865: August Kekulé javasolja, hog
- Page 9 and 10: A hat db p atompálya kombinációj
- Page 11 and 12: Sokszög és kör módszer a annul
- Page 13: Cikloheptatrién kation (tropilium
Aromás vegyületek<br />
1834-ben Eilhardt Mitscherlich német kémikus benzoesavat hevített CaO jelenlétében, melynek<br />
révén dekarboxilezéssel benzolt állított elő. Meghatározta a C 6 H 6 összegképletét.<br />
Alifás: Az alkánokhoz, alkénekhez illetve alkinekhez hasonló reaktivitást mutat a kémiai<br />
reakcióiban.<br />
Aromás: alacsony H/C hányadossal jellemezhető vegyületek. Rendkívül stabilak, oxidációs és<br />
addíciós reakcióra nem hajlamosak, viszont könnyen vihetők elektrofil szubsztitúciós (S E Ar)<br />
reakciókba. Az első vegyületeket balzsamokból, gyantákból és illóolajokból nyerték.<br />
A benzaldehidet például a keserű mandulából. Kekule: az aromás vegyületek 6 szén atomos<br />
egységet tartalmaznak, benzol az alapváz.<br />
Nevezéktan:<br />
fluorbenzol<br />
nitrobenzol<br />
toluol<br />
fenol<br />
1
Szerkezet Triviális név Szubsztitúciós név<br />
CH 3<br />
benzol<br />
toluol<br />
metilbenzol<br />
6<br />
CH 3<br />
1<br />
2<br />
CH 3<br />
5<br />
4<br />
3<br />
CH 3<br />
1<br />
o-, m-, p-xilol<br />
o-, m-, p-dimetilbenzol<br />
5 3<br />
H 3 C CH 3<br />
mezitilén<br />
1,3,5-trimetilbenzol<br />
H 3 C<br />
CH<br />
CH 3<br />
kumol<br />
izopropilbenzol<br />
CH CH 2<br />
sztirol<br />
vinilbenzol<br />
2
enzolszulfonsav<br />
benzoesav<br />
acetofenon<br />
anizol<br />
Két szubsztituens relatív helyzetét az orto, meta, és para (o-, m-, p- rövidítés) előtagokkal<br />
vagy számokkal adhatjuk meg.<br />
p-dibrómbenzol<br />
o-dibrómbenzol<br />
m-dibrómbenzol<br />
Dimetilbenzol származékokat xiléneknek nevezzük:<br />
o-xilol m-xilol p-xilol<br />
3
Ha a C 6 H 5 csoportot szubsztituensként kezeljük, akkor fenil csoportként nevezzük el. Ha a fenil<br />
csoport egy alkil lánchoz kapcsolódik, akkor a nagyobb szerkezeti egység lesz az alapnév. Ha<br />
a lánc telítetlen a mérettől függetlenül az lehet az alapnév.<br />
Fenil csoport rövidítése C 6 H 5 — vagy Ph—. Benzil csoport a fenilmetil csoportot jelenti és<br />
Bn a rövidíytése.<br />
4
Benzol szerkezete<br />
nincs reakció<br />
lassú reakció<br />
A benzol brómozása során csak egy monobrómbenzol származék keletkezik. <br />
két lehetséges magyarázat:<br />
i) A hat hidrogén közül csak egy reaktív ebben a reakcióban.<br />
ii) A benzol hat hidrogénje ekvivalens, és bármelyik reakciója ugyanzt a terméket adja<br />
5
1865: August Kekulé javasolja, hogy a benzol szén atomjai gyűrűt képeznek, és váltakozó<br />
egyszeres és kétszeres kötésekkel kapcsolódnak egymáshoz. Minden szén atomhoz egy hidrogén<br />
atom kapcsolódik<br />
A Kekulé szerkezete két különböző 1,2-dibrómbenzolt feltételez, de csak egy ilyen létezik.<br />
1900 előtt a kémikusok feltételéztek, hogy a váltakozó egyszeres és kétszeres kötések<br />
felelősek az aromás tulajdonságokért.<br />
1911, Richard Willstatter<br />
Ciklooktatrién addíciós reakcióban reagál brómmal,<br />
hidrogénnel könnyen addíciós reakcióba vihető, és KMnO 4<br />
oldattal oxidálható, nem aromás vegyület<br />
Benzol stabilitása: A benzol stabilabb, mint a Kekulé szerkezet alapján várható lenne<br />
H° vizsgálata ciklohexén, ciklohexadién és benzol esetén. Összehasonlításuk alapján a<br />
stablitásra következtethetünk.<br />
6
Rezonancia elmélet: A benzol szerkezete két rezonáns határszerkezeti formával (I és II)<br />
adható meg, melyek azonos mértékben járulnak hozzá a hibrid (III) kialakításához.<br />
A benzol planáris szerkezetű, és az összes szén-szén kötése azonos kötéstávolságot mutat.<br />
ennek értéke (1.39 Å), ami a szén-szén egyszeres kötésre (1.47 Å) és az sp 2 hibridizációjú<br />
atomok közötti kétszeres kötésre (1.33 Å) jellemző értékek között van.<br />
A rezonancia elmélet szerint, ha két ekvivalens határszerkezeti formával jellemezhető egy<br />
szerkezet az aktuális molekula (hibrid) mindig alacsonyabb energiájú, mint az egyes határszerkezeti<br />
formák.<br />
MO elmélet:<br />
hat sp 2 hibridizációjú szén atom kapcsolódik<br />
gyűrűvé. Minden egyes szén atomnak van<br />
egy p pályája, ami a gyűrű síkja alatt<br />
illetve fölött helyezkedik el.<br />
8
A hat db p atompálya kombinációjával hat molekulapálya jön létre, melyen hat elektront kell<br />
elhelyeznünk. .<br />
lazító<br />
p atompályák<br />
kötő<br />
Az aromás rendszer kialakulásának feltételei:<br />
•a gyűrűt alkotó atomváz koplanáris (vagy közel koplanáris) legyen,<br />
•valamennyi gyűrűt alkotó atom rendelkezzék p z<br />
-atompályával,<br />
•a delokalizációban 4n+2 számú (n értéke 0 vagy pozitív egész szám) p-elektron vegyen részt<br />
(Hückel-szabály).<br />
9
Benzol molekulapályái a csomósíkok jelölésével<br />
E<br />
Vertikális csomósíkok<br />
száma<br />
- 2<br />
3<br />
- <br />
LUMO<br />
lazító<br />
2<br />
0<br />
<br />
2<br />
4<br />
3<br />
2<br />
6<br />
5<br />
HOMO<br />
kötő<br />
1<br />
0<br />
1<br />
10
Sokszög és kör módszer a annulének molekulapályáinak rajzolására. A szaggatott vonal alatt<br />
lévő pályák kötő pályák. A vonalon és fölötte lévők lazító pályák.<br />
lazító MO<br />
nem planáris szerkezet<br />
nem aromás<br />
Ciklooktatetraénnek 8 elektronja van. Ez nem felel meg a Hückel szabálynak, mivel 4n szám.<br />
Ha planáris lenne, két elektron betöltetlen lazító molekupályán lenne, ami kedvezőtlen.<br />
Ennek megfelelően a szerkezete nem aromás és nem planáris. Váltakozó egyszeres és kétszeres<br />
kötések vannak benne 1.48 és 1.34 Å kötéshosszakkal.<br />
11
Aromás ionok<br />
A ciklopropenil kation aromás: Két p elektron megfelel a Hückel szabálynak, n= 0<br />
Cl + SbCl 5 SbCl 6<br />
ciklopropenil-kation<br />
(n = 0)<br />
A ciklopentadién nem aromás, de a metilén csoport protonjai szokatlanul savas jellegűek.<br />
Ciklopentadiénnek 4 elektronja van, ami nem delokalizálható az egész molekulában a metilén<br />
csoport miatt.<br />
Ha a metilén csoport deprotonálódik, sp 2 hibridállapotú lesz, és a két visszamaradó elektron a<br />
p pályát tölti be. Ez az új p pálya átlapolhat a kötések pályáival, és a hat elektron aromás<br />
redszert alkot. Ez magyarázza a ciklopentadienil anion szokatlanul nagy stabilitását.<br />
<strong>12</strong>
Cikloheptatrién kation (tropilium kation)<br />
sp 3<br />
metilén szén<br />
A cikloheptatrién hat elektronja nem delokalizálódhat a gyűrűben, mert a metilén csoport<br />
szén atomjának nincs ehhez szabad p pályája.<br />
Egy hidrid anion (H - , proton két elektronnal) eltávolítása után a metilén szén atomon lesz egy<br />
üres p pálya, és sp 2 hibridizációjú lesz. A kationban 7 p átfedő p pályán hat elektron lesz.<br />
A cikloheptatrienil kation aromatic és a hét hidrogénje ekvivalens.<br />
13