Correction TP Quelle formulation choisir.pdf - Webnode
Correction TP Quelle formulation choisir.pdf - Webnode
Correction TP Quelle formulation choisir.pdf - Webnode
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
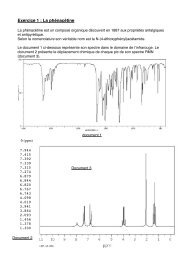
<strong>Quelle</strong> <strong>formulation</strong> <strong>choisir</strong> ?Monsieur Malalatet lit tranquillement chez lui lorsqu'il ressent une désagréable sensation de fièvre. Biendécidé à terminer de lire le chapitre de son livre au suspense insoutenable, il se dirige vers sa salle de bainpour prendre une aspirine®. Dans son placard à pharmacie se trouvent deux boites d'aspirine différentes :A. Aspirine du Rhône®B. Aspégic®Monsieur Malalatet se demande quelle aspirine® <strong>choisir</strong>.En vous appuyant sur l’activité documentaire et les activités expérimentales, que conseillerez- vous àM Malalatet ?Doc 1Connue sous le nom d’aspirine, l’acide acétylsalicylique, à température ordinaire, se présente sous formed’une poudre blanche, pas du tout agréable à absorber, même avec beaucoup de sucre !Cette poudre a subi, depuis sa création, toute sorte de transformation, pour la rendre plus comestible etdigeste. Elle a été, comme une star qu’elle est, maquillée, parée, coiffée, remplie de bulles… pour nous larendre plus agréable et plus efficace. Cette étude se fait par des pharmaciens spécialistes de la galéniqueet de la pharmacocinétique qui s’appuie sur les propriétés de la molécule et du milieu dans lequel elle va setrouver.Il en résulte de nombreuses <strong>formulation</strong>s qui ont toutes en commun le principe actif acide acétylsalicyliqueou de son dérivé, l’ion acétylsalicylate ; les différences sont dues à la variété des excipients utilisés.Elles sont mises au point par des chimistes et des pharmaciens, pour répondre à des besoins thérapeutiquesspécifiques et /ou de confort pour le malade.Pour être actif (ou efficace) le principe actif doit arriver dans le sang pour être distribué dans toutl’organisme. Ce passage se fait à travers la paroi stomacale (petite surface) ou la paroi intestinale (trèsgrande surface) à l’unique condition que la molécule active soit dissoute.Plus le passage dans le sang est rapide, plus le principe actif agit vite.Doc 2Données Acide acétylsalicylique Ion acétylsalicylateFormule C 9 H 8 O 4-C 9 H 7 O 4Solubilité dans l’eau à 20 °C Très faible GrandeSolubilité dans l’éthanol Grande -Domaine de prédominance pH < 3,5 pH >3,5Effets secondairesIrritant vis-à-vis de l’estomac.Peut provoquer des saignements Pas d’effets notables( fluidifie le sang)Indications thérapeutiquesAnalgésique, antipyrétique, antiinflammatoireà dose élevée ;antiagrégant plaquettaireAnalgésique, antipyrétique, antiinflammatoireà dose élevée ;antiagrégant plaquettaire
Doc 3Voici des extraits de notices de 2 <strong>formulation</strong>s de l’aspirine :ASPIRINE DU RHÔNE® 500d'un repas même léger. Absorber les comprimésaprès les avoir fait désagréger dans un verre d'eauASPEGIC® 1000 mgCompositionPrincipe actif : Acétylsalicylate de DL lysine : 1800mg (quantité correspondante en acideacétylsalicylique: 1000 mg)CompositionPrincipe actif : Acide acétylsalicylique 500 mgExcipients: amidon, gel de silice.Mode d'administrationDoit être utilisé de préférence avant ou au coursExcipients : glycine, arôme mandarine,glycyrrhizinate d'ammonium pour un sachet.Mode d'administrationBoire immédiatement après dissolution complètedans un grand verre d'eau, lait, soda ou jus de fruit.ACTIVITÉ DOCUMENTAIREA l’aide des documents, répondre aux questions suivantes :1. Quel est le point commun à la composition de ces médicaments ? Ilsont le même principe actif : l’aspirine2. Comment nomme-t-on toutes les autres espèces présentes dans lemédicament ? Ce sont les excipientsSelon le pH du milieu, le principe actif de l’aspirine® est présent sous forme moléculaire C 9 H 8 O 4 ou sousforme ionique C 9 H 7 O 4-C 9 H 8 O 4 C 9 H 7 O 4-3,5pH<strong>Quelle</strong> que soit la forme absorbée, celle-ci va dans l’estomac dont le pH vaut environ 1.3. Sous quelle forme trouve-t-on l’aspirine dans l’estomac ? Le pH de l’estomac est inférieur à 3,5 doncl’aspirine y est sous forme moléculaire.4. Quel(s) inconvénient(s) peut-on prévoir pour le patient ?D’après le tableau de données, la formemoléculaire présente des effets secondaires tels que, irritations de l’estomac, fluidification du sang.
ACTIVITÉ EXPERIMENTALE 1 : Dissolution des médicaments dans l'eauExpérience 1 : solubilité de l’aspirine du Rhône®‣ Broyer ½ comprimé dans un mortier‣ Introduire une partie de la poudre obtenue dans un bécher contenant environ 25 mL d’eaudistillée.Agiter.‣ Observer l’aspect du mélange : Le justifier par la forme (moléculaire ou ionique) del’aspirine dans cette <strong>formulation</strong> .‣ On observe un mélange trouble : Cette <strong>formulation</strong> contient de l’aspirine sous formemoléculaire ( voir composition) Or, celle-ci a une très faible solubilité dans l’eau d’oùl’aspect trouble.‣ Le pH de la solution est –il alors supérieur ou inférieur à 3,5 ? Il doit être inférieur à 3,5‣ Le vérifier à l’aide du papier pH. La mesure donne pH = 3. Ce qui est cohérentExpérience 2 : solubilité de l'Aspégic®.‣ Verser le 1/4 du sachet dans un bécher contenant environ 25 mL d’eau puis agiter.‣ Observer l’aspect du mélange : que peut-on en conclure ? On observe un mélange limpide :Ce médicament se dissout dans l’eau‣ En déduire, à l’aide du tableau de données, la forme (moléculaire ou ionique) de l’aspirinedans l’eau. C’est la forme ionique qui a une grande solubilité dans l’eau‣ Le pH de la solution est –il alors supérieur ou inférieur à 3,5 ? Il doit être supérieur à 3,5‣ Le vérifier à l’aide du papier pH. La mesure donne pH = 6. Ce qui est cohérentACTIVITÉ EXPERIMENTALE 2 : mise en évidence d’un excipientExpérience préliminaire : test de l’amidon‣ Déposer quelques gouttes d’eau iodée sur un peu d’amidon : Qu’observe-t-on ? Unecoloration noire apparaitExpérience 1 : Proposer une expérience pour mettre en évidence la présence ou l’absence d’amidon danschaque médicament. La réaliser après l’avoir décrite au professeur.Gouttes d’eau iodéePoudre d’aspirine du Rhône ® Poudre d’Aspégic ®On observe une coloration noire sur l’aspirine du Rhône mais pas sur l’ Aspégic ® :L’Aspirine du Rhône ® contient de l’amidon. L’Aspégic ® n’en contient pas.Les résultats sont-ils en accord avec la composition des médicaments ? On lit effectivement sur la noticel’amidon dans la liste des excipients de l’ L’Aspirine du Rhône ® mais il n’apparait pas dans celle de l’Aspégic ® .
ACTIVITÉ EXPERIMENTALE 3 : Influence du milieuPour étudier ce qui se passe lorsque l'Aspégic® arrive dans l'estomac, on souhaite reproduire dans un bécher lesconditions chimiques régnant dans le milieu stomacal qui est un milieu très acide . Proposer une expérience quipermette de simuler au mieux cette condition.L’expérience sera réalisée par le professeur au bureau.Même quantité de poudre d’Aspégic ®25 mL d’eau 25 mL d’acide chlorhydrique pH = 1Bécher témoinbécher simulant milieu stomacal‣ Qu’observe-ton ? On observe la formation d’un précipité blanc‣ Le résultat est-il cohérent avec la réponse à la question 3 de l’activité documentaire ?Dans l’estomac , l’aspirine est sous forme moléculaire donc insoluble .‣ Pourquoi cette <strong>formulation</strong> est –elle plus adaptée aux personnes à estomac fragile ( observerla taille des grains d’aspirine)Avec l’Aspégic ® , les cristaux d’aspirine qui vont se formerdans l’estomac sont plus petits que ceux directement ingérés avec de l’aspirine du Rhône ® ; Ilen résulte une agressivité moindre pour l’estomac.CONCLUSION :Quel médicament conseillez- vous à M Malalatet ? Justifier votre réponse.Si m Malalatet a un estomac fragile, la <strong>formulation</strong> de l’aspirine qui lui conviendra le mieuxest celle de l’Aspégic.Sinon, le choix se fera selon les préférences de M Malalatet ( par exemple ,s’il n’a pas enviede boire , il préférera la <strong>formulation</strong> de l’Aspirine du Rhône) ou encore s’il est allergique àl’un des excipients, il l’évitera.
EXERCICE : ETUDE DE L’ASPIRINE PH 8A la demande de leur professeur, des élèves réalisent en travaux pratiques les expériences décrites ci-dessous :Protocole- Préparer 2 erlenmeyers (notés A et B) contenant respectivement 50 mL d'acide chlorhydrique à 0,5 mol.L -1 et50 mL de solution d'hydroxyde de sodium à 0,5 mol.L -1 .- A l'aide d'un papier pH, mesurer la valeur du pH dans chaque erlenmeyer.- Ajouter dans chaque erlenmeyer un comprimé d’aspirine® pH8. Agiter avec un agitateur magnétique.- Noter vos observations dans le tableau après quelques minutes.A l’issue de leurs manipulations, les élèves notent leurs résultats dans le tableau et obtiennent les résultatssuivants :Bécher A BpH avant dissolution 1 12Observations Pas de dissolution du cachet Dissolution totale du cachet1) D'après les observations notées dans le tableau et les informations du texte, pourquoi dit-on d’uncomprimé d’aspirine® pH8 qu'il est gastro-résistant ?2) La notice du médicament indique qu'on doit avaler le comprimé d’aspirine® pH8 sans le croquer.Émettre une hypothèse sur la raison qui peut justifier cette consigne.Dans le cas de l’aspirine pH8, le principe actif est libéré dans la paroi intestinale sous forme ionique.3) <strong>Quelle</strong>s informations contenues dans les documents fournis peuvent justifier que : « Le principe actif est libéré dans la paroi intestinale ». « sous forme ionique ».4) L’aspirine, quand elle a une <strong>formulation</strong> du type de l’aspirine® pH8 est parfois appelée « aspirineretard ». Justifier l’appellation « aspirine retard » en cochant les bonnes réponses :absorbé.retard » permet au médicament d’être avalé plus facilement.retard » permet au comprimé de traverser l’estomac sans que le principe actif soit5) Cette <strong>formulation</strong> convient-elle bien pour soulager un mal de tête soudain ?