Bonnes pratiques d'achat pour les antipaludéens à ... - libdoc.who.int
Bonnes pratiques d'achat pour les antipaludéens à ... - libdoc.who.int
Bonnes pratiques d'achat pour les antipaludéens à ... - libdoc.who.int
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
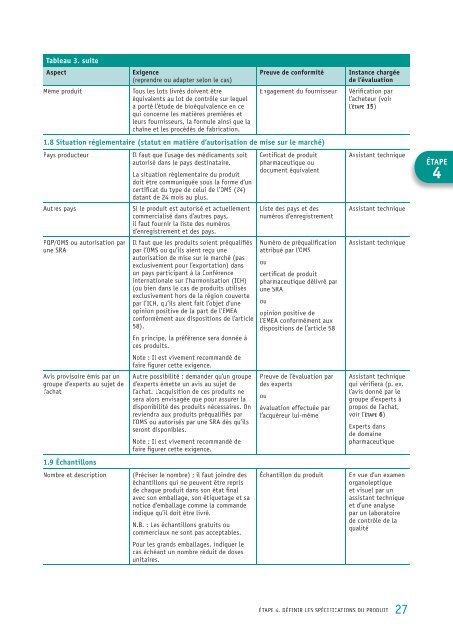
Tableau 3. suiteAspectmême produitExigence(reprendre ou adapter selon le cas)Tous <strong>les</strong> lots livrés doivent êtreéquivalents au lot de contrôle sur lequela porté l’étude de bioéquivalence en cequi concerne <strong>les</strong> matières premières etleurs fournisseurs, la formule ainsi que lachaîne et <strong>les</strong> procédés de fabrication.Preuve de conformitéengagement du fournisseur1.8 Situation réglementaire (statut en matière d’autorisation de mise sur le marché)pays producteurautres payspqp/oms ou autorisation parune sraavis provisoire émis par ungroupe d’experts au sujet del’achat1.9 Échantillonsil faut que l’usage des médicaments soitautorisé dans le pays destinataire.la situation réglementaire du produitdoit être communiquée sous la forme d’uncertificat du type de celui de l’oms (24)datant de 24 mois au plus.si le produit est autorisé et actuellementcommercialisé dans d’autres pays,il faut fournir la liste des numérosd’enregistrement et des pays.il faut que <strong>les</strong> produits soient préqualifiéspar l’oms ou qu’ils aient reçu uneautorisation de mise sur le marché (pasexclusivement <strong>pour</strong> l’exportation) dansun pays participant à la conférence<strong>int</strong>ernationale sur l’harmonisation (ich)(ou bien dans le cas de produits utilisésexclusivement hors de la région couvertepar l’ich, qu’ils aient fait l’objet d’uneopinion positive de la part de l’emeaconformément aux dispositions de l’article58).en principe, la préférence sera donnée àces produits.note : il est vivement recommandé defaire figurer cette exigence.autre possibilité : demander qu’un grouped’experts émette un avis au sujet del’achat. l’ lacquisition de ces produits nesera alors envisagée que <strong>pour</strong> assurer ladisponibilité des produits nécessaires. onreviendra aux produits préqualifiés parl’oms ou autorisés par une sra dès qu’ilsseront disponib<strong>les</strong>.note : il est vivement recommandé defaire figurer cette exigence.nombre et description(préciser le nombre) ; il faut joindre deséchantillons qui ne peuvent être reprisde chaque produit dans son état finalavec son emballage, son étiquetage et sanotice d’emballage comme la commandeindique qu’il doit être livré.n.B. : <strong>les</strong> échantillons gratuits oucommerciaux ne sont pas acceptab<strong>les</strong>.<strong>pour</strong> <strong>les</strong> grands emballages, indiquer lecas échéant un nombre réduit de dosesunitaires.certificat de produitpharmaceutique oudocument équivalentliste des pays et desnuméros d’enregistrementnuméro de préqualificationattribué par l’omsoucertificat de produitpharmaceutique délivré parune sraouopinion positive del’emea conformément auxdispositions de l’article 58preuve de l’évaluation pardes expertsouévaluation effectuée parl’acquéreur lui-mêmeéchantillon du produitInstance chargéede l’évaluationVérification parl’acheteur (voirl’étape 15)assistant techniqueassistant techniqueassistant techniqueassistant techniquequi vérifiera (p. ex.l’avis donné par legroupe d’experts àpropos de l’achat,voir l’étape 6)experts dansde domainepharmaceutiqueen vue d’un examenorganoleptiqueet visuel par unassistant techniqueet d’une analysepar un laboratoirede contrôle de laqualitéÉTAPE4éTape 4. déFinir <strong>les</strong> spéciFicaTions du produiT27