La Couleur des Minéraux - Page perso minéraux Alain ABREAL ...
La Couleur des Minéraux - Page perso minéraux Alain ABREAL ...
La Couleur des Minéraux - Page perso minéraux Alain ABREAL ...
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
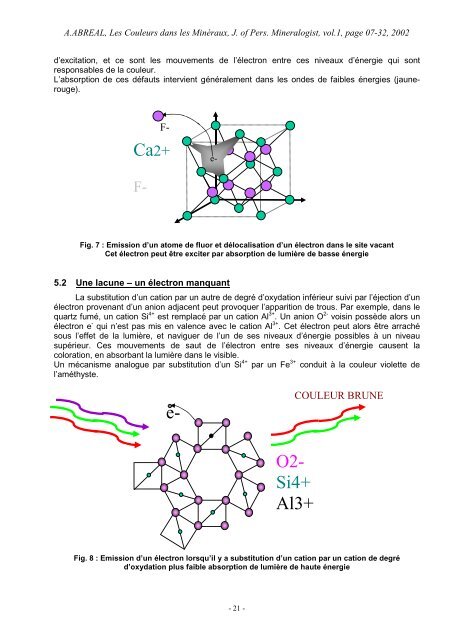
A.<strong>ABREAL</strong>, Les <strong>Couleur</strong>s dans les <strong>Minéraux</strong>, J. of Pers. Mineralogist, vol.1, page 07-32, 2002d’excitation, et ce sont les mouvements de l’électron entre ces niveaux d’énergie qui sontresponsables de la couleur.L’absorption de ces défauts intervient généralement dans les on<strong>des</strong> de faibles énergies (jaunerouge).F-Ca2+e-F-Fig. 7 : Emission d’un atome de fluor et délocalisation d’un électron dans le site vacantCet électron peut être exciter par absorption de lumière de basse énergie5.2 Une lacune – un électron manquant<strong>La</strong> substitution d’un cation par un autre de degré d’oxydation inférieur suivi par l’éjection d’unélectron provenant d’un anion adjacent peut provoquer l’apparition de trous. Par exemple, dans lequartz fumé, un cation Si 4+ est remplacé par un cation Al 3+ . Un anion O 2- voisin possède alors unélectron e - qui n’est pas mis en valence avec le cation Al 3+ . Cet électron peut alors être arrachésous l’effet de la lumière, et naviguer de l’un de ses niveaux d’énergie possibles à un niveausupérieur. Ces mouvements de saut de l’électron entre ses niveaux d’énergie causent lacoloration, en absorbant la lumière dans le visible.Un mécanisme analogue par substitution d’un Si 4+ par un Fe 3+ conduit à la couleur violette del’améthyste.e-COULEUR BRUNEO2-Si4+Al3+Fig. 8 : Emission d’un électron lorsqu’il y a substitution d’un cation par un cation de degréd’oxydation plus faible absorption de lumière de haute énergie- 21 -