THESE POUR LE DOCTORAT D'ETAT EN MEDECINE MEDECINE ...
THESE POUR LE DOCTORAT D'ETAT EN MEDECINE MEDECINE ...
THESE POUR LE DOCTORAT D'ETAT EN MEDECINE MEDECINE ...
- No tags were found...
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
UNIVERSITE PAUL SABATIER – TOULOUSE IIIFACULTES DE <strong>MEDECINE</strong>Année 2007 2007 TOU 3 1563<strong>THESE</strong><strong>POUR</strong> <strong>LE</strong> <strong>DOCTORAT</strong> D’ETAT <strong>EN</strong> <strong>MEDECINE</strong><strong>MEDECINE</strong> SPECIALISEE CLINIQUEPrésentée et soutenue publiquementLe 26 Octobre 2007ParCharles DAOInterne des HôpitauxRésultats cliniques et radiologiques à long terme del’implant PPA propos de 54 cas de descellements aseptiques deprothèse totale de hancheDirecteur de Thèse : Pr Jean PUGETJURYMonsieur le Professeur Jean PUGETMonsieur le Professeur Paul BONNEVIAL<strong>LE</strong>Monsieur le Professeur Philippe CHIRONMonsieur le Professeur Jérôme SA<strong>LE</strong>S DE GAUZYMonsieur le Docteur Jean-Louis TRICOIREPrésidentAssesseurAssesseurAssesseurSuppléant
I INTRODUCTIONII G<strong>EN</strong>ERALITESA/ HISTOIRE DE L’ARTHROPLASTIE TOTA<strong>LE</strong> DE HANCHEB/ <strong>LE</strong>S CAUSES DU DESCEL<strong>LE</strong>M<strong>EN</strong>T ASEPTIQUEC/ CLASSIFICATION DE LA PERTE DE SUBSTANCE OSSEUSE FEMORA<strong>LE</strong>D/ <strong>LE</strong>S DIFFER<strong>EN</strong>TS MOY<strong>EN</strong> DE REPRISEE/ STRATEGIE THERAPEUTIQUEF/ ANALYSE DE LA RECONSTRUCTION OSSEUSEG/ TECHNIQUE CHIRURGICA<strong>LE</strong>III NOTRE ETUDEA/ MATERIEL ET METHODEB/ RESULTATSC/ COURBES DE SURVIED/ DISCUSSIONIV CONCLUSIONANNEXESBIBLIOGRAPHIE1
I INTRODUCTIONL’arthroplastie totale de hanche est devenue, comme le présageait Charnley, une interventionorthopédique de routine. Il est posé approximativement 120 000 prothèses totales de hancheen France par an dont plus de 12 000 révisions avec un taux de progression annuel de 10%environ.Les implantations primaires sont en constante progression, devant une demandecroissante dans une population vieillissante en age et en nombre, mais aussi de plus en plusexigeante, élargissant le champ des indications vers des patients plus jeunes.L’essor de l’arthroplastie totale de hanche dans les années 80 se répercute aujourd’huien terme de rescellement. D’autre part, l’implantation sur des patients de plus en plus jeunesaccroît le risque de reprises itératives.La reprise d’arthroplastie totale de hanche devient donc de plus en plus fréquente etrépandue devant le vieillissement de la population et une demande fonctionnelle accrue.Elle pose essentiellement le problème de la perte du capital osseux fémoral etcotyloïdien. Elle doit donc permettre une reconstruction osseuse et une stabilité mécanique del’implant.La planification pré-opératoire est donc primordiale dans le choix de la techniquechirurgicale et le choix des implants.Nous présentons ici une série de reprises de prothèse totale de hanche pour descellementaseptique utilisant la prothèse de reconstruction « PP » réalisés entre 1991 et 2003.II G<strong>EN</strong>ERALITESA/ HISTOIRE DE LA PRO<strong>THESE</strong> TOTA<strong>LE</strong> DE HANCHEL’apparition de l’arthroplastie totale de hanche a considérablement modifié le pronosticde la pathologie dégénérative coxo-fémorale qui aboutissait jusqu’alors à l’ankylosedouloureuse et une gène fonctionnelle majeure 113 .Les premières prothèses totales de hanche (Mc kee 73 en 1960, Charnley 17 en 1961 etMuller 85 1961), qui reposaient sur le principe d’une articulation à rotule, présentaient desrésultats prometteurs 18,22,74 .2
NOUVEL<strong>LE</strong> EVOLUTIONNous assistons actuellement au développement de nouvelles orientations en matière deprothèses totales de hanche :- Les arthroplasties totales à tête de gros diamètre et couple métal/métal- L’évolution des voies d’abord (voies antéro-latérales) et les techniques miniinvasives.76- La chirurgie assistée par ordinateur (navigation) 47 .Nous citons à part les techniques de resurfaçage. Mac Minn 24 , en 1992, et Amstutz 1 en1996 développent une double cupule à friction métal/métal. La surface de friction Métasul,utilisée en Europe depuis 1988, est appliquée à la double cupule en 2001. Toutes les sociétésinternationales ont actuellement développé des implants de resurfaçage.B/ <strong>LE</strong>S CAUSES DU DESCEL<strong>LE</strong>M<strong>EN</strong>T ASEPTIQUELe descellement aseptique peut être considéré comme une véritable maladie iatrogèneliée à l’implantation d’une prothèse totale de hanche. Il correspond au facteur limitantessentiel de la longévité des arthroplasties totales de hanche.<strong>LE</strong>S FACTEURS DU DESCEL<strong>LE</strong>M<strong>EN</strong>TLe patientLe très jeune age 20,40 , l’obésité 18,111 , l’activité physique intense 112 sont des facteursfavorisants ainsi que l’implantation d’une prothèse sur une hanche non vierge 27 .Le scellementLe scellement prothétique entraîne une nécrose osseuse au niveau du sited’implantation. Cette nécrose est due à la dévascularisation osseuse par le passage des râpes, àla toxicité locale du monomère, à la réaction thermique et l’hyper pression qui accompagnentla polymérisation du ciment 7 .5
Le cimentSoumis à la fréquence importante des contraintes notamment en torsion 93,110 , il sefragilise progressivement à l’interface implant-ciment et entraîne la libération de débrisd’usure, responsables d’une réaction à corps étranger, source d’une ostéolyseprogressive 114,115 . Il s’y associe également une dégradation des propriétés mécaniques avec letemps 82 .L’implantUn dessin inadapté de l’implant fémoral peut entraîner un excès de contraintes sur leciment aboutissant à une fragmentation du ciment ou une mauvaise transmission descontraintes sur le support osseux cortical, source d’ostéolyse progressive par « stressschielding». L’ostéolyse peut également être due à l’usure du couple de frottement utiliséavec libération de débris de polyéthylène et formation d’un granulome.Le chirurgienLe positionnement approximatif des implants, en varus notamment 84 , ainsi que latechnique de scellement et de cimentage influent naturellement sur la longévité del’arthroplastie 41 .Ces différents facteurs aboutissent à une perte osseuse péri-prothétique responsable dudescellement des implants.LA PERTE OSSEUSE PERI-PROTHETIQUELa perte osseuse péri-prothétique peut être due au remodelage adaptatif de l’os, àl’ostéolyse ou à l’association des deux.Le remodelage adaptatif de l’osIl se caractérise par une atrophie corticale proximale de sévérité variable. Elle intéresseaussi bien les tiges cimentées que non-cimentées. La modification de la distribution descontraintes qui suit l’implantation d’une tige prothétique dans un fémur, entraîne unealtération de l’environnement mécanique local et un changement de l’architecture osseuse.Oh et Harris 94 ont montré que sur un fémur sain soumis à une certaine charge, lescontraintes diminuent de proximal en distal, la région du calcar concentrant le maximum deforce. L’insertion d’une tige prothétique fémorale inverse cette répartition. C’est la tige de la6
prothèse qui supporte alors les contraintes maximales alors que le calcar en subit unminimum. Il s’en suit une résorption du calcar et une hypertrophie corticale distale. Il s’agitdonc d’un transfert de contraintes via la tige fémorale du calcar au fémur distal (stressschielding)63,69 .Charnley et Cupic 18 ont rapporté 41,5% de signes radiologiques de résorption du calcaraprès remplacement prothétique par un implant de Charnley à 10 ans de recul. Nicholson 92retrouve 22,8% de résorption du calcar au recul de 4 ans, également après l’implantationd’une prothèse de Charnley et il signalait une hypertrophie corticale distale au niveau de latige de la prothèse. Cette hypertrophie corticale distale a été définie comme un élargissementfusiforme de l’os cortical au niveau de l’extrémité de la prothèse 106 . Blacker et Charnley 7différencient deux types d’hypertrophie corticale, avec et sans augmentation du diamètre de ladiaphyse.Ce remodelage osseux est lié, selon Jacobs et al 50 , à la rigidité de l’implant. Les tiges lesmoins rigides induisaient moins de stress-schielding mais étaient associées à un taux plusimportant de fractures de fatigue de l’implant.L’ostéolyseL’ostéolyse péri-prothétique peut être globale ou focale, elle intéresse les implantsdescellés cimentés 14,19 et non-cimentés. L’atteinte focale peut toucher les implants nondescellés cimentés 88 ou non cimentés 67 . Elle correspond le plus souvent aux zones dedéficience en ciment pour les arthroplasties cimentées 68 .L’examen microscopique des produits de tiges descellées retrouve au sain d’un stromatissulaire fibreux, des fragments de macrophages, des cellules géantes, des particules depolyméthylméthacrylate et des débris de métal avec une apparente réaction à corps étranger 81 .La présence de polyméthylmétacrylate (ciment) au sain de ce tissu fibreux a initialementconduit au concept de « maladie du ciment » 51 . La présence de ce même tissu à l’interfaceimplant-os sur des tiges non-cimentées a fait évoluer ce concept vers celui de « maladie desparticules », englobant la réaction aux débris de polyméthylmétacrylate mais aussi de métal etde polyéthylène.Plusieurs publications ont fait état de l’association entre la membrane de l’interface et lasurvenue d’ostéolyse périprothétique 43,58,89,114 . Ces érosions endostées ont été décrites aussibien autour d’implants cimentés et non cimentées, qu’autour d’implants stables ou descellés.Les alliages de Chrome-Cobalt (CoCr), Titane-Alumine-Vanadium (TiAIV), ainsi que lepolyéthylène avec des poids moléculaires très élevés ont été associés à des activations du tissu7
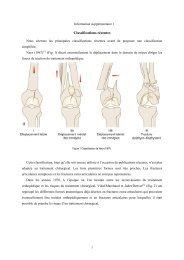
cellulaire périprothétique conduisant à l’ostéolyse et au descellement. Cette théorie repose surdeux observations expérimentales.La première est que des débris de métal et de polyéthylène dont la taille avoisine lemicron, induisent une réaction à corps étranger quand ils sont placés dans des différentsmilieux tissulaires d’origine animale 36,48 .La seconde est que ces mêmes tissus sont capables de produire des enzymes variées etdes cytokines pouvant stimuler la résorption osseuse 35,36 . L’existence d’une communicationentre la cavité articulaire et ces zones d’ostéolyse focale serait l’un des moyens de transportdes débris causant cette ostéolyse 2 .C/ CLASSIFICATION DE LA PERTE DE SUBSTANCE OSSEUSEFEMORA<strong>LE</strong>Il existe de nombreuses classifications de la perte de substance osseuse périprothétique.Il s’agit pour la plupart de classifications radiologiques descriptives.SOFCOT 88C’est la classification de Vives définie pour le symposium de 1988 que nous avonsappelé SO.F.C.O.T. 88Stade I : les corticales sont amincies mais correctes avec une lyse plus ou moinsimportante du MerckelStade II : la corticale latérale est très amincie, mais la corticale médiale amincie restecorrecteStade III : la corticale latérale est très amincie et la corticale médiale en partie détruitesous le petit trochanter,Stade IV : le fémur est pellucide ou disparu.8
AAOSPour la classification AAOS 23 , trois niveaux sont évalués :Le niveau I situé au-dessus du petit trochanter,Le niveau II situé sur la diaphyse 10 cm au-dessous du petit trochanterLe niveau III au-delà.Il s'agit d'une classification mixte, qui évalue à la fois les dégâts osseux selon unegraduation croissante pour les stades IIa, IIb, IIc et III, mais qui en même temps décrit desanomalies morphologiques localisées comme les cals vicieux, les fractures, les sténoses, maisaussi des pertes de substance localisées comme les types 1A1 ou 1A2 ou 1C.Type IA1 Type IA2 Type IB Type IC9
Type IVA /IVB Type V Type VIClassification de Paprosky 97Stade I : Métaphyse proximale intacte. Merckel partiellement détruit. Perte de substanceantérieure et postérieure peu importante. Diaphyse intacte.Stades II (II A, IIB, IIC) : la métaphyse est altérée, il n'y a plus de Merckel, la perte desubstance antérieure et postérieure est majeure, la diaphyse est intacte.Stade II A : Merckel disparu mais la perte de substance osseuse n'atteint pas la régionsous-trochantérienne.10
Stade IIB : Disparition de la face antéro-latérale de la métaphyse (région soustrochantérienne).Stade IIC : Absence d'appui métaphysaire (corticale médiale absente ou nonfonctionnelle).Stade III : La métaphyse ne peut plus assurer de soutien. Il n'y a plus de Merckel. Pertede substance antérieure et postérieure majeure. La diaphyse est intéressée par la destructionosseuse.SOFCOT 99Le symposium de la SOFCOT en 1999 nous a montré certaines insuffisances de laclassification SO.F.C.O.T. 88, et il est apparu utile de la faire évoluer en l'intitulantSO.F.C.O.T. 99. Cette évolution se traduit par des modifications mineures, la trame de laclassification SO.F.C.O.T. 88 ayant été maintenue. Les modifications portent sur l'ajout desuffixes aux stades précédemment décrits et sur la création d'un stade « zéro ». Ainsi on peutsimplement ajouter aux stades habituels des lettres suffixes identifiant respectivement l'état dugrand trochanter par la lettre T, l'atteinte diaphysaire distale à plus de 10 cm sous le petittrochanter par la lettre D, la lettre F permet d'identifier une fracture, et V un cal vicieux ouune déformation. Cette évolution était indispensable car il semblerait qu'une atteinte distaledoive être considérée même dans un stade III, qu'il s'agisse d'une destruction ou d'unedéformation fémorale.Il faut signaler que ces différentes classifications évaluent la perte de substance osseuseau travers d’un bilan radiologique. Elles sous-estiment fréquemment l’importance des dégâtset la situation doit être réévaluée systématiquement en per-opératoire après extraction del’implant fémoral et nettoyage des débris de ciment.11
D/ <strong>LE</strong>S DIFFER<strong>EN</strong>TS MOY<strong>EN</strong>S DE REPRISE<strong>LE</strong>S TIGES DE REVISION CIM<strong>EN</strong>TEESBien que les tiges de révision cimentées aient l’avantage de faciliter la fixation primaireen permettant une mobilisation immédiate, la surface endostée, souvent lisse et sclérotique,empêche une fixation optimale de l’implant du type de celle obtenue en chirurgie primaire.Dohmae et al 25 ont montré que les forces de cisaillement nécessaires pour mobiliser leciment diminuent de 20% après la première reprise et chutent encore de 6% en cas dedeuxième révision. En plus de l’absence d’interdigitation du ciment dans l’os lors d’unereprise avec une tige cimentée, il semble également que la pressurisation du ciment autourd’une longue tige de reprise soit moins bonne.Les résultats obtenus dans différentes séries publiées ne sont pas satisfaisants avec untaux de descellement entraînant une révision, allant de 3 à 38%, pour un recul allant jusqu’à15 ans. Le taux global de descellement radiographique atteint même 53% si l’on inclue lespatients n’ayant pas subi de nouvelle révision 38,70,83,87,109 .L’amélioration des techniques de cimentage (préparation minutieuse du canal,pressurisation optimale du ciment) a permis d’améliorer les résultats de ces reprises. Ce tauxde descellement reste néanmoins élevé, il est de l’ordre de 10% à 9 ans de recul moyen 33,53,99 .Il est également possible, dans des situations particulières, de recimenter un implantfémoral à l’intérieur du fourreau cimenté pré-existant. Cette technique est néanmoins àréserver par exemple à des patients dont l’état général ne permet pas un nettoyage minutieuxde l’ensemble du manteau de ciment .Cette technique à fait l’objet de publications plus oumoins récentes. Lieberman et al 64 n’ont pas retrouvé de re-révision ni descellement desimplants dans une série de 19 patients, à 59 mois de recul. Cependant, Li et al 23 ont constatédans une étude biomécanique que les forces de cohésion étaient significativement diminuéesentre les deux enveloppes de ciment, surtout s’il persistait des débris ou du sang à l’intérieurdu manteau de ciment initial.12
<strong>LE</strong>S TIGES DE REVISION NON CIM<strong>EN</strong>TEESAfin de tenter d’abaisser le taux de descellement des séries de révision cimentées, il aété développé des tiges de révision non cimentées.Les résultats de ces révisions non cimentées ont été publiés et semblent meilleurs dansl’ensemble à ceux des reprises non cimentées. Il faut néanmoins différencier les tiges àtraitement de surface total et celles qui sont à traitement de surface uniquement proximal.En effet, dans les séries utilisant des tiges à revêtement proximal le taux de re-révisionest selon les séries de 3% à 10% à 3 ou 4 ans de recul 65,86 , mais il s’élève à 18 à 42% si lerecul atteint 7 à 8ans 5,30 .Le traitement de surface total permet d’obtenir des résultats plus favorables enpermettant d’optimiser l’ancrage distal. Dans les séries utilisant ce type d’implant, pour unrecul compris entre 4 et 8 ans, le taux de re-révision oscille entre 0 et 6%.Signalons la série d’Essig, utilisant la prothèse modulaire « PP »à traitement de surfacetotal, dans laquelle le taux de ré-intervention est de 7% pour un recul moyen de 6 ans 32 .<strong>LE</strong>S REPRISES AVEC GREFFE IMPACTEELe principe est de cimenter un implant fémoral à l’intérieur d’un lit de greffe morceléeimpactée 28,29,77 .Elle permet dans ces situations, de reconstituer un nouveau canal médullaire grâce àl’impaction d’os à l’intérieur du fût fémoral préexistant. Une tige fémorale peut alors êtrecimentée dans le nouveau canal médullaire, rendant possible une éventuelle désescalade.Cette technique permet une restauration du stock osseux, comme le montrent les étudeshistologiques effectuées après l’ablation des tiges post mortem 45 , ou sur des biopsies 2,91 .Les résultats de cette technique semblent satisfaisants avec un recul atteignant 5 ans. Eneffet, le taux de re-révision dans ces séries ne dépasse 4% 9,28,59,77 .Cette technique, malgré lerisque de fracture fémorale et d’infection, parait donc adaptée aux descellements conservantun fémur plus ou moins continent. Le taux d’enfoncement de l’implant fémoral est néanmoinsimportant mais sans répercussion clinique dans la majorité des cas. Le risque de fracturefémorale serait quant à lui corrélé à la longueur du bras de levier distal 28,29,71,77 . Il est doncrecommandé, si la prothèse est en regard d’une corticale amincie, de la renforcer par uneallogreffe apposée 44,96 .13
<strong>LE</strong>S ALLOGREFFES SEGM<strong>EN</strong>TAIRES MASSIVESIl s’agit d’une technique essentiellement utilisée en France par l’équipe de l’hôpitalCochin (Pr Kerboull, Pr Courpied). Elle est proposée dans les reprises comportant une pertede substance segmentaire étendue, afin de reconstruire l’extrémité supérieure du fémur. Elleest en général associée à une longue tige cimentée. Celle-ci est scellée à la greffe corticale enproximal et au fémur hôte en distal.Courpied 21 a présenté une série de 20 reprises fémorales utilisant cette technique. A unrecul moyen de 5 ans, il rapporte 3 cas de descellement radiologique et un cas de migration dela tige. Il existait 7 cas de résorption partielle de l’allogreffe et 2 cas de résorption majeure.<strong>LE</strong>S PRO<strong>THESE</strong>S NON CIM<strong>EN</strong>TEES MODULAIRESCette technique a été rapportée à partir du système PP en France et par Chandler enAmérique du Nord. Cette technique est fondée sur l’idée de s’adapter aux modifications del’extrémité supérieure du fémur, qu’il s’agisse de déformations de la métaphyse ou de pertede substance.Le système PP recherche un appui le plus proximal possible, mais en zone suffisammentsolide pour stabiliser la tige. La partie prothétique métaphysaire a pour objectif de combler laperte de substance osseuse métaphysaire. La stabilité est assurée par la collerette et surtout parl’appui de la tige quadrangulaire dans le fût fémoral. La tige fémorale possède également untraitement de surface total. Dans une série de 46 reprises, Essig 32 a retrouvé un taux dedescellement de 10%.Chandler, lui, cherche à remplir la métaphyse et à résoudre l’incongruence métaphysodiaphysaire.Il rapporte dans une série de 52 prothèses avec un recul moyen de 3 ans, un tauxde descellement de 10%.Mc Carthy 15 a publié une série de révision utilisant la prothèse modulaire S-ROM® , untaux de ré-intervention de 1,5 % à 5 ans de recul.Chao et Sim 16 ont présenté une série de méga-prothèses modulaires, suivant lareconstruction de l’extrémité supérieure du fémur après exérèse tumorale mais égalementdans des reprises fémorales stade IV 66 . La technique chirurgicale est fondée sur le cimentaged’une tige fémorale associée à des greffes corticales devant induire la reconstruction osseuse.14
<strong>LE</strong>S PRO<strong>THESE</strong>S NON CIM<strong>EN</strong>TEES VEROUIL<strong>LE</strong>ESLe concept de prothèses de reprise de hanche verrouillées a été introduit en France parVives, et par Stossel en Grande-Bretagne 108 . Vives associait initialement à cette tigeverrouillée, une allogreffe impactée morcelée. Actuellement, il a abandonné cette allogreffe etpréfère effectuer une fémorotomie en appliquant le concept de consolidation osseuse aprèstraitement d’une fracture par enclouage verrouillé. Cependant, la transmission des contraintesvers l’extrémité distale de la prothèse, peut entraîner un stress-schielding accru etinhomogène, pouvant aboutir à une faillite de l’implant.E/ STRATEGIE THERAPEUTIQUELa réalisation d’une reprise de prothèse totale de hanche doit tenir compte de multiplesparamètres qui ne concernent pas tous l’acte chirurgical. Dans ce contexte, la planificationpré-opératoire est essentielle.Etat général du patient.L’âge de ces patients est en général supérieur à celui des prothèses de premièreintention. Les comorbidités sont également plus fréquentes, ainsi que les portes d’entréeinfectieuse. Le score ASA est le plus souvent égal à 2 ou 3.La présence d’une boiterie et d’une éventuelle inégalité de longueur des membresinférieurs doit également être noté, car cela peut orienter le choix des implants.Tous ces éléments sont alors pris en considération dans l’analyse bénéfice-risque del’intervention.Arthroplastie initialeLe type de prothèse initiale, le diamètre de la tête fémorale et le mode de fixationdoivent être documentés à l’aide des compte-rendus opératoires ou des registres.Le type de descellementUn descellement global de la tige fémorale n’entraînera que des lésions osseusesminimes lors de l’extraction endo-médullaire de l’implant fémoral. À l’inverse, un15
descellement n’intéressant que l’interface implant-ciment augure d’une extraction difficile etdonc des lésions osseuses secondaires non négligeables qu’il faut savoir anticiper.L’évaluation du stock osseux reste un des facteurs les plus importants dans le choix dela technique chirurgicale. Les classifications les plus fréquemment utilisées sont celles dePaprosky, SoFCOT, AAOS.Puget propose de regrouper les différentes situations chirurgicales en trois niveauxlésionnels pratiques 100 .Niveau I : Pas de perte de substance osseuse significativeCe stade peut être considéré comme une prothèse de première intention. Des techniquesdiverses, comme une tige non cimentée à traitement de surface proximal ou total, une tigecimentée ou même une technique d’impaction de greffe peuvent être utilisées avec desrésultats similaires. Cependant, une atteinte importante du calcar peut rendre nécessairel’utilisation d’un implant modulaire de type PP avec appui transversal trochantérodiaphysaire.Niveau II : Perte de substance osseuse avec métaphyse non continente maisdiaphyse continenteL’utilisation de tiges de révision non scellées à press-fit diaphysaire paraît êtreaujourd’hui la solution de choix. Si l’on souhaite reconstruire la métaphyse dans les cas peudétruits, une technique associant prothèse cimentée et allogreffes morcelées impactées peutêtre utilisée.Niveau III : Métaphyse et diaphyse incontinenteLes tiges verrouillées sans ciment apportent une sécurité immédiate, mais il existe unrisque d’enfoncement à l’ablation des vis ou une rupture de celles-ci par excès de contraintes.On peut également rechercher un blocage fémoral diaphysaire distal autour d’une tige nonscellée et non verrouillée. La reconstruction métaphysaire et diaphysaire est alors de bonnequalité et durable. Le risque d’enfoncement est important pour ce type d’implant.L’allogreffe massive structurelle avec scellement d’une longue tige type Kerboull faitpartie des options possibles si l’on dispose d’une banque d’os 37 .16
F/ ANALYSE DE LA RECONSTRUCTION OSSEUSELes modifications osseuses péri-prothétiques et donc la reconstruction osseuse peuventêtre analysées selon deux moyens techniques distincts : la radiographie conventionnelle et ladensitométrie biphotonique à rayons X.RADIOGRAPHIE CONV<strong>EN</strong>TIONNEL<strong>LE</strong>Des clichés radiographiques standards de face et de profil, de bonne qualité, permettenttout d’abord d’évaluer la stabilité mécanique de l’implant fémoral avec notamment la qualitéde l’interface corticale-implant, la stabilité de l’implant dans le plan axial (enfoncement),frontal et sagittal (index de varisation).La reconstruction osseuse proprement dite est, elle, analysée grâce à la mesure desépaisseurs corticales et de l’index cortical. Les épaisseurs corticales sont mesurées sur lecliché de face (rotule au zénith) du post-opératoire immédiat et à la révision et ceci à troisniveaux : petit trochanter, 5cm et 10 cm en dessous de la collerette d’appui de la tige fémoralesur un axe perpendiculaire à l’axe anatomique du fémur.L’index cortical de Hoffman peut être calculé selon la formule :IC = (Epaisseur corticale interne + Epaisseur corticale externe) X 100Largeur du canal médullaireLes zones de liseré et d’ostéolyse sont également déterminées selon les 7 zonespériprothétiques de Gruen 97 .17
Zones de Gruen de face et de profilD<strong>EN</strong>SITOMETRIE BIPHOTONIQUE A RAYONS X (DPX)Il s’agit d’une technique performante qui permet, in vivo de déterminer de façon précisela densité osseuse péri-prothétique. Elle a été jugée suffisamment précise et reproductiblepour être utilisée dans des publications récentes afin d’évaluer la reconstruction osseuse 57,61 .Cette technique peut également être adaptée aux 7 zones de Gruen comme cela a été faitdans la série de reprises par prothèse de Puget de Nehme 90 .18
G/ TECHNIQUE CHIRURGICA<strong>LE</strong>Le Système PP 101Il s’agit d’un implant initialement imaginé en 1981 pour le traitement chirurgical desfractures trochantériennes comminutives du sujet âgé. Il permettait grâce à son appuidiaphysaire transversal et son faible volume, la reconstruction du massif trochantérien autourde l’embase prothétique ainsi qu’un lever précoce diminuant la morbidité de ce type depathologie.Il trouve alors progressivement une indication préférentielle dans les reprisesd’arthroplastie totale de hanche associées à une perte de substance osseuse de l’extrémitésupérieure du fémur. Le système PP permet une reprise de l’ostéogenèse et une restitution ducapital osseux péri-prothétique.L’appui diaphysaire de cet implant est un appui cortical le plus proximal possible. Cetappui est de niveau variable, ce qui explique le développement d’un système modulaires’adaptant aux différentes situations rencontrées.Le matériel 101Le kit « PP » comprend une tige fémorale et une embase solidarisée par une vis d’union,dont l’appui diaphysaire peut être augmenté par une rondelle. Chaque élément du kit estdisponible dans des tailles variables et c’est en jouant sur les différentes associations possiblesque l’on s’adapte aux différentes situations chirurgicales.En dehors des têtes prothétiques qui sont en chrome cobalt, l’ensemble des pièces estréalisé en alliage de Titane de faible densité, d’Aluminium et de Vanadium connu sous ladésignation de TA 6V. Ce matériel permet une bonne biocompatibilité, une résistance élevéeà la rupture avec un module d’élasticité situé entre ceux de l’acier ou du chrome cobalt et del’os cortical.La tige diaphysaire est longue, de section quadrangulaire, décroissante de proximal endistal. Elle possède également une courbure à concavité postérieure correspondant à lamorphologie anatomique du fémur. Ce dessin permet à la tige d’avoir un effet autobloquantdans deux plans. L’extrémité en sifflet diminue, quant à elle, les contraintes au niveau de lacorticale.L’ostéo-intégration est assurée par un traitement de surface total avec trois rangées derainurages et d’écailles orientées de façon à faciliter l’ablation éventuelle de la tige.19
La tige est surmontée d’une collerette d’appui augmentant la stabilité primaire au niveaude l’ostéotomie transversale. Elle est percée à sa face supérieure de plusieurs orificespermettant de régler l’antéversion du col fémoral. L’antéversion physiologique est repérée parun marquage laser au niveau de la collerette et de l’embase.Cette tige est disponible en 3 longueurs (126/180/270) et initialement, en sept tailles (9 à21mm). La taille 9 a été ensuite retirée du catalogue.Si l’appui osseux de la collerette s’avère insuffisant, des rondelles d’appui de taillesdifférentes peuvent, en théorie, être ajoutées.L’embase possède à sa partie inférieure une cavité tronconique qui reçoit la tigefémorale avec laquelle elle est vissée. Un téton d’antéversion s’adapte aux orifices de la partiesupérieure de la tige fémorale. L’embase est perforée de multiples orifices le long de sesbords médial et latéral permettant la réinsertion des éléments ostéo-musculaires de l’extrémitésupérieure du fémur (le digastrique fessier-vaste externe en dehors, le psoas en dedans insérésur le petit trochanter).Cette embase est disponible en tailles de longueur croissante de 20 à 160 mm.La tête prothétique réalisée en alliage de chrome cobalt s’adapte sur le cône morse ducol de l’embase métaphysaire. Quatre diamètres de tête sont possibles (22/26/28/32) ainsi que4 longueurs de col (court, moyen, long et extra-long sur demande).Voie d’abord et technique chirurgicale 101Nous utilisons dans le service un abord postéro-latéral de l’articulation coxo-fémorale.Le patient est installé en décubitus latéral strict, la hanche à opérer étant en légèreflexion et adduction. Le relief du grand trochanter est alors aisément palpé.L’incision cutanée selon Gibson est rectiligne, légèrement incurvée vers l’arrière et doitêtre centrée en proximo-distal et en antéro-postérieur sur le relief du grand trochanter. Dans lavoie de Moore, la ligne de réflexion se situe deux doigts au-dessous du sommet du grandtrochanter.On incise ensuite, après avoir franchi le tissu sous-cutané, la portion aponévrotique duFascia-Lata. Le muscle Gluteus Maximus (Grand Fessier) est alors discisé dans le sens de sesfibres (Moore) ou désinséré de son insertion sur la bandelette de Maissiat (Gibson). Ensuite,après avoir placé un écarteur de type Charnley, on a le jour sur le digastrique Gluteus Medius-Grand Trochanter-Vastus Lateralis. Le positionnement de la jambe en rotation interne faitalors apparaître en arrière un espace cellulo-graisseux au fond duquel chemine le nerfSciatique. Cette rotation interne du membre inférieur met en tension les muscles pelvi-20
trochantériens rotateurs externes qui se dirigent vers la fossette digitale et la ligne intertrochantériennepostérieure.On peut décider à ce temps de l’intervention de pratiquer une trochantérotomie endigastrique dérivée de la technique d’Osborne et modifiée par Bourgeon et Vidal 102 . Onpratique longitudinalement et dans un plan frontal, d’arrière en avant, une premièreostéotomie à la scie oscillante qui permet d’obtenir une baguette osseuse pédiculée par tousles rotateurs externes. Celle-ci est mobilisée et maintenue en arrière à l’aide d’un écarteur detype Homann. Elle emporte assez souvent le petit trochanter qui est fréquemment très fragilisépar les destructions osseuses de la région. En augmentant encore la rotation interne, aprèsavoir ruginé le vaste externe sur le fémur sans le désinsérer de la crête trochantérienne, legrand trochanter est ostéotomisé dans un plan sagittal. Cette deuxième ostéotomie estperpendiculaire à la première.Ainsi, on libère un ensemble digastrique composé du Gluteus-Medius-Grand trochantervastusLateralis qui peut être mobilisé et maintenu par un deuxième Homann. On obtient alorsun bon jour sur la partie supérieure de la prothèse qui peut être nettoyée des débris habituels.On peut élargir l’abord en sectionnant l’insertion fémorale du grand fessier sur la ligne âpre,tout en laissant environ 1 cm pour la réinsertion en fin d’intervention. L’abord est ainsifacilité pour pratiquer l’ablation de la prothèse et du ciment ce qui diminue le risque de fausseroute. Les deux fragments ostéotomisés qui sont restés pédiculés (grand trochanter et baguettedes rotateurs externes) seront le point de départ de la reconstruction osseuse.Le dernier temps de l’abord consiste, après l’ablation de la prothèse primitive, en larecoupe de la diaphyse fémorale dans la zone qui apparaîtra suffisamment solide pourrecevoir la collerette de la prothèse.21
Cet abord peut être susceptible de variations. La trochantérotomie n’est pas toujoursnécessaire en cas d’extraction aisée de l’implant fémoral descellé. A l’inverse, latrochantérotomie peut évoluer vers une ostéotomie plus étendue ou être associée à unefémorotomie en fonction des difficultés opératoires rencontrées.III NOTRE ETUDEA/ MATERIEL ET METHODEPrésentation de la sérieEntre Octobre 1991 à Septembre 2003, 247 patients ont bénéficié d’une reprise deprothèse totale de hanche. Si on écarte les reprises pour descellement septique et les reprisespar des implants standards, on obtient un total de 146 patients opérés pour des descellementsaseptiques d’arthroplastie totale de hanche utilisant le système PP.A chacun des patients, ont été adressé, par courrier, une ou deux lettres de convocationpour une consultation clinique et un bilan radiologique. Nous avons également adressé uncourrier aux médecins traitants des patients n’ayant pas répondu aux lettres de convocations.A ce jour :- 24 patients sont décédés (17%).- 6 patients n’ont pas pu se déplacer pour des raisons non orthopédiques (accidentvasculaire cérébral récent, démence de type Alzheimer, grabatisation multi-factorielle…).- 20 patients n’ayant pas pu se déplacer pour des raisons de prise en charge financière dutransport ou d’éloignement géographique, ont néanmoins répondu à un questionnaire simpleévaluant la marche, l’utilisation de cannes, le périmètre de marche, la douleur et lasatisfaction.- 39 patients (26%) ont été considérés comme perdus de vue malgré l’envoi de deuxlettres de convocation et d’un courrier au médecin traitant référencé.- 3 patients sont partis à l’étranger.22
Répartition des patients de la sérieL’étude clinique et radiologique porte donc sur un total de 54 hanches opérées d’unchangement de prothèse totale de hanche par la prothèse de reconstruction « PP », dans lecadre d’un descellement aseptique d’une arthroplastie totale de hanche. Pour les patients nonrevus en consultation, le caractère incomplet des observations cliniques et radiologiques nerendait pas possible l’inclusion dans l’étude radio-clinique.L’élaboration des tables et des courbes de survie de Kaplan-Maier prenait en compte latotalité de la série, c’est-à-dire les 146 cas, comprenant les patients revus, les patients ayantrépondu au questionnaire, les décès et les patients perdus de vue.Méthodologie statistiqueLe recueil des données a été effectué sur le logiciel Microsoft Excel®. L’analysestatistique a été réalisée sur Microsoft Excel® et sur le logiciel de statistique SPSS®. Lescourbes et les tables de survie ont été calculées avec le logiciel dédié XL-Stat®.La répartition de chaque paramètre a été étudiée par le calcul de la moyenne, écart-typeet intervalle de confiance à 95% pour un paramètre quantitatif, et par le dénombrement desvaleurs (fréquence d’apparition) pour un paramètre qualitatif.L’analyse à deux variables a été effectuée au moyen de 2 tests :- le test du Chi2 si les deux variables sont qualitatives- le test de comparaison de moyenne par la méthode des couples si les deux variablessont quantitatives.23
1 / Epidémiologie de la sérieL’âge moyen au recul est de 69,8 ans avec des extrêmes allant de 28 à 89 ans.Il existait une nette prédominance féminine avec 38 femmes (70%) et 16 hommes(30%).On retrouve quasiment autant de côtés droits (26) que de cotés gauches (28).Le poids moyen était de 71 kg, la taille moyenne de 164 cm, et l’index de massecorporel moyen de 26,75 (18-40) :- Il existait une surcharge pondérale (24
2 / Etiologie initialeLes étiologies initiales étant à l’origine du remplacement prothétique de la hancheétaient :Arthrose : 15 patients (28%)Luxation congénitale de hanche au stade d’arthrose : 24 patients (44%)Traumatique (fracture cervicale) : 6 patients (11%)Ostéonécrose aseptique de hanche : 2 patients (3%)Rhumatismale (coxite inflammatoire) : 2 patients (3%)Arthropathie hémophilique : 3 patients (5%)Ostéochondrite au stade d’arthrose : 1 patient (1,5%)Désarthrodèse : 1 patient (1,5%)Répartition des étiologies initiales3 / Arthroplastie initialeIl s’agissait dans la majorité des cas d’implants fémoraux cimentés (43 cas), de typeMuller ou Charnley (80%). Dans 10 cas, la tige était non cimentée avec traitement de surface(19%), et dans 1 cas, il s’agissait d’un implant verrouillé dans le cadre d’une reprise itérative.4 / Type de descellement25
Ce descellement était bipolaire dans 41 cas (76%) et uni-polaire dans 13 cas (23%).Il s’agissait d’un descellement aseptique confirmé par la négativité des prélèvementsréalisés systématiquement en per-opératoire.Selon la classification de Vives (SOFCOT 88), l’atteinte fémorale était répartie de lafaçon suivante :Pour le fémurStade 1 : 20 cas (37%)Stade 2 : 17 cas (31,5%)Stade 3 : 14 cas (26%)Stade 4 : 3 cas (5,5%)Pour le trochanterStade 1 : 31 cas (57%)Stade 2 : 2 cas (4%)Grand trochanter non altéré : 21 cas (39%)Il existait également 6 atteintes diaphysaires à plus de 10 cm en dessous du petittrochanter (11%).Selon la classification de l’AAOS, la répartition était :26
Stade 1A1 : 17 cas (31,5%)Stade 1A2 : 8 cas (15%)Stade 1B : 3 cas (5%)Stade 1C : 1 cas (2%)Stade 2A : 6 cas (11%)Stade 2B : 6 cas (11%)Stade 2C : 2 cas (4%)Stade 3 : 9 cas (15%)5 / Intervention et technique chirurgicaleLes interventions ont été effectuées dans le même centre, par 3 opérateurs différents.L’intervention consistait donc en un changement en un temps d’une prothèse totale de hanchedescellée par un implant de reprise de type PP. Cet implant est caractérisé par la modularitédes différents composants (tige et embase essentiellement). La tige est non cimentée, àtraitement de surface total, possédant un appui diaphysaire proximal.L’âge moyen lors de l’intervention était de 60 ans les extrêmes allant de 22 ans à 84 ans.L’évaluation de l’état général retrouvait un score de l’American Society ofAnesthesiology (ASA) égal à 2 en moyenne.27
Les interventions ont été réalisées dans la majorité des cas sous anesthésie générale saufdans un cas ou une rachi-anesthésie a été préférée chez un patient âgé de 84 ans, fragile sur leplan anesthésique.La durée opératoire était en moyenne de 166 minutes.Voie d’abordLa voie d’abord était dans la totalité des interventions un abord postéro-latéral.L’incision cutanée était variable : elle était soit rectiligne selon Gibson (7 cas), soit incurvéevers l’arrière selon Moore (47 cas).Une trochantérotomie en digastrique selon la technique précédemment décrite a étéréalisée dans 34 cas (63%).La fémorotomie selon la technique de Wagner a, quant à elle, été nécessaire dans 18 cas(33%) afin de réaliser soit l’extraction de l’implant fémoral, soit l’ablation du bouchon deciment.Ces différents artifices ont imposé l’utilisation de cerclages de fil d’acier(trochantérotomie et fémorotomie) ou de cerclages de type Partridge® (fémorotomie).Il a été nécessaire de réaliser un fagotage du fémur sur 20 cm dans 1 cas en raison ducaractère très déformé du fémur et de l’élargissement trop important du fût diaphysaire.Au total, chez 12 patients, ni la trochanterotomie ni la fémorotomie n’ont éténécessaires.Réimplantation du cotyleLe changement de prothèse a été bipolaire dans 41 cas (76%).Une greffe osseuse de type allogreffe cortico-spongieuse, autogreffe cortico-spongieuseou spongieuse à été nécessaire au niveau du cotyle dans 18 cas (33%), afin de combler laperte du capital osseux péri-cotyloidien.L’utilisation d’un anneau de soutient (Kerboul, Ganz ou Muller), afin de compléter lagreffe osseuse et de faciliter le recentrage, a été nécessaire dans 21 cas (39%). Un cotylestandard était alors scellé dans cet anneau de soutient.Réimplantation au niveau du fémurLa tigeDans toutes les interventions, nous avons impacté la tige à frottement dur, de façon àobtenir une bonne stabilité primaire.28
La longueur des implants fémoraux la plus utilisée était 180 mm (45cas/83%), l’implant« long » mesurant 270mm a été utilisé 6 fois, et la tige de 126mm n’a été quant à elleimplantée que 3 fois. Celle-ci est actuellement retirée du catalogue.La répartition des tailles des implants fémoraux était suivante :On peut noter que 41 tiges soit 76% des implants étaient des tailles 15,17 et 19.La rondelle permettant d’optimiser l’assise horizontale a été utilisée à 4 reprises (7,4%).Le concepteur conseille aujourd’hui de ne pas utiliser cette rondelle. La stabilitéprimaire de la tige doit provenir de calage diaphysaire proximal. La présence de cette rondellepeut entraîner une fausse impression de stabilité primaire et aboutir à un descellement précocede l’implant fémoral.L’embaseLes tailles d’embase les plus utilisées étaient les embases 20,30 et 40 totalisant 42 cas.L’embase 50 a été utilisée 7 fois, l’embase 70 à 2 reprises.Les tailles 80 et 100 ont été implantées chacune 1 fois.Chez les 12 patients n’ayant pas nécessité de trochantérotomie ni de fémorotomie, lesembases utilisées étaient dans 10 cas des tailles 20 et 30.29
Taille du col et de la tête fémoraleLe col moyen a été utilisé 36 fois et le col long 16 fois. Le col extra-long et le col courtont été utilisés chacun une fois.La tête fémorale 32 mm a été implantée 17 fois, la tête 28 mm 37 fois.Il n’existait pas de différence significative en terme de luxation, descellementcotyloïdien ou de l’implant fémoral entre le groupe utilisant une tête 32 mm par rapport àcelui avec des têtes 28 mm.6 / Complications per-opératoiresLa complication per-opératoire la plus fréquente a été la fracture diaphysaire du fémurlors du passage des râpes d’essai ou de l’implantation de la tige définitive. Elle est survenue à6 reprises dans notre série soit 11%. Elles ont nécessité dans 3 cas un cerclage immédiat dufémur à l’aide de fil d’acier ou de cerclages de type Partridge®. Dans 1 cas, un cerclageassocié à une ostéosynthèse par plaque en raison d’une fracture fémorale supra-condylienneassociée. Il s’agissait dans les 2 autres cas de traits de fracture non déplacés, découverts sur laradiographie post-opératoire. Pour les 3 derniers cas, l’appui a été différé avec mise endécharge pendant 4 à 6 semaines.Nous avons également relevé 2 fractures du petit trochanter et 1 fracture du grandtrochanter per-opératoire qui ont également été traitées par cerclage.30
Lors de l’ablation du bouchon de ciment, du passage des râpes d’essai ou del’implantation de la tige définitive, le risque de « fausse route » est également important. Uncontrôle radiographique per-opératoire était donc réalisé au moindre doute. Il a permis dediagnostiquer 3 fausses routes (5,5%) dans cette série.Parmi les trois cas de fausses routes, 2 n’avaient pas bénéficié d’une trochantérotomie.Au total, dans cette série, nous avons rencontré 12 complications per-opératoires de typefracture ce qui représente 22% des interventions.La survenue d’une fracture n’était liée ni au sexe, ni à la présence d’une obésité, d’unâge élevé lors de l’intervention, d’un stade fémur de la SOFCOT élevé, ni à la réalisation ounon d’une trochantérotomie.La présence d’une fracture per-opératoire ne modifie pas statistiquement les résultatsfonctionnels au recul, que ce soit les scores totaux PMA et HHS ainsi que les sous-scores dedouleur.31
7 / Suites opératoires immédiatesLuxations post-opératoires précocesNous avons observé 5 cas de luxations post-opératoires précoces, c’est-à-dire dans desdélais allant de 2 semaines à 2 mois post-opératoires.Chez un patient, la luxation s’est produite deux fois, à 1 mois et 2 mois suivantl’intervention.Pour 4 patients, la réduction a été réalisée sans difficulté, sous anesthésie, sans aucunretentissement sur les suites opératoires.Pour 1 patient, la réduction a été impossible et a abouti au déstabilisation précoce del’implant cotyloïdien. Une reprise chirurgicale précoce a été nécessaire afin de le remplacerpar un cotyle double mobilité.Il s’agit de la seule reprise chirurgicale précoce toute cause confondue dans notre série.Il n’y avait pas de corrélation significative entre l’âge lors de l’intervention, le scoreASA, l’IMC, la réalisation d’une trochantérotomie, la taille de l’embase mise en place et lasurvenue d’une luxation précoce.Le nombre de prothèses ayant précédé la reprise étudiée est lui statistiquement lié à lasurvenue d’épisodes de luxations post-opératoires (p=0,004).Complications infectieuses précocesIl n’y a pas eu d’infection post-opératoire précoce dans notre série.Durée d’hospitalisation et sortieLa durée d’hospitalisation dans le service était en moyenne de 18 jours (9-31).Les patients ont été transférés en centre de rééducation dans 46 cas (86%) et enétablissement de moyen séjour dans 4 cas.Le retour à domicile a été possible pour 4 patients.32
8 / RévisionTous les patients de la série ont été revus en consultation pour ce travail avec uninterrogatoire et un examen clinique. Cela nous a permis de calculer pour chacun :- le score fonctionnel Harris Hip Score 42 (HHS) fondé sur l’évaluation de ladouleur, la fonction, les mobilités de hanche ainsi que les attitudes vicieuses. Il est coté sur untotal de 100 points.- Inférieur à 70 : mauvais- Entre 70 et 79 : correct- Entre 80 et 90 : bon- Entre 90 et 100 : excellent- le score fonctionnel de Postel et Merle d’Aubigné 78 (PMA) qui évalue la douleur,la mobilité de la hanche avec ou sans attitude vicieuse et la marche (cotation sur 18).- un indice subjectif de satisfaction allant de 1 (insatisfait) à 5 (très satisfait).La présence d’une douleur située au niveau de la cuisse a également été notée. L’étudede la station debout et de la marche a permis de déceler une boiterie de type Trendelenburg ouune attitude vicieuse ainsi que d’apprécier une éventuelle inégalité de longueur des membresinférieurs.La classification de Charnley a été réévaluée à la révision afin de noter les modificationsdes facteurs pouvant compromettre la marche par rapport à l’intervention.Un bilan radiographique complet a été réalisé comprenant :- un cliché de bassin de face en charge- les radiographies de hanche face et profil incluant la totalité de la prothèse- un cliché pangonométrique réalisé en charge33
9 / Analyse radiologiquePré-opératoireDétermination sur la radiographie pré-opératoire du stade de descellement de l’implantfémoral selon les classifications de la SOFCOT 88 modifiée et de l’AAOS.Post-opératoire immédiat- Mesure de la distance entre le sommet du grand trochanter et la pointe de la tigefémorale.- Détermination de la position de la tige par rapport à l’axe fémoral dans le plan frontal,sur le cliché de face (Normale, Varus ou Valgus supérieur à 5°).- Évaluation des zones de contact entre la tige et l’os cortical de face et de profil selonles zones de Gruen précédemment décrites.- Mesure des épaisseurs corticales interne et externe ainsi que de la largeur du canalmédullaire à différents niveaux :- petit trochanter- 5 cm sous le petit trochanter- 10 cm sous le petit trochanter- Mesure de la tête fémorale afin d’établir un facteur de correction pour pouvoir calculerles valeurs réelles d’épaisseur corticale et de distance entre grand trochanter et pointe de latige.- Calcul de l’index cortical selon Hoffman 46 pour chaque niveau (petit trochanter, 5 cmet 10 cm sous le petit trochanter).- Calcul du taux de remplissage du canal fémoral au petit trochanter et 5 cm :Diamètre de la tigeTaux de remplissage du canal médullaire = -------------------------- X 100Largeur du canalNous n’avons pas calculé le taux de remplissage à 10 cm en dessous du petit trochanteren raison de l’impossibilité de mesurer de façon fiable la largeur de l’extrémité distale de latige PP. Le dessin quadrangulaire, l’affinement distal de la tige associés à des incidencesradiographiques variables rendaient difficile cette mesure.34
B/ RESULTATSLe recul moyen dans cette série était de 109 mois soit 9 ans avec des extrêmes allant de3,5 ans à 17 ans, la déviation standard étant de 49,3 mois.L’âge moyen au recul était de 69,8 ans, les extrêmes allant de 28 à 89 ans et la déviationstandard étant de 11,5 années.1 / Reprises chirurgicalesAu recul, il y a eu au total 18 reprises chirurgicales (33%):- 6 reprises n’intéressant que le cotyle en raison d’un descellement associé ou non àune usure excessive du polyéthylène. Sur ces 6 reprises, 3 cas correspondaient initialement àdes changements unipolaires intéressant uniquement l’implant fémoral.- 4 reprises bipolaires pour un nouveau descellement bipolaire aseptique des implantsfémoraux et cotyloïdiens. Parmi ces réinterventions, une a été effectuée dans un autre centreavec une allogreffe massive d’extrémité supérieure de fémur et un implant fémoral d’uneautre conception.- 1 reprise isolée d’une tige fémorale pour une fracture et un descellement associé del’implant fémoral.- 1 réintervention pour changement de taille d’embase et de longueur de col pour desépisodes de luxation tardive.- 1 réintervention afin de traiter une pseudarthrose du grand trochanter symptomatique,par une décortication et de nouveaux cerclages.- 1 lavage chirurgical pour un sepsis tardif.- 4 changements de prothèse en deux temps pour des sepsis avérés.36
Parmi les 4 patients ayant bénéficié de l’utilisation de la rondelle complémentaire afinde compléter l’appui transversal, un seul a présenté un descellement de la tige fémorale. Ils’agissait d’une des reprises bipolaires à un délai de plus de 7 ans.Délai de la reprise chirurgicaleNous avons calculé le délai séparant la nouvelle reprise chirurgicale du changementinitial de prothèse. Il était en moyenne de 57,6 mois (4,8 ans), les extrêmes allant de 12 mois(1 an) à 170 mois (14 ans).Si l’on étudie à part les reprises pour complications septiques (4 changements en 2temps et un lavage chirurgical), ce délai est alors de 39,4 mois (3,3ans), les extrêmes allantde 24 mois (2 ans) à 84 mois (7 ans).Complications infectieuses tardivesNous avons dénombré 5 sepsis sur prothèse (9%) pour lesquels un changement deprothèse en 2 temps a été réalisé dans 4 cas. Il était effectué dans un premier temps la déposede la prothèse puis la mise en place d’une Spacer en ciment et d’une antibiothérapie adaptéependant au moins 3 mois et enfin une réimplantation d’une nouvelle prothèse. Dans 1 cas, letraitement retenu a été un lavage chirurgical soigneux de la prothèse et une antibiothérapieadaptée et prolongée.37
Nous n’avons pas retrouvé de corrélation statistique entre la survenue d’unecomplication septique tardive et :- le sexe- l’IMC- l’âge lors de l’intervention- le score ASA- le caractère bipolaire de la révision- la durée opératoire- la réalisation d’une trochantérotomie- le nombre d’intervention précédant la reprise- la présence d’une complication opératoire.Luxation tardiveNous avons observé 5 luxations tardives dans cette série. Dans 2 cas, il s’agissait d’uneauthentique instabilité prothétique à distance de l’intervention et elles ont toutes les deuxbénéficié d’une réintervention. Pour les 3 autres cas, il s’agissait de luxations précoces suivantla reprise chirurgicale pour un autre motif.Il n’existait pas de relation statistiquement significative entre pseudarthrose du grandtrochanter et luxation tardive (p=0,545).Survie de l’implant fémoralBien qu’il y ait eu 18 reprises chirurgicales, il n’y a eu que 9 reprises de l’implantfémoral. Il s’agissait dans 4 cas d’un changement en 2 temps pour une complication septique.Dans 4 cas, il s’agissait d’un nouveau descellement bipolaire. Dans 1 cas, la tige fémoraleétait fracturée et descellée nécessitant le changement de l’implant fémoral uniquement.Fracture de l’implantNous avons constaté un cas de fracture de l’implant fémoral. La fracture de l’implants’était produite à la jonction entre la tige proprement dite et la collerette d’appui. Il s’agissaitd’une tige de petit diamètre (taille 9). Cette taille qui a été retirée du catalogue par la suite.Récidive du descellementUn nouveau descellement non septique de la prothèse totale de hanche s’est produit à 11reprises. Il était bipolaire dans 4 cas, unipolaire intéressant uniquement le cotyle dans 5 cas et38
unipolaire n’intéressant que le fémur dans 2 cas. Dans cette dernière catégorie, un des patientsa été réopéré et l’autre patient refuse pour l’instant toute nouvelle intervention.Le descellement de l’implant fémoral n’était pas lié statistiquement à l’IMC, à l’âge dupatient, au stade fémur de la SOFCOT.Autres complicationsNous signalons dans 4 cas, un dévissage de la vis unissant l’embase et la tige. Celle-ciétait soit dévissée soit complètement désadaptée de l’embase. Il n’existait néanmoins pas dedémontage de l’implant fémoral. Cette complication radiologique était dans tous les cas sansrépercussion clinique.Ces 4 cas correspondaient tous à des embases de petite taille (3 embases de 20 et 1embase de 30).2 / Résultats cliniquesScores fonctionnels* HHS (Harris Hip Score)Au recul, le score de Harris moyen était de 71 points. Les valeurs minimales etmaximales étaient respectivement de 21 et 98 points. La déviation standard a été calculée à18,2 points. Le score maximal possible étant de 100 points.Le sous-score fonction était en moyenne de 28 (4-46 et DS=10) pour une valeurmaximale théorique de 46 points.Le sous-score clinique (intégrant le score de douleur et de mobilité) atteignait unemoyenne de 42 points pour un maximum possible de 54 (15-54, DS=9,7).Le Score total de Harris était supérieur ou égal à 70 (résultat correct) dans 33 cas soit61% de la série. Il était supérieur à 90 (excellent résultat) dans 8 cas (15%).Pour 6 patients, le HHS était inférieur à 50 points.39
* PMA (Score de Postel et Merle d’Aubigné)Le score fonctionnel PMA évaluant la douleur, la mobilité de la hanche avec ou sansattitude vicieuse et la qualité de la marche, était en moyenne 12,8 points (4-18, DS=3,6).Le score moyen douleur était de 3,8 points (0-6 et DS=1,9).Le score moyen de mobilité était de 5,1 (1-6 et DS=1,1).Le score moyen de marche était de 3,9 (0-6 et DS= 3,6).Indice de SatisfactionCet indice subjectif est coté de 1 à 5 selon la satisfaction ressentie par le patient(insatisfait, pas très satisfait, moyennement satisfait, satisfait, très satisfait).L’indice moyen de satisfaction dans la série était de 4 (satisfait).Le nombre de patients dont l’indice était supérieur à 3, c'est-à-dire satisfait ou trèssatisfait était de 38 soit 70% des patients.3 patients était cotés 1 (pas satisfait) soit 5%.Douleurs de cuisseLors de la révision, nous avons retrouvé 16 douleurs localisées à la cuisse (29,6%).Dans 2 cas, la tige implantée était une tige longue mesurant 270 mm. Les autres cascorrespondaient à des implants fémoraux de longueur standard (180mm) et à une tige delongueur 126mm.Dans 3 cas, l’implant fémoral était varisé de plus de 5 degrés par rapport à l’axe dufémur sur la radiographie de face lors de la révision.Il n’existait pas de corrélation significative entre la présence de douleurs de cuisse et lamise en place d’une tige longue de 270mm, la réalisation d’une fémorotomie, la présenced’une tige varisée à la révision ou la présence d’une fracture per-opératoire.BoiterieL’insuffisance du moyen fessier à l’origine de la boiterie de Trendelenburg a été évaluéeen consultation lors de la marche et de la position debout en appui monopodal.Pour 4 patients, la marche était impossible et la boiterie n’a pas donc pu être évaluée.Chez les patients déambulants, nous avons retrouvé 27 cas soit 50% d’insuffisance dumoyen fessier entraînant une boiterie de Trendelenburg.Statistiquement, cette boiterie de Trendelenburg n’est pas significativement corrélée àla présence d’une inégalité des membres inférieurs (p=0,409) ni à la réalisation d’une40
trochantérotomie (p=0,399). Elle est cependant significativement liée à la présence d’unepseudarthrose du grand trochanter (p=0,031).Evolution du statut « Charnley »A la révision, 22 patients étaient classés Charnley A (41%), 27 patients étaient de stadeCharnley B (50%) et 5 patients Charnley C (9%).Il y a eu un changement de statut Charnley dans 13 cas (24%) :- 9 cas d’évolution du stade A vers le stade B.- 4 cas d’évolution vers le stade CÉvolution du stade Charnley.41
Patients perdus-vivantsIl s’agissait des patients n’ayant pas pu se déplacer à la consultation de révision, maisqui ont répondu directement ou par l’intermédiaire de leur médecin traitant à un questionnairesimple. Ce questionnaire évaluait la qualité de la marche, l’utilisation de cannes, le périmètrede marche, l’autonomie pour la toilette personnelle et la satisfaction.Nous avons eu 20 patients dans ce cas, ce qui représente 32% des patients non revuscliniquement en consultation.MarcheLe périmètre de marche était limité à l’intérieur de l’habitation dans 5 cas. Il était limitéà 500 mètres chez 7 patients et illimité ou supérieur à 500 mètres dans 8 cas.CannesElles étaient nécessaires à la déambulation dans 11 cas (55%).DouleurElle était absente dans 6 cas (30%). Chez 11 patients, la douleur était considérée commemodérée (55%). Elle était sévère dans 3 cas.Toilette16 patients étaient autonomes pour effectuer leur toilette (80%) et 4 patientsnécessitaient l’aide d’une tierce personne.Satisfaction14 patients se considéraient satisfaits de leur intervention (70%) et 6 patients étaientinsatisfaits. Parmi les patients non satisfaits, un patient souffrait essentiellement d’unelombosciatique invalidante.3 / Résultats radiologiquesPositionnement de l’implant fémoralLe positionnement de l’implant fémoral dans le plan frontal par rapport à l’axe du fémura été analysé sur les clichés post-opératoires immédiats et à la révision.Nous avons retrouvé en post-opératoire immédiat, 6 cas de tiges fémorales varisées deplus de 5 degrés (9%). Trois de ces patients ont subi une nouvelle intervention. Pour 1 cas, ils’agissait d’une fausse route avec effraction de la corticale antérieure à 7 ans de l’interventionet pour laquelle il a été réalisé uniquement un changement de tige. Les 2 autres cas42
correspondaient pour l’un à une reprise bipolaire pour un descellement global de la prothèseet pour l’autre à une reprise de cotyle uniquement.A la révision, 6 tiges étaient varisées et 1 tige valgisée.La tige valgisée correspondait au changement d’une tige initialement varisée ayantentraîné une fausse route.Dans ce groupe de tiges varisées, le score HHS était de 69 points et le sous-scoredouleur de 32 points. Le score PMA était de 12 points en moyenne et le sous-score/douleur de3,5 points.Il n’existait de corrélation significative de la présence d’une tige varisée au recul avec :- Poids : p=0,289- Stade Fémur SoFCOT : p=0,068- Réalisation d’une trochantérotomie : p=0,857- Diamètre de la tige : p=0,179- Sous-score de HHS/douleur : p=0,773- Sous-score PMA/douleur : p=0,527- Score HHS : p=0,823- Score PMA : p=0,731- Indice de satisfaction : p=0,862La présence d’une tige varisée était par contre significativement corrélée à l’index demasse corporel (p=0,046).Qualité de l’ancrage distalLa qualité de l’ancrage distal de l’implant fémoral a été notée selon 3 types (tige libre,englobement et console-piédestal). La tige était libre dans 28 cas (52%), englobée dans 11 cas(20%) et était de type « console » dans 15 cas (28%).Migration et enfoncement de la tigeLa migration de l’implant fémoral et notamment son enfoncement dans le futdiaphysaire a été évaluée par la mesure de la distance entre le sommet du grand trochanter etla pointe de la tige.Nous avons exclu de cette mesure, les cas où la tige a été reprise et les cas présentantune pseudarthrose associée à une migration du grand trochanter.L’enfoncement moyen de la tige était de 5 mm (0-16mm).43
Inégalité de longueurNous avons relevé dans notre série 27 inégalités de longueur des membres inférieurssupérieures ou égales à 1cm, elles concernaient le coté opéré dans 63% des cas et elles étaienten moyenne de 0,83 cm.Consolidation trochantérienneNous rappelons que la trochantérotomie en digastrique a été réalisée à 34 reprises(63%).Sur ces 34 trochantérotomies, 19 ont consolidé.Dans 14 cas, l’évolution s’est faite vers une non continuité osseuse du grand trochanter(26% de la série).Deux patients ont bénéficié d’une reprise chirurgicale (décortication et nouveauxcerclages). Un des patients a consolidé, l’autre cas est à moins de 6 mois de cette nouvelleintervention.Parmi les 12 patients non repris, 6 présentaient une pseudarthrose serrée avec noncontinuitéosseuse, mais continuité fonctionnelle et 6 patients présentaient une véritablepseudarthrose avec migration du grand trochanter.Dans ce groupe de patients :- Le score HHS moyen (66,08) était inférieur au score HHS de la série (71 points).- Le sous-score HHS/fonction (26 points) était également inférieur à la moyenne de lasérie (28 points).- Le sous-score HHS/douleur (35 points) était lui supérieur au score douleur moyen dela série (33 points).-Nous n’avons pas retrouvé de différence significative de scores fonctionnels (HHS etPMA) entre le groupe avec pseudarthrose du grand trochanter et le groupe sanspseudarthrose ni entre le groupe avec pseudarthrose serrée et le groupe sans pseudarthrose.Chez un patient, il existait une lyse quasi-complète du grand trochanter. Il s’agissaitd’un patient étant à 1 an d’une reprise en 2 temps pour sepsis sur prothèse.44
Contact corticalNous avons étudié les zones de contact entre la tige de la prothèse et les corticalesfémorales. Cette analyse a été réalisée selon les zones de Gruen de face et de profil. Ces zonessont cotées de 1 à 7 sur la face et de 8 à 14 sur le profil.Post-opératoire immédiatSur la faceZone 1 2 3 4 5 6 7Pourcentage 0 74% 43% 0 24% 85% 0* Sur le profilZone 8 9 10 11 12 13 14Pourcentage 0 76% 50% 0 20% 85% 0Répartition pré-opératoire des zones de contact os-prothèse de face et de profil0%0%0%0%74%85%76%85%43%24%50%20%0%0%45
Au recul* Sur la faceZone 1 2 3 4 5 6 7Pourcentage 0 85% 52% 11% 35% 87% 0* Sur le profilZone 8 9 10 11 12 13 14Pourcentage 7% 74% 48% 7% 24% 85% 0Répartition au recul des zones de contact os-prothèse0%0%7%0%85%87%74%85%52%35%48%24%11%7%La présence d’un contact cortical en zone 6 et 11, à la révision, était liée statistiquementà la survenue de douleurs de cuisse avec respectivement p=0,027 et p=0,031.46
Liseré* Sur la faceZone 1 2 3 4 5 6 7Pourcentage 68% 7% 4% 5% 5% 5% 52%* Sur le profilZone 8 9 10 11 12 13 14Pourcentage 59% 7% 4% 5% 4% 7% 54%Répartition des zones de liseré à la révision68%52%59%54%7%5%7%7%4%5%4%4%5%5%Il existait une relation statistiquement significative entre la présence d’un liseré enzones 3, 9, 10, 12 et 13 et la présence de douleurs de cuisse avec 0,022
Corticale déficiente* Sur la faceZone 1 2 3 4 5 6 7Pourcentage 22% 7% 6% 0% 0% 7% 15%* Sur le profilZone 8 9 10 11 12 13 14Pourcentage 19% 4% 4% 2% 2% 2% 20%Répartition des zones de corticales déficiente22%15%19%20%7%7%4%2%6%0%4%2%0%2%La présence d’une corticale déficiente dans les différentes zones de Gruen ne modifiaitpas la proportion de douleurs de cuisse.48
Epaisseur corticale et reconstruction osseuseLes épaisseurs corticales et les index corticaux ont été mesurés et calculés en postopératoireimmédiat et à la révision à 3 niveaux différents (petit trochanter, 5 cm et 10 cm).Post-opératoire immédiat* Petit trochanterLes épaisseurs moyennes des corticales interne et externe étaient respectivementde 4,1mm (0,85-11,38, DS=2,65) et 4,3mm (0-12, DS=2,9).La largeur du canal médullaire était en moyenne de 29,7mm (12,5-50, DS=9,1).L’index cortical de Hoffman au petit trochanter en post-opératoire immédiat a étécalculé à 33,8 (4,7-119, DS=25,7).* à 5 cm en dessous du petit trochanterLa corticale interne mesurait en moyenne de 5,2mm (0,9-12,8 et DS=2,4).La corticale externe mesurait en moyenne 5,3mm (0,82-10,26, DS= 1,91).La largeur du fût diaphysaire était de 17,4mm (9,8-24,3 et DS=4).L’index cortical a été calculé à 63,5 (15-157 et DS=29,8).* à 10 cm en dessous du petit trochanterLes mesures moyennes étaient pour la corticale interne de 5,8mm (0,9-15,1 etDS=2,6) et pour la corticale externe de 5,5mm (0-9,9 et DS=2,2).La largeur du canal fémoral était de 14,6mm (8,8-22,8, DS=3).L’index cortical était calculé à 83,2 (17-182, DS=37,9).Révision*petit trochanterLes mesures réalisées sur les clichés à la révision étaient :- Corticale interne : 5,7mm (0-12,7 et DS=3,4).- Corticale externe : 5,4mm (0-13,1 et DS=3,2).- Largeur du canal médullaire : 27,7mm (13,9-47,7 et DS=8,2)- Index Cortical : 46,2 (0-130 et DS=30,7)49
* à 5 cm au-dessous du petit trochanter- Corticale interne : 5,8mm (0,9-10,7 et DS=2,1).- Corticale externe : 6,3mm (1,6-14,4 et DS=2,8).- Largeur du canal médullaire : 17,1mm (8,5-24,6 et DS=3,8).- Index Cortical : 76,3 (20-200, DS=36,9).* à 10 cm au-dessous du petit trochanter- Corticale interne : 6,2mm (0,8-12,2 et DS=2,35).- Corticale externe : 6mm (1,4-11,9 et DS=2,4).- Largeur du canal médullaire : 15,6mm (5,9-25,2 et DS=4,2).- Index Cortical : 87,4 (12,5-243 et DS=43,3).Comparaison post-opératoire immédiat et à la révision* petit trochanter- L’épaisseur de la corticale interne est passée de 4,1mm à 5,7mm. Ce gaind’épaisseur de 1,53 mm est statistiquement significatif avec t=3,2 et p=0,002- L’épaisseur de la corticale externe est passée de 4,3mm à 5,4mm soit un gain de1,05 mm. Cette différence est significative avec t=2,536 et p=0,014- La largeur du canal médullaire est passée de 29,7mm à 27,7 mm. La variation estsignificative, t=2,225 et p=0,031- L’Index Cortical est passé de 33,8 à 46,2 ce qui représente une augmentation de11,97 points. Cette différence est très significative, t=3,203 et p=0,002.* à 5cm en dessous du petit trochanter- L’épaisseur moyenne de la corticale interne est passée de 5,2mm à 5,8mm. Elle adonc augmenté de 0,54 mm et cette différence est significative avec t=2,357 et p=0,022- L’épaisseur moyenne de la corticale externe est passée de 5,3mm à 6,3mm soit ungain de 10 mm. La variation est significative, t=2,66 et p=0,01- La largeur moyenne du canal médullaire est passée de 17,4mm à 17,1mm. Ici lavariation n’est pas significative, t=0,299 et p=0,766- L’Index Cortical est passé de 63,5 à 76,3 soit une augmentation de 11,8 points. Ladifférence est significative avec t=2,436 et p=0,018.50
* à 10cm en dessous du petit trochanter- L’épaisseur moyenne de la corticale interne est passée de 5,8mm à 6,2mm. Ladifférence est non significative avec t=1,213 et p=0,231- L’épaisseur moyenne de la corticale externe est passée de 5,5mm à 6mm. Cettevariation de 0,58 mm est ici juste significative, t=2,007 et p=0,05- La largeur moyenne du canal médullaire est passée de 14,6mm à 15,6mm. Ladifférence est statistiquement significative, t=2,379 et p=0,021.- L’Index Cortical est passé de 83,2 à 87,4 soit un gain de 2,58 points. La différenceest par contre non significative avec t=0,473 et p=0,638.Il existe donc dans notre série, une augmentation statistiquement significative del’épaisseur des corticales interne et externe au niveau du petit trochanter et à 5 cm endessous du petit trochanter. Ce résultat est confirmé par l’augmentation significative del’index cortical de Hoffman à ces 2 niveaux.Au niveau 10 cm sous le petit trochanter, les résultats ne sont pas homogènes.L’augmentation d’épaisseur de la corticale externe est juste significative alors que lesvariations d’épaisseur de la corticale interne de d’index cortical ne sont passtatistiquement significatives.Il existait une augmentation significative de gain d’épaisseur de la corticaleinterne au niveau du petit trochanter entre le groupe ayant un stade « fémur » 1 ou 2 etle groupe présentant un stade « fémur » 2 ou 3 de la classification SOFCOT (p=0 ,012).Ce n’était pas le cas pour les autres mesures d’épaisseur corticale.En ce qui concerne les largeurs de canal médullaire, on note que cette mesurediminue de façon significative au niveau du petit trochanter et augmente, également defaçon significative au niveau 10 cm au dessous du petit trochanter. La variation delargeur au niveau 5 cm au-dessous du petit trochanter est, elle, non significative.51
Gain d’épaisseur et d’index corticalMoyenne Ecart-typeCorticale médiale-petit trochanter 1,53 mm 3,38Corticale latérale-petit trochanter 1,05 mm 3,00Corticale médiale-5cm 0,54 mm 1,67Corticale latérale-5cm 0,99 mm 2,7Corticale médiale-10cm 0,35 mm 2,13Corticale latérale-10cm 0,58 mm 2,08Index de Hoffman- petit trochanter 11,97 26,7Index de Hoffman-5cm 11,79 34,56Index de Hoffman-10cm 2,58 39,11Taux de remplissageEn post-opératoire immédiat, le taux de remplissage de la tige à l’intérieur du fûtfémoral était, en moyenne, de 61,2% au petit trochanter et de 97,3% à 5 cm en dessous dupetit trochanter. Au recul, ils étaient respectivement de 64,2% et 99,6%.Il n’y avait pas d’augmentation significative de ce taux entre la phase post-opératoireimmédiate et le recul. Il n’y avait pas non plus de différence significative de taux deremplissage entre les tiges de diamètre supérieur ou égal à 17 et les tiges plus minces.Ossifications hétérotopiques péri-prothétiquesLa présence d’ossifications péri-prothétiques a été notée lors de l’analyse du bilanradiographique de la révision.Elles étaient évaluées selon la classification de Brooker précédemment décrite.Il n’existait pas d’ossification autour de la prothèse chez 30 patients (56%).Elles étaient présentes et de stade 1 dans 13 cas (24%).Les ossifications péri-prothétiques pelviennes ou de l’extrémité supérieure du fémurdistantes de moins d’1 cm (Brooker 2) intéressaient 8 patients (15%).Les patients cotés Brooker 3 et 4 étaient respectivement au nombre de 2 et 1 cas (5%).Aucun des patients dans cette série n’a bénéficié d’une nouvelle intervention afin detraiter spécifiquement ces ossifications péri-prothétiques.Il n’existait pas de différence significative de scores fonctionnels (HHS, PMA,satisfaction) entre le groupe présentant un stade de Brooker supérieur à 1.52
Répartition des ossifications péri-prothétiques selon Brooker.53
C/ COURBES DE SURVI<strong>EN</strong>ous signalons que les tables et les courbes de survie ont été calculées à partir de latotalité de la série, c’est-à-dire 146 patients car elles tiennent compte des décès et des perdusde vue.Nous avons utilisé la méthode de Kaplan-Maier pour calculer les courbes de survieactuarielle selon 3 évènements : reprise de l’implant fémoral (toutes causes confondues),reprise de l’implant fémoral en dehors de complication septique, descellement aseptique del’implant fémoral avec ou sans reprise.Reprise de l’implant fémoral, toute cause confondue10,90,80,70,60,50,40,30,20,100 2 4 6 8 10 12 14 16 18 20Nombre d'annéesA 5 ans, le taux de survie en considérant l’évènement « Reprise de l’implant fémoral »,quelque soit la cause était de 90,2% +/-5,3. A 10 ans, ce taux de survie était de 84,7% +/-7,3.54
Reprise de l’implant fémoral en dehors d’évènement infectieux10,90,80,70,60,50,40,30,20,100 2 4 6 8 10 12 14 16 18 20Nombres d'annéesLe taux de survie cumulée en considérant l’évènement « Reprise de l’implant fémoral endehors d’un évènement infectieux » était à 5 ans de 95,1%, +/-3,9. A 10 ans, le taux de survieétait de 92,5% +/-5,2Descellement aseptique de l’implant fémoral10,90,80,70,60,50,40,30,20,100 2 4 6 8 10 12 14 16 18 20Nombre d'annéesLe taux de survie cumulée en considérant l’évènement « Descellement aseptique del’implant fémoral » était à 5 ans de 95,1% +/-3,9. Ce taux était de 90% +/-6,1 à 10 ans.A 15 ans, ce taux chute à 78,2% +/-15,2.55
Reprise implantfémoralReprise implant fémoralaseptiqueDescellement aseptiqueimplant fémoral5 ans 90,2% (+/-5%) 95,1% (+/-4%) 95,1% (+/-4%)10 ans 84,7% (+/-7%) 92,5% (+/-5%) 90% (+/-6%)15 ans 78,2% (15%)Taux de survie selon l’évènementD/ DISCUSSIONMéthodologieIl s’agissait ici d’une étude rétrospective sur dossiers, elle est donc soumise à certainescritiques méthodologiques.Il existe ainsi un biais de recrutement en raison de la multiplicité des étiologies, destades de descellement variable ou encore du nombre d’interventions antérieures. En effet,Kavanagh a montré que la qualité du résultat final était dépendante du nombre d’interventionsayant précédé la reprise chirurgicale étudiée 55 .Ce travail correspond à une série multi-opérateur mais mono-centrique, ce qui peutinfluencer la qualité du résultat. Cela représente un biais de performance.Le biais de susceptibilité est lui bien contrôlé par la mise en place d’un implant uniquechez tous les patients de la série.La taille de l’échantillon étudiée est supérieure à 30 permettant l’adoption del’hypothèse d’une distribution normale et donc d’utiliser les tests statistiques classiques.Le nombre de perdus de vue est important, ce qui peut nuire à la fiabilité de l’analysestatistique.L’examinateur ayant recueilli les données était différent des opérateurs et n’était nipromoteur ni concepteur de matériel implanté. Ceci doit en principe augmenter l’objectivitéde l’étude.56
Nous avons décidé de comparer ce travail à différentes séries récentes de reprisesd’arthroplastie de hanche utilisant des techniques différentes, mais dans lesquelles il existaitune homogénéité des implants :-Les reprises cimentées (Katz 53 ) utilisant les dernières techniques de cimentage.-Les reprises cimentées associées à une greffe osseuse impactée (Gie 34 ) selon latechnique d’Exeter.-Les reprises cimentées avec greffe osseuse selon la technique d’Exeter modifiée(Migaud 80 ) avec mise en place d’un treillis métallique endofémoral.-Les reprises non cimentées avec tiges verrouillées comme la tige Ultime® (May 72 )-Les reprises non cimentées utilisant différents implants*Wagner® (Boisgard 8 / implant fémoral non scellé à ancrage distal)*S-Rom® (Chandler 15 , McCarthy 75 / implant modulaire non cimenté)*PP® (Essig 32 / Tige modulaire à traitement de surface total)*JRI® (Raman 103 / implant à revêtement d’hydroxyapatite proximal)*PFMR® (Le Béguec 62 / implant modulaire et concept Press-fit)EffectifLe travail que nous avons réalisé était basé sur la revue clinique et radiologique de 54cas de révision de prothèse totale de hanche. Cet effectif associé à un recul moyen supérieur à5 ans permet d’établir les tables et les courbes de survie dans cette série. Il est sensiblementcomparable à ceux des séries de Boisgard 8 (n=52), Chandler 15 (n=52), Essig 32 (n=42) et Gie 34(n=68).AgeL’âge moyen lors de la révision était dans notre série de 60 ans, les extrêmes allant de28 à 89 ans. Dans les différentes séries que nous avons citées, l’age moyen était le plussouvent supérieur ou égal à 60 ans. Seule la série de Migaud 80 présentait un age moyen aurecul de moins de 60 ans (58 ans).On peut expliquer cet age précoce dans notre série par le fait que dans 44% des cas,l’étiologie initiale ayant motive la mise en place de la première arthroplastie totale de hancheétait une maladie luxante de la hanche. Il s’agissait donc de jeunes patients.57
Année Technique et Implants Effectif Recul Age moyenKatz 1997 Tige Cimentée 83 11,9 ans 64 ansGie 1993 Allogreffe impactée et tige Cimentée 68 2,5 ans 68,8 ansMigaud 1997Allogreffe morcelée, impactée et tigeCimentée avec treillis19 6,9 ans 58 ansMay 2006 Tige Verrouillée (Ultime®) 101 6 ans 72,3 ansBoisgard 2001 Tige non Cimentée (Wagner®) 52 3,6 ans 70 ansChandler 1995 Non Cimentée, modulaire (S-Rom®) 52 3 ans 60 ansMcCarthy 2007 Non Cimentée, modulaire (S-Rom®) 67 14 ans -Essig 1993 Non Cimentée, modulaire (PP®) 42 4 ans 65 ansLe Béguec 2002 Non cimentée, modulaire (PFM-R®) 152 3 ans 75 ansRaman 2005 Non cimentée (JRI®) 86 8 ans 71 ansNotre Série 2007 Non Cimentée, modulaire (PP®) 54 9 ans 60 ansReculD’un point de vue clinique, un recul moyen de 2 ans est un minimum à la fois nécessaireet suffisant pour apprécier un résultat dans sa forme définitive. En effet, l’état clinique d’unpatient n’évolue guère après un an (en l’absence de complications) et tout au plus, on peutnoter une légère diminution de la boiterie ou une amélioration de quelques degrés de laflexion, si le patient n’est pas handicapé par sa hanche controlatérale. En ce qui concerne lesdouleurs, celles-ci sont en règle générale absentes après un an d’évolution. Si elles persistentaprès ce délai, il faut rechercher un descellement de la tige ou du cotyle. Si ce n’est pas le cas,on peut alors évoquer des fémoralgies liées à la mise en place d’un implant sans ciment.Sur le plan radiologique, un recul moyen de 2 ans est nécessaire pour apprécier lespremiers résultats, en sachant que, s’il est possible dans cet intervalle, d’évaluer lareconstruction du stock osseux et la qualité de l’ostéo-intégration, il faut un recul plusimportant pour évaluer le remodelage osseux adaptatif et les autres complications inhérentes àtoute arthroplastie (usure, etc).Migaud 80 et Boisgard 8 n’ont pas retrouvé de modifications radiologiques au delà de 18mois après l’intervention. Boisgard 8 a également signalé la stabilité des signes cliniquescomme la boiterie ou la douleur après 12 mois d’évolution.58
Le recul moyen dans notre série était de 9 ans avec un recul minimal de 3,5 ans et unmaximum de 17 ans. Ce recul est donc suffisant pour évaluer les résultats à moyen et surtout àlong terme de cette technique chirurgicale. Dans les séries auxquelles nous avons décidé decomparer notre travail, le recul varie en moyenne de 2,5 ans à 14 ans pour la série deMcCarthy 75 .Fiche de révisionLa fiche de révision utilisée dans ce travail a été inspirée de celle utilisée par J.Berthelet 6 en 2002 à Amiens puis O.May 72 en 2006 à Lille, toute deux sur la tige de révision àverrouillage distal Ultime®.Étiologie primitiveIl existait dans notre série un taux important de pathologie dysplasique de hanche(44%), ce qui n’est pas le cas des autres séries étudiées ou l’étiologie arthrosique prédominait.La mise en place d’une prothèse totale de hanche sur dysplasie semble techniquement plusdélicate avec des difficultés spécifiques. La reprise de prothèse sur ce terrain paraîtnaturellement plus difficile avec un retentissement probable sur le résultat fonctionnel final.Type de descellementL’interprétation des clichés radiographiques pré-opératoires était soumise auxvariabilités inter-individuelles des classifications appliquées. Dans le symposium de laSoFCOT 1999, Migaud et al 79 a souligné qu’aucune classification n’était reproductible,néanmoins, les plus reproductibles étaient celles décrites par Vivès pour le symposium de laSoFCOT 1988 et la classification AAOS au moins pour les 10 cm au dessous du petittrochanter. D’autre part Vivès insiste sur la nécessité d’associer les classifications, car lanomenclature est souvent insuffisante pour décrire des cas complexes.Nous avons donc logiquement appliqué les classifications de Vivès modifiée SoFCOT etde l’AAOS dans cette étude.Dans notre série, 37% des défects osseux étaient de stade 1, 31,5% étaient cotés stade 2et 26 % stade 3 selon la classification de la SoFCOT et 61% des patients présentaient uneatteinte trochantérienne. Selon la classification de l’AAOS, 46% des cas correspondaient àdes stades 1A1 et 1A2.Ce sont les séries de Katz (80% de stade A de Harris), Essig (52% de stade SOFCOT Iet IIa) et Le Béguec (43% des stade Sofcot I) qui se rapprochent le plus de notre travail en59
terme d’évaluation préopératoire des dégâts osseux. Les séries d’Essig 32 et de Le Béguec 62 onten plus l’avantage d’utiliser la classification de la SOFCOT.Dans les autres études, les altérations osseuses sont plus évoluées et la comparaison desrésultats cliniques et radiologiques est donc plus délicate. Nous signalons qu’aucune desséries que nous avons citée n’a utilisé la cotation de l’AAOS dans l’évaluation pré-opératoire.Il faut préciser que ces différentes classifications sont des évaluations radiographiquespré-opératoires. Elles ne tiennent donc pas des dégâts qui peuvent se surajouter lors del’extraction de la prothèse et le nettoyage des débris de ciment. Ces classifications devraientêtre réévaluée systématiquement en per-opératoire.Type de classificationRépartition des dégâts osseuxKatz Harris A=80% ; B=18% ; C=2%Gie EndoKlinik I=5% ; II=71% ; III=23% ; IV=0%Migaud SOFCOT/Vives I=0% ; II=10% ; III=74% ; IV=16%May SOFCOT/Vives I=28% ; II=20% ; III=25% ; IV=26%Boisgard SOFCOT/Vives I=0% ; II=10% ; III=46% ; IV=44%Chandler44% de défects osseux importantsMcCarthy Paprosky I=0% ; II=46% ; IIIa=25% ; IIIb=13% ; IV=15%Essig Paprosky I=6% ; IIa=46% ; IIb=19% ; IIc=11% ; III=17%Le Béguec SOFCOT I=43% ; II=22% ; III=25% ; IV=10%Raman Paprosky I=33% ; II=50% : IIIa=11% ; IIIb=5% ; IV=0SOFCOT :Notre série SOFCOT/Vives et AAOSI=37% ; II=31,5% ; III=26% ; IV=5%T (1ou2)=61% ; D=11%AAOS :IA1=31,5% ; IA2=15% ; IB=5% ; IC=2% ; IIA=11% ;IIB=11% ; IIC=11% ; III=17%Classifications des dégâts osseux selon les séries.60
ComplicationsFractures per-opératoiresDans notre série, le nombre de fractures per-opératoires était de 9 cas dont 6 casconcernaient la diaphyse fémorale (11%). Les 3 autres fractures per-opératoires intéressaientle petit trochanter (2 cas) et le grand trochanter (1 cas).Cette complication peut survenir soit pendant la préparation endo-fémorale (ablation del’implant et des débris de ciment), soit lors du passage des râpes ou de la mise en place del’implant définitif pour les implants non cimentés. Cela explique la présence de cettecomplication dans les séries de reprises cimentées de Gie 34 (3%) et Migaud 80 (15%).Dans les séries utilisant les techniques de reprise non cimentées, ce taux varie de 3%pour Le Béguec 62 à 28% pour Chandler 15 . Notre série avec 11% de fractures, se situe ici, defaçon intermédiaire. Nous signalons que dans la série de Le Béguec, qui présente le taux leplus faible (3%), le taux de volet fémoral pédiculé était lui très important (84%) et selonl’auteur lui-même excessif.La survenue d’une complication fracturaire ne modifie pas en principe le résultat finalde l’intervention. C’est le cas dans notre étude ou l’analyse statistique des 2 groupes« fracture » et « pas de fracture » ne montre pas de différence significative en terme de scoresfonctionnels au recul final.Fracture de l’implantNous avons constaté un cas de fracture de l’implant. La faillite de l’implant s’estproduite au niveau de la jonction tige-collerette à 5 ans de l’intervention initiale. L’unionentre l’embase et la tige, qui était en théorie une zone de faiblesse, n’a pas présenté decomplication importante. Nous avons juste dénombré 4 dévissages de la vis d’union, sansaucun démontage et totalement asymptomatique.Fausse routeNous avons dénombré 3 fausses routes dans notre série soit 5 ,5% des interventions. Letaux de notre série est ici dans la moyenne des différentes séries citées. Ce taux, quand il estnoté, varie de 1,5% à 25% (5 cas dans la série de reprises cimentées de Migaud 80 ).61
Complications vasculo-nerveusesNous n’avons pas noté de lésion de structure vasculo-nerveuse dans notre travail.Raman 103 a signalé une lésion du nerf sciatique, la série de Le Béguec en comptait deux etEssig dans sa série de reprises par le système PP avait retrouvé une lésion sciatique et unelésion vasculaire (paquet obturateur) 32 .LuxationL’augmentation du taux de luxation dans les reprises est évoquée par de nombreuxauteurs. Les facteurs de ces luxations sont multiples (Huten 49 ) : outre les défauts liés aupositionnement des implants, les paramètres de la population étudiée comme l’âge élevé ou lachirurgie itérative sont des facteurs péjoratifs. Les taux retrouvés dans les différentes sériesque nous avons retenues allaient de 4,4% à 26%. Dans notre série, ce taux est de 9% pour lesluxations précoces et 12,9% en y ajoutant les luxations tardives à l’origine d’une reprisechirurgicale. Nous avions trouvé une relation significative entre épisodes de luxation etnombre d’intervention précédant la reprise.SepsisNous avons dénombré dans notre série 5 cas d’infection tardive ayant motivé dans 4 casune reprise chirurgicale et un changement de prothèse en 2 temps ce qui représente 9% de lasérie. Ce taux d’infection profonde était indépendant, dans notre travail, des caractéristiquesde la population étudiée.Ce taux est comparable à celui retrouvé dans la série à long terme de McCarthy, mais ilest plus élevé que ceux retrouvés dans les autres séries de la littérature. Le délai d’apparitionde ces événement infectieux était dans notre série de 3,3 ans avec un maximum atteignant 7ans. On peut remarquer que dans les séries de Gie, Boisgard, Chandler et Le Béguec danslesquelles le taux d’infection est effectivement inférieur, le recul est compris entre 2,5 et 3,5ans. On peut penser qu’avec une recul plus important, comme dans notre série ou celle deMcCarthy, le taux d’infection tardive de ces séries serait plus élevé.62
Fracture per-opératoire Luxation SepsisKatz 26% 2,4%Gie 3% 4,4% 0%Migaud 15% 5%May 17,2% 9% 1,3%Boisgard 4% 8% 0%Chandler 28% 23% 6%McCarthy - - 10%Le Béguec 3% 5% 2,6%Essig 12% 10% 4%Raman 6% 5% 2%SOFCOT 1999 4,7% 1%Notre série 11% 9% 9%Taux de complications dans les différentes sériesRésultats fonctionnelsNous avons utilisé dans ce travail les scores fonctionnels de Harris 42 et de Postel etMerle d’Aubigné 78 . Bien que le score PMA ne prenne que peu en compte l’activité globale dupatient, cette cotation reste néanmoins simple et reproductible. Nous l’avons donc associé à lacotation de Harris (Harris Hip Score) afin d’optimiser l’évaluation fonctionnelle. Cescotations ont enfin l’avantage d’être largement utilisées dans la littérature. Ces deux cotationsont été complétées par un indice subjectif de satisfaction divisé en 5 stades.Les résultats fonctionnels de notre série semblent inférieurs à ceux retrouvés dans lesdifférentes études que nous avons citées en ce qui concerne les cotations de Harris et Postel etMerle d’Aubigné. En ce qui concerne l’indice de satisfaction, 70% des patients considéraientle résultat satisfaisant ou très satisfaisant ce qui est comparable au chiffre retrouvé dans lasérie de May. On peut expliquer ces résultats par le taux élevé de boiterie de Trendelenburg(50%). On peut supposer que la médialisation induite par l’implant « PP » entraînant unediminution du bras de levier des muscles stabilisateurs de la hanche, de même que le taux nonnégligeable de pseudarthrose du grand trochanter peut être à l’origine de ces boiteries. Lacomparaison avec les autres séries reste délicate dans la mesure où les caractéristiques de63
chaque étude sont différentes en terme d’age, de stade Charnley, de dégâts osseux et aussi derecul. Dans notre série, 25% des patients ont changé de stade Charnley entre la date de leurinclusion et la révision, ce qui modifie l’évaluation fonctionnelle des patients. On peutsupposer que plus le recul est important, plus le taux de changement de stade Charnley estimportant. Dans les différentes séries citées, le score Charnley est parfois cité (Raman, Gie)mais l’évolution de ce critère n’est pas précisée.Le taux important de patients présentant une pathologie dysplasique dans notre série,avec une arthroplastie initiale difficile et une reprise également plus délicate, peut influer surle résultat fonctionnel final. Cela peut également expliquer les résultats fonctionnelslégèrement inférieurs de notre série.Série Implant Recul HHS PMA SatisfactionKatz Tige Cimentée 11,9 ans 49% de satisfactionGieAllogreffe impactée et tigeCimentée2,5 ans 15,84MigaudAllogreffe morcelée,impactée et tige Cimentée 6,9 ans 16,3avec treillisMay Tige Verrouillée (Ultime) 6 ans 13,4 (0-18)Satisfait/très satisfait=67,8%Insatisfait=11,1%BoisgardTige non Cimentée(Wagner)3,6 ans 14,6ChandlerNon Cimentée, modulaire(S-Rom)3 ans 82 (36-100) 84% de satisfactionEssigNon Cimentée, modulaire(PP)4 ans 14,3LebeguecNon cimentée, modulaire(PFM-R)3 ans 81,4 14,70Raman Non cimentée (JRI) 8 ans 82 (59-96) 14,5Notre Non Cimentée, modulaireSatisfait/très satisfait=70%9 ans 71 (21-98) 12,8Série(PP)Insatisfait=5%Résultats fonctionnels (HHS, PMA et satisfaction).64
Survie de l’implant et reprise chirurgicaleNotre taux de reprise chirurgicale de l’implant fémoral pour descellement aseptique étaitde 9%. Il est sensiblement identique au taux retrouvé dans l’étude d’Essig 32 (10%). Il est plusélevé que dans les séries de Boisgard 8 (4%), Chandler 15 (4%), le Béguec 62 (3%), Migaud 80(0%), Raman 103 (0%), Gie 34 (0%). On peut remarquer que, mis à part la série de Raman et deMigaud, ces études possèdent un recul limité allant de 2,5 à 3,6 ans. Cela peut expliquerl’absence ou le faible taux de reprise chirurgicale dans ces séries. Katz, dans sa série dereprise à un recul moyen de 11,9 ans, signale un taux de re-révision de l’implant fémoralaseptique de 16%. Il semble logique que plus on s’avance dans le long terme, plus le nombrede reprise des implants augmente.Les courbes de survie sont en théorie indispensables pour analyser les résultats desarthroplasties totales de hanche. Elles n’étaient précisées que dans les séries de Katz,McCarthy, Raman et May 53,72,103 . Leur avantage est de prendre en compte les patients décédéset les perdus de vue durant la période d’étude de la cohorte. Elles précisent le taux annuel et letaux cumulé d’apparition d’un événement qui est préalablement déterminé (reprisechirurgicale toutes causes confondues, reprise de la tige, descellement de la tige par exemple).La survenue de cet événement fait sortir le patient de la cohorte. La courbe de survie deKaplan-Maier est la traduction graphique de la table de survie qui comptabilise le nombre depatients, le nombre de perdus de vue, le nombre de décès, la probabilité de survie etl’intervalle de confiance de la méthode. Ces données devraient apparaître dans toutes lespublications sur les prothèses totales de hanche ayant un recul supérieur à 5 ans.A 5 ans, si on considère l’événement « reprise de l’implant fémoral descellé », la surviede l’implant dans notre série était supérieure (95,1%) à la survie dans la série de May (87%).A 10 ans, la survie de l’implant fémoral, dans notre série, était également supérieure(92,5%) à la survie de la série de Katz (81%) et de McCarthy (89%). Elle était inférieure à lasurvie de l’implant fémoral de la série de Raman (100%).Nous avons également étudié l’événement descellement de la tige fémorale, repris oupas. Le taux de survie dans notre série atteignait 90% mais était inférieur au taux retrouvédans la série de Raman avec 96% à 12 ans.La survie de la tige « PP » sur le long terme, semble donc tout à fait correcte, si on lacompare aux autres séries. Précisons que la série de Katz était une revue de reprises cimentéesdont les résultats paraissent en retrait par rapport aux autres techniques comme l’a préciséNehme 90 dans sa thèse sur les reprises de prothèses de hanche.65
Délai Évènement Taux de survie cumuléeKatz 10 ans Reprise de l’implant fémoral descellé 81%, +/-5%Raman (JRI®) 12 ans Reprise de l’implant fémoral descellé 100%12 ans Descellement de l’implant fémoral 96%May (Ultime®) 5 ans Reprise de l’implant fémoral descellé 87%, +/-3,5%McCarthy (S-ROM®) 10 ans Reprise de l’implant fémoral descellé 89%14 ans Reprise de l’implant fémoral descellé 60%Notre Série 5 ans Reprise de l’implant fémoral descellé 95,1%, +/-3,9%10 ans Reprise de l’implant fémoral descellé 92,5%, +/-5,2%5 ans Descellement de l’implant fémoral 95,1%, +/-3,9%10 ans Descellement de l’implant fémoral 90%, +/-6,1%Taux de survie suivant les séries (Katz, Raman, May).Contact osseux cortical et liseréDans ce travail, l’analyse des contacts osseux cortical en fonction des différentes zonesde Gruen 38 a montré que c’est en regard des zones 2,3,5,6 sur la face et 9,10,12,13 sur leprofil que le contact entre l’implant fémoral et la corticale était le plus étroit. Cela paraît êtrela conséquence directe du dessin spécifique et du concept de la tige « PP » qui recherche unappui et un calage diaphysaire le plus proximal possible. Ceci est confirmé par le fait que letaux de remplissage du canal fémoral était optimal (97%) à 5 cm en dessous du petittrochanter c'est-à-dire en zone diaphysaire proximal.Nous avons trouvé que le taux de contact osseux en zone 6 était lié à la survenue dedouleurs de cuisse. Cela peut correspondre au positionnement en varus de l’implant fémoral.Nous signalons que la fiche de révision ne prenait en compte qu’une varisation supérieure à5° de l’implant fémoral pour le classer dans la catégorie « tige varisée ».Les liserés péri prothétiques ont été notés en zone métaphysaire proximale (zone 1 et 7sur la face et zone 8 et 14 sur le profil. Cela est probablement lié à la modification de larépartition des contraintes sur le support osseux ou stress-schielding. Les contraintes sontalors pontées par la tige fémorale et transférées au fémur distal. Il s’en suit une atrophie et uneostéolyse corticale proximale et une hypertrophie distale. La mise au point de tige anatomique66
s’adaptant à la courbure physiologique du fémur et l’introduction des alliages de Titanecomme c’est le cas pour l’implant « PP » devaient limiter ce phénomène.Ossifications péri-prothétiquesDans notre étude, les ossifications péri-prothétiques représentaient 44 % de la série. Cetaux variait de 15% à 18% selon les séries (Chandler, Katz, Raman et Essig).Reconstruction osseuseLa restauration du stock osseux est un élément fondamental de la survie desrescellements des prothèses totales de hanche comme le montre Dujardin 26 dans lesymposium de la SOFCOT 1999. Dans cette optique, deux techniques semblent sedémarquer : les tiges à ancrage distal et les greffes morcelées impactées. Dans le premier cas,la régénération osseuse sera jugée sur le gain d’épaisseur corticale et dans le deuxième cas,sur l’intégration des greffons selon la classification de Pierchon 98 par exemple.L’indice de Hoffman 46 semble être également un bon indice de reconstruction osseuseglobal puisqu’il prend en compte les trois variables susceptibles d’évoluer à savoir la largeurdu canal et les deux épaisseurs corticales.La tige PP non cimentée fait partie de ces tiges à ancrage distal. La régénérationosseuse corticale diaphysaire autour de cet implant en Titane, même en l’absence de surfaceostéo-inductrice, a été démontrée par Essig 32 et Nehme 90 sur des travaux portant sur desreprises par le système « PP ». Ils ont noté, au recul, de façon significative une augmentationdes épaisseurs corticales à différents niveaux. L’analyse de la série de la SOFCOT 1999 amême montré que la régénération osseuse diaphysaire avec le système PP était l’une desmeilleures.Ces résultats sont confirmés dans notre série de 54 reprises utilisant l’implant PP. Nousavons effectivement retrouvé cette qualité de régénération osseuse avec des augmentationssignificatives des épaisseurs de corticales médiales et latérales au niveau du petit trochanter et5 cm en dessous de celui-ci. Au niveau 10 cm en dessous du petit trochanter, l’augmentationn’était significative qu’au niveau de la corticale médiale.Certains auteurs ont retrouvé une relation entre la régénération osseuse et le staded’altérations osseuses pré-opératoire. C’était également le cas ici, mais nous n’avons retrouvéde relation statistique qu’entre gain d’épaisseur corticale médiale au petit trochanter et stadeSOFCOT 3 ou 4.67
Cette régénération osseuse est conditionnée par l’application d’une techniquechirurgicale rigoureuse d’extraction et de réimplantation épargnant le manchonmusculopériosté diaphysaire associée à un abord limité par des ostéotomies pédiculées(trochantérotomie en digastrique par exemple) conservant la vascularisation régionale.La reconstruction osseuse semble être dans notre travail, maximale dans la région dupetit trochanter avec une baisse progressive quand on se dirige vers la partie distale de laprothèse. Ceci a été noté par Nehme 90 et peut être expliqué par le dessin spécifique del’implant. L’appui diaphysaire cortical exercé par la collerette induit probablement une miseen contrainte à ce niveau avec un gradient de force qui diminue en s’éloignant de cettecollerette.Dans les séries que nous avions retenues à titre comparatif, plusieurs auteurs n’ont pasprécisé leur protocole d’évaluation de la reconstruction osseuse (Katz, Gie, Chandler,Raman). Boisgard utilise une classification en 3 stades fondée sur la présence d’unereconstruction avec ou sans trabéculation. Le Béguec utilise lui sur une cotation en 4 stadesbasée sur le caractère complet ou incomplet de la régénération osseuse et sur la présence ounon de stress-schielding.Essig et May ont utilisé la mesure des épaisseurs corticales .May avait retrouvé uneaugmentation significative des épaisseurs corticales dans sa série de tiges verrouillées avecun gain maximal à 10 cm du petit trochanter. Il avait attribué ce résultat au processus deconsolidation des volets fémoraux réalisés dans sa série. Nous n’avons pas retrouvé cephénomène dans notre série.Gain Index Hoffman petittrochanterGain index Hoffman5cmGain Index Hoffman10cmMay +9 +15 +25Notre série +11,9 +11,7 +2,6Variation de l’Index de Hoffman à différents niveaux68
IV CONCLUSIONCe travail réalisé sur 54 reprises, à long terme, de prothèses totales de hanche par lesystème « PP » confirme les bons résultats déjà observés avec cette technique de reprise.Cette technique est fondée sur l’utilisation d’un implant modulaire, en titane, non cimenté, àtraitement de surface total sans revêtement d’hydroxy-apatite recherchant un blocagediaphysaire, associée à un abord chirurgical permettant de préserver la vascularisationrégionale. Elle permet de traiter les pertes osseuses modérées mais également sévères (StadeIII), en induisant une régénération osseuse métaphysaire et diaphysaire avec un taux decomplications sensiblement identique aux autres séries. Ce travail avait l’avantage d’évaluercette technique avec un recul moyen de 9 ans, ce que l’on peut considérer comme du longterme en matière de reprise d’arthroplastie de hanche. Bien que les résultats cliniques soientdiscrètement inférieurs aux résultats de la littérature, l’indice de satisfaction et la survie decet implant à long terme étaient tout à fait satisfaisants et supérieurs à ceux retrouvés dans lalittérature. Ceci traduit peut-être la qualité de la reconstruction osseuse péri-prothétique..Le système « PP » reste donc une réponse toujours adaptée pour le traitement desdescellements aseptiques d’arthroplastie totale de hanche asssociés à une perte osseuse périprothétique.Vu par le Président du JuryProfesseur J.Puget69
BIBLIOGRAPHIE1. Amstutz, H. C.; Beaule, P. E.; Dorey, F. J.; Le Duff, M. J.; Campbell, P. A.; andGruen, T. A.: Metal-on-metal hybrid surface arthroplasty: two to six-year follow-upstudy. J Bone Joint Surg Am, 86-A(1): 28-39, 2004.2. Anthony, P. P.; Gie, G. A.; Howie, C. R.; and Ling, R. S.: Localised endosteal bonelysis in relation to the femoral components of cemented total hip arthroplasties. J BoneJoint Surg Br, 72(6): 971-9, 1990.3. Archibeck, M. J.; Berger, R. A.; Jacobs, J. J.; Quigley, L. R.; Gitelis, S.;Rosenberg, A. G.; and Galante, J. O.: Second-generation cementless total hiparthroplasty. Eight to eleven-year results. J Bone Joint Surg Am, 83-A(11): 1666-73,2001.4. August, A. C.; Aldam, C. H.; and Pynsent, P. B.: The McKee-Farrar hiparthroplasty. A long-term study. J Bone Joint Surg Br, 68(4): 520-7, 1986.5. Berry, D. J.; Harmsen, W. S.; Ilstrup, D.; Lewallen, D. G.; and Cabanela, M. E.:Survivorship of uncemented proximally porous-coated femoral components. ClinOrthop Relat Res, (319): 168-77, 1995.6. Berthelet, J.: La tige "Ultime" étude à propos de 78 cas au recul moyen de 4 ans.Thèse, Université de Picardie Jules Vernes: Amiens, 2002.7. Blacker, G. J., and Charnley, J.: Changes in the upper femur after low frictionarthroplasty. Clin Orthop Relat Res, (137): 15-23, 1978.8. Boisgard, S.; Moreau, P. E.; Tixier, H.; and Levai, J. P.: [Bone reconstruction, leglength discrepancy, and dislocation rate in 52 Wagner revision total hip arthroplastiesat 44-month follow-up]. Rev Chir Orthop Reparatrice Appar Mot, 87(2): 147-54,2001.9. Boldt, J. G.; Dilawari, P.; Agarwal, S.; and Drabu, K. J.: Revision total hiparthroplasty using impaction bone grafting with cemented nonpolished stems andcharnley cups. J Arthroplasty, 16(8): 943-52, 2001.10. Brooker, A. F.; Bowerman, J. W.; Robinson, R. A.; and Riley, L. H., Jr.: Ectopicossification following total hip replacement. Incidence and a method of classification.J Bone Joint Surg Am, 55(8): 1629-32, 1973.11. Callaghan, J. J.: Total hip arthroplasty. Clinical perspective. Clin Orthop Relat Res,(276): 33-40, 1992.12. Callaghan, J. J.; Dysart, S. H.; and Savory, C. G.: The uncemented porous-coatedanatomic total hip prosthesis. Two-year results of a prospective consecutive series. JBone Joint Surg Am, 70(3): 337-46, 1988.13. Callaghan, J. J.; Templeton, J. E.; Liu, S. S.; Pedersen, D. R.; Goetz, D. D.;Sullivan, P. M.; and Johnston, R. C.: Results of Charnley total hip arthroplasty at aminimum of thirty years. A concise follow-up of a previous report. J Bone Joint SurgAm, 86-A(4): 690-5, 2004.14. Carlsson, A. S.; Gentz, C. F.; and Linder, L.: Localized bone resorption in thefemur in mechanical failure of cemented total hip arthroplasties. Acta Orthop Scand,54(3): 396-402, 1983.15. Chandler, H. P.; Ayres, D. K.; Tan, R. C.; Anderson, L. C.; and Varma, A. K.:Revision total hip replacement using the S-ROM femoral component. Clin OrthopRelat Res, (319): 130-40, 1995.16. Chao, E. Y., and Sim, F. H.: Composite fixation of salvage prostheses for the hip andknee. Clin Orthop Relat Res, (276): 91-101, 1992.70
17. Charnley, J.: Arthroplasty of the hip. A new operation. Lancet, 1(7187): 1129-32,1961.18. Charnley, J., and Cupic, Z.: The nine and ten year results of the low-frictionarthroplasty of the hip. Clin Orthop Relat Res, (95): 9-25, 1973.19. Charnley, J.; Follacci, F. M.; and Hammond, B. T.: The long-term reaction of boneto self-curing acrylic cement. J Bone Joint Surg Br, 50(4): 822-9, 1968.20. Collis, D. K.: Cemented total hip replacement in patients who are less than fifty yearsold. J Bone Joint Surg Am, 66(3): 353-9, 1984.21. Courpied, J.: Femoral revisions in iterative total hip arthroplasties. Reconstructionwith segmental allograft. Hip 99 Congress proceedings. Toulouse France, 295-8,1999.22. Cupic, Z.: Long-term follow-up of Charnley arthroplasty of the hip. Clin OrthopRelat Res, (141): 28-43, 1979.23. D'Antonio, J.; McCarthy, J. C.; Bargar, W. L.; Borden, L. S.; Cappelo, W. N.;Collis, D. K.; Steinberg, M. E.; and Wedge, J. H.: Classification of femoralabnormalities in total hip arthroplasty. Clin Orthop Relat Res, (296): 133-9, 1993.24. Daniel, J.; Pynsent, P. B.; and McMinn, D. J.: Metal-on-metal resurfacing of thehip in patients under the age of 55 years with osteoarthritis. J Bone Joint Surg Br,86(2): 177-84, 2004.25. Dohmae, Y.; Bechtold, J. E.; Sherman, R. E.; Puno, R. M.; and Gustilo, R. B.:Reduction in cement-bone interface shear strength between primary and revisionarthroplasty. Clin Orthop Relat Res, (236): 214-20, 1988.26. Dujardin, F., and Mazirt, N.: Régénération osseuse spontanée. SymposiumSO.F.C.O.T, 1999.27. Echeverri, A.; Shelley, P.; and Wroblewski, B. M.: Long-term results of hiparthroplasty for failure of previous surgery. J Bone Joint Surg Br, 70(1): 49-51, 1988.28. Eldridge, J. D.; Smith, E. J.; Hubble, M. J.; Whitehouse, S. L.; and Learmonth, I.D.: Massive early subsidence following femoral impaction grafting. J Arthroplasty,12(5): 535-40, 1997.29. Elting, J. J.; Mikhail, W. E.; Zicat, B. A.; Hubbell, J. C.; Lane, L. E.; and House,B.: Preliminary report of impaction grafting for exchange femoral arthroplasty. ClinOrthop Relat Res, (319): 159-67, 1995.30. Emerson, R. H., Jr.; Malinin, T. I.; Cuellar, A. D.; Head, W. C.; and Peters, P.C.: Cortical strut allografts in the reconstruction of the femur in revision total hiparthroplasty. A basic science and clinical study. Clin Orthop Relat Res, (285): 35-44,1992.31. Engh, C. A., and Massin, P.: Cementless total hip arthroplasty using the anatomicmedullary locking stem. Results using a survivorship analysis. Clin Orthop Relat Res,(249): 141-58, 1989.32. Essig, J., and Puget, J.: La reprise d'arthroplastie totale de hanche par la prothèse dereconstruction du système PP. Thèse, Université Toulouse III, 1993.33. Estok, D. M., 2nd, and Harris, W. H.: Long-term results of cemented femoralrevision surgery using second-generation techniques. An average 11.7-year follow-upevaluation. Clin Orthop Relat Res, (299): 190-202, 1994.34. Gie, G. A.; Linder, L.; Ling, R. S.; Simon, J. P.; Slooff, T. J.; and Timperley, A.J.: Impacted cancellous allografts and cement for revision total hip arthroplasty. JBone Joint Surg Br, 75(1): 14-21, 1993.35. Goldring, S. R.; Jasty, M.; Roelke, M. S.; Rourke, C. M.; Bringhurst, F. R.; andHarris, W. H.: Formation of a synovial-like membrane at the bone-cement interface.71
Its role in bone resorption and implant loosening after total hip replacement. ArthritisRheum, 29(7): 836-42, 1986.36. Goodman, S. B.; Chin, R. C.; Chiou, S. S.; Schurman, D. J.; Woolson, S. T.; andMasada, M. P.: A clinical-pathologic-biochemical study of the membranesurrounding loosened and nonloosened total hip arthroplasties. Clin Orthop Relat Res,(244): 182-7, 1989.37. Gross, A. E., and Hutchison, C. R.: Proximal femoral allografts for reconstruction ofbone stock in revision arthroplasty of the hip. Orthop Clin North Am, 29(2): 313-7,1998.38. Gruen, T. A.; McNeice, G. M.; and Amstutz, H. C.: "Modes of failure" of cementedstem-type femoral components: a radiographic analysis of loosening. Clin OrthopRelat Res, (141): 17-27, 1979.39. Halley, D. K., and Glassman, A. H.: Twenty- to twenty-six-year radiographic reviewin patients 50 years of age or younger with cemented Charnley low-frictionarthroplasty. J Arthroplasty, 18(7 Suppl 1): 79-85, 2003.40. Halley, D. K., and Wroblewski, B. M.: Long-term results of low-friction arthroplastyin patients 30 years of age or younger. Clin Orthop Relat Res, (211): 43-50, 1986.41. Harris, W. H.: The first 32 years of total hip arthroplasty. One surgeon's perspective.Clin Orthop Relat Res, (274): 6-11, 1992.42. Harris, W. H.: Traumatic arthritis of the hip after dislocation and acetabularfractures: treatment by mold arthroplasty. An end-result study using a new method ofresult evaluation. J Bone Joint Surg Am, 51(4): 737-55, 1969.43. Harris, W. H.; Schiller, A. L.; Scholler, J. M.; Freiberg, R. A.; and Scott, R.:Extensive localized bone resorption in the femur following total hip replacement. JBone Joint Surg Am, 58(5): 612-8, 1976.44. Head, W. C.; Bauk, D. J.; and Emerson, R. H., Jr.: Titanium as the material ofchoice for cementless femoral components in total hip arthroplasty. Clin Orthop RelatRes, (311): 85-90, 1995.45. Heekin, R. D.; Engh, C. A.; and Vinh, T.: Morselized allograft in acetabularreconstruction. A postmortem retrieval analysis. Clin Orthop Relat Res, (319): 184-90,1995.46. Hofmann, A. A.; Wyatt, R. W.; France, E. P.; Bigler, G. T.; Daniels, A. U.; andHess, W. E.: Endosteal bone loss after total hip arthroplasty. Clin Orthop Relat Res,(245): 138-44, 1989.47. Honl, M. et al.: Comparison of robotic-assisted and manual implantation of a primarytotal hip replacement. A prospective study. J Bone Joint Surg Am, 85-A(8): 1470-8,2003.48. Howie, D. W., and Vernon-Roberts, B.: The synovial response to intraarticularcobalt-chrome wear particles. Clin Orthop Relat Res, (232): 244-54, 1988.49. Huten, D.: Luxation et subluxation des prothèses totales e hanches. Cahiersd'enseignement de la SOFCOT, 55, 1996.50. Jacobs, J. J.; Sumner, D. R.; and Galante, J. O.: Mechanisms of bone lossassociated with total hip replacement. Orthop Clin North Am, 24(4): 583-90, 1993.51. Jones, L. C., and Hungerford, D. S.: Cement disease. Clin Orthop Relat Res, (225):192-206, 1987.52. Judet, R.; Siguier, M.; Brumpt, B.; and Judet, T.: A noncemented total hipprosthesis. Clin Orthop Relat Res, (137): 76-84, 1978.53. Katz, R. P.; Callaghan, J. J.; Sullivan, P. M.; and Johnston, R. C.: Long-termresults of revision total hip arthroplasty with improved cementing technique. J BoneJoint Surg Br, 79(2): 322-6, 1997.72
54. Kavanagh, B. F.; Dewitz, M. A.; Ilstrup, D. M.; Stauffer, R. N.; and Coventry, M.B.: Charnley total hip arthroplasty with cement. Fifteen-year results. J Bone JointSurg Am, 71(10): 1496-503, 1989.55. Kavanagh, B. F., and Fitzgerald, R. H., Jr.: Multiple revisions for failed total hiparthroplasty not associated with infection. J Bone Joint Surg Am, 69(8): 1144-9, 1987.56. Kerboull, L.; Hamadouche, M.; Courpied, J. P.; and Kerboull, M.: Long-termresults of Charnley-Kerboull hip arthroplasty in patients younger than 50 years. ClinOrthop Relat Res, (418): 112-8, 2004.57. Kilgus, D. J.; Shimaoka, E. E.; Tipton, J. S.; and Eberle, R. W.: Dual-energy X-ray absorptiometry measurement of bone mineral density around porous-coatedcementless femoral implants. Methods and preliminary results. J Bone Joint Surg Br,75(2): 279-87, 1993.58. Kim, K. J.; Chiba, J.; and Rubash, H. E.: In vivo and in vitro analysis ofmembranes from hip prostheses inserted without cement. J Bone Joint Surg Am, 76(2):172-80, 1994.59. Kim, Y. H.: Cemented revision hip arthroplasty using strut and impacted cancellousallografts. J Arthroplasty, 19(6): 726-32, 2004.60. Kim, Y. H.: Long-term results of the cementless porous-coated anatomic total hipprosthesis. J Bone Joint Surg Br, 87(5): 623-7, 2005.61. Kiratli, B. J.; Heiner, J. P.; McBeath, A. A.; and Wilson, M. A.: Determination ofbone mineral density by dual x-ray absorptiometry in patients with uncemented totalhip arthroplasty. J Orthop Res, 10(6): 836-44, 1992.62. LeBéguec, P.: Reprise des prothèses fémorales descellées avec tiges fémorales pressfit.Maitrise orthopédique, 2002.63. Lewis, J. L.; Askew, M. J.; Wixson, R. L.; Kramer, G. M.; and Tarr, R. R.: Theinfluence of prosthetic stem stiffness and of a calcar collar on stresses in the proximalend of the femur with a cemented femoral component. J Bone Joint Surg Am, 66(2):280-6, 1984.64. Lieberman, J. R.; Moeckel, B. H.; Evans, B. G.; Salvati, E. A.; and Ranawat, C.S.: Cement-within-cement revision hip arthroplasty. J Bone Joint Surg Br, 75(6): 869-71, 1993.65. Malkani, A. L.; Lewallen, D. G.; Cabanela, M. E.; and Wallrichs, S. L.: Femoralcomponent revision using an uncemented, proximally coated, long-stem prosthesis. JArthroplasty, 11(4): 411-8, 1996.66. Mallory, T. H.; Lombardi, A. V., Jr.; Leith, J. R.; Fujita, H.; Hartman, J. F.;Capps, S. G.; Kefauver, C. A.; Adams, J. B.; and Vorys, G. C.: Minimal 10-yearresults of a tapered cementless femoral component in total hip arthroplasty. JArthroplasty, 16(8 Suppl 1): 49-54, 2001.67. Maloney, W. J.; Jasty, M.; Harris, W. H.; Galante, J. O.; and Callaghan, J. J.:Endosteal erosion in association with stable uncemented femoral components. J BoneJoint Surg Am, 72(7): 1025-34, 1990.68. Maloney, W. J.; Jasty, M.; Rosenberg, A.; and Harris, W. H.: Bone lysis in wellfixedcemented femoral components. J Bone Joint Surg Br, 72(6): 966-70, 1990.69. Markolf, K. L.; Amstutz, H. C.; and Hirschowitz, D. L.: The effect of calcarcontact on femoral component micromovement. A mechanical study. J Bone JointSurg Am, 62(8): 1315-23, 1980.70. Martin: Les prothèses de charnley-Kerboul. Rev Chir Orthop Reparatrice Appar MotSymposium Sofcot, 1989.73
71. Masterson, E. L.; Masri, B. A.; Duncan, C. P.; Rosenberg, A.; Cabanela, M.; andGross, M.: The cement mantle in femoral impaction allografting. A comparison ofthree systems from four centres. J Bone Joint Surg Br, 79(6): 908-13, 1997.72. May, O.: Implant fémoral de reprise à verrouillage distal. A propos de 101 cas, aurecul minimum de 5 ans. Thèse, Université Lille II, 2006.73. Mc Kee G. K: Developement of total Prosthesis Replacement of the Hip. Clin OrthopRelat Res, 1970.74. Mc Kee G. K, C. S. C.: The statistics of the Mc Kee Farrar Method of total HipReplacement. Clin Orthop Relat Res, 1973.75. McCarthy, J. C., and Lee, J.: Complex Revision Total Hip Arthroplasty withModular Stems at a Mean of 14 Years. Clin Orthop Relat Res, 2007.76. McMinn, D. J.; Daniel, J.; Pynsent, P. B.; and Pradhan, C.: Mini-incisionresurfacing arthroplasty of hip through the posterior approach. Clin Orthop Relat Res,441: 91-8, 2005.77. Meding, J. B.; Ritter, M. A.; Keating, E. M.; and Faris, P. M.: Impaction bonegraftingbefore insertion of a femoral stem with cement in revision total hiparthroplasty. A minimum two-year follow-up study. J Bone Joint Surg Am, 79(12):1834-41, 1997.78. Merle d'Aubigné, R.: Cotation chiffrée de la fonction de la hanche. Rev Chir OrthopReparatrice Appar Mot, 56: 481-486, 1970.79. Migaud, H.; Eddine., A.; Demondion, X.; Jardin, C.; Laffargue, P.; andDujardin, F.: Classification des pertes de substances: reproductilbilité desclassifications et groupements lésionnels. Symposium SO.F.C.O.T.1999, 1999.80. Migaud, H.; Jardin, C.; Fontaine, C.; Pierchon, F.; d'Herbomez, O.; andDuquennoy, A.: [Femoral reconstruction with endosteal bone allografts protected bya metallic mesh in reoperation of total hip prosthesis. 19 cases with an average followupof 83 months]. Rev Chir Orthop Reparatrice Appar Mot, 83(4): 360-7, 1997.81. Mirra, J. M.; Amstutz, H. C.; Matos, M.; and Gold, R.: The pathology of the jointtissues and its clinical relevance in prosthesis failure. Clin Orthop Relat Res, (117):221-40, 1976.82. Mittelmeier, H., and Heisel, J.: Sixteen-years' experience with ceramic hipprostheses. Clin Orthop Relat Res, (282): 64-72, 1992.83. Morrey, B. F., and Kavanagh, B. F.: Complications with revision of the femoralcomponent of total hip arthroplasty. Comparison between cemented and uncementedtechniques. J Arthroplasty, 7(1): 71-9, 1992.84. Muller, M. E.: Lessons of 30 years of total hip arthroplasty. Clin Orthop Relat Res,(274): 12-21, 1992.85. Muller, M. E.: Total Hip Prothesis. Clin Orthop Relat Res, 1970.86. Mulliken, B. D.; Rorabeck, C. H.; and Bourne, R. B.: Uncemented revision totalhip arthroplasty: a 4-to-6-year review. Clin Orthop Relat Res, (325): 156-62, 1996.87. Mulroy, R. D., Jr., and Harris, W. H.: The effect of improved cementing techniqueson component loosening in total hip replacement. An 11-year radiographic review. JBone Joint Surg Br, 72(5): 757-60, 1990.88. Mulroy, W. F., and Harris, W. H.: Revision total hip arthroplasty with use of socalledsecond-generation cementing techniques for aseptic loosening of the femoralcomponent. A fifteen-year-average follow-up study. J Bone Joint Surg Am, 78(3):325-30, 1996.89. Murray, D. W., and Rushton, N.: Macrophages stimulate bone resorption when theyphagocytose particles. J Bone Joint Surg Br, 72(6): 988-92, 1990.74
90. Nehme, A., and Puget, J.: Le système PP dans les reprises de PTH. Thèse, UniversitéToulouse III, 2000.91. Nelissen, R. G.; Bauer, T. W.; Weidenhielm, L. R.; LeGolvan, D. P.; and Mikhail,W. E.: Revision hip arthroplasty with the use of cement and impaction grafting.Histological analysis of four cases. J Bone Joint Surg Am, 77(3): 412-22, 1995.92. Nicholson, O. R.: Proceedings: Total hip replacement-a radiological review. J BoneJoint Surg Br, 57(2): 256, 1975.93. Nunn, D.; Freeman, M. A.; Tanner, K. E.; and Bonfield, W.: Torsional stability ofthe femoral component of hip arthroplasty. Response to an anteriorly applied load. JBone Joint Surg Br, 71(3): 452-5, 1989.94. Oh, I., and Harris, W. H.: Proximal strain distribution in the loaded femur. An invitro comparison of the distributions in the intact femur and after insertion of differenthip-replacement femoral components. J Bone Joint Surg Am, 60(1): 75-85, 1978.95. Olsson, S. S.; Jernberger, A.; and Tryggo, D.: Clinical and radiological long-termresults after Charnley-Muller total hip replacement. A 5 to 10 year follow-up studywith special reference to aseptic loosening. Acta Orthop Scand, 52(5): 531-42, 1981.96. Pak, J. H.; Paprosky, W. G.; Jablonsky, W. S.; and Lawrence, J. M.: Femoralstrut allografts in cementless revision total hip arthroplasty. Clin Orthop Relat Res,(295): 172-8, 1993.97. Paprosky, W. G.; Bradford, M. S.; and Younger, T. I.: Classification of bonedefects in failed prostheses. Chir Organi Mov, 79(4): 285-91, 1994.98. Pierchon, F.; Migaud, H.; and Duquennoy, A.: [Reconstitution of femoral bonestock in loosening of total hip prosthesis]. Acta Orthop Belg, 59(3): 278-86, 1993.99. Pierson, J. L., and Harris, W. H.: Effect of improved cementing techniques on thelongevity of fixation in revision cemented femoral arthroplasties. Average 8.8-yearfollow-up period. J Arthroplasty, 10(5): 581-91, 1995.100. Puget: Stratégies dans les reprises de prothèse totale de hanche. Conférencesd'enseignement de la SOFCOT 2006.101. Puget J, T. J.: Reprise de prothèse totale de hanche par système PP. Reconstructionprothétique de l'extrémité supérieure du fémur, 14-16 Octobre 1993: 60-70, 1993.102. Puget, J.; Tricoire, J. L.; Chiron, P.; and Uthéza, G.: Système PP : Matériel ettechnique. Le descellement fémoral des prothèses totales de hanche, 204, 1992.103. Raman, R.; Kamath, R. P.; Parikh, A.; and Angus, P. D.: Revision of cementedhip arthroplasty using a hydroxyapatite-ceramic-coated femoral component. J BoneJoint Surg Br, 87(8): 1061-7, 2005.104. Ridgeway, S.; Wilson, J.; Charlet, A.; Kafatos, G.; Pearson, A.; and Coello, R.:Infection of the surgical site after arthroplasty of the hip. J Bone Joint Surg Br, 87(6):844-50, 2005.105. Ring, P. A.: Five to fourteen year interim results of uncemented total hip arthroplasty.Clin Orthop Relat Res, (137): 87-95, 1978.106. Ritter, M. A., and Fechtman, R. W.: Distal cortical hypertrophy following total hiparthroplasty. J Arthroplasty, 3(2): 117-21, 1988.107. Russotti, G. M.; Coventry, M. B.; and Stauffer, R. N.: Cemented total hiparthroplasty with contemporary techniques. A five-year minimum follow-up study.Clin Orthop Relat Res, (235): 141-7, 1988.108. Sabo, D.; Reiter, A.; Simank, H. G.; Thomsen, M.; Lukoschek, M.; andEwerbeck, V.: Periprosthetic mineralization around cementless total hipendoprosthesis: longitudinal study and cross-sectional study on titanium threadedacetabular cup and cementless Spotorno stem with DEXA. Calcif Tissue Int, 62(2):177-82, 1998.75
109. Stromberg, C. N.; Herberts, P.; and Palmertz, B.: Cemented revision hiparthroplasty. A multicenter 5-9-year study of 204 first revisions for loosening. ActaOrthop Scand, 63(2): 111-9, 1992.110. Sugiyama, H.; Whiteside, L. A.; and Kaiser, A. D.: Examination of rotationalfixation of the femoral component in total hip arthroplasty. A mechanical study ofmicromovement and acoustic emission. Clin Orthop Relat Res, (249): 122-8, 1989.111. Sutherland, C. J.; Wilde, A. H.; Borden, L. S.; and Marks, K. E.: A ten-yearfollow-up of one hundred consecutive Muller curved-stem total hip-replacementarthroplasties. J Bone Joint Surg Am, 64(7): 970-82, 1982.112. Weaver, J. K.: Activity expectations and limitations following total jointreplacement. Clin Orthop Relat Res, (137): 55-61, 1978.113. Wiklund, I., and Romanus, B.: A comparison of quality of life before and afterarthroplasty in patients who had arthrosis of the hip joint. J Bone Joint Surg Am,73(5): 765-9, 1991.114. Willert, H. G.; Bertram, H.; and Buchhorn, G. H.: Osteolysis in alloarthroplasty ofthe hip. The role of ultra-high molecular weight polyethylene wear particles. ClinOrthop Relat Res, (258): 95-107, 1990.115. Willert, H. G.; Ludwig, J.; and Semlitsch, M.: Reaction of bone to methacrylateafter hip arthroplasty: a long-term gross, light microscopic, and scanning electronmicroscopic study. J Bone Joint Surg Am, 56(7): 1368-82, 1974.116. Wroblewski, B. M.: 15-21-year results of the Charnley low-friction arthroplasty. ClinOrthop Relat Res, (211): 30-5, 1986.117. Zaoussis, A. L., and Patikas, A. F.: Experience with total hip arthroplasty in Greece,the first 20 years. A particular reference to long-term results with the McKee-Farrartechnique. Clin Orthop Relat Res, (246): 39-47, 1989.76
ANNEXES1 / Fiche de révision2 / Iconographie77
Fiche de révision PP-Etat CivilNom : ________________Date de Naissance :________Prénom : ________________Age (J0) :_____Poids (kgs):_____-Charnley :Taille (m) :_______A-1 articulation protheséeB-2 artC->2 ou isf. card. ou resp-Côté :-Etiologie primitive :a : arthroseb : dysplasiec : rhumatismalen : nécroset : traumatique: autre-Antécédents : - Hanche (en clair)- Membre inférieur homolatéral (en clair)- Médicaux-Etiologie reprise : 1 - Descellement aseptique Bipolaire Unipolaire2 - Descellement septique3 - Fracture sur PTH Johansson ( A au dessus de la tige,B autour de la tige, C sous la tige)4 - Instabilité/ Luxation5 – Fracture d’implant-Devenir :R : RevuD : Décédé Date événement :P : Perdu de vue-PTH précédente :-Trendelenburg :1 - Cimentée2 - Non cimentée sans traitement de surface3 - Non cimentée avec traitement de surface4 - Non cimentée verrouillée1- Oui2- Non78
-Stade So.F.C.O.T 99 (modification So.F.C.O.T. 88)0 - Stade 0 : Fémur sans lésion osseuse1 - Stade I : corticale amincies mais correctes avec une lyse plus ou moinsimporante duMerckel2 - Stade II : corticale latérale très amincie mais la corticale médiale amincie restecorrecte3 - Stade III : corticale latérale très amincie et la corticale médiale en partie détruitesousle petit trochanter4 - StadeIV : Le fémur est pellucide ou disparuT0- Pas de lésion du grand trochanterT1- Grand trochanter altéré ou déjà coupé et consolidéT2- Pseudarthrose du grand trochanterD : Atteinte diaphysaire distale à plus de 10cm sous le petit trochanterF : FractureV : Cal vicieux- Classification AAOS79
-InterventionAge :Durée d’intervention (mn):Nombre total de culots :ASAAnesthésie :Révision cupule :1-AG2-Rachi1-oui2-nonRévision fémur :- Voie d’abord 1- Latérale2- Moore- Artifice 0- RAS1- Trochantérotomie2- Fémorotomie3- fenêtre osseuse- Fixation (de l’artifice) :1- cerclages2- Vis3- Cerclages+vis- Reconstruction (greffe) :1-oui Si oui type de greffe :2-non1- spongieuse impactée2- ChapeletDurée d’hospitalisationCommentaire :80
-Matériel implanté PP*Tige :Longueur : 126 Diamètre :9 11 13 15 17 19180 autre :270*Tête :Taille 22 26 28 32*Col :Taille Antéversion du col :- court- moyen 1- 0°- long 2- 8°- extra-long 3-15°*Pièce métaphysaire20 30 40 50 60 70 80 100 120 140 160*Rondelle29 31 33 35*Complication per-opératoire1-Fracture2-Fausse route-Radiographie post-opératoire immédiate- Distance pointe de la tige – grand trochanter (mm)- Position tige 1- Normale2- varus > 5°3-valgus > 5°- Zone de contact tige/os (Zone de Gruen)Face 1 2 3 4 5 6 7Profile 8 9 10 11 12 13 14- Epaisseur corticale :Corticale interne Corticale externe Largeur canalPetit trochanter5cm10cm-Diamètre tête ou tige mesurée sur les radiographies : (facteur decorrection : échelle réelle)tête81
REVISION-Date-Recul (mois)-Charnley : 1-A2-B3-C-Trendelenburg :1-oui2-non-Inégalité de longueur des membres inférieurs (cm) :-Score Harris-Score MA-Indice de satisfaction :1- Insatisfait2- Pas très satisfait3- Moyennement satisfait4- Satisfait5- Très satisfait- Douleurs de cuisse : 1-oui2-nonDouleurCOTATION MER<strong>LE</strong> D’AUBIGNEPas d’A.V6 Aucune Flexion > 90°MobilitéAVF<strong>LE</strong>X. RE -RI5 Rare-légère 80 à 70° Flexion > 90°AVA.B - A.D4 Souvent au bout de 30’ à 1 H 70 à 50° 80 à 70° Flexion > 90°3 10 à 20’ 50 à 30° 70 à 50° 80 à 70°Marche -stabilitéNormale ouillimitéeLimitée oulégère boiteriesi prolongéecanne pourlonguedistance. Pasd’instabilitéCanne poursortir – boiterienette. LégèreinstabilitéCanne enpermanence –instabilité2 Avant 10’ < 30° 50 à 30° 70 à 50° 2 Cannes1 Immédiatement à la marche < 30° 50 à 30° Béquilles0 Permanente < 30° Impossible82
COTATION DE HARRIS ( Maxi 100 pts ) +Fonction : maxi 46 ptsMontée des escaliers : Normale ………. 4Rampe ………. 2Difficile ………. 1Impossible…..…. 0Transport en commun : Oui ……… 1Non ……… 0Siège :Confortable > 1 heure……4Confortable ½ heure..……2Inconfortable ……0Chaussettes :Aisément……….4( ôter et mettre ) Difficilement…….2Impossible……...0Boiterie : Aucune ……….11Légère ……….8Modérée……….5Sévère ……….0Cannes : Aucune ……….111 longue marche.71 canne ……….51 canne anglaise.32 cannes………..22 cannes anglaises..0Distance : Illimitée ……..11600 m ……..8300 m ……..5Quelques pas...2Grabataire.……0Total intermédiaire ( maxi 47 pts ) ………….Douleur : maxi 44 pts :Aucune……………………….44Rare légère ……………………….40Modérée ( aspirine ) ……………………….30Importante ( autre antalgique ) ……..……20Sévère…………………..…..10Permanente……………………….0Attitude vicieuse maxi 4 ptsAbsence de Flessum > 30 ……………………..1Add fixée > 10 ……………………..1Rot int > 10 ……………………..1Racc > 3 cm ……………………..1Mobilité ( max 6 pts ) :Flexion 0 – 45°45 – 90°90 – 110°110 –130°Abduction 0 – 15°15 –20°20 – 45°Rotation ext en extension : 0 – 15°> 15°Rotation interneAdduction 0 –15°Extension 0TotalTotal intermédiaire ( maxi 54 pts )83
Etude radiographique à la révision- Distance pointe de la tige – grand trochanter (mm) :Tige- Position tige 1- Normale2- varus > 5°3-valgus > 5°- Canal distal 1- Tige libre2- Console3- Englobement- Etat de la tige : 1- Stable2- Migration : ____mm3- Fracture4- Ablation sans remplacement5- Ablation et remplacementFémur- Consolidation du volet : 1- Oui2- non _________ 1- Défect partie inférieure2-Défect partie moyenne3- Défect partie supérieure- Consolidation d’une pseudarthrose de GT pré-existante1- oui2- non + serrée3- non + migration GT- Ostéo-intégration d’une greffe ou d’un substitut : 1-oui2-non- Zone de contact tige/os (Zone de Gruen)Face 1 2 3 4 5 6 7Profile 8 9 10 11 12 13 14- Corticale déficiente (moins de 2mm d’épaisseur)Face 1 2 3 4 5 6 7Profile 8 9 10 11 12 13 1484
-LiseréFace 1 2 3 4 5 6 7Profile 8 9 10 11 12 13 14-Réaction corticaleFace 1 2 3 4 5 6 7Profile 8 9 10 11 12 13 14- Epaisseur corticale :Petit trochanter5cm10cmCorticale interne Corticale externe Largeur canal-Diamètre tête ou tige mesurée sur les radiographies : (facteur de correction :échelle réelle) tête tige- Ossification péri-prothétique0 aucune 1 légères 2 modérées 3majeures 4 jointivesZone de Gruen85
SYSTEME PP86
Cas n°1 :Mme P…. (53 ans)1997 : Descellement bipolaire d’une prothèsecimentée de type Charnley datant de 1975.Usure du PE et excentration de la tête fémorale.1997 : Révision par une tige PP de taille 15 etanneau de soutient de Ganz.2007 : Résultats à 9 ans de recul.87
Cas n°2 :Mme L…. (85 ans) :1999 : Descellement bipolaire d’une PTH cimentée mise enplace en 1992 (radiographie 1).Reprise par tige PP et cotyle standard impacté Atlas avecréalisation d’une trochantérotomie (radiographie 2).2007 : Résultats à 7 ans de recul (radiographie 3).Radiographie 1Radiographie 2Radiographie 388
Cas n°3Radiographie 1 Radiographie 2Radiographie 3Radiographie 4Mme M…. (57 ans)1994 : Descellement bipolaire d’une prothèse cimentée de (radiographie 1).Reprise par tige PP de taille 9 et anneau de Kerboul (radiographie 2).1999 : Fracture de l’implant et reprise par tige PP de taille 13 (radiographie 3 et 4).89
Résumé en anglaisFrom 1991 to 2003, we performed 146 revisions utilizing the same modular and uncementedfemoral stem. At a mean follow-up of 9 years, 24 patients had died, 26 were not available forfollow-up and 39 were lost to follow-up, leaving 54 revisions. The indication was asepticloosening for all cases.Outcome was assessed using the Harris Hip Score and Postel andMerle d’Aubigné score. Radiological findings evaluate stem stability, radiolucent lines andbone reconstructionAt the last follow-up, there was a significant improvement in functional status of the patientswith a HHS 71 and a PMA score 12.8. We have found that poor femoral bone quality wasstatisticaly associated with an increase of bone growth (p=0,012). With removal of thefemoral componant for aseptic loosening, the 10-year rate of survival of the femoral stem was92.5%.Our study shows significant improvement in function and relief of pain. Long termradiographic outcome are encouraging with bone reconstruction and low re-revision rate.90