Laurent Geiss - desc orthopedie
Laurent Geiss - desc orthopedie
Laurent Geiss - desc orthopedie
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
UNIVERSITE TOULOUSE III – Paul SABATIERFACULTE DE MEDECINEAnnée 2012 2012 TOU3 1599THESEPOUR LE DIPLOME D’ETAT DE DOCTEUR EN MEDECINEMEDECINE SPECIALISEE CLINIQUEPrésentée et soutenue publiquementpar :<strong>Laurent</strong> <strong>Geiss</strong>Interne des HôpitauxLe 15 octobre 2012Evaluation du saignement des fractures trochantériennes traitéespar clou GammaDirecteur de Thèse : Monsieur le professeur Philippe ChironMonsieur le Professeur Jean PUGETMonsieur le Professeur Paul BONNEVIALLEMonsieur le Professeur Philippe CHIRONMonsieur le Professeur Jean-Michel LAFFOSSEMonsieur le Docteur Jean-Louis TRICOIREMonsieur le Docteur Fabrice FERREPrésidentAssesseurAssesseurAssesseurSuppléantMembre Invité
REMERCIEMENTS
Monsieur le Professeur Jean Puget Professeur des universités Praticien hospitalier Chirurgie orthopédique et traumatologie Professeur, cher Maitre vous me faites le grand honneur d’avoir accepté laprésidence de ce jury. Je tiens à vous remercier de nous avoir enseigné l’art de lachirurgie. Votre enthousiasme et votre vision de l’orthopédie sont pour moi unesource d’inspiration. Voyez dans ce travail un témoignage de mon respect.
Monsieur le Professeur Paul Bonnevialle Professeur des universités Praticien hospitalier Chirurgie orthopédique et traumatologie Professeur, cher Maitre je suis très honoré de votre présence dans ce jury. Jetiens à vous remercier pour la bienveillance que vous nous portez. Votreimplication dans le travail, tant universitaire que clinique, force le respect.Veuillez trouver dans ce travail l’expression de ma profonde considération.
Monsieur le Professeur Philippe ChironProfesseur des universités Praticien hospitalier Chirurgie orthopédique et traumatologie Professeur, cher Maitre, vous m’avez fait l’honneur de diriger cette thèse. Vousm’avez accueilli dès mon arrivée à Toulouse et je mesure la chance d’avoir putravailler à vos côtés durant ces années d’internat. Vous m’avez confié ce sujetde thèse qui s’est révélé passionnant pour moi. Je tiens à vous remercier pour laqualité et la richesse de votre enseignement. Vos qualités de chirurgien et declinicien sont un exemple. Veuillez trouver dans ce travail ma profonde estime.
Monsieur le Professeur Jean-Michel LaffosseProfesseur des universités Praticien hospitalier Chirurgie orthopédique et traumatologie Professeur, cher Maitre, je vous suis très reconnaissant de siéger dans ce jury.Tout au long de ces années vous m’avez enseigné tant bien que mal la rigueur, lapersévérance, la technique, la théorie et l’humilité. Votre abnégation et vosqualités de chirurgiens font de vous un de nos Maitres. C’est avec un profondrespect et toute mon affection que je vous présente mon travail.
Monsieur le Docteur Jean-Louis TricoireMaitre de conférence des universitésPraticien hospitalierChirurgie orthopédique et traumatologieCher Maitre, je suis très sensible à votre présence dans ce jury. Je vous remerciede m’avoir transmis vos connaissances sur l’histoire de la médecine. A votrecontact j’ai beaucoup appris sur tous les plans. Votre efficacité et votre dextéritéchirurgicale font l’unanimité. Recevez ce travail comme une marque de monadmiration à votre égard.
Monsieur le Docteur Fabrice FerreChef de clinique et assistant des hôpitaux universitairesAnesthésie-réanimationJ’ai beaucoup apprécié l’intérêt que tu m’as spontanément porté en acceptant desiéger à ce jury. Ta vision des relations anesthésistes-chirurgiens t’honore.Reçois ici l’expression de ma sincère amitié et de ma plus grande estime.
Evaluation du saignement desfractures trochantériennes traitéespar clou Gamma
Afin d’évaluer les pertes sanguines périopératoires réelles des formules ont étédéveloppées. Celles-ci prennent en compte la chute en hématocrite, le nombre de concentrésglobulaires transfusés et le volume sanguin total du patient 10,51 , mais il n’existe pas d’étudeanalysant spécifiquement le saignement périopératoire réel des fractures du massiftrochantérien
II. OBJECTIFS L’objectif de cette étude est de déterminer le saignement périopératoire réel des patientsprésentant une fracture pertrochantérienne après une ostéosynthèse par clou Gamma etd’analyser les facteurs l’influençant.Notre hypothèse : Bien que l’ostéosynthèse percutanée par clou Gamma paraisse minimaleinvasive, elle est à l’origine d’un saignement significatif.Après avoir détaillé les différentes façons de calculer le saignement périopératoire réel, àl’aide d’une étude prospective, nous évaluerons la part de saignement liée au clou Gamma etles autres facteurs corrélés au saignement.
III. METHODE DE CALCUL DU SAIGNEMENT Les données disponibles sur le saignement des fractures pertrochantériennes dans lalittérature se limitent, le plus souvent, à la mesure du volume sanguin recueilli dans le champopératoire, à la chute en hémoglobine ou au taux de transfusion de concentrés globulaires.Pourtant, ces variables ne permettent pas d’évaluer de manière fiable le saignement etrendent les résultats difficilement comparables entre les individus, les chirurgiens, lescentres et les différents types d’ostéosynthèse:• La mesure des pertes sanguines peropératoires sous-estime systématiquement lespertes sanguines réelles. Foss 21 a démontré que le saignement périopératoire totalétait 3 à 6 fois supérieur au volume recueilli dans le champs opératoire lors de laprise en charge chirurgicale des fractures de l’ESF. De plus, l’évaluation exactedes pertes peropératoires est compliquée, du fait des pertes sur le sol, del’évaporation et du liquide de lavage. Cette mesure est donc peu reproductible.• Le nombre de concentrés globulaires transfusés ne constitue qu’un indicateurindirect du saignement périopératoire. En outre, le seuil transfusionnel varie enfonction de la tolérance clinique du patient, de son âge et de ses comorbidités, deshabitudes de l’anesthésiste, du centre et des recommandations nationales. C’estdon un indicateur indirect de saignement.• L’évaluation du saignement par la mesure de la chute en hémoglobine ou enhématocrite est également biaisée par le recours à la transfusion, d’autant que leseuil transfusionnel est variable (cf. ci-dessus).Afin d’analyser quantitativement le saignement de manière fiable, des formulesmathématiques ont donc été développées. Celles-ci permettent de déterminer le saignementpériopératoire réel qui peut être exprimé :• En volume érythrocytaire perdu (VEP) selon Mercuriali 51 ,• En volume sanguin total perdu (VSTP) selon Brecher 10 , Gross 28 ou Lisander.
La solution de cette équation différentielle intégrée entre le moment I (bilan initial) et lemoment F (bilan final) pour un VST constant est :!"# = ln !"# !!"# !C’est en 1975 que Bourke 8 décrivit le premier cette équation, mais Brecher 10 , en 1997, lacompléta et y intégra l’hémodilution normovolémique aigüe, les transfusions autologues etallogéniques, les transfusions de globules rouges récupérés en peropératoire et postopératoireet enfin l’ascension de l’hématocrite après transfusion. (cf annexe).Par souci de clarté, nous n’intègrerons dans la formule que les transfusions allogéniques,seules réalisés dans la prise en charge de nos patients opérés d’une fracture pertrochantériennepar clou Gamma.Brecher décrit 3 phases dans l’évolution de l’hématocrite dans la période périopératoire.Appliquée au modèle d’une fracture nécessitant un geste chirurgical, la phase 1 correspondaux pertes sanguines comprises entre le traumatisme et l’hématocrite minimal atteint etnécessitant ou non une transfusion. Cette phase couvre la période préopératoire, opératoire etpostopératoire précoce. La phase 2 correspond au maintien de l’hématocrite à un niveauacceptable à l’aide de transfusions et le volume sanguin perdu correspond alors au volumesanguin transfusé. La phase 3 correspond au saignement compris entre la mesure del’hématocrite minimal et la mesure de l’hématocrite final (5 ème jour postopératoire) il peuts’agir d’un gain si l’hématocrite final est supérieur à l’hématocrite initial ou d’une perte sil’hématocrite final est inférieur à l’hématocrite minimal.
Graphique 1 : : Phases de la perte sanguine à partir de la chirurgie (Brecher, 1997) 10Selon Brecher, le volume sanguin périopératoire total perdu correspond à la sommedes volumes sanguins perdus au cours de ces trois phases.III.4.1) Volume sanguin total perdu durant la phase 1 :La phase 1 correspond aux pertes sanguines comprises entre le traumatisme etl’hématocrite minimal atteint et nécessitant ou non une transfusion. Cette phase couvre lapériode préopératoire, opératoire et postopératoire précoce.!"# !1 = !"#×!" !"# !!"# !"#Où :− VST P1 = Volume sanguin total perdu durant la phase 1,− VST = Volume sanguin total selon Nadler,− Hct I = Hématocrite le jour du traumatisme,− Hct min = Hématocrite mesuré avant transfusion ou hématocrite minimal mesuréentre le traumatisme et J+5.
III.4.2) Volume sanguin total transfusé durant la phase 2 :La phase 2 correspond au maintien de l’hématocrite à un niveau acceptable, à l’aide detransfusions. Le volume sanguin perdu correspond alors au volume sanguin transfusé.!"# !"#$%& =!"#$ ∗ 0.2!"# !"#Où :−−−VST transf = Volume sanguin total transfusé,nCGR = Nombre de concentrés globulaires transfusés,Hct min = Hématocrite mesuré le jour de la transfusion.III.4.3) Volume sanguin total perdu ou gagné durant la phase 3 :Durant cette phase, en fonction de l’hémostase, des transfusions et de l’érythropoïèse dupatient, l’hématocrite peut augmenter ou baisser.• Si l’hématocrite final est supérieur à l’hématocrite minimal, alors le volumesanguin total gagné durant la phase 3 correspond à :!"# !3 =!"#×(!"# ! − !"# !"#)!"# !"#Où :− VST G3 = Volume sanguin total gagné durant la phase 3,− VST = Volume sanguin total,− Hct min = Hématocrite mesuré avant transfusion ou hématocriteminimal mesuré entre le traumatisme et J+5,− Hct F = Hématocrite mesuré le 5 ème jour postopératoire.• Si la valeur de l’hématocrite final est inférieur à l’hématocrite minimal(mesuré au moment de la transfusion), alors le volume sanguin total perdu durantla phase 3 correspond à :!"# !"#!"# !3 = !"#×!"!"# !Où :− VSP3 = Volume sanguin total perdu durant la phase 3,− VST = Volume sanguin total,− Hct min = Hématocrite mesuré avant transfusion,− Hct F = Hématocrite mesuré le 5 ème jour postopératoire.
Etude :Analyse du saignement périopératoireréel de 180 fracturespertrochantériennes traitées par clouGamma
IV. ETUDENotre objectif était de déterminer le saignement périopératoire réel des fractures du massiftrochantérien ostéosynthèsées par clou Gamma et d’identifier les facteurs l’influençant.Il s’agissait d’une étude prospective, consécutive et unicentrique portant sur 180 patients,tous traités par clou gamma3 trochanteric 180, lors d’une fracture intéressant le massiftrochantérien.L’analyse portait sur le taux de transfusion et le saignement périopératoire réel exprimé envolume de globules rouges (érythrocytes) perdu (VEP) selon la formule de Mercuriali, enpourcentage de volume érythrocytaire perdu par rapport au volume érythrocytaire initial(%VEP), en volume sanguin perdu (VSTP) selon la formule de Brecher 10 . (cf. chapitre calculdu saignement).Dans un premier temps, nous aborderons la méthodologie de l’étude, avec l’inventaire <strong>desc</strong>ritères d’inclusion, d’exclusion, des variables recueillies ainsi que des précisions concernantl’analyse statistique et la prise en charge des patients.Dans un deuxième temps nous détaillerons le matériel de l’étude avec la présentation <strong>desc</strong>aractéristiques de la série.IV.1) Méthodologie :• Etude prospective,• Unicentrique,• Série consécutive de 180 patients,• Fractures pertrochantériennes,• Traitées par clou Gamma,• Période d’inclusion : 2007 à 2010.
IV.1.1) Critères d’inclusion :• Age indifférent,• Fracture du massif trochantérien,• Fracture récente,• Patient mono-traumatisé,• Traité en première intention par clou Gamma,• Recueil de l’ensemble des données nécessaires au calcul du saignement périopératoireréel.IV.1.2) Critères d’exclusion :• Abord du foyer de fracture pour réduction,• Fracture dont le trait s’étendait plus de 3cm sous la projection du petit trochanter,• Fractures pathologiques,• Fracture concomitante,• Bilan initial réalisé plus de 12h après le traumatisme,• Recueil insuffisant de données (pas de numération sanguine entre le 4 ème et le 6 ème jourpostopératoire; absence de notion du poids et/ou de la taille même après avoir contactéle patient ou sa famille),• Reprise chirurgicale précoce au cours de l’hospitalisation initiale,• Hémorragie en dehors du site opératoire au cours de l’hospitalisation (gastrointestinal).IV.1.3) Variables retenues pour l’analyse statistique :Nous avons relevé l’ensemble des caractéristiques du patient et les variables connues dansla littérature comme facteur d’hémorragie ou susceptibles de l’être. La fiche de recueil dedonnées figure dans les annexes p. Nous détaillerons donc les caractéristiques des patients,leurs comorbidités, les traitements en cours, le type de fracture, les variables opératoires et lesvariables postopératoires retenues pour l’analyse statistique.
Caractéristiques du patient :− L’âge en année (différence entre la date de naissance et la date de la fracture),− Le sexe (H/F),− L’IMC était calculé à partir du poids et de la taille des patients (P/Taille²).Etat du patient en préopératoire :− Le score ASA (classé en deux catégories : 1/2 et 3/4 ),− La présence de troubles cognitifs ou d’accident vasculaire cérébral (oui/non),− Antécédents de pathologies cardiovasculaires (oui/non),− Antécédents de pathologie respiratoires ou décompensation respiratoire en cours(oui/non),− Antécédents d’ulcère ou d’hémorragie digestive (oui/non),− Trouble de la coagulation en dehors de la prise d’anticoagulant (oui/non) caractérisé parune thrombopénie
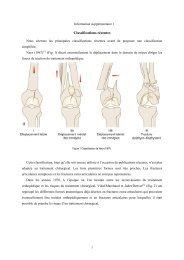
Type de fracture :L’analyse des radiographies préopératoires était réalisée par le même observateur selon :a) La classification d’Evans 19 modifiée par Jensen 34 permet d’analyser le saignement enfonction des régions anatomiques lésées. Les 6 types ont été regroupés en 5 classes :• Type 1 et 2 : fracture 2 fragments, regroupés car le trait de fracture est simple etparallèle à la ligne intertrochantérienne,• Type 3 : fracture pertrochantérienne avec comminution de la console externe(fracture du grand trochanter),• Type 4 : fracture pertrochantérienne avec comminution de l’arche interne (fracturedu petit trochanter),• Type 5 : fracture pertrochantérienne avec comminution de la console externe et del’arche interne (fracture du grand et petit trochanter),• Type R : Reverse fracture, mais exclusion des fractures dont le trait <strong>desc</strong>endait plusde 3cm sous la projection du petit trochanter. Nous avons donc uniquementconservé les fractures dont le trait passait perpendiculairement ou légèrementobliquement par rapport au massif trochantérien afin que le saignement d’originediaphysaire n’interfère pas avec le saignement d’origine métaphysaire.Figure 1: Classification d'Evans modifiée par Jensen
) La classification d’Ender 17 qui permet d’analyser le saignement en fonction dudéplacement initial de la fracture et du mécanisme lésionnel. Le type 7ʹ′,8 et 8ʹ′ étaientexclu car il s’agit de fractures sous-trochantériennes dont le trait dépasse le petittrochanter de plus de 3cm. Les 7 autres types ont été regroupés en 4 classes en fonction dudéplacement de la fracture :• Type 1 et 2 : regroupés car fracture en éversion peu ou pas déplacées (ouvertureantérieure (type 1) et parfois détachement d’un fragment postérieur (type 2).• Type 3 : fracture à grand déplacement externe, supérieur et postérieur signant undélabrement musculo-tendino-ligamentaire important.• Type 4 et 5 : regroupées car fracture-impaction par mécanisme d’inversion.• Type 6 et 7 : fractures intertrochantériennes et sous-trochantériennes hautes.Figure 2: Classification d'Ender
c) La classification de l’AO 56 qui permet d’analyser la fracture en fonction de sacomminution et de la direction du trait de fracture. Le type A31 était exclu car il s’agitde fractures sous-trochantériennes dont le trait dépasse le petit trochanter de plus de 3cm.Les 8 autres types ont été regroupés en 3 classes :• Type A1 : A.1, A1.2 et A1.3 regroupés car il s’agit de fractures 2 fragments• Type A2 : A2.1, A2.2 et A2.3 regroupés car il s’agit de fractures comminutives• Type A3 : A3.2 et A3.3 : fractures intertrochantériennes et sous-trochantérienneshautesFigure 3: Classification de l'AOVariables peropératoires :− Délai opératoire (entre le traumatisme et la chirurgie) en heures,− Alésage (oui/non),− Rachianesthésie (oui/non),− Survenue d’une hypotension peropératoire caractérisée par une PAS inférieure à90mmHg (oui/non),− Le temps opératoire en minutes.
Variables postopératoires :− Anticoagulation postopératoire adaptée à la fonction rénale (oui/non),− Délai entre l’anticoagulation et la chirurgie en heures.Variables liées au calcul du saignement :− Nombre de concentrés globulaires transfusés entre le traumatisme et le jour retenu pour lecalcul du saignement périopératoire réel J5 ±1 jour (nCGR),− Hématocrite le jour du traumatisme (Hct I),− Hématocrite au 5 ème jour postopératoire ±1jour (Hct F),− Hématocrite minimal mesuré entre le traumatisme et J+5 ou hématocrite le jour de latransfusion (Hct min).IV.1.4) Protocole de prise en charge des patients :La gestion d’un patient présentant une fracture de l’ESF est standardisée tant aux urgencesque dans le service.A l’arrivée aux urgences, les patients bénéficiaient d’un bilan clinique, biologique etradiographique préopératoire standard. Une traction non-collée était mise en place jusqu’àl’intervention.L’intervention chirurgicale avait lieu dans les meilleurs délais en fonction <strong>desc</strong>omorbidités, du traitement personnel des patients et des contraintes pratiques. Les patientssous clopidogrel ont vu leur traitement interrompu en moyenne plus de deux jours avantl’intervention, sauf contre-indication. Les patients sous acide acétylsalicylique étaient opéréssans délai supplémentaire. Les patients sous anticoagulant étaient opérés une fois que leurINR était inférieure à 1,5. Tous les patients bénéficiaient d’une anticoagulation postopératoirepréventive (enoxaparine sodique ou héparine calcique) et celle-ci était débutée le jour del’intervention. Les patients sous antiagrégant plaquettaire en préopératoire reprenaient tousleur traitement à J+1.L’intervention a consisté en la mise en place d’un clou Gamma3 (Stryker Trauma®,Geneva, Switzerland) selon la technique chirurgicale standard. Après réduction du foyer defracture sur table orthopédique. L’alésage diaphysaire n’a pas été systématique. L’abord dufoyer de fracture constituait un critère d’exclusion. La réduction du foyer de fracture
• Le volume érythrocytaire perdu (VEP), selon Mercuriali 51 , correspondait à:!"# = !"#×∆!"# + !"#$×0.2Où :− VEP = Volume érythrocytaire perdu en litres selon Mercuriali 51 ,− ΔHct = Hct I − Hct F : Différence entre Hématocrite le jour du traumatisme et à J+5 (±1jour),− VST = Volume sanguin total selon Nadler et Hidalgo 57 ,− nCGR = Nombre de concentrés globulaires transfusés entre le traumatisme et J+5 (±1 jour).• Le pourcentage de volume érythrocytaire perdu rapporté au volume érythrocytaireinitial (%VEP) correspondait à :%!"# = !"#!"# ×100Où :− %VEP = VEP exprimé en pourcent du volume érythrocytaire initial,− VEP = Volume érythrocytaire perdu en litres selon Mercuriali 51 ,− VET = Volume érythrocytaire total initial.• Le volume sanguine total perdu (VSTP), selon Brecher 10 correspondait à:!"# ×(!"# F −!"# min )!"#$ = !"#× ln !"# !!"# !"# + !"#$×0.2 − !" !"# ! > !"#$%&!"# !"# + !"# !"#!"!"# !"#!"# ×!" !" !"# ! < !"# !"#!"# !Où :− VSTP = Volume sanguin total perdu en litres, selon Brecher,− VST = Volume sanguin total selon Nadler ,− Hct I = Hématocrite le jour du traumatisme,− Hct min = Hématocrite mesuré avant transfusion ou hématocrite minimal mesuréentre le traumatisme et J+5 en l’absence de transfusion,− n CGR = Nombre de concentrés globulaires transfusés,− Hct F = Hématocrite à J+5 +/- 1jour.
IV.1.6) Analyse statistique :Les résultats étaient analysés par un statisticien de notre établissement (Lepage B.). Laperte sanguine (VEP et %VEP) étant mesurée par des variables quantitatives, les analysesbivariées étaient réalisées par un test T de Student lorsqu’on s’intéressait à l’association avecdes variables binaires, par une ANOVA (ou un test de Kruskal Wallis) lorsqu’on s’intéressaità l’association avec une variable qualitative à plus de deux classes, et par un test decorrélation de Pearson (ou de Spearman) lorsqu’on s’intéressait à l’association avec desvariables quantitatives. Le choix des tests non paramètriques a été fait quand les conditionsd’application des tests de Student, d’ANOVA, ou de corrélation de Pearson n’étaient pasprésentes.Pour l’analyse multivariée, seuls les facteurs, dont le degré de significativité était inférieurà 0.20, après analyse univariée, ont été pris en compte. Afin d’éviter les problèmes decolinéarité, les 3 classifications de fracture ont été étudiées séparément dans l’analysemultivariée. Par souci de clarté, nous présentons un tableau d’analyse multivariée, en mettanten commun les 3 classifications. Les autres variables que le type de fracture ont été calculéeslors de l’analyse multivariée du saignement en fonction de la classification d’Evans. Lesrésultats de l’analyse multivariée, en fonction des classifications d’Ender et de l’AO ne fontpas différer de manière significative les autres facteurs de risque.
IV.2) Matériel : Analyse <strong>desc</strong>riptive de la cohorteDurant la période d’inclusion, 253 clous gamma trochanteric 180® ont été mis en place enpremière intention, pour une fracture pertrochantérienne récente. Les patients exclus de cetteétude ont été :• 14 fractures <strong>desc</strong>endant plus de 3cm sous le petit trochanter (sous-trochantérienne ettrochantéro-diaphysaire) étaient traitées par clou Gamma court.• 18 patients n’avaient pas bénéficié d’une prise de sang à J5 +/-1jour.• 11 fiches de recueil ne comportaient pas le poids et /ou taille, même après avoir tenté detéléphoner au patient ou à sa famille.• 11 patients ont été exclus du fait d’un délai entre la fracture et le bilan biologique réaliséaux urgences supérieur à 12 heures.• 10 patients ont présenté une fracture concomitante (poignet, épaule ou polytraumatisé).• 5 patients ont été opérés plus de 7 jours après le traumatisme.• 2 patients ont été exclus du fait de la nécessité d’un abord pour réduire la fracture.• 2 fractures pathologiques.Au total notre population d’étude concernait 180 patients.IV.2.1) Les caractéristiques de la cohorte :Dans le tableau 1 figure les principales caractéristiques de la cohorte étudiée. On comptait130 femmes (72,2%) pour 50 hommes (27,8%) Figure 5. Les patients étaient âgés de 84,5 ansen moyenne (±10,9 ans) Graphique 2. L’IMC (indice de masse corporel) moyen était de 23,3kg/m2 (écart type : 4,6 kg/m2), la moitié des patients avait un IMC inférieur à 22,5 kg/m2, 44personnes étaient en surpoids (24,4%) et 14 étaient obèses (7,8%) Figure 6.Tableau 1: Caractéristiques des patients (âge, poids, taille) Nb patients moyenne écart type minimum médiane maximum Age en années 180 84,5 10,9 35,3 86 102,6 Poids en kg 180 61 13,9 39 60 105 Taille en cm 180 1,62 0,09 145 162 186 IMC 180 23,3 4,6 15,2 22,5 41,1 IMC = indice de masse corporelle
IV.2.2) Antécédents des patients :Les antécédents et comorbidités des patients sont décrits dans le Tableau 2. Un score ASAde 3 ou 4 était observé chez 74 patients (41,1%). La plupart des patients présentaient plusieurscomorbidités et notamment des antécédents cardiovasculaires (65,6%) ou des troublescognitifs (48,3%).Tableau 2: Etat préopératoire des patients (ATCD, comorbidités) Troubles cognitifs/ ATCD d’AVC ATCD cardiovasculaires ATCD ulcère, gastrite ou hémorragie digestive ATCD respiratoires Insuffisance rénale sévère pré et/ou postopératoire (1) Troubles de la coagulation (2) Nb patients % non 93 51,7% oui 87 48,3% non 62 34,4% oui 118 65,6% non 128 71,1% oui 52 28,9% non 126 70% oui 54 30% non 118 65,6% oui 62 34,4% non 169 93,8% oui 11 6,2% 1 10 5,6% 2 96 53,3% Score ASA 3 71 39,4% 4 3 1,7% 1 ou 2 106 58,9% Score ASA binaire 3 ou 4 74 41,1% 1: clairance de la créatinine
IV.2.3) Traitements préopératoires interférent avec l’hémostase :Les traitements des patients, à leur admission aux urgences susceptibles d’interférer avec lesaignement sont décris dans le Tableau 3.22,8% des patients étaient sous Acide Acétylsalicylique (Kardegic®) seul, 11,1% despatients étaient sous Clopidogrel (Plavix®) plus ou moins en association avec l’AcideAcétylsalicylique et 9,4% des patients étaient sous anti-vitamine K (Previscan®,Coumadine®).Tableau 3: Traitements préopératoires interférant avec l'hémostase Nb patients % Non 102 56,7% Antiagrégants Kardégic® 41 22,8% plaquettaires ou anti-‐Plavix® ± Kardegic® (1) 20 11,1% vitamine K (AVK) AVK (2) 20 11,1% (1) dont 3 patients sous AVK ; (2) dont 3 patients sous PlavixLes délais moyens entre le traumatisme et la chirurgie ainsi que la comparaison de cesdélais en fonction de l’antiagrégation plaquettaire préopératoire figurent dans le Tableau 4.On constate que le délai moyen entre le traumatisme et la chirurgie était comparable(p=0.22) pour les patients sous Acide -Acétylsalicylique et les patients sans antiagrégantsplaquettaire (environ 1 jour). Alors que les patients sous Clopidogrel ± Acide -Acétylsalicylique avaient un délai opératoire significativement supérieur aux patients sousAcide -Acétylsalicylique seul (environ 2 jours) (p
IV.2.5) Paramètres biologiques pré et postopératoires mesurés :Les différents paramètres biologiques pré et postopératoires relevés figurent dans leTableau 6. En moyenne les patients présentaient une hémoglobine le jour de leur arrivée auxurgences de 12,6g/dl (±1,4), le Taux de prothrombine (TP) moyen initial était de 85,5%(±14,7) et la clairance de la créatinine selon la formule de Cockcroft était de 42 µmol/l enpréopératoire. De plus, les patients sous anti-vitamine K avaient un INR moyen de 2,6 à leurarrivée aux urgences et 50% d’entre eux étaient opérés avec un INR
Dans le Tableau 7 figurent les valeurs des volumes sanguins mesurés. Le volume sanguintotal calculé selon la formule de Nadler et Hidalgo 57 le volume sanguin total moyen à l’arrivéeaux urgences était de 3,831 litres (±0,766). Le volume érythrocytaire moyen le jour dutraumatisme (VST × Hématocrite initial) était de 1,457ml (±0,376).Tableau 7: Volumes sanguins mesurés Nb patients moyenne écart type min médiane max Volume sanguin total (1) (2) en litres 180 3,831 (0,766) 2,592 3,598 6,233 Volume érythrocytaire initial (2) en 180 1,457 (0,376) 0,760 10,4 262,3 litres (1) : selon Nadler ; (2) : le jour du traumatismeIV.2.6) Caractéristiques de l’intervention :Les variables opératoires relevées figurent dans les Tableaux 8 et 9. Le délai opératoiremoyen était de 29 heures et 50% des patients étaient opérés dans les 24 premières heuressuivant le traumatisme. Le temps opératoire moyen était de 34,1 minutes. Les donnéesdisponibles pour l’alésage ne concernaient que 108 patients ; 59,2% des patients nebénéficiaient pas d’alésage avant la mise en place du clou. 57,8% des interventions seréalisaient sous rachianesthésie et on observait une hypotension peropératoire dans 41,1% <strong>desc</strong>as (pression artérielle systolique < 9mmHg).Tableau 8: Variables peropératoires quantitatives Délai opératoire en heures Temps opératoire en minutes Nb patients moyenne écart type minimum médiane maximum 180 29,2 17,6 9 24 96 180 34,1 12,3 15 30 100 Tableau 9: Variables peropératoires qualitatives Nb patients % Alésage non 64 59,2% oui 44 40,8% Rachianesthésie non 76 42,2% oui 104 57,8% PAS inférieur à 90mmHg en non 106 58,9% peropératoire oui 74 41,1% PAS = pression artérielle systolique
IV.2.7) Caractéristiques de l’anticoagulation postopératoirepréventive chez les patients présentant une insuffisancerénale sévère :Les données concernant l’anticoagulation postopératoire préventive chez les patientsprésentant une insuffisance rénale sévère (clairance créat.
Graphique 3: Comparaison de la valeur moyenne d'hématocrite préopératoire chez les patients insuffisants rénaux sévères en fonction de l'anticoagulation post-‐opératoire 149 108 créa^nine en µmol/L p=0.04 IRS et AC adaptée IRS et AC inadaptée IRS = insuffisance rénale sévère ; AC = anticoagulation postopératoire préventive
IV.3) Résultats :Nous présenterons dans un premier temps les résultats de l’analyse du saignement globallors d’une ostéosynthèse par clou Gamma d’une fracture trochantérienne, puis les facteursinfluençant ce saignement après analyse uni et multivariée.IV.3.1) Saignement périopératoire réel après ostéosynthèse d’unefracture trochantérienne par clou Gamma :Les résultats concernant l’évaluation du saignement figurent dans le Tableau 11. Le tauxd’hémoglobine moyen mesuré à l’admission aux urgences était de 12.6 (±1.4) g/dl et la chuted’hémoglobine moyenne mesurée était de 2.2 (±1.9) g/dl entre le jour du traumatisme et J5±1jour après transfusion.En moyenne, la perte périopératoire totale d’érythrocyte (VEP), selon la formule deMercuriali 51 , étaient de 541 ml (± 240ml) allant de 0 à 1800ml. Ceci correspondait à 39%(±19.4%) du volume sanguin érythrocytaire initial des patients (%VEP).Le volume sanguin total perdu (VSTP), selon Brecher 10 , était de 2251ml (±1214ml).Tableau 11: Saignement périopératoire réel : résultats globaux moyenne écart type min max VEP 541 ml (240) -‐59 1800 %VEP 39,0% (19,4) -‐5,5% 118,6% VSTP 2,251 litres (1,214) -‐0,02 10 Hb I 12,6 g/dl (1,4) 8,5 16,5 ΔHb 2,2 g/dl (1,9) -‐2,1 7 VEP = volume érythrocytaire perdu ; % VEP= rapport en pourcent entre VEP et volume érythrocytaire initial; VSTP= volume sanguin total perdu; Hb I = hémoglobine le jour du traumatisme ; ΔHb= différence entre hémoglobine initiale et à J+5
Le Graphique 4 représente la cinétique des pertes sanguines exprimées en VEPOn voit qu’avant l’intervention, la perte moyenne de volume érythrocytaire était de 225ml.La perte de volume érythrocytaire était maximale (297ml) entre la chirurgie et le premier jourpostopératoire puis le saignement diminuait pour devenir quasiment nul au 4 ème jourpostopératoire.Graphique 4: VEP par jour en fonction du délai par rapport à l'intervention 350 300 250 200 150 100 50 0 J < 0 J 0 J+1 J+2 J+3 J+4 J+5 J+6 IV.3.2) Taux de transfusion après ostéosynthèse par clou Gamma :Dans le Tableau 12 figurent les informations sur les transfusions réalisées sur notre cohorte.Le taux de patients transfusés était de 63.3% à J+5; en moyenne chaque patient transfusé abénéficié de 2,4 concentrés globulaires à J+5. Si le critère d’évaluation porte sur l’ensemblede la période d’hospitalisation, alors au total 122 patients étaient transfusés, soit 67.7% despatients.Tableau 12: Taux de transfusion des patients traités par clou Gamma Nb taux patients transfusions transfusés nb de concentrés globulaires par patient nb de concentrés globulaires par patient transfusé à J+5 114 63,3% 1,5 2,4 au cours de l'hospitalisation 122 67,7% 1,7 2,5
Le Graphique 5 détaille la cinétique des transfusions en fonction du délai par rapport àl’intervention. La moitié des patients transfusés (47,5%) l’était le jour de l’intervention.Graphique 5 : Evolution du nombre de patients transfusés en fonction du délai par rapport à l'intervention Nb pa^ents transfusés 70 60 50 40 30 20 10 0 -‐1 0 1 2 3 4 5 6 7 8 >8 Délai en jours par rapport à l'interven^on IV.3.3) Corrélations entre les pertes sanguines et le volumetransfusé :Les Graphique 6,7 et 8 analysent la corrélation entre le volume sanguin transfusé (exprimé en volume de globules rouges) et le saignement (exprimé en VEP, %VEP et VSTP). On constate que le volume sanguin transfusé était corrélé de manière linéaire avec le saignement (pour les trois figures). Et plus le saignement était important plus le volume transfusé l’était. C’étaient les valeurs du saignement exprimées en pourcentage de volume érythrocytaire perdu (%VEP) qui étaient le mieux corrélées au volume sanguin transfusé (R² le plus proche de 1).
Graphique 6: Corrélation entre le VEP, selon Mercuriali, et le volume sanguin transfusévolume érythrocytaire transfusé en ml 1400 1200 1000 800 600 400 200 VEP en litres 0 0,0 0,5 1,0 1,5 R² = 0,39 Graphique 7: Corrélation entre le %VEP et le volume transfusé volume érythrocytaire transfusé en ml 1400 1200 1000 800 600 400 200 %VEP 0 0% 20% 40% 60% 80% 100% 120% R² = 0,65 Graphique 8: Corrélation entre le VSTP selon Brecher et le volume transfusé volume érythrocytaire transfusé en ml 1400 1200 1000 800 600 400 200 0 VST en litres 0 1 2 3 4 5 6 R² = 0,46
IV.3.4) Analyse univariée des variables influençant le saignementpériopératoire :L’analyse des facteurs de risque de saignement a porté sur le volume érythrocytaire perdu(VEP) et sur le pourcentage de volume érythrocytaire perdu afin d’évaluer l’impact de la pertesanguine en érythrocyte sur le volume érythrocytaire initial des patients.Les facteurs analysés étaient les données préopératoires liées aux patients, à ses traitementset à ses comorbidités, le type de fracture, les données peropératoires et l’anticoagulationpreventive postopératoire.a) Analyse univariée des données préopératoiresen fonction du saignement périopératoire réel :Dans les Tableaux 13 et 14 figurent l’analyse du saignement périopératoire en VEP et%VEP des variables préopératoires.Le sexe féminin, l’âge élevé, une insuffisance rénale sévère et la prise d’anticoagulant oud’antiagrégants plaquettaires en préopératoire augmentaient significativement (p
Tableau 13: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction des données préopératoires qualitatives VEP %VEP sexe ATCD cardio-vaculairesATCD pulmonaires ATCD cognitifs / neurologiques ATCD UGD ou hémorragie digestive Insuffisance rénale sévère Troubles de l'hémostase Score ASA Antiagrégants plaquettaire ou anti-‐vitamine K en préopératoire écart écart type n VEP type p %VEP hommes 50 0,579 (0,27) 31,1% (15,4) 0,14* femmes 130 0,527 (0,23) 42,1% (20,0) non 62 0,515 (0,26) 37,3% (22,7) 0,28* oui 118 0,555 (0,23) 39,9% (17,5) non 126 0,541 (0,22) 39,6% (19,0) 0,97* oui 54 0,543 (0,27) 37,7% (20,4) non 93 0,553 (0,24) 40,3% (19,9) 0,55* oui 87 0,529 (0,24) 37,7% (18,8) non 128 0,530 (0,23) 38,8% (19,6) 0,28* p 0,001* 0,41 * 0,51 * 0,43 * 0,77* oui 52 0,570 (0,27) 39,6% (19,1) non 118 0,531 (0,25) 35,5% (18,7) 0,29* 0,0003* oui 62 0,561 (0,21) 45,6% (18,9) non 169 0,537 (0,23) 38,8% (18,6) 0,17* oui 11 0,567 (0,29) 40,2% (23,3) 0,51 * 1 ou 2 106 0,552 (0,23) 40,2% (19,7) 0,48* 3 ou 4 74 0,524 (0,25) 37,2% (18,9) 0,35 * non (ref) 102 0,480 (0,22) 34,9% (17,0) kardégic® 41 0,652 (0,23) 47,3% (22,2) plavix® 0,007¥ 20 0,591 (0,26) 42,5% (17,0) 0,004¥ AVK 20 0,531 (0,24) 36,2% (22,2) * test de Student ; ¥ correlation de Spearman ; VEP = volume érythrocytaire perdu entre le traumatisme et J5 en litres; %VEP= rapport en pourcent entre VEP et volume érythrocytaire initial; ATCD= antécédents ; UGD = ulcère gastro-‐duodénal ; ASA = American society of anesthesiology Tableau 14: Analyse univariée du saignement périopératoire réel en fonction des données préopératoires quantitatives VEP %VEP moyenne rho (VEP) p rho (%VEP) p Age 84,5 0,12 0,11* 0,23 0,002* IMC 23,3 0,13 0,09* -‐0,13 0,08* * corrélation de Spearman ; VEP = volume érythrocytaire perdu entre le traumatisme et J5 en litres; %VEP= rapport en pourcent entre VEP et volume érythrocyaire initial
) Analyse univariée du type de fractureen fonction du saignement périopératoire réelDans le tableau 15 figure l’analyse du saignement en fonction du type de fracture rencontré.Tableau 15 : Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction du type de fractureVEP %VEP Classification Evans modifiée Jensen Evans Ender AO Nb type patients VEP écart type p %VEP écart type p 1 ou 2 40 0,43 (0,209) 0,0001* 31,5% (16,1) 0,0001 3 10 0,575 (0,338) 41,4% (34,3) 4 49 0,476 (0,189) 31,6% (13,3) 5 67 0,643 (0,223) 46,7% (18) Reverse 14 0,589 (0,300) 45,4% (25,5) 1,2 ou 4 89 0,457 (0,195)
Selon la classification de l’AO, les patients qui présentaient une fracture comminutive (A2)ou sous /intertrochanterienne (A3) saignaient significativement plus que les patients quiprésentaient une fracture de type A1. c) Analyse univariée des données opératoiresen fonction du saignement périopératoire réelDans les tableaux 16 et 17 figurent l’analyse des pertes sanguines périopératoires enfonction des données opératoires.Les patients qui avaient bénéficié d’une rachi-anesthésie avaient un VEP significativementinférieur aux patients qui avaient bénéficié d’une anesthésie général. Et ils saignient doncmoins.Les patients qui avaient présenté une hypotension peropératoire caractérisé par unepression arterielle systolique
Tableau 17: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction des données opératoires quantitatives VEP %VEP moyenne écart type rho p° rho p° Délai opératoire en heures 29,2 (17,6) 0,04 0,55 0,01 0,94 Temps opératoire en minutes 34,1 (10,3) 0,01 0,94 -‐0,01 0,94 ° correlation de Spearman ; VEP: perte sanguine exprimée en volume érythrocytaire perdu en litres; %VEP: perte sanguine exprimée en pourcentage du volume sanguin initial d) Analyse univariée de l’anticoagulation postopératoire en fonction du saignement périopératoire réel : Dans le Tableau 18 figure les resultats de l’analyse du saignement en fonction del’anticoagulation postopératoire préventive.Un surdosage de l’anticoagulation postopératoire préventive chez les patients présentantune insuffisance rénale sévère était significativement associé à une augmentation du %VEPsans augmentation du VEP.Tableau 18: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction de l’anticoagulation postopératoire AC adaptée à la fonction rénale Nb patients VEP VEP écart type p* %VEP %VEP écart type non 31 0,559 (0,232) 45,7% (21,9) 0,72 oui 149 0,538 (0,239) 37,6% (18,4) * test de Student; VEP = volume érythrocytaire perdu entre le traumatisme et J5 en litres; %VEP= rapport en pourcent entre VEP et volume érythrocyaire initial ; AC = anticoagulation postopératoire péventive p* 0,04
IV.3.5) Analyse multivariée des variables influençant lesaignement périopératoire :Tableau 19: Analyse multivariée des facteurs de risque de saignement périopératoire réel (VEP, %VEP) VEP %VEP Classification Evans modifiée par Jensen Classification Ender Classification AO Sexe AC ou anti-agrégants en préop. Insuffisance rénale et AC PAS
Le Tableau 19 présente les résultats de la régression multivariée des facteurs de risqued’augmentation du volume éythrocytaire perdu (VEP) ou d’augmentation du pourcentage devolume érythrocytaire perdu par rapport au volume érythrocytaire initial (%VEP). Seuls lesfacteurs de risques dont le degré de significativité était supérieur à 0,2 après analyse bivariéeont été conservés pour l’analyse multivariée. Concernant le type de fracture, les 3classifications ont été évaluées séparément pour éviter les problèmes de colinéarité. En grasfigure les valeurs significatives avec un intervalle de confiance de 95%. En dehors du type defracture, les variables qui figurent dans ce tableau sont analysées en fonction de laclassification d’Evans.Pour la classification d’Evans 19 modifiée par Jensen 34 une fracture de type 3, 5 ou Reverseentrainait une augmentation du VEP et du %VEP significative par rapport au groupe deréférence (type 1 ou 2) et indépendante des autres facteurs de risque. Ainsi, les types 3, 5 etReverse avaient un VEP moyen augmenté respectivement de 30%, 40% et 35%. De même le%VEP était augmenté respectivement de 25%, 40% et 42%.Pour la classification de Ender, une fracture de type 4 ou 5 et 6 entrainait une augmentationdu VEP et du %VEP significative par rapport au groupe de référence (type 1 ou 2) etindépendante des autres facteurs de risque. Ainsi, par rapport aux types 1 ou 2, les types 4/5 etles types 6 ou 7 avaient un VEP moyen augmenté respectivement de 31% et 29%. De mêmele %VEP était augmenté respectivement de 36% et 40%.Pour la classification de l’AO, une fracture de type A2 et A3 entrainait une augmentationdu VEP et du %VEP significative par rapport au groupe de référence (type A1) etindépendante des autres facteurs de risque. Ainsi, par rapport au type A1, les types A2 et A3avaient un VEP moyen augmenté de 25%. De même, le %VEP était respectivement augmentéde 26% et 34%.Bien que les femmes avaient un VEP sensiblement inférieur aux hommes (-74ml ; NonSignificatif), elles perdaient en moyenne 20% de %VEP de plus.La prise d’Acide Acétylsalicylique (Kardegic®) en préopératoire entrainait uneaugmentation significative du VEP de 149ml (+31%) et de 33% du %VEP. La prise deClopidogrel (Plavix®) ou d’anti-vitamine K en préopératoire n’entrainait pas d’augmentationsignificative du saignement.
Une anticoagulation postopératoire préventive inadaptée à une insuffisance rénale sévère(surdosage) entrainait une augmentation significative du %VEP de 26%. Une insuffisancerénale sévère seule n’était pas un facteur de risque de saignement.La constatation d’une hypotension peropératoire s’accompagnait d’une augmentationsignificative de 103ml du VEP (+20%) et du %VEP de +25%.Les patients ayant bénéficié d’une rachi-anesthésie ne présentaient pas de différencesignificative de saignement, après analyse multivariée, comparativement aux patients ayantbénéficié d’une anesthésie générale.L’âge et l’indice de masse corporelle n’avaient pas d’influence significative sur lesaignement après analyse multivariée.En l’absence de facteur de risque significatif et indépendant d’augmentation du VEP, lesaignement moyen était de 420ml de VEP et 1,8l de VSTP et le taux de transfusion était de55,3% (cf. Tableau 20).En l’absence de facteur de risque significatif et indépendant d’augmentation du %VEP, lesaignement moyen était de 454ml de VEP et 1,6l de VSTP et le taux de transfusion était de23,5% (cf Tableau 20).Tableau 20: Analyse du saignement pour les séries sans facteur de risque d'augmentation du VEP ou du %VEP nb patient VEP VSTP %transfusions série sans FdR VEP 47 420ml 1,8 L 55,3% Série sans FdR %VEP 17 454ml 1,6 L 23,5% série globale 180 541ml 2,2 L 63,3% FdR = Facteurs de risque ; VEP= volume érythrocytaire perdu ; VSTP = volume sanguin total perdu %VEP = VEP rapporté au volume érythrocytaire initial
DISCUSSION
V. DiscussionV.1) Réponse à l’hypothèse :L’hypothèse selon laquelle le clou Gamma entraine un saignement important lors del’ostéosynthèse d’une fracture pertrochantérienne est confirmée avec un saignementpériopératoire réel significatif (2,2 L de volume sanguin total perdu) et un taux de transfusionde 63%.V.2) Critiques :Certains biais sont liés à des problèmes de recueil des données, d’autres sont liés auxdifférentes formules permettant le calcul du saignement périopératoire. Nous détaillerons cesdifférents biais.V.2.1) Biais : recueils des donnéesBien qu’il s’agisse d’une étude prospective, 18 patients n’ont pas eu de prise de sang à J+5±1 jour et 11 patients ont été exclus de l’étude du fait d’absence de données concernant lepoids et la taille ce qui empêchait le calcul du volume sanguin total selon Nadler 57 .Des difficultés pour relever les variables ont été rencontrées. Les données concernantl’heure du traumatisme, le délai et la durée opératoire sont parfois approximatives et lesantécédents des patients étaient difficilement relevables chez les personnes démentes enl’absence de transmissions du médecin traitant. Enfin seul 108 patients
V.2.2) Biais : calcul du volume sanguin périopératoire perduDes réserves sont à émettre quand à l’application des formules de Mercuriali et de Brecherdans le cadre de la traumatologie. Ainsi, l’hématocrite mesurée à l’admission aux urgences nereflète pas l’hématocrite avant le traumatisme puisque le saignement débute dès la chute dusujet. Ceci conduit donc à une sous-estimation du saignement périopératoire.D’autre part ces patients âgés et fragiles se présentent aux urgences avec un certain degréde déshydratation ce qui entraine une hémoconcentration et donc une surestimation del’hématocrite initiale et par conséquent une surestimation du saignement périopératoire.Certains auteurs corrigent les valeurs d’hématocrite initial en considérant que ces patientstraumatisés présentent une hypovolémie de 10% 21 . Pour notre part nous pensons que cettehémoconcentration est compensée par la sous-estimation de l’hématocrite initiale liée au délaientre le traumatisme et la prise de sang réalisée aux urgences.Afin de calculer au mieux le saignement périopératoire réel, une attention particulière doitêtre apportée au jour retenu comme valeur de l’hématocrite final. Cette mesure doit se réaliseà distance de l’intervention pour prendre en compte l’ensemble du saignement postopératoireet permettre un équilibre du volume sanguin total du patient sans être trop à distance de l’actechirurgical pour ne pas entrainer une sous-évaluation du saignement du fait de l’érythropoïèsenaturelle du patient.Le saignement se poursuit 2 à 4 jours après l’ostéosynthèse de la fracture 23 , dans notreétude le saignement s’arrêtait au 5 ème jour postopératoire (cf. Graphique 4 p.36)Quelques heures après une intervention chirurgicale la rétention de fluide peut représenterplusieurs litres 32 et conduire à une surestimation du saignement total calculé par hémodilution.Il faut attendre l’équilibre du compartiment sanguin et l’arrêt du saignement pour déterminerle saignement périopératoire réel. La mesure de l’hématocrite finale doit donc être réalisée àdistance de l’intervention.Mais il ne faut pas que cette mesure se fasse trop à distance de la chirurgie carl’érythropoïèse naturelle du patient conduirait à une augmentation de l’hématocrite et lesaignement réel serait alors sous-estimé car la formule utilisée ne tient pas compte del’érythropoïèse naturelle. Cette ascension naturelle de l’hématocrite semble avoir lieu entre le4 ème et le 5 ème jour postopératoire 36,51,66 .
Afin de minimiser ces phénomènes et d’apprécier au mieux le saignement périopératoireréel, nous avons retenu comme valeur d’hématocrite final (Hct F) l’hématocrite mesurée le5 ème jour postopératoire (±1jour) comme de nombreux auteurs 10,21,26,42,48,51 .Le volume érythocytaire contenu dans chaque poche de concentré globulaire est variable,nous n’avons pas relevé exactement le volume de globule rouge de chaque transfusion. Nousavons considérer qu’en moyenne un concentré globulaire allogénique transfusé contenait200mL d’érythrocytes grâce à l’étude de Goodnough 27 . D’autres auteurs estiment sans étayerleur considération qu’un concentré globulaire contient 180ml d’erythrocytes 51 .Tous ces biais s’appliquent à l’ensemble des malades ce qui conserve la valeurcomparative de ces chiffres. Le calcul de la perte sanguine périopératoire à l’aide desformules de Brecher 10 et Mercuriali 51 est plus fiable que la simple estimation des pertesperopératoires, de la chute en hémoglobine ou du taux de transfusion.V.3) Quelle formule reflète le mieux le saignement ?Dans notre étude nous avons calculé le saignement périopératoire réel selon différentesformules. Ainsi le saignement a été exprimé en volume érythrocytaire perdu (VEP) selonMercuriali 51 , en VEP rapporté au volume érythrocytaire total initial et exprimé en pourcent(%VEP) et en volume sanguin total perdu (VSTP) selon Brecher 10 .La formule de Mercuriali nécessite un équilibre du volume sanguin total entre letraumatisme et le 5 ème jour postopératoire (J+5). Il semble que l’on puisse considérer que cevolume est stable comme en atteste les publication utilisant J+5 comme référence pour lecalcul du saignement périopératoire réel 10,21,26,42,48,51 . La formule de Brecher permettant dedéterminer le volume sanguin total perdu nécessite un équilibre constant du volume sanguintotal hors il semble que les mécanismes d’homéostasie du volume plasmatique soientdépassées durant l’intervention chirurgicale et les premières heures qui la suive 29,32 . Ainsi à10 minutes d’intervalle en peropératoire, il semble exister d’importantes variations du volumesanguin du patient 29 puisque les systèmes d’homéostasie sont dépassés. Afin d’évaluer demanière fiable le volume sanguin total perdu il faudrait constamment doser l’hématocrite etmesurer le volume sanguin du patient.Pour cette raison, nous considérons que le calcul du VEP selon Mercuriali 51 est plusproche de la réalité que le calcul du VSTP selon Brecher 10 puisque le calcul du VEP n’est
soumise qu’à un biais : l’équilibre du volume sanguin total du patient entre le jour dutraumatisme et le 5 ème jour postopératoire.Mais à VEP équivalent, l’impact de cette perte n’est pas comparable entre les sujets del’étude puisque leur volume sanguin total, comme leur volume érythrocytaire total initial sontvariables. En effet, le VST varie considérablement en fonction du poids, de la taille et dusexe du patient. De même l’hématocrite initiale (et donc le volume érythrocytaire total initial)varie en fonction du sexe et des comorbidités (insufisance rénale chronique, maladieinflammatoire, néoplasie…). Par exemple, dans notre série les femmes perdaient moins devolume érythrocytaire (-12,8% de VEP) mais du fait d’un poids, d’une taille et d’unehématocrite initiale moindre elle perdaient proportionnelement à leur stock en globule rougeplus de sang (+19,9% de %VEP, p
Pour ces raisons, nous pensons que la formule que nous proposons du rapport entre levolume érythrocytaire perdu et le volume érythrocytaire total initial (%VEP) est lemeilleur indicateur de l’impact du saignement sur les patients et donc de la probabilitéd’être transfusé. Et cette formule permet notamment d’identifier les individusparticulièrement sensibles au saignement du fait d’un volume sanguin total et/ou d’unhématocrite initial faible.V.4) Comparaison des résultats du saignement et du taux detransfusion à la littérature lors d’une ostéosynthèse par clou :V.4.1) Comparaison des résultats globaux du saignement à lalittérature :Le saignement périopératoire comprend la période post-traumatique, peropératoire etpostopératoire. Dans la littérature, la plupart des auteurs se contentent de relever les pertessanguines peropératoire et rapportent des valeurs faibles allant de 120 à 300ml 1,5,30,58 lorsd’une ostéosynthèse par clou Gamma.L’ostéosynthèse par clou Gamma des fractures du massif trochantérien s’accompagnaitdans notre étude d’un saignement périopératoire important avec un volume érythroytaireperdu de 541mL (± 240ml) soit 39% (±19.4%) du volume érythrocytaire initial et 2,2 litres(±1,2 litres) de volume sanguin périopératoire total perdu (cf. Tableau 11 p.45)Foss 21 dans la seule étude évaluant le saignement périopératoire réel lors d’uneostéosynthèse par clou cervico-diaphysaire (IMHS, Smith & Nephew Inc., Memphis, USA)en utilisant une formule analogue 45 à celle de Brecher a retrouvé un volume sanguin totalperdu de 1,9 litres.Le calcul du saignement périopératoire réel nous permet d’affirmer quecontrairement aux pertes peropératoires faibles habituellement rapportées dans lalittérature, le saignement périopératoire réel lors d’une ostéosynthèse par clou Gammaest en fait important.
V.5) Quelle est la part de l’acte chirurgical dans le saignementpériopératoire réel ?Si le saignement est lié à différent facteurs propres au patient et à la fracture,l’ostéosynthèse avec son contingent de lésions tissulaires joue également un rôle. Dans noteétude on constatait que la perte sanguine maximale avait lieu entre le jour opératoie et lepremier jour postopératoire avec en moyenne un volume érythrocytaire perdu de 297ml(Graphique 4). Ce tableau est toutefois soumis à des biais puisque l’ensemble des patientsn’ont pas bénéficié de bilans sanguins quotidiens. Les patients étaient transfusés en majoritéle jour de l’intervention (58 patients) (Graphique 5).Graphique 4: VEP par jour en fonction du délai par rapport à l'intervention350 300 250 200 150 100 50 0 J < 0 J 0 J+1 J+2 J+3 J+4 J+5 J+6
Graphique 5 : Evolution du nombre de patients transfusés en fonction du délai par rapport à l'intervention 70 60 Nb pa^ents transfusés 50 40 30 20 10 0 -‐1 0 1 2 3 4 5 6 7 8 >8 Délai en jours par rapport à l'interven^on Garcia et al. 23 avait déjà retrouvé un delta d’hématocrite maximal entre J+0 et J+1.Si la fracture semble liée à des pertes sanguines importantes (224ml de VEP) ; c’est durantl’intervention et les premières heures qui la suivent qu’ont lieu les pertes sanguines les plusimportantes (297ml de VEP). Le geste chirurgical joue donc un rôle majeur dans lespertes sanguines périopératoires réelles des patients présentant une fracturepertrochanterienne.Nous détaillerons maintenant les autres facteurs corrélés à une augmentation dusaignement périopératoire réel.
V.6.1) Facteur de risque de saignement : le type de fractureLe principal facteur de risque retrouvé a été le type de fracture. Cuenca 14 , a déjà démontréque le taux de transfusion est augmenté lorsque la fracture est comminutive ou soustrochantérienne(AO type A2 et A3) mais il n’existe pas d’étude corrélant le type de fractureau saignement périopératoire réel.Nous avons donc analyser le volume érythrocytaire perdu en fonction des classificationd’Evans 19 modifiée par Jensen 34 , d’Ender 17 et de l’AO 56 . L’ensemble de ces classificationsétaient corrélées de manière significative et indépendante au volume érythrocytaie perdu(VEP) et au %VEP.Ainsi, dans notre étude, les différents types de fracture entrainant une augmentationsignificative du volume érythrocytaire perdu étaient :• Pour la classification d’Evans (référence =type 1/2) :§ Type 3,§ Type 5,§ Reverse fracture.• Pour la classification d’Ender (référence = type 1/2) :§ Type 4/5,§ Type 6/7.• Pour la classification de l’AO (référence = A1)§ Groupe A2,§ Groupe A3.Nous détaillerons et interprétons donc les résultats pour chacune de ces classifications
a) Corrélation du VEP en fonction de la classification d’Evansmodifiée par Jensen :L’intérêt de cette classification dans notre étude est d’analyser le saignement enfonction des régions anatomiques du massif trochantérien touchées.Plus que le caractère comminutif de la fracture, notre étude semble démontrer quecomparativement à une fracture deux fragments les types de fracture entrainant uneaugmentation significative et indépendante du VEP étaient :• Les fractures intéressant le grand trochanter :o Type 3 : VEP=+130ml avec IC95% :3 à 257ml,o Type 5 : VEP= +174ml avec IC95% :93 à 256ml.• Une reverse fracture : VEP=+149ml avec IC95% :8 à 290ml même aprèsexclusion des fractures dont le trait <strong>desc</strong>endait plus de 3 cm sous le petittrochanter.Tableau 22: extrait de l'analyse multivariée corrélant le VEP au type de fracture selon Evans Classification Evans modifiée par Jensen Type de fracture Coef du VEP IC95% borne inf IC95% borne sup augmentation en % du VEP 1 ou 2 (ref) 0 3 0,130 0,003 0,257 +30,2% 4 0,020 -‐0,069 0,110 +4,7% 5 0,174 0,093 0,256 +40,5% Reverse 0,149 0,008 0,290 +34,7% p
3 : Branche profonde de l’artère circonflexe latérale de la cuisse (ACMC), 4 :Branches terminales de l’ACMC, 5 : Insertion du tendon du moyen fessier, 6 : Insertion du tendon du pyramidal, 7 : Rameaux pour petit trochanter, 8 : Branche trochantérienne de l’ACMC, 9 : Branche de la première perforante, 10 : Rameaux nourriciers du grand trochanter, Figure 7: Vue postéro-‐supérieure de l'ESF : artère circonflexe médiale de la cuisse (ACMC) et ses branches 1 : Artère du ligament rond, 2 : Branche profonde de l’ACMC, 3 : Branche ascendante de l’artère circonflexe latérale de la cuisse (ACLC), 4 : Branche transversal de l’ACLC, 5 : Branche <strong>desc</strong>endante de l’ACLC. Figure 8 : Vue antérieur de l'ESF : artère circonflexe latérale de la cuisse (ACLC) et ses branches
Ainsi, les fractures touchant le grand trochanter (Evans 3 et 5) lèsent de nombreux vaisseauxtel que : • Des branches de l’ACMC :§§• Des branches de l’ACLC :§§Rameaux nourriciers du grand trochanter,Branche trochantérienne.Rameaux nourriciers du grand trochanter,Branche transversale.• Une branche de l’artère glutéale supérieure pour l’insertion distale du moyenfessier. Figure 9 : Evans type 3 Figure 10: Evans type 5
Les Reverse fracture selon Evans, qui dans notre étude, passent par la face externe du massiftrochantérien de la crête trochantérienne à 3cm sous le niveau du petit trochanter, touchentquand à elles les vaisseaux suivant :• La branche trochantérienne de l’ACMC.• Des branches de l’ACLC :§ Branche transversale,§ Branche <strong>desc</strong>endante.• Une branche de la première perforante de l’artère fémorale profonde.Figure 11: Reverse fracture d’Evans b) Corrélation du VEP en fonction de la classification de Ender :Le VEP variait également en fonction de la classification d’Ender 17 .L’intérêt de cette classification dans notre étude est d’analyser le saignement enfonction du déplacement fracturaire.Ainsi nous avons observé que certains type de la classification d’Ender étaitsignificativement et indépendamment associés à une augmentation du VEP par rapport autype 1/2 (Tableau 23):§ Fractures en rotation interne avec impaction métaphysaire :Ø Type 4/5 : VEP = +130ml avec IC95% de 32 à 230ml.§ Fractures inter/sous-trochantériennes :Ø Type 6/7 : VEP = +112ml avec IC95% de 5 à 219ml.
Tableau 23 : Extrait de l'analyse multivariée corrélant le VEP au type de fracture selon Ender Classification Ender Type de fracture Coef en litres de VEP 1 ou 2 (ref) 0 IC95% borne inf IC95% borne sup augmentation en % du VEP 3 0,068 -‐0,047 0,182 +17,5% 4 ou 5 0,121 0,032 0,230 +31,1% 6 ou 7 0,112 0,005 0,219 +28,8% p 0,05 Pour les types 4 et 5 c’est l’impaction de l’os spongieux métaphysaire, richementvascularisé, qui doit être à l’origine de l’augmentation du saignement et peut-être que lors dela réduction, la distraction nécessaire augmente également le saignement. Enfin peut-être queles fractures en rotation interne sont plus comminutive ou atteignent plus souvent le grandtrochanter (cf. VEP en fonction Evans et AO). Figure 12: Type 4 et5 d'Ender
Comme dans la classification d’Evans modifiée par Jensen les fractures inter et soustrochanteriennesentrainent également une augmentation du VEP pour des raisons anatomiquede part les lésions qu’elles engendrent sur les branches de l’ACMC et de l’ACLC.Figure 13: Type 6 et 7 d'Enderc) Corrélation du VEP en fonction de la classification de l’AO :On observait également des variations de VEP en fonction de la classification de l’AO 56 .L’intérêt de cette classification dans notre étude est de pouvoir analyser le saignementen fonction de la comminution fracturaire et de pouvoir comparer les résultats à la seuleétude 14 décrivant un risque transfusionnel supérieur en fonction du type de fracture.Des groupes de fracture était significativement et indépendamment lié à une augmentationdu VEP par rapport au groupe de référence A1 :• Fractures comminutives :Ø Groupe A2 : VEP = +110ml avec un IC95% de 32ml à 187ml.• Fractures inter et sous-trochantériennes :Ø Groupe A3 : VEP = +111ml avec un IC95% de 2 à 220ml.Tableau 24 : Extrait de l'analyse multivariée corrélant le VEP au type de fracture selon l’AO Classification AO Type de fracture A1 (ref) Coef en litres de VEP 0 IC95% borne inf IC95% borne sup augmentation en % du VEP A2 0,110 0,032 0,187 +25,0% A3 0,111 0,002 0,220 +25,2% P 0,01
Donc, selon la classification de l’AO les fractures comminutives (A2) saignent plus(+25%) que les fractures deux fragments.Figure 14 : Type A2.1, A2.2 et A2.3 selon l'AO Et comme dans la classification d’Evans modifiée par Jensen et la classification d’Enderles fractures inter et sous trochantériennes saignent plus (+25%) que les fractures deuxfragments pour des raisons anatomique de part les lésions qu’elles engendrent sur les branchesde l’ACMC et de l’ACLC .Figure 15: Type A3.2 et A3.3 de l'AO
Au total après l’analyse de la corrélation entre le saignement et le type de fracture nousavons pu mettre en évidence de nouveaux facteurs de risque de saignement (VEP) tel que :• Une fracture du grand trochanter (Evans type 3 et 5) +39,1%,• Une fracture avec impaction métaphysaire (Ender type 4 et 5) +31%,• Une fracture comminutive (AO type A2) +25%,• Une fracture inter et sous-trochantériennes +25% à +35%.Bien que Cuenca 14 est déjà retrouvé une augmentation du risque transfusionnel pour lesfractures comminutives et sous-tochantériennes (AO type A2 et A3), nous sommes lespremiers analyser le type de fracture en fonction du saignement périopératoire réel et nosrésultats sont donc scientifiquement plus valable.Bien que nous ayons exclus les fractures dont le trait <strong>desc</strong>endait plus de 3 cm sous laprojection du petit trochanter pour éviter que le saignement d’origine diaphysaire n’interfèreavec l’analyse du saignement des fractures du massif trochantérien nos résultats sontprobablement extrapolable à l’ensemble des fractures sous-trochantérienne qui entraineraientdonc une augmentation du saignement périopératoire par rapport aux fracturespertrochantériennes deux fragments.D’autres facteurs déjà connu ont été identifié dans notre étude comme étant des facteurs derisque de transfusion. Nous les détaillerons dans les paragraphes suivants.V.6.2) Facteur de risque de saignement : le sexe fémininet corrélation du saignement périopératoire réel en fonctiondes donnés préopératoireLes caratéristiques préopératoires tel que l’âge, l’indice de masse corporel et lescomorbidités n’étaient pas corrélées de manière indépendante aux pertes sanguines. Seul lesexe féminin entraînait une augmentation du %VEP.Notre étude a retrouvée une diminution sensible du saignement en valeur absolue(VEP) des femmes par rapport aux hommes mais cette différence n’était passignificative après analyse multivariée (p=0.06). Par contre nous avons retrouvé uneaugmentation significative et indépendante du saignement rapporté au volume érythrocytaireinitiale total (%VEP) chez les femmes (Graphique 9 p. suivante). Cette différence entre un
VEP bas et un %VEP haut s’explique car les femmes ont un volume érythrocytaire initial totalinférieur aux hommes du fait d’un poids, d’une taille et d’un taux d’hématocrite dans lapopulation générale plus faible pour les femmes. Les femmes sont donc plus sensibles ausaignement que les hommes.Graphique 9: Comparaison du VEP et du %VEP en fonction du sexeHommes p > 0,05 0,579 0,527 Femmes p < 0,05 42,10% Saignement 31,10% VEP en litres %VEP Rapporté au volume érythrocytaire initial le pourcentage de volume érythrocytaireperdu (%VEP) est donc significativement et indépendamment plus important (+20%)chez les femmes ce qui conduit à une plus forte probabilité d’être transfusé.
V.6.3) Facteur de risque de saignement : Aspirineet corrélation du saignement péri-opératoire réel en fonctionde l’anticoagulation et antiagrégation préopératoire :La prise d’aspirine ou de clopidogrel inhibe l’agrégation plaquettaire, son rôle dans lel’augmentation du saignement périopératoire est discuté 47 . Foss et al. 21 , ont retrouvé uneaugmentation significative du volume sanguin total perdu pour les patients prenant del’aspirine en préopératoire. Dans notre étude, nous avons retrouvés une associationindépendante entre la prise d’aspirine en préopératoire et l’augmentation du volumeérythrocytaire perdu (VEP = +149ml avec un IC95% de 71 à 226ml). Mais la prise dePlavix n’entrainait pas d’augmentation du VEP. Ceci peut-être expliqué par l’absence defenêtre thérapeutique entre le traumatisme et la chirurgie chez les patients sous Aspegicdans notre étude (délai opératoire moyen = 26 heures) alors que les patient sous Plavixbénéficiaient d’une fenêtre thérapeutique (délai opératoire moyen = 47 heures)(p
Deux études 21,68 ont mise en évidence une augmentation du volume sanguin total perdusignificative et indépendante des patients ayant présenté une hypotension peropératoire.Avec un VEP augmenté de 103ml (+20%) après analyse multivariée notre étude semblecorroborer cette hypothèse.Pourtant on aurait pu attendre une diminution des pertes sanguines comme le laisse penserla technique de l‘hypotension peropératoire contrôlée qui est sensé réduire le saignementperopératoire dans l’arthroplastie de hanche 71 . L’une des explications pourrait-être que c’estun saignement majoré qui serait à l’origine de cette hypotension peropératoire. L’autreexplication pourrait-être que l’hypotension augmenterait le saignement par un mécanisme devasoplégie, une modification de la rhéologie ou des mécanismes d’hémostase.La rachi-anesthésie est souvent décrite comme réduisant le recourt à la transfusionpostopératoire 33,63 . L’analyse univariée (Tableau 16 p.52) retrouve une diminution significativedu VEP mais cette diminution n’est pas indépendante compte tenu des résultats de l’analysemultivariée (Tableau 19 p.54).Dans notre étude, la réalisation d’une anesthésie générale était significativement associée àun risque accru d’hypotension peropératoire. Et ce serait donc par une réduction du risqued’hypotension que la rachianesthésie diminuerait le risque hémorragique.Graphique 10 : Analyse croisée de la fréquence d'hypotension peropératoire en fonction du type d'anesthésie65% 76% % pa{ents 35% 24% Anesthésie générale Rachi-‐anesthésie PAS < 90mmHg: NON PAS < 90mmHg: OUI Chi2: p < 0.0001
V.6.5) Facteur de risque de saignement : anticoagulationpostopératoire préventive inadaptée à la fonction rénaleL’insuffisance rénale chronique est associée à un risque hémorragique accru eninduisant des modifications de l’hémostase primaire. De nombreuses anomalies dumétabolisme des plaquettes ainsi que des cellules endothéliales ont été décrites. Avec lesmodifications rhéologiques provoquées par l’anémie, elles conduisent à une diminution del’adhésion et de l’agrégation plaquettaire 61,73 . D’autre part les patients insuffisants rénauxsévères ont un taux d’hématocrite plus bas que la moyenne de la population générale et sontdonc plus sensible au saignement.Nous n’avons pas retrouvé de corrélation entre l’insuffisance rénale et le saignementexprimé en valeur absolu (VEP). Par contre le pourcentage de VEP rapporté au volumeérythrocytaire total initial (%VEP) variait en fonction de la fonction rénale. Ceci peuts’expliquer par un taux d’hématocrite basal et un poids plus faible que la moyenne desindividus. Ainsi, les patients présentant une insuffisance rénale sévère et dontl’anticoagulation postopératoire préventive était adapté à leur fonction rénale avaient uneaugmentation de 12% de leur %VEP mais ce résultat n’était pas significatif. Par contre, lespatients présentant une insuffisance rénale sévère mais dont l’anticoagulationpostopératoire préventive n’était pas adapté à leur fonction rénale avaient uneaugmentation significativement et indépendamment de 26% de leur %VEP.Dans notre série, 50% des patients insuffisants rénaux sévères étaient surdosés enanticoagulant. Hors ces patients sont naturellement plus sensibles à un saignement que lamoyenne puisque leur volume sanguin est plus faible. Il convient donc de calculer la formulede Cockcroft pour tous les patients avant de leur administrer une anti-coagulationpostopératoire préventive et afin d’évaluer la susceptibilité au saignement de ceux-ci.Après avoir analyser le saignement et les facteurs l’influençant nous allons maintenantanalyser l’impact de ce saignement chez ces patients pour la plupart âgés et fragiles.V.7) Conséquences du saignement :Dans notre série ces fractures sont survenues chez des personnes âgés (85 ans d’âgemoyen) et présentant de nombreuses comorbidités. Ainsi 65% des patients présentaient unepathologie cardio-vasculaire. Outre les complications infectieuses et immunes liés auxtransfusion 70 ces patients sont sensibles à l’anémie et aux modifications de la volémie.
Dans la littérature 14,18,21,35,43,77 , une augmentation des pertes sanguines ou du nombre deconcentrés globulaires transfusés semble corrélée à :• Une augmentation de la mortalité entre 0 et 3 mois,• Une augmentation des infections,• Une augmentation des thromboses veineuses profondes,• Une augmentation des décompensations rénales et cardiaques,• Une augmentation de la durée d’hospitalisation,• Une diminution des résultats fonctionnels précoces.Dans notre série les pertes sanguines ont entrainées un taux de transfusion de 63,3%. Cetaux de transfusion important se trouve dans la moyenne des données retrouvées dans lalittérature (36 à 80%) 14,16,21,25,31 . Comparativement à une arthroplastie totale de hanche cetaux de transfusion est deux à trois fois supérieur 42 . De plus même en l’absence de facteur derisque de saignement les pertes sont de 436ml de volume érythrocytaire perdu et 1,6L devolume sanguin total perdu.Compte tenu du risque hémorragique qu’encourt le patient des mesures de prévention despertes sanguines sont donc à mettre en place. Leur détail figure dans le prochain chapitre.V.8) Prévention du risque hémorragique :En premier lieu il convient de bien identifié ce risque hémorragique et de ne pas le sousestimer.Dès son arrivé aux urgences le patient doit donc bénéficier d’une évaluation précisede son état préopératoire et des facteurs de risque de saignement présenté. Un interrogatoire,une radiographie et un bilan biologique complet sont donc nécessaires.Certains facteurs de risque sont non-modifiables comme le sexe et le type de fracture. Ilconvient tout de même de bien identifier le type de fracture pour analyser le risque desaignement d’autant que les fractures touchant le grand trochanter qui sont plushémorragiques sont sous-évaluées à la radiographie standard selon une étude récente 44 .D’autres facteurs de risque peuvent faire l’objet d’une attention particulière etd’investigations complémentaires :• Bien que la prise d’aspirine soit liée à une augmentation du saignement 21 , durecours aux transfusions et d’une mortalité accru de 5 fois le premier mois suivantl’intervention 39 il n’est pas certain qu’une fenêtre thérapeutique soit bénéfique
compte tenu de l’augmentation des complications de décubitus liée àl’augmentation du délai opératoire 72 et de l’augmentation du risquecardiovasculaire liée à l’arrêt du traitement 11 .• L’hypotension peropératoire doit être prévenu même si on ne sait pas si c’est ellequi entraine une augmentation du saignement ou l’inverse. Si la rachi-anesthésien’est pas indépendamment liée à un risque accru de saignement, le lien significatifqui existe entre l’absence de d’hypotension peropératoire et la rachi-anesthésielaisse à penser que la rachi-anesthésie prévient le saignement en diminuant le risqued’hypotension peropératoire.• L’anticoagulation postopératoire préventive doit être adaptée à la fonctionrénale et le calcul de la clairance de la créatine devrait être systématique d’autantque, souvent chez ces patients âgés et léger, la valeur absolue de la créatinine peutêtrenormale alors que le calcul de la clairance retrouve une insuffisance rénalesévère.En postopératoire une surveillance étroite de la numération sanguine est nécessaire aumoins jusqu’au 5 ème jour suivant l’intervention compte tenu de la durée du saignementpostopératoire.Des traitements visant à réduire le saignement ou ses conséquences sont égalementenvisageables tels que :• Le traitement par acide tranexamique en peropératoire a prouvé son efficacitémais pas son innocuité dans la réduction du recours à la transfusion sanguine chezles patients bénéficiant d’une chirurgie pour fracture de hanche 81 .• L’érythropoietine (EPO) semble réduire le risque de recours à la transfusion dansles fractures de l’extremité supérieure du fémur 23 mais son délai d’action n’offreun réel bénéfice que quelques semaines après sa prise et reste à évaluer. Outre ces considérations médicales, compte tenu du saignement périopératoire importantqui accompagne la chirurgie par clou Gamma il est licite de se demander si le choix du typed’ostéosynthèse n’influe pas sur le saignement d’autant plus que nos résultats semblentmontrer que le pic de saignement à lieu durant l’intervention et les heures qui la suivent.Nous tenterons donc de déterminer si le choix du type d’ostéosynthèse a une influence surle saignement.
V.9) L’ostéosynthèse par vis-plaque diminue t’elle lesaignement ?L’ostéosynthèse est progressivement devenue le traitement de référence des fracturestrochantériennes dans les années 1950. Deux types d’implants sont actuellement utilisés : lesvis-plaques à appui cortical externe et les clous centro-médullaire cervico-trochantériens dontle chef de file est le clou Gamma. Les indications et les résultats de ces deux typesd’ostéosynthèse sont actuellement discutées 60 compte tenu de la fragilité des patients atteintsd’une fracture trochantérienne, le saignement doit faire parti des critères de choix entre cesdeux techniques.Le clou Gamma participe au saignement per et postopératoire des fracturespertrochantérienne pour des raisons anatomiques:• Triple abord,• Traversée du moyen fessier,• Lésion potentielle de l’artère glutéale supérieure,• Lésion de l’insertion trochantérienne du moyen fessier 49 ,• Lésions potentielles des branches de l’artère circonflexe médiale et latérale de lacuisse au niveau de la fossette digitale 52 ,• Trépanation du grand trochanter,• Alésage,• Distraction des fragments osseux fracturés,• Lésion potentielle de la branche transversale de l’ACLC et de la branchetrochantérienne de l’ACMC lors du méchage de la vis cervico-céphalique,• Lésions potentielle des artères perforantes terminales lors du méchage de la vis deverrouillage distale.Une étude réalisée dans notre service par Molinier 53 a retrouvé unedistance moyenne entre la crête trochantérienne et la première perforante de 8,8cm cequi correspond au niveau de projection de la vis de verrouillage distal du clouGamma3®.
Comparativement, les vis-plaques peuvent induire un saignement per etpostopératoire du fait :• Abord cutané élargi,• Lésions musculaires du vaste externe,• Lésion potentielle de la branche transversale de l’ACLC et de la branchetrochantérienne de l’ACMC lors du méchage de la vis cervico-céphalique,• Lésions des artères perforantes terminales si la plaque fait plus de 8cm 53 .En comparaison au clou Gamma, les vis-plaques dynamique (DHS) ont l’avantage de nepas aborder le foyer de fracture et de ne pas léser le moyen fessier et le grand trochanter maisau prix d’un abord en regard du muscle vaste externe. Dans la dernière méta-analyse deParker 60il n’existe pas de différence significative en terme de transfusion et de pertessanguines peropératoire entre le clou gamma et la DHS mais aucune des études reprisent danscette méta-analyse ne comparent le saignement périopératoire réel.Foss 21 , quand à lui, a retrouvé une augmentation de 26% du volume sanguin total perdu(p
La mise en place minimale invasive de la plaque PCCP (Orthofix, Lewisville, TX, USA)s’accompagne de taux de transfusions compris entre 14 et 40% 6,12,25,62,76 . Ces taux detransfusions faibles sont significativement inférieurs aux vis-plaques standards 41 . Et pourGiancola 25 le taux de transfusion entre le clou Gamma et la plaque PCCP est 50% plusfaible pour la PCCP (p
Figure 17: La vis-‐plaque Traumax Tableau 26: Analyse comparative du VEP et des transfusions entre le clou Gamma et la Traumax Traumax(n=168)Gamma3(n=163*)RRpVolumeérythrocytaireperdu (ml)347 ± 272 577 ± 284 1,6
• L’absence de lésion des branches perforantes de l’artère fémorale profondepour la vis-plaque Traumax.Toutefois les vis-plaques standard et minimale invasive ont l’inconvénient d’abimer lemuscle vaste externe, mais il semble exister une diminution des hématomes postopératoirepour les vis-plaques mini-invasives versus la plaque DHS 9 .Les vis-plaques minimales invasives semblent réduire significativement le saignementpériopératoire réel et le recours aux transfusions par rapport au clou Gamma.Au terme de cette étude on peut identifier des patients à haut risque de saignement et detransfusion. Il s’agit des femmes prenant de l’aspirine en préopératoire et présentant unefracture à risque de saignement (Evans 3/5, Ender 4/5, AO A.2 ou fracture inter/soustrochantérienne).Chez ces patients il convient d’être particulièrement attentif au maintientd’une volémie et d’un taux d’hématocrite optimale par la surveillance étroite de la numérationsanguine, la réalisation d’une rachi-anesthésie, la prévention des hypotensions peropératoireset l’adaptation de l’anticoagulation postopératoire préventive à la clairance de la créatinine.Enfin, en dehors des fractures sous-trochantériennes ou très instables, ces patients àhaut risque de saignement devraient pouvoir bénéficier d’une ostéosynthèse par visplaqueminimale invasive.
Conclusion
VII. Conclusion :Dans la littérature, le saignement des fractures du massif trochantérien n’est pas évalué demanière précise. Il semble que le volume érythrocytaire perdu (VEP), selon Mercuriali, est laformule la plus fiable pour l’évaluation du saignement périopératoire réel. La formule quenous proposons permettant d’évaluer le pourcentage de volume érythrocytaire perdu rapportéau volume érythrocytaire initial (%VEP) est la formule la mieux corrélée au volume sanguintransfusé et permet donc de déterminer au mieux l’impact du saignement sur un patient.Bien que l’ostéosynthèse percutannée des fractures trochantériennes par clou Gammaparaisse minimale-invasive, le calcul du saignement périopératoire réel retrouve des valeursimportantes avec un volume sanguin total perdu de 2,2 litres et un volume érythrocytaireperdu de 541ml entre le traumatisme et J5. Ce saignement conduit à un taux de transfusionsde 63%.Après analyse multivariée, des facteurs de risque connus sont significativements etindépendamments corrélés à une augmentation du VEP et/ou du %VEP tel que : la prised’aspirine en préopératoire (+31% de VEP), une anticoagulation préventive inadapté à lafonction rénale (+26.5% de %VEP), le sexe féminin (+20% de %VEP) et une hypotensionperopératoire (+20% de VEP).Nous avons mis en évidence des facteurs de risque liés au type de fracture tel que : unefracture touchant le grand trochanter (+39,1% de VEP), une fracture en rotation interne avecimpaction métaphysaire (+31% de VEP), une fracture comminutive (+25% de VEP) et unefracture inter ou sous-trochantérienne (+25% à +35% de VEP).Même en l’absence de ces facteurs de risque le saignement était important et il semble quela majeure partie de ce saignement a lieu au moment de l’intervention et dans les heures qui lasuivent. Le type d’ostéosynthèse joue donc un rôle central dans le saignement périopératoire.Les vis-plaques minimales invasives réduisent le volume érythrocytaire perdu et le taux detransfusion en comparaison au clou Gamma.
Compte tenu des risques hémorragiques encourus chez ces patients aux nombreusescomorbidités, il convient d’utiliser une vis-plaque minimale invasive pour l’ostéosynthèse desfractures pertrochantériennes si le type de fracture le permet. Le clou Gamma devrait doncêtre réservé aux fractures sous-trochantériennes ou très instables.
Table des Figures Figure 1: Classification d'Evans modifiée par Jensen ............................................................................ 29 Figure 3: Classification d'Ender ............................................................................................................. 30 Figure 4: Classification de l'AO .............................................................................................................. 31 Figure 5: Clou Gamma3 ...................................................................................................................... 33 Figure 6: Répartition des patients en fonction du sexe ........................................................................ 37 Figure 8: Répartition des patients en fonction de l'IMC ....................................................................... 37 Figure 16: vue postéro-‐supérieure de l'ESF : artère circonflexe médiale de la cuisse (ACMC) et ses branches ................................................................................................................................................ 69 Figure 17 : Vue antérieur de l'ESF : artère circonflexe latérale de la cuisse (ACLC) et ses branches .... 69 Figure 18 : Evans type 3 ........................................................................................................................ 70 Figure 19: Evans type 5 ......................................................................................................................... 70 Figure 20: Reverse fracture d’Evans ...................................................................................................... 71 Figure 21: Type 4 et5 d'Ender ............................................................................................................... 72 Figure 22: Type 6 et 7 d'Ender .............................................................................................................. 73 Figure 23 : Type A2.1, A2.2 et A2.3 selon l'AO ...................................................................................... 74 Figure 24: Type A3.2 et A3.3 de l'AO .................................................................................................... 74 Figure 25: La vis-‐plaque PCCP ............................................................................................................ 84 Figure 26: La vis-‐plaque Traumax ....................................................................................................... 85 Table des Tableaux Tableau 1: Caractéristiques des patients (âge, poids, taille) ................................................................. 36 Tableau 2: Etat préopératoire des patients (ATCD, comorbidités) ....................................................... 38 Tableau 3: Traitements préopératoire interférant avec l'hémostase ................................................... 39 Tableau 4: Analyse du délai opératoire en fonction du type d’antiagrégant plaquettaire ................... 39 Tableau 5: Répartition des patients en fonction du type de fracture ................................................... 40 Tableau 6: Paramètres biologiques des patients .................................................................................. 41 Tableau 7: Volumes sanguins mesurés ................................................................................................. 42 Tableau 8: Variables peropératoires quantitatives ............................................................................... 42 Tableau 9: Variables peropératoires qualitatives ............................................................................... 42 Tableau 10: Anticoagulation postopératoire préventive adapté ou non à la fonction rénale .............. 43 Tableau 11: Saignement périopératoire réel : résultats globaux .......................................................... 45 Tableau 12: Taux de transfusion des patients traités par clou Gamma ................................................ 46 Tableau 13: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction des données préopératoires qualitatives .................................................................................................... 50 Tableau 14: Analyse univariée du saignement périopératoire réel en fonction des données préopératoires quantitatives ................................................................................................................ 50 Tableau 15 : Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction du type de fracture ................................................................................................................................................. 51 Tableau 16: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction des données opératoires qualitatives ......................................................................................................... 52 Tableau 17: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction des données opératoires quantitatives ....................................................................................................... 53
Tableau 18: Analyse univariée du saignement périopératoire réel (VEP, %VEP) en fonction de l’anticoagulation postopératoire .......................................................................................................... 53 Tableau 19: Analyse multivariée des facteurs de risque de saignement périopératoire réel (VEP, %VEP) .................................................................................................................................................... 54 Tableau 20: Analyse du saignement pour les séries sans facteur de risque d'augmentation du VEP ou du %VEP ................................................................................................................................................ 56 Tableau 21: Bibliographie récente du taux de transfusions des fractures trochantériennes ostéosynthésées par clou ...................................................................................................................... 63 Tableau 22: extrait de l'analyse multivariée corrélant le VEP au type de fracture selon Evans ........... 68 Tableau 23 : Extrait de l'analyse multivariée corrélant le VEP au type de fracture selon Ender ......... 72 Tableau 24 : Extrait de l'analyse multivariée corrélant le VEP au type de fracture selon l’AO ............ 73 Tableau 25: Revue de la littérature des transfusions et du saignement périopératoire réel des vis-plaques mini-‐invasive ............................................................................................................................ 83 Tableau 26: Analyse comparative du VEP et des transfusions entre le clou Gamma et la Traumax .... 85 Table des Graphiques Graphique 1 : : Phases de la perte sanguine à partir de la chirurgie (Brecher, 1997) 9 ......................... 22 Graphique 2: Répartition des patients en fonction de l'âge au moment du traumatisme ................... 37 Graphique 3: Comparaison de la valeur moyenne d'hématocrite préopératoire chez les patients insuffisants rénaux sévère en fonction de l'anticoagulation post-‐opératoire ...................................... 44 Graphique 4: VEP par jour en fonction du délai par rapport à l'intervention ....................................... 46 Graphique 5 : Evolution du nombre de patient transfusé en fonction du délai par rapport à l'intervention ......................................................................................................................................... 47 Graphique 6: Corrélation entre le VEP, selon Mercuriali, et le volume sanguin transfusé ................... 48 Graphique 7: Corrélation entre le %VEP et le volume transfusé .......................................................... 48 Graphique 8: Corrélation entre le VSTP selon Brecher et le volume transfusé .................................... 48 Graphique 9: Comparaison du VEP et du %VEP en fonction du sexe ................................................... 76 Graphique 10 : Analyse croisée de la fréquence d'hypotension peropératoire en fonction du type d'anesthésie .......................................................................................................................................... 78
BIBLIOGRAPHIE 1. Adams, C. I.; Robinson, C. M.; Court-‐Brown, C. M.; and McQueen, M. M.: Prospective randomized controlled trial of an intramedullary nail versus dynamic screw and plate for intertrochanteric fractures of the femur. J Orthop Trauma, 15(6): 394-‐400, 2001. 2. Adunsky, A.; Lichtenstein, A.; Mizrahi, E.; Arad, M.; and Heim, M.: Blood transfusion requirements in elderly hip fracture patients. Arch Gerontol Geriatr, 36(1): 75-‐81, 2003. 3. Allen, T. H.; Peng, M. T.; Chen, K. P.; Huang, T. F.; Chang, C.; and Fang, H. S.: Prediction of blood volume and adiposity in man from body weight and cube of height. Metabolism, 5(3): 328-‐45, 1956. 4. American-‐Society-‐of-‐Anesthesiologists: New classification of physical status. Anesthesiology, (24): 111, 1963. 5. Baumgaertner, M. R.; Curtin, S. L.; and Lindskog, D. M.: Intramedullary versus extramedullary fixation for the treatment of intertrochanteric hip fractures. Clin Orthop Relat Res, (348): 87-‐94, 1998. 6. Bensafi, H.; Laffosse, J. M.; Giordano, G.; Dao, C.; Chiron, P.; and Puget, J.: The percutaneous compression plate (PCCP) in the treatment of trochanteric hip fractures in elderly patients. Acta Orthop Belg, 72(3): 314-‐9, 2006. 7. Bojan, A. J.; Beimel, C.; Speitling, A.; Taglang, G.; Ekholm, C.; and Jonsson, A.: 3066 consecutive Gamma Nails. 12 years experience at a single centre. BMC Musculoskelet Disord, 11: 133, 2010. 8. Bourke, D. L., and Smith, T. C.: Estimating allowable hemodilution. Anesthesiology, 41(6): 609-‐12, 1974. 9. Brandt, S. E.; Lefever, S.; Janzing, H. M.; Broos, P. L.; Pilot, P.; and Houben, B. J.: Percutaneous compression plating (PCCP) versus the dynamic hip screw for pertrochanteric hip fractures: preliminary results. Injury, 33(5): 413-‐8, 2002. 10. Brecher, M. E.; Monk, T.; and Goodnough, L. T.: A standardized method for calculating blood loss. Transfusion, 37(10): 1070-‐4, 1997. 11. Burger, W.; Chemnitius, J. M.; Kneissl, G. D.; and Rucker, G.: Low-‐dose aspirin for secondary cardiovascular prevention -‐ cardiovascular risks after its perioperative withdrawal versus bleeding risks with its continuation -‐ review and meta-‐analysis. J Intern Med, 257(5): 399-‐414, 2005. 12. Carvajal Pedrosa, C., and Hernández Cortés, P.: Pertrochanteric hip fracture osteosynthesis with percutaneous compression plate. Rev esp cir ortop traumatol, 55(1): 19-‐25, 2011. 13. Charrois, O.; Kahwaji, A.; Vastel, L.; Rosencher, N.; and Courpied, J. P.: Blood loss in total hip arthroplasty for rapidly destructive coxarthrosis. Int Orthop, 25(1): 22-‐4, 2001. 14. Cuenca, J.; Garcia Erce, J. A.; Martinez, A. A.; Solano, V. M.; and Herrera, A.: [Preoperative blood test results and type of fracture as transfusional risk factors in patients older than 65 years with trochanteric hip fracture]. Rev Esp Anestesiol Reanim, 51(9): 515-‐22, 2004. 15. Dillon, M. F.; Collins, D.; Rice, J.; Murphy, P. G.; Nicholson, P.; and Mac Elwaine, J.: Preoperative characteristics identify patients with hip fractures at risk of transfusion. Clin Orthop Relat Res, 439: 201-‐6, 2005. 16. Efstathopoulos, N. E.; Nikolaou, V. S.; and Lazarettos, J. T.: Intramedullary fixation of intertrochanteric hip fractures: a comparison of two implant designs. Int Orthop, 31(1): 71-‐6, 2007. 17. Ender, H. G.: Treatment of per-‐ and sub-‐trochanteric fractures with Ender's flexible intramedullary pins. Amer. Orthomed Corp. New York, 1976. 18. Engoren, M.; Mitchell, E.; Perring, P.; and Sferra, J.: The effect of erythrocyte blood transfusions on survival after surgery for hip fracture. J Trauma, 65(6): 1411-‐5, 2008. 19. Evans, E. M.: The treatment of trochanteric fractures of the femur. J Bone Joint Surg Br, 31B(2): 190-‐203, 1949.
20. Fisher, A. A.; Srikusalanukul, W.; Davis, M. W.; and Smith, P. N.: Clinical profiles and risk factors for outcomes in older patients with cervical and trochanteric hip fracture: similarities and differences. J Trauma Manag Outcomes, 6(1): 2, 2012. 21. Foss, N. B., and Kehlet, H.: Hidden blood loss after surgery for hip fracture. J Bone Joint Surg Br, 88(8): 1053-‐9, 2006. 22. Garcia-‐Alvarez, F.; Al-‐Ghanem, R.; Garcia-‐Alvarez, I.; Lopez-‐Baisson, A.; and Bernal, M.: Risk factors for postoperative infections in patients with hip fracture treated by means of Thompson arthroplasty. Arch Gerontol Geriatr, 50(1): 51-‐5, 2010. 23. Garcia-‐Erce, J. A.; Cuenca, J.; Haman-‐Alcober, S.; Martinez, A. A.; Herrera, A.; and Munoz, M.: Efficacy of preoperative recombinant human erythropoietin administration for reducing transfusion requirements in patients undergoing surgery for hip fracture repair. An observational cohort study. Vox Sang, 97(3): 260-‐7, 2009. 24. Gautier, E.; Ganz, K.; Krugel, N.; Gill, T.; and Ganz, R.: Anatomy of the medial femoral circumflex artery and its surgical implications. J Bone Joint Surg Br, 82(5): 679-‐83, 2000. 25. Giancola, R.; Antonini, G.; Delle Rose, G.; and Crippa, C.: Percutaneous compression plating versus gamma nail for the treatment of pertrochanteric hip fractures. Strategies Trauma Limb Reconstr, 3(1): 9-‐14, 2008. 26. Good, L.; Peterson, E.; and Lisander, B.: Tranexamic acid decreases external blood loss but not hidden blood loss in total knee replacement. Br J Anaesth, 90(5): 596-‐9, 2003. 27. Goodnough, L. T.; Bravo, J. R.; Hsueh, Y. S.; Keating, L. J.; and Brittenham, G. M.: Red blood cell mass in autologous and homologous blood units. Implications for risk/benefit assessment of autologous blood crossover and directed blood transfusion. Transfusion, 29(9): 821-‐2, 1989. 28. Gross, J. B.: Estimating allowable blood loss: corrected for dilution. Anesthesiology, 58(3): 277-‐80, 1983. 29. Hahn, R. G.: A haemoglobin dilution method (HDM) for estimation of blood volume variations during transurethral prostatic surgery. Acta Anaesthesiol Scand, 31(7): 572-‐8, 1987. 30. Hardy, D. C.; Descamps, P. Y.; Krallis, P.; Fabeck, L.; Smets, P.; Bertens, C. L.; and Delince, P. E.: Use of an intramedullary hip-‐screw compared with a compression hip-‐screw with a plate for intertrochanteric femoral fractures. A prospective, randomized study of one hundred patients. J Bone Joint Surg Am, 80(5): 618-‐30, 1998. 31. Harrington, P.; Nihal, A.; Singhania, A. K.; and Howell, F. R.: Intramedullary hip screw versus sliding hip screw for unstable intertrochanteric femoral fractures in the elderly. Injury, 33(1): 23-‐8, 2002. 32. Holte, K.; Sharrock, N. E.; and Kehlet, H.: Pathophysiology and clinical implications of perioperative fluid excess. Br J Anaesth, 89(4): 622-‐32, 2002. 33. Hu, S.; Zhang, Z. Y.; Hua, Y. Q.; Li, J.; and Cai, Z. D.: A comparison of regional and general anaesthesia for total replacement of the hip or knee: a meta-‐analysis. J Bone Joint Surg Br, 91(7): 935-‐42, 2009. 34. Jensen, J. S.: Classification of trochanteric fractures. Acta Orthop Scand, 51(5): 803-‐10, 1980. 35. Johnston, P.; Wynn-‐Jones, H.; Chakravarty, D.; Boyle, A.; and Parker, M. J.: Is perioperative blood transfusion a risk factor for mortality or infection after hip fracture? J Orthop Trauma, 20(10): 675-‐9, 2006. 36. Kateros, K.; Sakellariou, V. I.; Sofianos, I. P.; and Papagelopoulos, P. J.: Epoetin alfa reduces blood transfusion requirements in patients with intertrochanteric fracture. J Crit Care, 25(2): 348-‐53, 2009. 37. Kempf, I.; Grosse, A.; Taglang, G.; and Favreul, E.: [Gamma nail in the treatment of closed trochanteric fractures. Results and indications apropos of 121 cases]. Rev Chir Orthop Reparatrice Appar Mot, 79(1): 29-‐40, 1993.
38. Kempf, I.; Jaeger, J. H.; North, J.; Grosse, A.; Paty, J.; Boyoud, A.; and Schmidt, R.: [Centro-medullary nailing of the femur and the tibia using Kuntscher's technic. Value of locking the nail]. Acta Orthop Belg, 42 Suppl 1: 29-‐43, 1976. 39. Kragh, A. M.; Walden, M.; Apelqvist, A.; Wagner, P.; and Atroshi, I.: Bleeding and first-‐year mortality following hip fracture surgery and preoperative use of low-‐dose acetylsalicylic acid: an observational cohort study. BMC Musculoskelet Disord, 12: 254, 2011. 40. Kurdy, N. M., and Hokan, R.: A cross-‐matching policy for fractures of the proximal third of the femur. Injury, 24(8): 521-‐4, 1993. 41. Kuzyk, P. R.; Guy, P.; Kreder, H. J.; Zdero, R.; McKee, M. D.; and Schemitsch, E. H.: Minimally invasive hip fracture surgery: are outcomes better? J Orthop Trauma, 23(6): 447-‐53, 2009. 42. Laffosse, J. M.; Accadbled, F.; Molinier, F.; Chiron, P.; Hocine, B.; and Puget, J.: Anterolateral mini-‐invasive versus posterior mini-‐invasive approach for primary total hip replacement. Comparison of exposure and implant positioning. Arch Orthop Trauma Surg, 128(4): 363-‐9, 2008. 43. Lawrence, V. A.; Silverstein, J. H.; Cornell, J. E.; Pederson, T.; Noveck, H.; and Carson, J. L.: Higher Hb level is associated with better early functional recovery after hip fracture repair. Transfusion, 43(12): 1717-‐22, 2003. 44. Lecoq, M.; Cavaignac, E.; and Bonnevialle, P.: Mémoire DESC: Apport du scanner dans les fractures du massif trochantérien. Validation des classifications d’Evans et AO. 2011. 45. Lisander, B.; Ivarsson, I.; and Jacobsson, S. A.: Intraoperative autotransfusion is associated with modest reduction of allogeneic transfusion in prosthetic hip surgery. Acta Anaesthesiol Scand, 42(6): 707-‐12, 1998. 46. Lyons, A. R.: Clinical outcomes and treatment of hip fractures. Am J Med, 103(2A): 51S-‐63S; discussion 63S-‐64S, 1997. 47. Manning, B. J.; O'Brien, N.; Aravindan, S.; Cahill, R. A.; McGreal, G.; and Redmond, H. P.: The effect of aspirin on blood loss and transfusion requirements in patients with femoral neck fractures. Injury, 35(2): 121-‐4, 2004. 48. Martinez, V.; Belbachir, A.; Jaber, A.; Cherif, K.; Jamal, A.; Ozier, Y.; Sessler, D. I.; Chauvin, M.; and Fletcher, D.: The influence of timing of administration on the analgesic efficacy of parecoxib in orthopedic surgery. Anesth Analg, 104(6): 1521-‐7, table of contents, 2007. 49. McConnell, T.; Tornetta, P., 3rd; Benson, E.; and Manuel, J.: Gluteus medius tendon injury during reaming for gamma nail insertion. Clin Orthop Relat Res, (407): 199-‐202, 2003. 50. McSwiney, M. M.; O'Farrell, D.; Joshi, G. P.; and McCarroll, S. M.: Blood transfusion in total hip arthroplasty: guidelines to eliminate overtransfusion. Can J Anaesth, 40(3): 222-‐6, 1993. 51. Mercuriali, F., and Inghilleri, G.: Proposal of an algorithm to help the choice of the best transfusion strategy. Curr Med Res Opin, 13(8): 465-‐78, 1996. 52. Mileski, R. A.; Garvin, K. L.; and Crosby, L. A.: Avascular necrosis of the femoral head in an adolescent following intramedullary nailing of the femur. A case report. J Bone Joint Surg Am, 76(11): 1706-‐8, 1994. 53. Molinier, F.: memoire <strong>desc</strong>: Etude anatomique des branches perforantes terminales de l'artère fémorale profonde. Edited, 2011. 54. Moore, F. D.: Metabolic care of the surgical patient. Edited, Philadelphia, WB Saunders, 1959. 55. Morrison, R. S.; Chassin, M. R.; and Siu, A. L.: The medical consultant's role in caring for patients with hip fracture. Ann Intern Med, 128(12 Pt 1): 1010-‐20, 1998. 56. Muller, M. E., and Nazarian, S.: [Classification of fractures of the femur and its use in the A.O. index (author's transl)]. Rev Chir Orthop Reparatrice Appar Mot, 67(3): 297-‐309, 1981. 57. Nadler, S. B.; Hidalgo, J. H.; and Bloch, T.: Prediction of blood volume in normal human adults. Surgery, 51(2): 224-‐32, 1962. 58. O'Brien, P. J.; Meek, R. N.; Blachut, P. A.; Broekhuyse, H. M.; and Sabharwal, S.: Fixation of intertrochanteric hip fractures: gamma nail versus dynamic hip screw. A randomized, prospective study. Can J Surg, 38(6): 516-‐20, 1995.
59. Parker, M., and Johansen, A.: Hip fracture. BMJ, 333(7557): 27-‐30, 2006. 60. Parker, M. J., and Handoll, H. H.: Gamma and other cephalocondylic intramedullary nails versus extramedullary implants for extracapsular hip fractures in adults. Cochrane Database Syst Rev, (9): CD000093, 2010. 61. Pepion, C.; Jacob, L.; and Samama, C. M.: [Chronic renal failure and haemorrhagic syndrome]. STV, 15(8): 442-‐448, 2003. 62. Peyser, A.; Weil, Y.; Liebergall, M.; and Mosheiff, R.: Percutaneous compression plating for intertrochanteric fractures. Surgical technique, tips for surgery, and results. Oper Orthop Traumatol, 17(2): 158-‐77, 2005. 63. Rashiq, S., and Finegan, B. A.: The effect of spinal anesthesia on blood transfusion rate in total joint arthroplasty. Can J Surg, 49(6): 391-‐6, 2006. 64. Reina, N.: Thèse: La vis plaque dynamique Traumax: Etude prospective multicentrique de 168 fractures pertrochantériennes. 2012 TOU3 1515, 2012. 65. Rosencher, N.; Kerkkamp, H. E.; Macheras, G.; Munuera, L. M.; Menichella, G.; Barton, D. M.; Cremers, S.; and Abraham, I. L.: Orthopedic Surgery Transfusion Hemoglobin European Overview (OSTHEO) study: blood management in elective knee and hip arthroplasty in Europe. Transfusion, 43(4): 459-‐69, 2003. 66. Saikawa, I.; Hotokebuchi, T.; Arita, C.; Inaba, S.; Shuto, T.; Tsutsui, H.; and Sugioka, Y.: Autologous blood transfusion with recombinant erythropoietin treatment. 22 arthroplasties for rheumatoid arthritis. Acta Orthop Scand, 65(1): 15-‐9, 1994. 67. Saudan, M.; Lubbeke, A.; Sadowski, C.; Riand, N.; Stern, R.; and Hoffmeyer, P.: Pertrochanteric fractures: is there an advantage to an intramedullary nail?: a randomized, prospective study of 206 patients comparing the dynamic hip screw and proximal femoral nail. J Orthop Trauma, 16(6): 386-‐93, 2002. 68. Sehat, K. R.; Evans, R. L.; and Newman, J. H.: Hidden blood loss following hip and knee arthroplasty. Correct management of blood loss should take hidden loss into account. J Bone Joint Surg Br, 86(4): 561-‐5, 2004. 69. Selvakumar, K.; Saw, K. Y.; and Fathima, M.: Comparison study between reamed and unreamed nailing of closed femoral fractures. Med J Malaysia, 56 Suppl D: 24-‐8, 2001. 70. Shander, A.; Javidroozi, M.; Ozawa, S.; and Hare, G. M.: What is really dangerous: anaemia or transfusion? Br J Anaesth, 107 Suppl 1: i41-‐59, 2011. 71. Sharrock, N. E., and Salvati, E. A.: Hypotensive epidural anesthesia for total hip arthroplasty: a review. Acta Orthop Scand, 67(1): 91-‐107, 1996. 72. Shiga, T.; Wajima, Z.; and Ohe, Y.: Is operative delay associated with increased mortality of hip fracture patients? Systematic review, meta-‐analysis, and meta-‐regression. Can J Anaesth, 55(3): 146-‐54, 2008. 73. Sirois, C.; Tailloon, I.; and daleau, P.: Saignements chez les patients insuffisants rénaux recevant de l’eptifibatide lors d’intervention coronarienne percutanée. Pharmactuel, 38(5): 260-‐5, 2005. 74. Tornetta, P., 3rd, and Tiburzi, D.: The treatment of femoral shaft fractures using intramedullary interlocked nails with and without intramedullary reaming: a preliminary report. J Orthop Trauma, 11(2): 89-‐92, 1997. 75. Utrilla, A. L.; Reig, J. S.; Munoz, F. M.; and Tufanisco, C. B.: Trochanteric gamma nail and compression hip screw for trochanteric fractures: a randomized, prospective, comparative study in 210 elderly patients with a new design of the gamma nail. J Orthop Trauma, 19(4): 229-‐33, 2005. 76. Varela-‐Egocheaga, J. R.; Iglesias-‐Colao, R.; Suarez-‐Suarez, M. A.; Fernandez-‐Villan, M.; Gonzalez-‐Sastre, V.; and Murcia-‐Mazon, A.: Minimally invasive osteosynthesis in stable trochanteric fractures: a comparative study between Gotfried percutaneous compression plate and Gamma 3 intramedullary nail. Arch Orthop Trauma Surg, 129(10): 1401-‐7, 2009. 77. Vochteloo, A. J.; Borger van der Burg, B. L.; Mertens, B. J.; Niggebrugge, A. H.; de Vries, M. R.; Tuinebreijer, W. E.; Bloem, R. M.; Nelissen, R. G.; and Pilot, P.: Outcome in hip fracture
patients related to anemia at admission and allogeneic blood transfusion: an analysis of 1262 surgically treated patients. BMC Musculoskelet Disord, 12: 262, 2011. 78. Waast, D.; Touraine, D.; Wessely, L.; Ropars, M.; Coipeau, P.; Perrier, C.; and Guillot, P.: [Pertrochanteric fractures in elderly subjects aged over 75]. Rev Chir Orthop Reparatrice Appar Mot, 93(4 Suppl): 2S33-‐46, 2007. 79. White, T. O.; Clutton, R. E.; Salter, D.; Swann, D.; Christie, J.; and Robinson, C. M.: The early response to major trauma and intramedullary nailing. J Bone Joint Surg Br, 88(6): 823-‐7, 2006. 80. Zickel, R. E.: An intramedullary fixation device for the proximal part of the femur. Nine years' experience. J Bone Joint Surg Am, 58(6): 866-‐72, 1976. 81. Zufferey, P. J.; Miquet, M.; Quenet, S.; Martin, P.; Adam, P.; Albaladejo, P.; Mismetti, P.; and Molliex, S.: Tranexamic acid in hip fracture surgery: a randomized controlled trial. Br J Anaesth, 104(1): 23-‐30.
ANNEXES
Annexes : Article originel de Brecher permettant le calcul du volumesanguin total perdu (VSTP):
Article originel de Mercuriali permettant le calcul du volumeérythrocytaire perdu (VEP)
Fiche de recueil de données :Nom : Prénom :Sexe (H / F) : Date de naissance :Téléphone domicile : Téléphone famille :Date du traumatisme : Heure du traumatisme :Date de la chirurgie : Heure de la chirurgie :Poids : Taille :Score ASA : ATCD cardio-vasculaires (oui/non) :ATCD neurologiques(oui/non) : ATCD pulmonaire (oui/non) :ATCD ulcère/hémorragie dig. (oui/non) : Kardegic (oui/non) :Plavix (oui/non) : AVK (oui/non) :Classification Evans : Classification Ender :Classification AO : TP préop :Creat pré-op. : Créat.post-op :Temps opératoire : Délai opératoire :Alésage (oui/non) :Anticoagulation post opératoire (type etposologie) :Nb transfusions : Date transfusions :Plaquettes préop : INR préop :Hct J trauma : Hct J4 :Hct J0 : Hct J5 :Hct J1 : Hct J6 :Hct J2 : Hct J7 :Hct J3 :
Proposition d’article :Résumé:Analyse du saignement péri-opératoire réel des fracturestrochantériennes traitées par clou GammaObjectif : L’objectif de cette étude est de déterminer le saignement péri-opératoire réel des patientsprésentant une fracture trochantérienne et ayant bénéficié d’une ostéosynthèse par clou Gamma.Methods : L’analyse a porté sur une série prospective et consécutive de 180 patients. Afin d’évaluer lesaignement péri-opératoire réel, nous avons tenu compte du delta d’hématocrite, du nombre de culotsglobulaires transfusés et du volume sanguin total du patient, pour calculer le volume érythrocytaireperdu selon Mercuriali et le volume sanguin total perdu selon Brecher.Résultats : Les patients perdaient en moyenne 541mL (±240ml) de volume érythrocytaire soit 39%(±19%) de leur volume érythrocytaire initial et 2251ml (± 1214ml) de volume sanguin total. Ilsétaient transfusés dans 63% des cas entre le traumatisme et J+5. Des facteurs de risque connus tel quela prise d’aspirine en préopératoire (+31%) et une hypotension per-opératoire (+20,4%) étaientassociés de manière significative et indépendante à une augmentation du volume érythrocytaire perdu.Cette étude a permis d’identifier un nouveau facteur de risque important de saignement : les fracturesintéressant le grand trochanter (type 3,5 et Reverse fracture selon Evans) (+38,5%). Cependant, enl’absence de ces facteurs, le saignement des fractures pertrochantériennes après ostéosynthèse par clouGamma était de 420ml de volume érythrocytaire perdu et le taux de transfusion était de 55%.Conclusion : Même si le clou gamma est introduit de manière percutanée il s’agit d’une techniquehémorragique.Introduction :Avec le vieillissement de la population, les fractures per-trochantériennes constituent un véritableproblème de santé publique. En traumatologie, les fractures de l’extrémité supérieure du fémur sont lapremière cause d’hospitalisation chez la personne âgée et 2/3 de ces fractures concernent le massiftrochantérien 59 . Il s’agit de patients âgés, souvent dépendants et présentant de nombreusescomorbidités 20 . La mortalité a un an est comprise entre 12 et 37% 46,55,59 .Le saignement est inhérent à la fracture et aux antécédents du patient. Mais, avec son contingent delésions tissulaires, l’acte chirurgical rend également compte d’une part des pertes sanguines. Le clouGamma, largement utilisé pour l’ostéosynthèse des fractures pertrochantérienne et connu pour êtreminimal invasif, réduirait donc théoriquement le risque hémorragique. Beaucoup d’auteurs rapportentdes pertes sanguines observées en per-opératoire faibles lors de sa mise en place allant de 120 à300ml 1,5,30,58 . Pourtant, on sait que l’analyse du saignement par l’estimation des pertes sanguines peropératoireest peu reproductible et entraine une sous-estimation du saignement péri-opératoireréel 21,26,68 . Des formules ont donc été développées afin d’évaluer les pertes sanguines péri-opératoiresréelles en prenant en compte la chute en hématocrite, le nombre de concentré globulaires transfusés etle volume sanguin total du patient 10,51 , mais il n’existe pas d’étude analysant spécifiquement lesaignement péri-opératoire réel des fractures du massif trochantérien
L’évaluation précise du saignement péri-opératoire réel lors de l’utilisation d’un type d’ostéosynthèseest importante car chez ces patients fragiles l’anémie aigüe et les transfusions sont corrélés à uneaugmentation de la morbi-mortalité dans la chirurgie de la hanche 14,21,35,43 .L’objectif de cette étude est de déterminer le saignement péri-opératoire réel des patients présentantune fracture pertrochantérienne et d’analyser les facteurs l’influençant ; notre hypothèse est que bienque l’ostéosynthèse par clou Gamma se fasse de manière percutanée, le saignement péri-opératoireréel est important.Matériel et méthode :Nous avons suivi, de manière prospective et continu, tous les patients monotraumatisés ayant bénéficiéd’une ostéosynthese par clou Gamma entre janvier 2007 et janvier 2010 pour une fracture du massiftrochantérien dans un seul centre afin d’évaluer le saignement péri-opératoire réel et le taux detransfusion. Puis nous avons corrélés le saignement aux variables relevées.L’analyse portait sur une série continue de 180 patients. Les critères d’exclusions comprenaient : lesfractures dont le trait <strong>desc</strong>endait plus de 3cm sous le petit trochanter, les fractures ayant nécessités uneréduction à foyer ouvert, les patients présentant une fracture associée quelque soit sa localisation, lesfractures pathologiques, une prise de sang initiale réalisée plus de 12h après le traumatisme, uneintervention chirurgicale réalisée plus de 7 jours après le traumatisme et la survenue d’une hémorragieen dehors du site chirurgical au cours de l’hospitalisation.Le matériel utilisé était le clou Gamma3 trochanteric nail 180 (Stryker, Freiburg, Germany). Lamise en place du clou Gamma était réalisée par 5 opérateurs confirmés selon la technique chirurgicalestandard après réduction du foyer de fracture sur table orthopédique. L’alésage diaphysaire n’a pas étésystématique. Ce geste était réalisé sous anesthésie générale ou sous rachianesthésie.Les caractéristiques des patients sont décrites dans le tableaux 1. Les patients étaient âgés de 84,5(±10,9 ans) ans en moyenne. On comptait 130 femmes (72,2%). L’indice de masse corporel moyenétait de 23,3 kg/m 2 (±4,6 kg/m 2 ). Les patients présentaient de nombreuses comorbidités : 65,6%d’entre eux présentaient une pathologie cardio-vasculaire et 48,3% des patients présentaient unemaladie neuro-dégénérative ou des antécédents d’accident vasculaire cérébraux. Ainsi 41,1% despatients étaient classés ASA 4 3 ou 4.Les fractures étaient classées selon la classification d’Evans 19 modifiée par Jensen 34 ( tableau 2). Lesfractures de type 1 (3.9%) et 2 (18.3%) dont le trait de fracture intéressait la même région anatomique(ligne intertrochanterienne) étaient regroupées lors de l’analyse du saignement afin de constituer ungroupe référence (n=40, 22.2%).En pré-opératoire, il était réalisé un bilan clinique, biologique et radiographique. Une traction noncolléeétait mise en place jusqu’à l’intervention. L’intervention chirurgicale avait lieu dans lesmeilleurs délais en fonction des comorbidités, du traitement personnel des patients et des contraintespratiques. Les patients sous Clopidogrel avaient leur traitement interrompu en moyenne 2 jours avantl’intervention. Les patients sous Acide acétylsalicylique étaient opérés sans délai supplémentaire. Lespatients sous anticoagulant étaient opérés une fois que leur INR était inférieure à 1,5. Tous les patientsbénéficiaient d’une anticoagulation postopératoire préventive (enoxaparine sodique ou héparinecalcique) et celle-ci était débutée le jour de l’intervention. Les patients sous antiagrégant plaquétaireen pré-opératoire reprenaient tous leur traitement à J+1.
Un soluté isotonique glucosé d’hydratation était mis en place dès l’admission (20 à 25 ml/kg). Leshypotensions et/ou hypovolémie étaient traitées par soluté de macromolécules et/ou Ephedrine.L’antibioprophylaxie par Cephazoline 2gr était systématique. Le seuil transfusionnel systématiquedans ce protocole était de 10 g/dl d’hémoglobine (Hb) ou plus haut en cas de mauvaise toléranceclinique ou si le patient était à haut risque cardio-vasculaire.Tous les patients ont bénéficié d’un protocole de ré-autonomisation rapide. La verticalisation étaitréalisée si possible dès J+2 et l’appui était autorisé.La mesure de l’hématocrite était réalisée à l’admission aux urgences puis quotidiennement entre lejour de l’intervention et le cinquième jour post-opératoire. Les autres variables relevées étaient l’âge,le sexe, le poids, la taille, le score ASA 4 , les antécédents cardiaques, respiratoires, neurologiques etd’ulcère gastro-duodénal, l’insuffisance rénale sévère, les troubles de la coagulation. Nous avionségalement relevé les traitements interférant avec la coagulation tel que les antiagrégants plaquétaires etles anti-vitamine K. Les données opératoires recueillies étaient : le délai opératoire, le typed’anesthésie, le temps opératoire, l’alésage et l’hypotension per-opératoire caractérisée par une tensionartérielle systolique
Les résultats concernant l’évaluation du saignement figurent dans le tableau 3. En moyenne la pertetotale d’érythrocyte étaient de 541 ml (± 240ml). Ceci correspond a 39% (±19.4%) du volume sanguinérythrocytaire initial. La perte de volume sanguin total était de 2251ml (±1214ml). Le taux de patientstransfusés à J+5 était de 63% ; en moyenne chaque patient bénéficiait d’ 1,5 concentré globulaire.Les facteurs entrainant une augmentation significative du volume érythrocytaire perdu (VEP) figurentdans le tableau 1. Il s’agissait de la prise d’antiagrégant ou d’anticoagulant en préopératoire, de laréalisation d’une anesthésie générale et d’une pression artériel systolique
Le saignement péri-opératoire comprend l’hématome lié à la fracture et aux facteurs de risqueassociés, le saignement lié à l’acte chirurgical et l’hématome post-opératoire. L’ostéosynthèse par clouGamma des fractures du massif trochantérien s’accompagnait dans notre étude d’un saignement périopératoireimportant avec un volume érythroytaire perdu de 541mL soit 39% du volumeérythrocytaire initial et un volume sanguin péri-opératoire total perdu de 2251ml. Foss 21 dans la seuleétude utilisant une formule analogue a retrouvé un volume sanguin total perdu de 1861ml lors del’ostéosynthèse par clou cervico-diaphysaire. Bien que dans la littérature la mise en place d’un cloucervico-diaphysaire s’accompagne de pertes sanguines mesurées en per-opératoire faibles (120 à300ml 1,5,30,58 ), le saignement péri-opératoire réel est en fait important. Le clou Gamma participe ausaignement per et post-opératoire des fractures pertrochantérienne pour des raisons anatomiques: tripleabord, traversée du moyen fessier et lésion de son insertion trochantérienne 49 , lésion potentielle desbranches de l’artère circonflexe médiale et latérale de la cuisse au niveau de la fossette digitale 52 ,trépanation du grand trochanter, alésage, distraction des fragments osseux fracturés, lésions des artèresperforantes terminales par la vis de verrouillage.En comparaison au clou Gamma, les vis-plaques dynamique (DHS) ont l’avantage de ne pasaborder le foyer de fracture et de ne pas léser le moyen fessier et le grand trochanter mais au prix d’unabord en regard du muscle vaste externe. Dans la dernière méta-analyse de Parker 60 il n’existe pas dedifférence significative en terme de transfusion et de pertes sanguines per-opératoire entre le clougamma et la DHS mais aucune de ces études randomisées ne calculent le saignement péri-opératoireréel. Foss 21 quand à lui a retrouvé une augmentation de 26% du volume sanguin total perdu (p
d’augmentation des transfusions dans les fractures diaphysaires du fémur et du tibia 69,74 , de plusl’alésage ne semble pas modifier l’activation du système de coagulation 79 .Dans notre série ces fractures sont survenues chez des personnes âgés (85 ans d’âge moyen) etprésentant de nombreuses comorbidités . Ainsi 65% des patients présentaient une pathologie cardiovasculaire.Outre les risques liés à la transfusion 70 ces patients sont sensibles à l’anémie et auxmodifications de l’hématocrite. Dans la littérature, une augmentation des pertes sanguines ou dunombre de concentrés globulaires transfusés semble corrélée à une augmentation de la mortalité, desinfections, des thrombose veineuses profondes, des décompensation rénales et cardiaques, de la duréed’hospitalisation et grèveraient les résultats fonctionnels précoces 14,18,21,35,43 . Dans notre série les pertessanguines ont entrainées un taux de transfusion de 63,3%. Ce taux de transfusion important se trouvedans la moyenne des données retrouvées dans la littérature (36 à 80%) 14,16,21,25,31 . Comparativement àune arthroplastie totale de hanche ce taux de transfusion est deux à trois fois supérieur 42 . De plusmême en l’absence de facteur de risque de saignement les pertes sont de 436ml de volumeérythrocytaire perdu et 1,6L de volume sanguin total perdu.De nouvelles vis-plaques mise en place de manière percutanée semblent réduire le recours auxtransfusions. Ainsi, la mise en place minimale invasive de la plaque PCCP (Orthofix, Lewisville,TX, USA) s’accompagne de taux de transfusions compris entre 14 et 40% 6,12,25,62,76 . Ces taux detransfusions faibles sont significativement inférieurs aux vis-plaques standard 41 . Et pour Giancola 25 letaux de transfusion entre le clou Gamma à la plaque PCCP est 50% plus faible pour la PCCP(p
Figures : Tableau 1 : Analyse univariée du saignement (exprimé en volume érythrocytaire perdu) en fonction des variables relevées n moyenne écart type VEP écart type p âge 180 84,5 10,9 0,11° sexe homme 50 0,579 (0,27) 0,14* femme 130 0,527 (0,23) IMC 180 23,3 4,6 0,09° ATCD cardio-‐vaculaires non 62 0,515 (0,26) 0,28* oui 118 0,555 (0,23) ATCD pulmonaire non 126 0,541 (0,22) 0,97* oui 54 0,543 (0,27) ATCD troubles cognitifs / neurologique non 93 0,553 (0,24) 0,55* ATCD ulcère gatrique ou hémorragie digestive oui 87 0,529 (0,24) non 128 0,530 (0,23) 0,28* oui 52 0,570 (0,27) Insufisance rénale sévère non 118 0,531 (0,25) 0,29* oui 62 0,561 (0,21) trouble de l'hémostase non 169 0,537 (0,23) 0,27* oui 11 0,567 (0,29) Score ASA 1 ou 2 106 0,552 (0,23) 0,48* 3 ou 4 74 0,524 (0,25) Anticoagulants ou antiagrégants non 102 0,480 (0,22) 0,0007¥ aspirine 41 0,652 (0,23) clopidogrel 20 (1) 0,591 (0,26) AVK 20 0,531 (0,24) Délai opératoire en heures 29,2 17,6 0,55° temps opératoire en minutes 34,1 10,3 0,94° Alésage non 64 0,530 (0,210) 0,22* oui 44 0,579 (0,256) Rachianesthésie non 76 0,582 (0,250) 0,03* oui 104 0,512 (0,225) PAS per opératoire < 9mmHg non 106 0,504 (0,225) 0,005* oui 74 0,594 (0,246) * test de Student ; ° correlation de Spearman ; VEP: perte sanguine exprimée volume érythrocytaire perdu; ATCD= antécédents ; ¥ ANOVA ; AVK: Antagonistes de la vitamine K ; (1): dont 3 patients sous AVK et clopidogrel ; IMC : indice de masse corporelle ; PAS = pression arterielle systolique ; Tableau 3 :Valeurs du saignement péri-opératoire et du taux de transfusionmoyenne écart type min max VEP en mL 541 (240) -‐59 1800 %VEP 39,0% (19,4) -‐5,5% 118,6% VSTP en L 2,251 (1,214) -‐0,02 10 Hb le jour du traumatisme en g/dl 12,6 (1,4) 8,5 16,5 ΔHb en g/dl 2,2 (1,9) -‐2,1 7 VEP = volume érythrocytaire perdu entre le traumatisme et J5; % VEP= rapport en pourcent entre VEP et volume érythrocyaire initial; VSTP= volume sanguin total perdu; ΔHb= différence entre hémoglobine initiale et à J+5
tableau 2: Analyse du saignement en fonction du type de fracture classification type n VEP écart type p 1 ou 2 40 0,43 (0,209) 3 10 0,575 (0,338) Evans 4 49 0,476 (0,189) 0,0001 5 67 0,643 (0,223) R 14 0,589 (0,300) Evans 1,2 ou 4 89 0,457 (0,195) 3,5 ou R 91 0,623 (0,240) 0,0000001¥ ¥ test de Student; * test de Kruskal Wallis ;VEP: perte sanguine exprimée en volume érythrocytaire perdu Tableau 4 :Analyse multivariée des facteurs de risques de saignement exprimé en volumeérythrocytaire perdu (VEP)Classification Evans modifiée par Jensen PAS < 90mmHg en peropératoire sexe anticoagulants ou anti-agrégantsplaquéttaires IC95% coef en litres de VEP borne inf borne sup augmentation en % du VEP 1 ou 2 (ref) 0 3 0,130 0,003 0,257 +30,2% 4 0,020 -‐0,069 0,11 +4,7% 5 0,174 0,093 0,256 +40,5% Reverse 0,149 0,008 0,29 +34,7% non (ref) hommes (ref) 0 oui 0,103 0,034 0,171 +20,4% 0 femmes -‐0,074 -‐0,148 0,021 -‐12,8% non (ref) 0 Acide. Acetylsalicylique 0,149 0,071 0,226 +31,0% Clopidogrel -‐0,014 -‐0,13 0,101 -‐2,9% non (ref) AVK 0,048 -‐0,063 0,158 +10,0% 0 p*
GEISS<strong>Laurent</strong>TITRE : Evaluation du saignement des fractures trochantériennes traitées parclou Gamma.Soutenue à Toulouse, le 15 octobre 2012Résumé :Série prospective et consécutive de 180 patients permettant d’évaluer le saignementpériopératoire réel après ostéosynthèse par clou Gamma d’une fracture trochantérienne.Le volume érythrocytaire perdu moyen était de 541mL, soit 39% de leur volumeérythrocytaire initial et 2251ml de volume sanguin total. Ils étaient transfusés dans 63% <strong>desc</strong>as entre le traumatisme et J+5. Après analyse multivariée, les facteurs de risque desaignement étaient : la prise d’aspirine en préopératoire, une anticoagulation préventiveinadaptée à la fonction rénale, le sexe féminin, une hypotension peropératoire et le type defracture (fracture touchant le grand trochanter, fracture avec impaction métaphysaire, fracturecomminutive et fracture inter ou sous-trochantérienne).Bien que le clou Gamma soit introduit de manière percutanée, il s’agit d’une techniquehémorragique et, compte tenu des risques liés au saignement chez ces sujets fragiles, il estpréférable de réserver le clou Gamma aux fractures sous-trochantériennes.DISCIPLINE ADMINISTRATIVE : MEDECINE SPECIALISEE CLINIQUETitre en Anglais : Assessment of bleeding of trochanteric fractures treated with Gamma nail.Mots clés : saignement, transfusion, fracture pertrochantérienne, clou Gamma, personne âgée,facteurs de risqueKeywords : bleeding, transfusion, trochanteric fracture, Gamma nail, elderly, risk factorsFaculté de Médecine Toulouse Purpan - 37 Allée Jules Guesdes BP 7202 - 31073 Toulouse Cedex 7Directeur de thèse : Pr Philippe CHIRON