Valerie Lafontan - Descorthopedie.org
Valerie Lafontan - Descorthopedie.org
Valerie Lafontan - Descorthopedie.org
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
UNIVERSITE TOULOUSE III – Paul SabatierFACULTES DE MEDECINEANNEE 2012 MEMOIRE POUR L’OBTENTION DU DIPLOME D’ETUDES SPECIALISEES COMPLEMENTAIRES en CHIRURGIE ORTHOPEDIQUE ET TRAUMATOLOGIQUE Dr Valérie LAFONTAN Chef de Clinique au CHU de Rangueil, Toulouse Institut de l’Appareil LocoMoteur Septembre 2012 L’OBÉSITE EST-‐ELLE UN FACTEUR LIMITANT DANS LA MISE EN PLACE D’UNE PROTHÈSE UNI-‐COMPARTIMENTALE DE GENOU ? Analyse de la survie de 174 prothèses uni-‐compartimentales, 12 ans de recul moyen Directeur de mémoire Pr Philippe CHIRON 1
L’obésité est-‐elle un facteur limitant dans l’indication de la mise en place d’une prothèse uni-compartimentale de genou? Analyse de la survie de 174 prothèses uni-‐compartimentales, 12 ans de recul moyen 2
Il faut associer à ce travail deux collaborateurs : -‐Etienne CAVAIGNAC, interne des Hôpitaux de Toulouse en Chirurgie orthopédique et traumatologique. Je tiens à te remercier pour ta disponibilité, ton efficacité, ton sérieux et ton intérêt notamment dans la chirurgie du genou. Tu nous as permis de traiter dans les temps les dossiers et a participé activement à cette étude avec beaucoup de panache et de pertinence. -‐Matthieu WARGNY, interne des Hôpitaux de Toulouse en Santé Publique et Epidémiologie. Je tiens à te remercier pour avoir accepté de traiter nos données, et avoir produit ce travail de qualité en biostatistiques. Tu as pallié nos lacunes dans ce domaine, et a apporté la précision et le sérieux dont avait besoin cette étude clinique 3
Table des matières I. Introduction …………………………………………………6 II.Matériels et Méthodes ………………………………….8 II.1 Matériels …………………………………………………8 II.1.1 Généralités II.1.2 L’implant II.1.3 La technique chirurgicale II.2 Méthodes …………………………………………………10 II.2.1 Bilan pré-‐opératoire II.2.2 Bilan post-‐opératoire II.2.3 Présentation de la population d’étude III. Résultats ……………………………………………………….14 III.1 Analyse descriptive de la série ………………14 III.1.1 Les taux de survie III.1.2 Les autres résultats globaux III.1.3 Les échecs III.2 Analyse comparative de la série ………………16 III.2.1 Sous-‐groupe en fonction de l’IMC III.2.2 Sous-‐groupe en fonction du poids III.2.3 Sous-‐groupe de l’âge III.2.4 Concordance entre sous-‐groupe l’IMC et les autres critères III.3 Analyse comparative de la fonction ……...21 III.4 Analyse des facteurs de risque d’échecs ……...22 IV. Discussion ………………………………………………..23 V. Conclusion ………………………………………………..28 VI.Bibliographie ………………………………………………..29 VII. Annexe ………………………………………………………..32 4
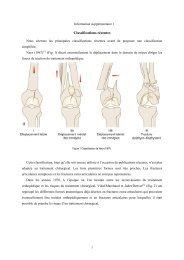
I. Introduction Les prothèses uni-‐compartimentales (PUC), bien indiquées, représentent une solution intéressante dans la prise en charge des gonarthroses, apportant une récupération fonctionnelle plus rapide et de meilleure qualité sans morbidité majeure en comparaison aux prothèses totales de genou (PTG). Les améliorations techniques et la plus grande rigueur dans le choix des patients ont permis d’obtenir, dans les travaux les plus récents, des taux de survie des PUC à peu près identiques à ceux des PTG. Les erreurs d’indications font partie des principales causes d’échec des PUC. Actuellement, les chirurgiens se réfèrent aux règles décrites par Scott et Kozin (10, 18) pour optimiser la sélection des patients éligibles aux PUC : Ø Ostéonécrose du condyle médial ou arthrose isolée uni-compartimentale fémoro-‐tibiale quel que soit le stade ; Ø Réductibilité de la déformation ; Ø Varus inférieur à 10° ou valgus inférieure à 14° ; Ø Ligament croisé antérieur (LCA) fonctionnel. Ainsi, toute translation antérieure supérieure à 10mm, la présence d’une cupule postérieure ou un aspect remanié des épines tibiales doivent contre-‐indiquer la PUC car reflets d’une insuffisance du LCA ; Ø Conservation des amplitudes articulaires ; Ø Poids inférieur à 80kg même si le poids n’est pas une contre-indication absolue. En effet, la littérature expose des résultats discordant en fonction du poids, ou plus exactement de l’Indice de Masse Corporelle (IMC) encore appelé dans les milieux anglo-‐saxons Body Mass Index (BMI) Forts des bons résultats dans les articles les plus récents, les chirurgiens tendent à élargir les indications des PUC ; ainsi ce qui était considéré comme une contre-‐indication ou un facteur de risque d’échec ne l’est plus forcément (21): les indications ou plutôt les contre-‐indications ne sont plus consensuelles. 5
L’objectif de notre étude était d’étudier l’impact de ces possibles facteurs de risque d’échecs (considérés par certains comme des contre-‐indications) sur la survie à 10 ans de PUC à plateau fixe tout polyéthylène ainsi que leur influence sur le taux de reprise. Le critère principal d’analyse était la survie en fonction de l’IMC. Les critères secondaires ont été l’âge de la mise en place de la PUC, le poids, l’état du cartilage fémoro-‐tibial contro-‐latéral, l’état du cartilage fémoro-patellaire et la correction du morphotype dans le plan frontal. 6
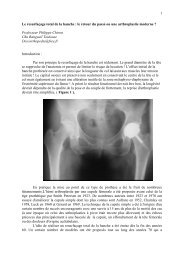
II. Matériels et Méthodes II.1 Matériels II.1.1 Généralités Il s’agit d’une étude rétrospective, monocentrique et continue, menée au sein du service de Chirurgie Orthopédique et Traumatologique du CHU de Toulouse-‐Rangueil. Elle inclut l’ensemble des PUC implantées par l’équipe chirurgicale de ce service de Janvier 1990 à Décembre 2004. Au total, 174 PUC mises en place chez 155 patients ont pu être analysées, réparties de la façon suivante : -‐ 140 revues en Décembre 2011 -‐ 15 révisées -‐ 19 perdues de vue ou patients décédés inclus dans l’étude. II.1.2 L’implant La prothèse utilisée était la prothèse HLS Uni (Tornier) (Fig.1) mise en place par voie minimale invasive. Les implants étaient cimentés et le plateau tibial a toujours été un plateau fixe « tout polyéthylène » (Fig. 2 et 3). 7
Fig.1 : Prothèse uni-compartimentale HLS Uni (Tornier). La particularité est le plateau tibial fixe cimenté « tout polyéthylène ». Fig.2 : PUC interne genou gauche, radiographie de face Fig. 3 : PUC interne genou gauche, radiographie de profil 8
II.1.3 La technique chirurgicale Elle n’a pas présenté de particularités. L’intervention a toujours été menée sous garrot pneumatique. La voie d’abord a toujours été classique : para-‐patellaire médiale pour les PUC médiales et para-‐patellaire latérale pour les PUC latérales. Après arthrotomie, l’état du cartilage de l’ensemble des compartiments ainsi que celui du pivot central a été vérifié. II.2 Méthodes II.2.1 Bilan pré-‐opératoire Chaque patient a bénéficié d’un bilan complet afin de colliger un certain nombre d’informations. Ø Les données générales o l’IMC (sachant que l’on parle d’obésité si l’IMC est supérieur à 30) ; o le poids en Kg ; o l’âge au moment de la mise en place de la prothèse ; o l’indication de la prothèse. Ø Le bilan radiographique standard du genou concerné (des clichés de face et de profil en charge, un schuss, un défilé fémoro-‐patellaire, et une télémétrie) o le stade de l’arthrose fémoro-‐tibiale du compartiment contro-latéral, selon la classification d’Alhback (Tableau 1) (1); Stade selon Ahlback Stade I Stade II Stade III Définition correspondante selon Ahlback Pincement de l’interligne articulaire < 3 mm Pincement complet de l’interligne articulaire Pincement complet et cupule entre 0 et 5 mm Stade IV Cupule entre 5 et 10 mm Stade V Cupule >10 mm Tableau 1 : Classification radiologique de la gonarthrose selon Ahlback 9
o le stade de l’arthrose fémoro-‐patellaire selon la classification d’Iwano (Tableau 2) (9) ainsi que le caractère symptomatique ; Tableau 2 : Classification radiologique de la gonarthrose selon Iwano o le morphotype dans le plan frontal par la mesure du Hip-‐Knee Angle (HKA). II.2.2 Bilan post-‐opératoire Pour chaque patient, des éléments objectifs et subjectifs ont été recueillis. Ø L’évaluation fonctionnelle o le score IKDC (en Annexe) o un questionnaire de satisfaction (en Annexe) Ø Le bilan radiographique complet (des clichés de face et de profil en charge, un schuss, un défilé fémoro-‐patellaire, et une télémétrie) o la mesure de la correction du morphotype dans le plan frontal pour toutes les PUC: on parle de normocorrection si le HKA est à 180° +/-‐ 3° ; on parle d’hypercorrection si le morphotype est modifié à plus de 3° et d’hypocorrection à moins de 3°; Ø La recherche de l’échec en temps que révision de la PUC et le motif de celle-‐ci. 10
II.2.3 Présentation de la population d’étude Ø L’IMC, le poids et l’âge L’IMC moyen était de 27,9 (19-‐43), le poids moyen de 71,5 Kg (47-‐115) et l’âge moyen de 66 ans (39-‐82). Ø Les indications des PUC (Fig.4 et 5) Les indications de la mise en place de la PUC étaient dans 161 cas l’arthrose uni-‐compartimentale (130 compartiments médiaux et 31 compartiments latéraux), dans 9 cas une nécrose toujours condylienne et dans 4 cas une séquelle de fracture du plateau tibial. Nous avons retrouvé dans 32 cas une arthrose contro-‐latérale associée (2 en stade I et 30 en stade II) et dans 39 cas, le compartiment fémoro-patellaire était considéré comme arthrosique (2 en stade I et 37 en stade II). Aucun patient ne présentait d’atteinte tri-‐compartimentale. Etiologie Latéralité arthrose Arthrose Nécrose Séquelle fract ext 5% 2% Med Lat 19% 93% 81% Fig.4 : Etiologies ayant conduit à la mise en place d’une PUC Fig.5 : Répartition de l’arthrose uni-compartimentale11
Ø Répartition en sous-‐groupes La population a ensuite été divisée en sous-‐groupes : o en fonction de l’IMC (limite à 30) ; o en fonction de l’âge (limite à 65 ans) ; o en fonction de la correction de la déformation dans le plan frontal (hypo-‐, normo-‐ ou hyper-‐correction) ; o en fonction de la présence d’arthrose dans un des autres compatiments, fémoro-‐tibial contro-‐latéral ou fémoro-patellaire.Le taux de survie, les scores fonctionnels et les radiographies ont été ainsi analysés aussi dans chaque sous-‐groupe. Le critère principal étant l’IMC, ce dernier a été étudié séparément puis groupé aux autres critères de jugement. Ø L’analyse statistique L’analyse a porté sur la comparaison du taux de survie à 10 ans et de la survie selon Kaplan Meier en fonction des différents sous-‐groupes. Les comparaisons ont été effectuées par des tests T de Student. Nous avons mesuré la corrélation entre l’IMC et le score IKDC par un coefficient de corrélation de Pearson. L’impact des différents facteurs sélectionnés sur la survie a été mesuré par un test de régression multimodale, donnant la valeur respective de l’odd ratio pour chacun des facteurs. Les résultats étaient jugés statistiquement significatifs si p
III. Résultats Les résultats ont été répartis et traités en plusieurs fois, selon les critères de jugement étudiés. Ainsi, nous délivrerons les résultats en plusieurs étapes : Ø Le taux de survie et les résultats globaux de la série Ø Le taux de survie en fonction de l’IMC Ø Les taux de survie en fonction de l’âge Ø Les résultats plus en détail dans le sous-‐groupe IMC III.1 Analyse descriptive III.1.1 Les taux de survie Le recul moyen était de 12 ans (6,5 à 22 ans). Le taux de survie à 10 ans pour l’ensemble de la série est à 92 % [85-‐94]. La figure 6 représente la courbe de survie de la prothèse pour la population totale. Le taux de survie cumulée est de 89.5 % avec un Intervalle de Confiance IC de 95% [82.9-‐93.7]. Fig. 6 : Taux de survie global 13
III.1.2 Les résultats globaux Ø Les scores IKDC (Fig.7) La moyenne du score genou au dernier recul était de 79,82 (46 à 96) et celle du score fonction était de 79,03 (55 à 100). 100 90 80 70 60 50 40 30 20 10 0 79,8 79 Score Genou Score fonction Fig.7 : Résultats du score IKDC Ø Correction dans le plan frontal (Tableau 3) Dans 6 cas (2,9 % de la série), le morphotype a été hypercorrigé. Hypocorection Normocorection Hypercorection Nombre 3 165 6 Pourcentage 2 94,8 3,2 Tableau 3 : Répartition de la population d’étude en fonction de la correction dans le plan frontal III.1.3 Les échecs 16 patients (soit 6,1 % des revus, auxquels sont ajoutés les patients décédés) ont dû bénéficier d’une reprise chirurgicale. Dans un cas la prothèse a été conservée et il a été réalisé l’ablation de corps étrangers (ostéophytes) à 7 ans de la mise en place de la prothèse. En ce qui concerne les 15 autres cas, 13 correspondent au changement de la PUC pour une PTG, 1 cas a été repris pour un changement de polyéthylène pour usure, et le dernier cas est représenté par la mise en place d’une PUC controlatérale pour décompensation du compartiment. 14
Les causes de reprise (Fig.8) ont été : -‐ descellement tibial aseptique dans 3 cas, -‐ décompensation arthrosique controlatérale dans 7 cas, -‐ usure du polyéthylène dans 1 cas, -‐ douleur inexpliquée dans 2 cas, -‐ conflit entre la pièce tibiale et le LLI dans 1 cas, -‐ conflit entre la pièce fémorale et le massif des épines dans 1 cas. -‐La reprise a été effectuée en moyenne à 34,6 mois. Cause de reprise Conulit pièce fémoral épines Conulit pièce tibial LLI douleur inexpliquée Usure PE Décompensation controlatéral Descellement Tibia asceptique 0 1 2 3 4 5 6 7 8 Fig.8 : Nombre de reprise des PUC en fonction des causes d’échec III.2 Analyse comparative de la survie III.2.1 Sous-‐groupes en fonction de l’IMC Les sous groupes en fonction de l’IMC ont été établis avec la limite de l’obésité pour un IMC à 30. Les courbes de survie sont superposables (Fig.9). Les taux de survie à 10 ans sont très proches, à environ 90% : 90% pour le groupe IMC>30 et 91 % pour le groupe IMC
-‐ Population avec un IMC < 30 : 89.1 % de TSC avec un IC95% [80.5; 94.0], avec 11 révisions sur 125 individus, soit 8.8 % de révisions. -‐ Population avec un IMC > 30 : 90.4 % de TSC avec un IC95% [76.2; 96.3], avec 4 révisions sur 49 individus, soit 8.2 % de révisions. Fig.9 : Courbe de survie en fonction de l’IMC III.2.2 Sous-‐groupes en fonction du poids Si la valeur seuil retenue est de 80 Kg (Fig.10), on observe moins d’évènements chez les patients de moins de 80 kg, même si les IC95% des taux de survie cumulés se chevauchent encore. -‐ Population avec un poids < 80 kg lors de la chirurgie : 91.8 % de TSC avec un IC95% [83.0; 96.1], avec 7 révisions sur 109 individus, soit 6.4 % de révisions. -‐ Population avec un poids > 80 kg lors de la chirurgie : 86.1 % de TSC avec un IC95% [73.9; 92.9], avec 8 révisions sur 65 individus, soit 12.3 % de révisions. 16
Fig.10 : Courbes de survie en fonction du poids 80 Kg Si la valeur seuil retenue est cette fois-‐ci un poids à 90 Kg (Fig.11), on observe alors moins d’évènements chez les patients de plus de 90 kg. Même si les effectifs sont faibles dans ce dernier groupe (30 individus), il est intéressant de noter que les tendances s’inversent par rapport aux résultats avec un seuil de 80 kg, puisque les patients plus massifs nécessitent ici moins de révision. Cela est notamment dû au grand nombre d’évènements chez les patients entre 80 et 90 kg (6 sur 35, soit 17.1 %) -‐ Population avec un poids < 90 kg lors de la chirurgie : 89.2 % de TSC avec un IC95% [81.7; 93.7], avec 13 révisions sur 144 individus, soit 9.0 % de révisions. -‐ Population avec un poids > 90 kg lors de la chirurgie : 91.1 % de TSC avec un IC95% [67.9; 97.8], avec 2 révisions sur 30 individus, soit 6.7 % de révisions. 17
Fig.11 : Courbes de survie en fonction du poids 90 Kg III.2.3 Sous-‐groupe en fonction de l’âge La limite de 65 ans a été retenue pour la constitution des sous-‐groupes. Le taux de survie à 10 ans des patients de plus de 65 ans était de 94 %, contre 89% pour les moins de 65 ans. Les taux de survie cumulés TSC des deux groupes sont représentés sur la figure 12. On obtient ainsi des courbes plus séparées que pour l’IMC à 30, même si les IC95% des taux de survie cumulés se chevauchent encore. -‐ Population avec un âge < 65 ans lors de la chirurgie : 85.4 % de TSC avec un IC95% [73.0; 92.4], avec 9 révisions sur 74 individus, soit 12.2 % de révisions. -‐ Population avec un âge > 65 ans lors de la chirurgie : 92.3 % de TSC avec un IC95% [84.8; 96.8], avec 6 révisions sur 94 individus, soit 6.0 % de révisions. 18
Fig.12 : Courbe de survie en fonction de l’âge III.2.4 Concordance entre le sous-‐groupe IMC et les autres critères Ø Si on groupe l’analyse en fonction de l’IMC (limite à 30) et en fonction de l’âge (limite à 65 ans). Les différences retrouvées ne sont pas statistiquement significatives Les taux de survie à 10 ans sont représentés dans le tableau 4. Taux de survie à 10 IMC < 30 IMC > 30 ans Age < 65 ans 90% 92% Age > 65 ans 91% 97% Tableau 4 : Taux de survie sous groupe IMC, corrélés à l’Age Ø Si on regroupe l’analyse de l’IMC en fonction de l’arthrose controlatérale (présence ou absence). On ne retrouve pas de comparaisons statistiquement significatives. Les taux de survie à 10 ans sont représentés dans le tableau 5. 19
Taux de survie à 10 IMC < 30 IMC > 30 ans Arthrose présente 94% 99% Arthrose absente 80% 93% Tableau 5 : Taux de survie à 10 ans sous groupe IMC, corrélés à l’Arthrose fémoro-‐tibiale contro-‐latérale Ø Si on groupe l’analyse de l’IMC à celle de l’arthrose fémoro-patellaire (présence ou absence). On ne retrouve pas de comparaison statistiquement significative. Les taux de survie à 10 ans sont représentés dans le tableau 6. Taux de survie à 10 IMC < 30 IMC > 30 ans Arthrose présente 95% 99% Arthrose absente 79% 93% Tableau 6 : Taux de survie à 10 ans sous groupe IMC, corrélés à l’Arthrose fémoro-‐patellaire III.3 Analyse comparative de la fonction L’analyse de la fonction du genou est menée par le biais du score IKDC, réparti en score « Genou » et en score « Fonction ». Les résultats des scores fonctionnels en fonction de l’IMC sont détaillés dans le tableau 7. L’ensemble des résultats est non statistiquement significatif. Score Genou Score Fonction p IMC > 30 76, 8 (72-‐88) 77 (58-‐89) N.S. IMC < 30 80 (55-‐95) 85 (75-‐100) N.S. Tableau 7 : Analyse du score IKDC en fonction de l’IMC Le coefficient de corrélation de Pearson est : -‐ entre l’IMC et le score genou de 0,177 (p
III.4 Facteurs de risque d’échecs Après avoir analysé avec attention les résultats en termes de survie et de fonction des PUC, notamment en prenant en compte la donnée « poids » et celle « IMC », il a été intéressant de dégager l’existence ou non de facteurs de risque d’échecs. L’outil statistique retenu (modèle de régression multimodale) est alors significatif (Chi2=24,467, p
I.V. Discussion Le premier élément de discussion, avant même de répondre à la question principale de notre sujet (influence de l’IMC sur la survie), pourrait concerner le choix de notre prothèse. Ce type de PUC, avec plateau fixe « tout polyéthylène », jouerait-‐il un rôle sur les résultats, notamment en terme de survie ? Pour justifier le choix de cette PUC, voici quelques éléments de réflexion et quelques données bibliographiques. Les utilisateurs des plateaux mobiles mettent en avant, par rapport aux plateaux fixes, la meilleure cinématique et la diminution de l’usure du polyéthylène par une meilleure répartition des contraintes (2). Cependant, elles sous-‐tendent l’utilisation d’un métal-‐back. Les plateaux mobiles ont souvent un meilleur résultat fonctionnel ainsi qu’un meilleur taux de satisfaction auprès des patients (5). Par contre, si la principale cause d’échec des plateaux fixes est le descellement, celle des plateaux mobiles est la luxation du polyéthylène (19) et l’hypercorrection liée à l’encombrement du métal-‐back (7). Ainsi, le choix entre plateau mobile et plateau fixe reste encore à la libre appréciation du chirurgien car aucune différence significative sur la survie à long terme n’a pu être démontrée en termes de descellement (16). Les plateaux « tout polyéthylène » et les plateaux « métal-‐back » possèdent leurs avantages et leurs inconvénients et le choix est actuellement une affaire d’école. Les plateaux métal-‐back sont supposés apporter une stabilité supplémentaire au plateau tibial, contrairement aux plateaux « tout polyéthylène » qui transmettent directement les pressions au tibia. Ils ont également l’avantage de permettre le changement isolé de l’insert en polyéthylène en cas d’usure. Cependant, la résection tibiale se doit d’être importante, car correspondant à l’épaisseur de l’insert en polyéthylène ajoutée à celle du métal-‐back. De plus, il ne faut pas négliger les dangers d'une interface supplémentaire : l’usure du polyéthylène apparait à son interface articulaire mais aussi à son interface avec le support métallique. Les produits libérés peuvent ainsi provoquer des ostéolyses. Il a été reproché aux plateaux « tout polyéthylène » d’être responsables d’effondrement tibial, pouvant aller jusqu’à 25% selon les études (17). 22
Nous n’avons eu aucun cas d’effondrement du plateau tibial dans notre série. A la lecture de la littérature, ces plateaux « tout polyéthylène » semblent tout de même avoir fait la preuve de leur fiabilité à long terme. Avec plus de 90% de survie à 10 ans et même 80% à 20 ans (4, 12), le taux de survie de ces PUC est similaire à celui des prothèses totales. Ces bons résultats peuvent être attribués à la qualité ainsi qu’à l’épaisseur du polyéthylène (9-‐11-‐13mm). Enfin, les plateaux « tout polyéthylène » permettent de préserver le stock osseux en diminuant la hauteur de la coupe tibiale. Récemment, la littérature n’a pas pu prouver de différence statistiquement significative entre ces deux types de plateaux, que ce soit à la vue des résultats cliniques ou des taux de survie (méta-‐analyse de 2007). Enfin, aucune étude à ce jour n’a comparé les plateaux fixes aux mobiles, les plateaux« tout polyéthylène » aux métal-‐back, au sein des populations obèses. Par contre, notre étude montre d’excellents résultats avec une PUC à plateau fixe « tout polyéthylène ». Si nous devions discuter la pertinence et la qualité de notre étude, nous pouvons lui reconnaître une série dont le nombre d’inclusions est intéressant, en comparaison des études rencontrées dans la littérature. Les scores fonctionnels pré-‐opératoires n’ont pas été relevés car ce qui nous intéresse et bel et bien le résultat objectif en terme de survie et la satisfaction du patient, et non pas une simple amélioration par rapport à un état précédent mais qui ne serait toujours pas acceptable pour le patient. Enfin, certains biais, positifs ou négatifs, pourraient être relevés : -‐ en effectuant une étude en sous-‐groupes, on diminue le nombre de cas dans chaque brin, ce qui rend difficile de dégager des facteurs de risque. Statistiquement parlant, ce type d’étude ne permet pas de prouver formellement que deux groupes auront des risques de révision prothétique semblables ; seules des différences peuvent ressortir comme statistiquement significatives. -‐ certains genoux auraient sans doute pu relever d’une indication de PUC mais ont été proposés à une PTG par le chirurgien ce qui constitue un biais d’inclusion. 23
Notre étude montre d’excellents résultats en terme de survie dans les populations obèses et âgés, ce qui doit nous amener à réfléchir sur les indications et les contre-‐indications de nos PUC. Probablement que la limitation de l’activité physique et sportive dans ce groupe de patients a un impact important sur la survie (15). Beaucoup d’équipes considèrent le poids comme un frein à la pose des PUC : l’IMC supérieur à 30 Kg/m2 ou un poids supérieur à 80 Kg sont les valeurs retenues pour contre-‐indiquer cette chirurgie. La plupart des études relatant les échecs ont cependant utilisé des valeurs-seuil d’IMC supérieures à 30 (32 pour Berend et Lombardi (3), 35 pour Bonutti (6)). Les causes d’échecs dans le groupe « obèse » sont essentiellement les fractures du plateau tibial, le descellement aseptique, la dégradation du compartiment controlatéral ou la douleur inexpliquée. Ces patients ont d’ailleurs des scores fonctionnels souvent moins bons. Bonutti (6) a également comparé deux groupes : IMC supérieur ou égal à 35, et IMC inférieur à 35. Respectivement, à 2 ans en moyenne, le taux de reprise est de 7% et 0%. Cinq patients dont l’IMC est supérieur ou égal à 35 ont été repris par une prothèse totale : 2 pour progression de l’arthrose, 2 pour descellement tibial (dont une fracture de stress précoce) et 1 pour douleur inexpliquée. Enfin, dans ce groupe, les scores fonctionnels étaient tous moins bons. Contrairement à ce que nous pourrions penser, la littérature, bien que faible dans le domaine, apporte également des études concluant à l’absence d’influence du poids sur la survie des PUC (11). Tabor (20) relate d’excellents résultats cliniques avec un recul de 20 ans. Naal (14) ne décrit pas dans sa série de différence statistiquement significative en terme de survie dans ses 3 groupes, groupe A avec un IMC inférieur à 25, groupe B avec un IMC entre 25 et 30 et groupe C avec un IMC supérieur à 30. L’analyse de notre série retrouve d’excellents résultats en terme de survie mais également de scores fonctionnels avec un recul moyen de 12 ans. Dans notre série, les patients présentant le plus de contre-‐indications « classiques » possèdent paradoxalement les meilleurs taux de survie. En effet, ceux avec l’IMC le plus élevé, les stades d’arthroses controlatérale ou fémoropatellaire les plus grands présentent des taux de survie supérieurs aux autres groupes. Ces chiffres sont vérifiés aux taux de survie à 10 ans et au recul moyen de 12 ans. 24
En ce qui concerne l ‘analyse seule de l’IMC, les courbes de survie des patients obèses et des non obèses sont équivalentes avec un taux de survie identique à 10 ans de 92%. L’analyse de la survie brute est un fait, mais il faut de pair analyser la fonction qu’ont ces patients. La différence de score fonction et genou au dernier recul dans les groupes obèses ou non est minime (3,2 points pour le score genou et 8 points pour le score fonction) et non significative. D’une part, la limitation du score fonction chez les obèses pourrait être corrélée à d’autres facteurs non liés au genou comme une insuffisance cardiaque, un diabète limitant la mobilité... D’autre part le calcul de la corrélation entre l’IMC et les scores fonctionnels retrouvent des chiffres très faibles, témoignant de l’absence de lien entre ces deux paramètres d’analyse. Le poids n’est donc pas pour nous une contre-‐indication à la PUC et ne devrait plus être considéré comme un facteur limitant dans le choix de cette chirurgie. Un autre sujet de discussion se pose à nous via cette étude : celle de l’âge. La PUC est-‐elle une prothèse du sujet jeune ou du sujet âgé ? Du fait de sa faible morbidité et des suites opératoires plus simples, la PUC est la prothèse de choix de la personne âgée, aux alentours de 70 ans, à condition bien sûr de respecter les autres critères d’indication. Chez les patients plus jeunes, de moins de 60 ans, ce type de prothèse doit-‐il être la référence du fait de son économie articulaire ? Notre étude retrouve de moins bons résultats pour les patients plus jeunes, les reprises étant également plus fréquentes dans ce groupe. Ces patients sollicitent bien plus leur prothèse, que se soit en terme de quantitatif (plus d’activité sportive et dans la durée du fait de l’espérance de vie) ou en terme qualitatif (sport avec impact et choc). Ainsi, chez les moins 65 ans, le taux de survie à 10 ans est de 89% et de 85,4% à 15 ans !!!! Cependant, force est de reconnaître qu’il vaut mieux reprendre une PUC qu’une PTG … La notion de l’âge est toujours à l’heure actuelle à l’appréciation du chirurgien. 25
Enfin, un facteur de risque principal d’échec des PUC, mais déjà identifié et connu des chirurgiens a été mis en exergue : l’hypercorrection. L’hypercorrection, voire même la normocorrection, est déjà reconnue pour prédisposer à l’évolution arthrosique du compartiment contro-‐latéral (8, 13). L’hypercorrection (et la normocorrection pour les genoux ayant un varus constitutionnel) est en effet responsable d’une surcharge du compartiment contro-‐latéral, créant une dégradation souvent rapide entre 2 et 5 ans. La littérature rappelle un principe essentiel de la PUC : elle ne doit compenser que l’usure. Dans notre étude, la présence d’une hypercorrection augmente par 3 le risque de reprise par décompensation du compartiment contro-‐latéral, dans un délai moyen de 63,3 mois. 26
VIII.Conclusion La prothèse unicompartimentale PUC est une chirurgie déjà ancienne, mais qui a connu succès et déboires. La meilleure sélection des patients et les améliorations techniques ont permis une progression nette et intéressante des résultats sur la fonction et la survie. Cependant, la littérature n’est pas toujours en harmonie et plusieurs questions restent encore en suspens. L’une d’elles concerne les critères de sélection, avec en tête de file des interrogations le poids : l’obésité, c’est-‐à-‐dire un IMC supérieur à 30, et même un poids supérieur à 80 kg doivent-‐ils contre-‐indiquer la PUC, comme peuvent le recommander certaines équipes ? Notre réponse, en s’appuyant sur cette étude de 174 PUC, est NON : l’obésité n’est pas une contre-‐indication et ces patients, aux comorbidités souvent importantes, peuvent relever à plus forte raison de ce type de chirurgie, moins agressive, à la récupération plus rapide. 27
IX. Bibliographie 1-‐ Ahlbäck S (1968). Osteoarthrosis of the knee. A radiographic investigation. Acta Radiol Suppl (277) 2-‐ Ashraf T, Newman JH, Desai VV, Beard D, Nevelos JE (2004). Polyethylene wear in a non-‐congruous unicompartmental knee replacement a retrieval analysis. The Knee; 11:177– 81 3-‐ Berend KR, Lombardi Jr AV, Mallory TH, et al (2005). Early failure of minimally invasive unicompartmental knee arthroplasty is associated with obesity. Clin Orthop Relat Res ; 440:60. 4-‐ Berger RA, Meneghini RM, Jacobs JJ, Sheinkop MB, Della Valle CJ, Rosenberg AG, et al (2005). Results of unicompartmental knee arthroplasty at a minimum of ten years of follow-‐up. J Bone Joint Surg (Am); 87: 999—1006. 5-‐ Bhattacharya R, et al (2011). Survivorship and patient satisfaction of a fixed bearing unicompartmental knee arthroplasty incorporating an all-‐polyethylene tibial component, Knee, article in press. 6-‐ Bonutti P, Goddard M, Zywiel M, Khanuja H, Johnson A, Mont M (2011). Outcomes of Unicompartmental Knee Arthroplasty Stratified by Body Mass Index. J of Arthroplasty, article in press 7-‐ Gleeson R E, Evans R, Ackroyd C E, Webb J, Newman J H (2004). Fixed or mobile bearing unicompartmental knee replacement? A comparative cohort study ? The Knee 11 ; 379– 384. 8-‐ Hang J R et al (2010). Outcome of revision of unicompartmental knee replacement. 1,948 cases from the Australian Orthopaedic Association National Joint Replacement Registry, 1999–2008. Acta Orthopaedica; 81 (1): 95–98 9-‐ Iwano T, Kurosawa H, Tokuyama H, Hoshikawa Y (1990). Roentgenographic and clinical findings of patellofemoral osteoarthrosis. With special reference to itsrelatioship femorotibial osteoarthrosis and etiologic factors. Clin Orthop Relat Res (252):190-‐7 28
10-‐ Kozinn SC, Scott R (1989). Unicondylar knee arthroplasty. J Bone Joint Surg Am;71:145-‐50 11-‐ Kuipers B M, Kollen B J, Kaijser Bots, Burger B J, Van Raay J, Tulp N, Verheyen C (2010). Factors associated with reduced early survival in the Oxford phase III medial unicompartment knee replacement. The Knee 17 : 48–52 12-‐ Lustig S, Paillot J-‐L, Servien E, Henry J, Ait Si Selmi T, Neyret P (2009). Cemented all polyethylene tibial insert unicompartimental knee arthroplasty: A long term follow-‐up study. Orthopaedics & Traumatology: Surgery & Research; 95, 12—21. 13-‐ Manson T T et al (2010). Unicondylar Knee Retrieval Analysis. The Journal of Arthroplasty Vol. 25 No. 6 Suppl. 1: 108-‐11 14-‐ Naal FD, Neuerburg C, Salzmann GM, et al (2009). Association of body mass index and clinical outcome 2 years after unicompartmental knee arthroplasty. Arch Orthop Trauma Surg; 129:463. 15-‐ Pandit H, Jenkins C, Gill HS, Smith G, Price AJ, Dodd CA, Murray DW. (2011) Unnecessary contraindications for mobile-‐bearing unicompartmental knee replacement. J Bone Joint Surg Br. 2011 May;93(5):622-‐8. 16-‐ Parratte S, Pauly V, Aubianac JM, Argenson JN (2011). No long-‐term difference between fixed and mobile medial unicompartmental arthroplasty. Clin Orthop Relat Res; Jul 6, article in press 17-‐ Saenz C L, McGrath M S, Marker D R, Seyler T M, Mont A M, Bonutti P M (2010). Early failure of a unicompartmental knee arthroplasty design with an all-polyethylene tibial component. The Knee 17; 53–56. 18-‐ Scott R (1997). Mistakes made and lesson learned after two decades of unicompartmental knee. In: Cartier P, Epinette J, Deschamps G, Hernigou P (eds). Unicompartmental Knee Arthroplasty. Paris. Expansion Scientifique Francaise 61: 163-‐6. 29
19-‐ Song M H, Kim B H, Ahn S J, Yoo S H, Lee M S (2009). Early Complications after Minimally Invasive Mobile-‐Bearing Medial Unicompartmental Knee Arthroplasty. The Journal of Arthroplasty Vol. 24 No. 8: 1281-‐84 20-‐ Tabor OB Jr, Tabor OB, Bernard M, Wan JY. (2005) Unicompartmental knee arthroplasty: long-‐term success in middle-‐age and obese patients. J Surg Orthop Adv. 2005 Summer;14(2):59-‐63. 21-‐ Vince KG, Cyran LT (2004). Unicompartmental knee arthroplasty: new indication, more complication? J Arthroplasty: 19:9 ; 224-‐29 30
X. Annexes Le score IKDC 31