Collège NotreDame de Jamhour Examen de Chimie
Collège NotreDame de Jamhour Examen de Chimie
Collège NotreDame de Jamhour Examen de Chimie
You also want an ePaper? Increase the reach of your titles
YUMPU automatically turns print PDFs into web optimized ePapers that Google loves.
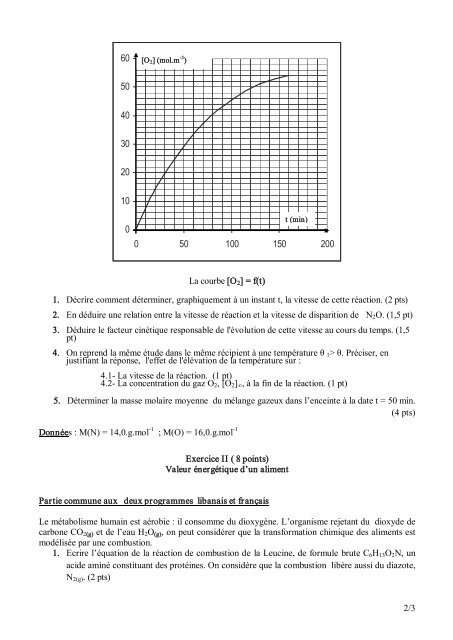
60<br />
[O 2 ] (mol.m 3 )<br />
50<br />
40<br />
30<br />
20<br />
10<br />
0<br />
t (min)<br />
0 50 100 150 200<br />
La courbe [O 2 ] = f(t)<br />
1. Décrire comment déterminer, graphiquement à un instant t, la vitesse <strong>de</strong> cette réaction. (2 pts)<br />
2. En déduire une relation entre la vitesse <strong>de</strong> réaction et la vitesse <strong>de</strong> disparition <strong>de</strong> N 2 O. (1,5 pt)<br />
3. Déduire le facteur cinétique responsable <strong>de</strong> l'évolution <strong>de</strong> cette vitesse au cours du temps. (1,5<br />
pt)<br />
4. On reprend la même étu<strong>de</strong> dans le même récipient à une température θ 1 > θ. Préciser, en<br />
justifiant la réponse, l'effet <strong>de</strong> l'élévation <strong>de</strong> la température sur :<br />
4.1 La vitesse <strong>de</strong> la réaction. (1 pt)<br />
4.2 La concentration du gaz O 2 , [O 2 ] ∞ , à la fin <strong>de</strong> la réaction. (1 pt)<br />
5. Déterminer la masse molaire moyenne du mélange gazeux dans l’enceinte à la date t = 50 min.<br />
(4 pts)<br />
Données : M(N) = 14,0.g.mol 1 ; M(O) = 16,0.g.mol 1<br />
Exercice II ( 8 points)<br />
Valeur énergétique d’un aliment<br />
Partie commune aux <strong>de</strong>ux programmes libanais et français<br />
Le métabolisme humain est aérobie : il consomme du dioxygène. L’organisme rejetant du dioxy<strong>de</strong> <strong>de</strong><br />
carbone CO 2(g) et <strong>de</strong> l’eau H 2 O (g) , on peut considérer que la transformation chimique <strong>de</strong>s aliments est<br />
modélisée par une combustion.<br />
1. Ecrire l’équation <strong>de</strong> la réaction <strong>de</strong> combustion <strong>de</strong> la Leucine, <strong>de</strong> formule brute C 6 H 13 O 2 N, un<br />
aci<strong>de</strong> aminé constituant <strong>de</strong>s protéines. On considère que la combustion libère aussi du diazote,<br />
N 2(g) . (2 pts)<br />
2/3