ÏÏ ÏÏ - Master 2 en Mécanique des fluides et Energétique
ÏÏ ÏÏ - Master 2 en Mécanique des fluides et Energétique
ÏÏ ÏÏ - Master 2 en Mécanique des fluides et Energétique
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
TD 1 UPMC<br />
<strong>Master</strong> « Energ<strong>et</strong>ique <strong>et</strong> Environnem<strong>en</strong>t »<br />
Mardi 15 novembre 2011<br />
1 – On considère une turbine à gaz aéronautique (TAG) représ<strong>en</strong>tée schématiquem<strong>en</strong>t ci<strong>des</strong>sous.<br />
Rappeler brièvem<strong>en</strong>t les élem<strong>en</strong>ts constitutifs de c<strong>et</strong>te TAG <strong>et</strong> préciser quelle est leur<br />
fonction. Préciser quelles sont les disciplines qui perm<strong>et</strong>t<strong>en</strong>t de simuler numériquem<strong>en</strong>t<br />
l’écoulem<strong>en</strong>t qui traverse les différ<strong>en</strong>tes parties d’un tel moteur.<br />
q c<br />
COMPREHENSION FINE DES ECOULEMENTS<br />
Aérodynamique Aérothermique Aérothermochimie<br />
q<br />
zp<br />
Thermodynamique Turbul<strong>en</strong>ce Combustion<br />
q a<br />
Étude <strong>des</strong> cycles<br />
thermodynamiques<br />
q contour<br />
ETUDES DES PERFORMANCES<br />
MOTEUR<br />
2 – Le cycle thermodynamique d’une TAG est composé de 4 phases (compression,<br />
combustion, dét<strong>en</strong>te <strong>et</strong> échappem<strong>en</strong>t). Donner une représ<strong>en</strong>tation du cycle thermodynamique<br />
théorique de Joule <strong>et</strong> du cycle réel de la TAG dans un plan [<strong>en</strong>tropie-<strong>en</strong>thalpie].<br />
3 – En vous appuyant sur le premier principe de la thermodynamique, déterminer la relation<br />
liant la pression, à la vitesse température lors de la phase de compression, supposée<br />
is<strong>en</strong>tropique, l’air qui traverse le compresseur étant supposé calorifiquem<strong>en</strong>t parfait.<br />
On considère la partie « chambre de combustion » dont un secteur est représ<strong>en</strong>té ci-<strong>des</strong>sus. La<br />
pression <strong>et</strong> la température <strong>en</strong> <strong>en</strong>trée du foyer sont déterminées par les conditions obt<strong>en</strong>ues <strong>en</strong><br />
sortie du compresseur. Comme on peut l’observer, le débit d’air se sépare <strong>en</strong> une partie qui<br />
alim<strong>en</strong>te le foyer <strong>et</strong> une autre partie qui passe dans le circuit de contournem<strong>en</strong>t. Une partie de<br />
ce débit d’air de contournem<strong>en</strong>t peut être év<strong>en</strong>tuellem<strong>en</strong>t utilisé pour refroidir les parois de la<br />
chambre <strong>et</strong> contribuer au brassage turbul<strong>en</strong>t au sein du foyer.<br />
4 – Montrer que les équations générales de l’Aérothermochimie qui régiss<strong>en</strong>t l’écoulem<strong>en</strong>t<br />
réactif dans la chambre de combustion peuv<strong>en</strong>t s’écrire sous la forme vectorielle, conservative<br />
suivante :<br />
∂ρφ<br />
∂ρU<br />
jφ<br />
( φ ) ( φ )<br />
+ = J<br />
j , j<br />
+ W (1)<br />
∂t<br />
∂x<br />
j<br />
Expliciter le vecteur <strong>des</strong> variables convectives φ , le vecteur relatif au transport moléculaire<br />
( )<br />
J φ<br />
j<br />
( )<br />
, <strong>en</strong>fin le vecteur <strong>des</strong> termes sources W φ .
5 – On suppose la chambre de combustion peut être assimilée à foyer homogène ouvert, muni<br />
d’une <strong>en</strong>trée <strong>et</strong> d’une sortie <strong>et</strong> pour lequel on suppose que, <strong>en</strong> régime établi, la pression<br />
demeure constante au cours du temps. Que devi<strong>en</strong>t l’équation (1) dans le cadre de ces<br />
hypothèses simplificatrices.<br />
On étudie le processus de combustion se développe dans l’intégralité du volume de la<br />
chambre de combustion. On suppose que les gaz frais injectés <strong>en</strong> <strong>en</strong>trée du foyer sont<br />
constitués d’un prémélange hydrocarbure-air à la richesseϕ<br />
=0. 8. Le coeffici<strong>en</strong>t de dilution<br />
D est supposé constant ( D = 3. 764 ). Par souci de simplicité, on considère que le processus<br />
de combustion est gouverné par un mécanisme réactionnel global représ<strong>en</strong>té sous la forme la<br />
plus simple par une seule étape réactionnelle irréversible :<br />
C<br />
H<br />
+ α O → β CO + H O (1)<br />
n m 2 2<br />
γ 2<br />
6 – Donner les expressions <strong>des</strong> coeffici<strong>en</strong>ts α , β , γ <strong>en</strong> fonction <strong>des</strong> deux <strong>en</strong>tiers m <strong>et</strong> n ,<br />
respectivem<strong>en</strong>t associés au nombre d’atomes d’hydrogène <strong>et</strong> de carbone constitutifs de<br />
l’hydrocarbure considéré. Le schéma réactionnel (1) vous parait-il a priori suffisant pour<br />
décrire la chimie complexe associée à la combustion d’un hydrocarbure dans l’air ?<br />
7 – Déterminer les fractions massiques <strong>des</strong> espèces chimiques mises <strong>en</strong> jeu, du coté <strong>des</strong> gaz<br />
frais, <strong>en</strong> fonction de la richesse ϕ <strong>et</strong> du coeffici<strong>en</strong>t de dilution D . Pour vous aider à répondre<br />
à c<strong>et</strong>te question, il vous est suggéré d’établir, puis de résoudre dans un second temps, le<br />
système d’équations suivant :<br />
Y<br />
Y<br />
C H<br />
n<br />
C H<br />
n<br />
m<br />
m<br />
− r<br />
+<br />
st<br />
ϕ Y<br />
O<br />
= 0<br />
( 1+<br />
D) Y = 1<br />
2<br />
O<br />
2<br />
où<br />
r<br />
st<br />
M<br />
CnH<br />
m<br />
= est le rapport stoechiométrique.<br />
α M<br />
O 2<br />
Réécrire la réaction (1) pour ces nouvelles conditions de mélange, sous stoechiométriques.<br />
Application numérique : Déterminer ces fractions massiques pour les valeurs<br />
proposéesϕ =0. 8, D = 3. 764 .<br />
8 – Déterminer la masse volumique ρ du mélange, toujours du coté <strong>des</strong> gaz frais, <strong>en</strong> fonction<br />
de la pression statique P (supposée constante dans tout le domaine) <strong>et</strong> de la température<br />
statiqueT (imposée coté gaz frais), lorsque l’on suppose que chaque constituant gazeux du<br />
mélange multi espèce obéit à la loi <strong>des</strong> gaz parfaits.<br />
Application numérique : Déterminer ρ lorsque<br />
P = 3bar<br />
<strong>et</strong> T ≈ 410 K .<br />
9 – Le débit d’air injecté Q &<br />
air<br />
(<strong>en</strong> kg/s) étant supposé connu, exprimer le débit de carburant<br />
Q & C n H m<br />
<strong>en</strong> fonction du débit d’air Q &<br />
air<br />
, de la richesse ϕ <strong>et</strong> du coeffici<strong>en</strong>t de dilution D . Donner<br />
égalem<strong>en</strong>t l’expression de la vitesse baryc<strong>en</strong>triqueU .<br />
Application numérique : Déterminer<br />
section d’<strong>en</strong>trée du conduit S = 0.<br />
0025 m<br />
Q & <strong>et</strong> U pour un débit d’air Q& air<br />
= 1kg / s <strong>et</strong> une<br />
C n H m<br />
2
10 – Pour les conditions fixées du coté <strong>des</strong> gaz frais, c'est-à-dire ϕ =0. 8 , calculer l’état<br />
thermochimique (fractions massique <strong>et</strong> température) du coté <strong>des</strong> gaz brûlés à l’équilibre<br />
chimique (correspondant à une situation de combustion complète).<br />
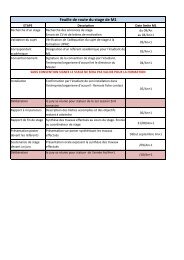
CONSTANTES :<br />
CALCUL DES COEFFICIENTS STOECHIOMETRIQUES<br />
Coeffici<strong>en</strong>t de dilution 3,764 coeffici<strong>en</strong>t O2<br />
15,5<br />
Constante gaz parfait 8,32 coeffici<strong>en</strong>t CO2<br />
10<br />
DONNEES COTE GAZ FRAIS<br />
Température (K) 410,621432<br />
DEFINITION DE L'HYDROCARBURE<br />
coeffici<strong>en</strong>t H2O<br />
11 Pression (Pa)<br />
3,00E+05<br />
Nombre atomes C : 10 CALCUL DU RAPPORT STOECHIOMETRIQUE<br />
Section (m2)<br />
0,0025<br />
Nombre atomes H : 22<br />
masse molaire CnHm 0,142<br />
Rapport stoechiométrique<br />
0,28629032<br />
masse molaire O2<br />
masse molaire N2<br />
masse molaire CO2<br />
masse molaire H2O<br />
0,032<br />
0,028<br />
0,044<br />
0,018<br />
DONNEES THERMODYNAMIQUES (Système GKS)<br />
Cp CnHm (gaz frais) J/mole/K<br />
Cp O2 (gaz frais) J/mole/K<br />
Cp N2 (gaz frais) J/mole/K<br />
Cp CO2 (gaz frais) J/mole/K<br />
Cp H2O (gaz frais) J/mole/K<br />
Enthalpie de formation CnHm J/mole<br />
Enthalpie de formation O2 J/mole<br />
Enthalpie de formation N2 J/mole<br />
272,3334602<br />
29,85594834<br />
29,10594092<br />
39,3396774<br />
33,98691107<br />
-249533,76<br />
0<br />
0<br />
Cp CnHm (gaz brûlés)<br />
J/mole/K<br />
Cp O2 (gaz brûlés) J/mole/K<br />
Cp N2 (gaz brûlés) J/mole/K<br />
Cp CO2 (gaz brûlés)<br />
J/mole/K<br />
Cp H2O (gaz brûlés)<br />
J/mole/K<br />
Enthalpie de formation CO2 J/mole<br />
Enthalpie de formation H2O J/mole<br />
Température de référ<strong>en</strong>ce<br />
K<br />
681,6032202<br />
38,92908201<br />
36,56735061<br />
61,48518898<br />
54,64224981<br />
-393550<br />
-241850<br />
298,15<br />
DONNEES THERMODYNAMIQUES (Converties système SI)<br />
Cp CnHm (gaz frais) J/kg/K 1917,841269 Cp CnHm (gaz brûlés) J/mole/K 4800,022677<br />
Cp O2 (gaz frais) J/kg/K 932,9983856 Cp O2 (gaz brûlés) J/mole/K 1216,533813<br />
Cp N2 (gaz frais) J/kg/K 1039,49789 Cp N2 (gaz brûlés) J/mole/K 1305,976808<br />
Cp CO2 (gaz frais) J/kg/K 894,0835773 Cp CO2 (gaz brûlés) J/mole/K 1397,390659<br />
Cp H2O (gaz frais) J/kg/K 1888,161726<br />
Cp H2O (gaz brûlés) J/mole/K 3035,680545<br />
Enthalpie de formation CnHm J/kg -249533,76<br />
Enthalpie de formation CO2 J/mole -8944318,182<br />
Enthalpie de formation O2 J/kg 0<br />
Enthalpie de formation H2O J/mole<br />
-13436111,11<br />
Enthalpie de formation N2 J/kg 0 Température de référ<strong>en</strong>ce K<br />
298,15<br />
ETAT THERMOCHIMIQUE DU COTE DES GAZ FRAIS<br />
Richesse 1,00<br />
Système linéaire<br />
A1 : Coeffici<strong>en</strong>t de CnHm<br />
B1 : Coeffici<strong>en</strong>t de O2<br />
G1 : Terme 2ième membre<br />
A2 : Coeffici<strong>en</strong>t de CnHm<br />
B2 : Coeffici<strong>en</strong>t de O2<br />
G2 : Terme 2ième membre<br />
Déterminant<br />
1,000<br />
FRACTIONS MASSIQUES<br />
-0,286 CnHm 0,056687894<br />
0,000 O2 0,198008419<br />
1,000 N2 0,745303687<br />
4,764 CO2 0<br />
1,000 H2O 0<br />
5,050 Somme : 1<br />
Débit massique d'air (kg/s) 1,00<br />
DEBIT (kg/s)<br />
débit CnHm 0,06009453<br />
RESULTATS GAZ FRAIS<br />
débit total 1,06009453 R_mel<br />
276,265287<br />
débit O2 0,20990764 ro mélange<br />
2,64E+00<br />
débit N2 0,79009236 Vitesse baryc<strong>en</strong>trique 1,60E+02<br />
ETAT THERMOCHIMIQUE DU COTE DES GAZ BRULES<br />
FRACTIONS MASSIQUES<br />
TEMPERATURE FINALE<br />
CnHm 0 Cp melange GF 1068,20153<br />
O2 0 Cp melange GB 1081,037<br />
N2 0,74530369 Contribution Enth Form GF -14145,5433<br />
CO2 0,17565263 Contribution Enth Form GB -2633132,72<br />
H2O 0,07904368 H melange GF 105996,612<br />
Somme : 1 T final<br />
2831,94795