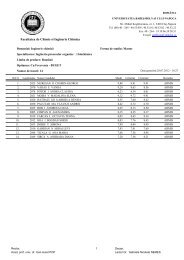
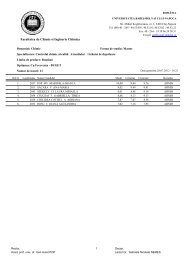
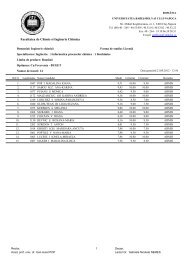
Synthèse et Analyse Structurale de Nouveaux Coronands ...
Synthèse et Analyse Structurale de Nouveaux Coronands ...
Synthèse et Analyse Structurale de Nouveaux Coronands ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Faculté <strong>de</strong>s Sciences Faculté <strong>de</strong> Chimie <strong>et</strong> Génie Chimique<br />
ROUEN CLUJ-NAPOCA<br />
Mirela BALOG<br />
<strong>Synthèse</strong> <strong>et</strong> <strong>Analyse</strong> <strong>Structurale</strong> <strong>de</strong> <strong>Nouveaux</strong><br />
<strong>Coronands</strong>, Cyclophanes <strong>et</strong> Composés<br />
1,3-Dioxaniques<br />
JURY<br />
Résumé <strong>de</strong> la thèse<br />
Pr. Pierre Krausz rapporteur Université <strong>de</strong> Limoges<br />
Pr. Ionel Mangalagiu rapporteur Université "I. A. Cuza" Iasi<br />
Pr. Ion Grosu Université "Babeş-Bolyai" Cluj-Napoca<br />
Pr. Gérard Plé Université <strong>de</strong> Rouen<br />
Dr. Yvan Ramon<strong>de</strong>nc Université <strong>de</strong> Rouen<br />
Pr. Sorin Mager Université "Babeş-Bolyai" Cluj-Napoca<br />
Soutenance le 25 Mars 2004
Je tiens à exprimer ma profon<strong>de</strong> gratitu<strong>de</strong> à Monsieur Pierre Krausz, Professeur<br />
à l’Université <strong>de</strong> Limoges, à Monsieur Ionel Mangalagiu, Professeur à l’Université « Ioan<br />
Alexandru Cuza » <strong>de</strong> Iasi, Monsieur Sorin Mager, Professeur à l’Université « Babes-<br />
Bolyai » <strong>de</strong> Cluj-Napoca <strong>et</strong> Madame Luminita Silaghi-Dumitrescu, Professeur à<br />
l’Université « Babes-Bolyai » <strong>de</strong> Cluj-Napoca, pour l’intérêt qu’ils ont porté à ce travail en<br />
acceptant <strong>de</strong> le juger.<br />
C<strong>et</strong>te thèse en co-tutelle a été réalisée a l’Université « Babes-Bolyai » <strong>de</strong> Cluj-<br />
Napoca, Faculté <strong>de</strong> Chimie <strong>et</strong> Génie Chimique, dans le Département <strong>de</strong> Chimie<br />
Organique <strong>et</strong> à l’Université <strong>de</strong> Rouen, Faculté <strong>de</strong>s Sciences, à l’IRCOF (Institut <strong>de</strong><br />
Recherche en Chimie Organique Fine), UMR 6014 du CNRS, au laboratoire « Fonctions<br />
Azotées <strong>et</strong> Oxygénées Complexes ». Je remercie monsieur le Professeur Guy<br />
Quéguiner, Directeur <strong>de</strong> l’UMR, pour m’avoir accueilli au sein <strong>de</strong> l’IRCOF.<br />
Je remercie la Région Haute Normandie, l’Ambassa<strong>de</strong> <strong>de</strong> France en Roumanie<br />
qui m’ont attribué <strong>de</strong>s bourses, le Service <strong>de</strong>s Relations Internationales en la personne <strong>de</strong><br />
Monsieur le Professeur Bernard Maitrot <strong>et</strong> Madame Mireille Corb<strong>et</strong> ainsi que l’Agence<br />
Universitaire <strong>de</strong> la Francophonie, pour l’ai<strong>de</strong> financière qu’ils m’ont accordé pour mes<br />
différents stages <strong>de</strong> recherche.<br />
Je remercie également Monsieur Ion Grosu, Professeur à l’Université « Babes-<br />
Bolyai », pour avoir encadré ce travail avec conviction, pour les encouragements, les<br />
conseils, pour la confiance qu’il m'a accordé ainsi que pour sa disponibilité.<br />
Je tiens également à remercier Monsieur Gérard Plé, Professeur à l’Université <strong>de</strong><br />
Rouen, pour m’avoir accueilli au sein <strong>de</strong> son équipe <strong>et</strong> permis <strong>de</strong> réaliser une partie<br />
importante <strong>de</strong> ce travail dans les meilleures conditions, pour ses conseils <strong>et</strong> pour les<br />
encouragements. Je remercie également Monsieur Yvan Ramon<strong>de</strong>nc, Maître <strong>de</strong><br />
Conférences à l’Université <strong>de</strong> Rouen, pour son ai<strong>de</strong>, son soutien, sa disponibilité <strong>et</strong> sa<br />
bonne humeur.<br />
Je tiens à remercier Monsieur Eric Condamine, Ingénieur <strong>de</strong> Recherche à<br />
l’IRCOF pour les analyses RMN plus délicates, Madame Corinne Loutelier-Bourhis,<br />
Maître <strong>de</strong> Conférences à l’Université <strong>de</strong> Rouen, Monsieur Albert Marcual, Maître <strong>de</strong><br />
Conférences à l’Université <strong>de</strong> Rouen, Madame Catherine Lange, Professeur à<br />
l’Université <strong>de</strong> Rouen, pour les analyses <strong>de</strong> masse, Madame Valérie Peulon-Agasse,<br />
Maître <strong>de</strong> Conférences à l’Université <strong>de</strong> Rouen, pour les analyses HPLC, ainsi que<br />
Monsieur Loïc Toup<strong>et</strong> <strong>de</strong> l’Université <strong>de</strong> Rennes <strong>et</strong> Monsieur Richard Attilla Varga,<br />
Docteur à l’Université « Babes-Bolyai », pour les analyses RX.<br />
Tous mes remerciements à Madame Marie-Clau<strong>de</strong> Brin<strong>de</strong>au pour sa gentillesse<br />
<strong>et</strong> ses encouragements <strong>et</strong> à Monsieur Jean-Pierre Machéré, Ingénieur <strong>de</strong> Recherche a<br />
l’Université <strong>de</strong> Rouen, pour sa disponibilité lors <strong>de</strong>s problèmes techniques.<br />
Enfin, un grand merci à tous mes amis <strong>de</strong>s <strong>de</strong>ux laboratoires (Rouen <strong>et</strong> Cluj-<br />
Napoca) pour leur soutien <strong>et</strong> leur amitié.
Introduction générale<br />
SOMMAIRE<br />
PREMIERE PARTIE :<br />
ETUDE DE LA STEREOCHIMIE DES COMPOSES 1,3-DIOXANIQUES-2,5-<br />
DISUBSTITUES – ATROPOISOMERES ET DETERMINATION DES<br />
ENTHALPIES LIBRES CONFORMATIONNELLES<br />
1. Bibliographie : Aspects généraux concernant la stéréochimie<br />
<strong>de</strong>s dérivés 1,3-dioxaniques substitués en positions 2 <strong>et</strong> 5<br />
1.1. Généralités<br />
1.2. Aspects thermodynamiques <strong>et</strong> cinétiques<br />
1.2.1. Enthalpies libres conformationnelles<br />
1.2.2. Energies d’activation pour l’inversion du cycle 1,3-dioxanique<br />
1.2.3. Composés 1,3-dioxaniques flexibles <strong>et</strong> anancomériques<br />
1.3. <strong>Analyse</strong> conformationnelle <strong>de</strong>s dérivés 2-aryl-1,3-dioxaniques<br />
2. Nos Résultats : <strong>Synthèse</strong> <strong>et</strong> stéréochimie <strong>de</strong> dérivés 1,3-dioxaniques :<br />
2.1. A partir <strong>de</strong> la 2,6-diacétylpyridine<br />
2.1.1. Introduction<br />
2.1.2. <strong>Synthèse</strong><br />
2.1.3. Aspects structuraux à l’état soli<strong>de</strong> <strong>et</strong> en solution<br />
2.1.4. Essais d’alkylation <strong>de</strong> l’atome d’azote du cycle pyridinique<br />
2.2. A partir <strong>de</strong> 5-aryl-2-furaldéhy<strong>de</strong>s<br />
2.2.1. <strong>Synthèse</strong><br />
2.2.2. Aspects stéréochimiques<br />
2.3. A partir du meso 2,4-pentanediol. Détermination <strong>de</strong>s valeurs<br />
<strong>de</strong>s enthalpies libres conformationnelles<br />
2.3.1. Introduction<br />
2.3.2. <strong>Synthèse</strong><br />
2.3.3. Aspects stéréochimiques<br />
2.3.4. Etu<strong>de</strong> par spectrométrie <strong>de</strong> masse<br />
3. Conclusion <strong>de</strong> la première partie<br />
4. Partie expérimentale<br />
4.1. Indications générales<br />
4.2. <strong>Synthèse</strong> <strong>de</strong>s composés 4-21<br />
4.3. Description <strong>de</strong>s composés 4-21<br />
Annexe I : Détails <strong>de</strong>s analyses par rayons X du composé 5<br />
Annexe II : Balayages combinés B/E = cste<br />
Annexe III : Liste <strong>de</strong>s produits<br />
Références<br />
1
DEUXIEME PARTIE :<br />
CONTRIBUTIONS DANS LE DOMAINE DE LA CHIMIE<br />
SUPRAMOLECULAIRE<br />
1. Bibliographie : Métho<strong>de</strong>s générales <strong>de</strong> synthèse <strong>de</strong>s<br />
composés macrocycliques<br />
1.1. Introduction<br />
1.2. Généralités<br />
1.3. Réactions template<br />
1.4. <strong>Synthèse</strong>s à partir <strong>de</strong> composés aminés<br />
1.4.1. Réactions avec <strong>de</strong>s dérivés halogénés<br />
1.4.1.1. Réactions <strong>de</strong>s monoamines<br />
1.4.1.2. Réactions <strong>de</strong>s diamines<br />
1.4.2. Réactions avec les dichlorures d’aci<strong>de</strong><br />
1.4.3. Réactions avec <strong>de</strong>s esters<br />
1.4.4. Réactions avec <strong>de</strong>s aldéhy<strong>de</strong>s<br />
1.4.4.1. Cas <strong>de</strong>s aldéhy<strong>de</strong>s aromatiques<br />
1.4.4.2. Cas <strong>de</strong>s aldéhy<strong>de</strong>s aliphatiques<br />
1.4.5. Réactions avec <strong>de</strong>s diols activés<br />
1.4.5.1. Réactions <strong>de</strong>s diamines primaires<br />
1.4.5.2. Réactions <strong>de</strong>s diamines secondaires<br />
1.5. <strong>Synthèse</strong>s à partir <strong>de</strong>s diphénols<br />
1.5.1. Réactions avec <strong>de</strong>s polyéthylèneglycols ditosylés<br />
1.5.2. Réactions avec <strong>de</strong>s dérivés halogénés<br />
1.6. <strong>Synthèse</strong>s à partir <strong>de</strong>s diols<br />
1.6.1. Réactions avec <strong>de</strong>s polyéthylèneglycols ditosylés<br />
1.6.2. Réactions avec <strong>de</strong>s dérivés halogénés<br />
1.6.3. Réactions avec <strong>de</strong>s dichlorures d’aci<strong>de</strong><br />
1.7. <strong>Synthèse</strong> <strong>de</strong> macrocycles comportant <strong>de</strong>s atomes <strong>de</strong> soufre<br />
1.8. Macrocyclisation par métathèse<br />
2. Nos Résultats : <strong>Synthèse</strong> <strong>et</strong> analyse structurale <strong>de</strong><br />
nouveaux composés macrocycliques à motif spiranique<br />
2.1. Introduction<br />
2.2. Considérations sur la stéréochimie <strong>de</strong>s composés spiraniques à<br />
cycle à six chaînons<br />
2.2.1. Composés monospiraniques à structure semi-flexible<br />
2.2.2. Monospiranes à structure anancomérique<br />
2.3. <strong>Synthèse</strong> <strong>de</strong> composés 1,3-dioxaniques à squel<strong>et</strong>te 2,4,8,10-tétraoxaspiro[5.5]undécane,<br />
précurseurs <strong>de</strong>s macrocycles<br />
2.4. <strong>Synthèse</strong> <strong>de</strong>s composés macrocycliques<br />
2
2.5. Aspects structuraux à l’état soli<strong>de</strong><br />
2.6. Aspects structuraux en solution<br />
2.7. Applications <strong>de</strong> la technique <strong>de</strong> l’électrospray: Etu<strong>de</strong> <strong>de</strong> la sélectivité <strong>de</strong><br />
complexation <strong>de</strong>s macrocycles, <strong>de</strong> la stabilité <strong>de</strong>s complexes <strong>et</strong> recherche<br />
d’espèces sandwich<br />
2.8 Essais <strong>de</strong> synthèse <strong>de</strong>s aza-oxa coronands à partir du spirane<br />
aminé 17<br />
2.9. Conclusions<br />
3. <strong>Synthèse</strong> <strong>et</strong> analyse structurale <strong>de</strong> nouveaux cyclophanes comportant<br />
<strong>de</strong>s cycles 1,3-dioxaniques. Premier “rocking chair” moléculaire.<br />
3.1. Introduction<br />
3.2. <strong>Synthèse</strong> <strong>et</strong> analyse structurale <strong>de</strong>s précurseurs<br />
[dérivés bis(1,3-dioxane-2-yl) benzénique]<br />
3.3. <strong>Synthèse</strong> <strong>de</strong>s cyclophanes<br />
3.4. <strong>Analyse</strong> structurale<br />
3.4.1. Structure du composé 30a. Rocking Chair moléculaire<br />
3.4.2. Méta <strong>et</strong> ortho cyclophanes<br />
3.5. Conclusions<br />
4. Conclusion <strong>de</strong> la <strong>de</strong>uxième partie<br />
5. Conclusion générale<br />
6. Partie expérimentale<br />
6.1. Protection <strong>de</strong>s hydroxyacétophénones<br />
6.2. <strong>Synthèse</strong> <strong>de</strong>s spiranes 10-11 <strong>et</strong> 14-15<br />
6.3. Hydrolyse <strong>de</strong>s esters 10-11<br />
6.4. <strong>Synthèse</strong> <strong>de</strong>s spiranes aminés 16 <strong>et</strong> 17<br />
6.5. Essais <strong>de</strong> synthèse d’isocyanates à partir du spirane aminé 17<br />
6.6. <strong>Synthèse</strong> <strong>de</strong>s dérivés ditosylés 26a-c, e<br />
6.7. <strong>Synthèse</strong> <strong>de</strong>s macrocycles 18-25<br />
6.8. <strong>Synthèse</strong> du diol 28<br />
6.9. <strong>Synthèse</strong> <strong>de</strong>s esters benzoylés 29<br />
6.10. Hydrolyse <strong>de</strong>s esters benzoylés 29<br />
6.11. <strong>Synthèse</strong> <strong>de</strong>s [7.7]cyclophanes (30a, 31a, 32a),<br />
[7.7.7]cyclophanes (31b, 32b) <strong>et</strong> [7.7.7.7]cyclophanes (31c, 32c)<br />
6.12. Description <strong>de</strong>s composés 10-25 <strong>et</strong> 27-32<br />
Annexe I : Détails <strong>de</strong>s analyses par rayons X <strong>de</strong>s composés 21a, 22a <strong>et</strong> 18b<br />
Annexe II : Détails <strong>de</strong>s analyses par rayons X <strong>de</strong>s composés 30a, 31a <strong>et</strong> 32a<br />
Annexe III : Liste <strong>de</strong>s produits<br />
Références<br />
3
INTRODUCTION GENERALE<br />
Ce travail est constitué <strong>de</strong> <strong>de</strong>ux parties bien distinctes, l’une concerne<br />
l’étu<strong>de</strong> <strong>de</strong> quelques aspects particuliers <strong>de</strong> la stéréochimie <strong>de</strong>s composés 1,3dioxaniques<br />
2-substitués <strong>et</strong> l’autre est focalisée sur l’élaboration, la synthèse <strong>et</strong><br />
l’analyse structurale <strong>de</strong> nouveaux composés macrocycliques (coronands à motifs<br />
spiraniques <strong>et</strong> cyclophanes possédant <strong>de</strong>s groupes 1,3-dioxaniques).<br />
Dans la première partie, nous nous sommes intéressés à l’étu<strong>de</strong><br />
stéréochimique <strong>de</strong> quelques dérivés 1,3-dioxaniques obtenus à partir du méso-<br />
2,4-pentanediol (I), <strong>de</strong> la 2,6-diacétylpyridine (II) <strong>et</strong> <strong>de</strong>s 5-aryl-2-furaldéhy<strong>de</strong>s (III).<br />
Y<br />
R 1<br />
2<br />
1<br />
R 2<br />
O<br />
O<br />
X<br />
3<br />
D 1<br />
6<br />
O<br />
4<br />
III<br />
5<br />
O<br />
R<br />
O<br />
O<br />
N<br />
II<br />
O<br />
O<br />
H +<br />
R 2<br />
I R D2 1<br />
R<br />
R<br />
O<br />
R<br />
L’intérêt <strong>de</strong>s composés (I) est qu’ils perm<strong>et</strong>tent <strong>de</strong> réaliser une étu<strong>de</strong> sur les<br />
préférences conformationnelles (∆G°) <strong>de</strong>s divers substituants en position 2 <strong>de</strong><br />
l’hétérocycle. C<strong>et</strong>te étu<strong>de</strong> est facilitée par la possibilité d’avoir pour les composés<br />
(I) <strong>de</strong>ux diastéréoisomères figés (D1 <strong>et</strong> D2) avec les groupements méthyles en<br />
positions 4 <strong>et</strong> 6 équatoriales <strong>et</strong> les groupements <strong>de</strong> la position 2 alternativement<br />
en orientation axiale <strong>et</strong> équatoriale. Les préférences conformationnelles (∆G°) sont<br />
déterminées par les rapports à l’équilibre entre les <strong>de</strong>ux diastéréoisomères <strong>de</strong>s<br />
composés cibles.<br />
4<br />
O<br />
O<br />
5<br />
4<br />
O<br />
6<br />
C<br />
3<br />
Y<br />
N<br />
2<br />
1<br />
C<br />
O<br />
X<br />
5<br />
4<br />
HO<br />
HO<br />
O<br />
1<br />
3<br />
2<br />
CHO
Les principaux aspects stéréochimiques étudiés dans le cas <strong>de</strong>s composés<br />
(II) <strong>et</strong> (III) sont liés à l’étu<strong>de</strong> <strong>de</strong> la préférence conformationnelle (axiale ou<br />
équatoriale) du groupement aromatique <strong>et</strong> <strong>de</strong> la détermination <strong>de</strong> la barrière <strong>de</strong><br />
rotation <strong>de</strong> ce cycle autour <strong>de</strong> ces liaisons avec les hétérocycles saturés.<br />
Dans la <strong>de</strong>uxième partie <strong>de</strong> ce travail, nous avons réalisé la synthèse <strong>et</strong><br />
l’analyse structurale d’une série <strong>de</strong> coronands (IV) à motif spiranique <strong>et</strong> d’une<br />
série <strong>de</strong> cyclophanes (V) incluant une partie acétalique provenant <strong>de</strong>s dérivés 1,3dioxaniques<br />
du 1,4-diacétylbenzène.<br />
Ces substrats présentent une pré-organisation qui favorise la<br />
macrocyclisation ; celle-ci nécessite l’utilisation comme template <strong>de</strong>s cations<br />
métalliques ou <strong>de</strong>s molécules organiques. Les coronands cibles (IV) sont<br />
intéressants car ils présentent <strong>de</strong>s cavités <strong>de</strong> taille <strong>et</strong> <strong>de</strong> géométrie différentes (par<br />
la modification <strong>de</strong>s valeurs n = 1-6 <strong>et</strong> m = 1-4). Ce sont <strong>de</strong>s récepteurs chiraux<br />
(due à la chiralité hélicoïdale du squel<strong>et</strong>te spiranique) <strong>et</strong> ils ont une capacité <strong>et</strong><br />
sélectivité <strong>de</strong> complexation remarquables.<br />
Les cyclophanes (V) présentent un intérêt particulier important du fait <strong>de</strong>s<br />
interactions entre les cycles aromatiques (π stacking) <strong>et</strong> au mouvement concerté<br />
(inversion en tan<strong>de</strong>m) <strong>de</strong>s cycles 1,3-dioxaniques.<br />
H3C<br />
O<br />
O O<br />
O CH3<br />
O (H2C H2C O) n<br />
m<br />
H 3C<br />
H 3C<br />
IV<br />
O<br />
O<br />
O<br />
O<br />
CH 3<br />
CH 3<br />
V<br />
CH 2 O<br />
CH 2<br />
O<br />
O<br />
C<br />
C O<br />
5<br />
H 3C<br />
O<br />
O O<br />
O CH 3<br />
OH OH<br />
H 3C<br />
H 3C<br />
C<br />
C<br />
O<br />
O
PREMIERE PARTIE<br />
2. Nos Résultats : <strong>Synthèse</strong> <strong>et</strong> stéréochimie <strong>de</strong> dérivés 1,3-dioxaniques :<br />
2.1. A partir <strong>de</strong> la 2,6-diacétylpyridine<br />
A la suite <strong>de</strong> nos étu<strong>de</strong>s sur la stéréochimie <strong>de</strong> composés 1,3-dioxaniques<br />
substitués en position 2 avec <strong>de</strong> groupes non-saturés 8 nous avons considéré<br />
intéressant d’étudier d’autres composés 2-aryl-1,3-dioxaniques qui peuvent<br />
présenter <strong>de</strong> la chiralité axiale <strong>et</strong> <strong>de</strong>s atropoisomères. 33,37 Nous avons choisi <strong>de</strong><br />
con<strong>de</strong>nser la 2,6-diacétylpyridine avec divers 1,3-propanediols. Dans ce cas,<br />
l’intérêt est double : dissymétrie du noyau aromatique déterminée par la présence<br />
<strong>de</strong> l’atome d’azote dans l’hétérocycle aromatique <strong>et</strong> l’empêchement <strong>de</strong> la rotation<br />
du cycle aromatique avec les cycles 1,3-dioxaniques. Cela conduit à la formation<br />
<strong>de</strong> plusieurs stéréoisomères (énantiomères <strong>et</strong> diastéréomères atropoisomères).<br />
2.1.2. <strong>Synthèse</strong><br />
Nous avons obtenu <strong>de</strong> nouveaux diacétals 1,3-dioxaniques par<br />
con<strong>de</strong>nsation <strong>de</strong> la 2,6-diacétylpyridine avec divers 1,3-propanediol-2,2disubstitués<br />
(Schéma 6). 33<br />
COCH3<br />
N<br />
COCH3<br />
+<br />
HO R<br />
HO<br />
R<br />
toluène,<br />
APTS<br />
reflux<br />
44 - 60%<br />
Schéma 6<br />
6<br />
O<br />
O<br />
R = CH3 4<br />
R = CH2Br 5<br />
R = COOCH2CH3 6<br />
Les réactions sont menées au reflux du toluène, dans les conditions <strong>de</strong> la<br />
distillation azéotropique <strong>de</strong> l’eau formée dans la réaction <strong>et</strong> en utilisant l’APTS<br />
comme catalyseur. Les nouveaux diacétals sont facilement isolés par<br />
cristallisation fractionnée dans un mélange <strong>de</strong> solvants (CH2Cl2 / MeOH). Les<br />
ren<strong>de</strong>ments se situent entre 44 - 60 %.<br />
Le composé 4 a été brièvement décrit dans la littérature 34 , étant isolé<br />
comme produit secondaire dans la mono protection <strong>de</strong>s groupes carbonyles <strong>de</strong> la<br />
2,6-diacétylpyridine.<br />
H3C<br />
N<br />
H3C<br />
O<br />
O<br />
R<br />
R<br />
R<br />
R
2.1.3. Aspects structuraux à l’état soli<strong>de</strong> <strong>et</strong> en solution<br />
Tous les composés synthétisés présentent <strong>de</strong>s structures anancomériques.<br />
Les équilibres conformationnels sont déplacés vers le conformère possédant le<br />
groupement aromatique en position axiale par rapport aux hétérocycles saturés<br />
(Schéma 7).<br />
H 3C<br />
O<br />
O<br />
N<br />
H 3C<br />
O<br />
O<br />
R<br />
R<br />
axiale, axiale<br />
R<br />
R<br />
H 3C<br />
H3C<br />
O<br />
O<br />
N<br />
O<br />
N<br />
H 3C<br />
CH 3<br />
O<br />
O<br />
O<br />
O<br />
équatoriale, axiale<br />
Schéma 7<br />
C<strong>et</strong>te préférence conformationnelle est suggérée par les différences<br />
d’enthalpie libre conformationnelle <strong>de</strong>s substituants méthyles <strong>et</strong> aromatiques dans<br />
la partie acétalique <strong>de</strong>s 1,3-dioxanes. Elle a été confirmée par les analyses<br />
effectuées à l’état soli<strong>de</strong> <strong>et</strong> en solution.<br />
Le diagramme ORTEP du composé 5 (Figure 5) montre l’orientation axiale<br />
du cycle aromatique par rapport aux <strong>de</strong>ux hétérocycles saturés. On observe que<br />
le cycle pyridinique est orthogonal par rapport aux <strong>de</strong>ux cycles 1,3-dioxaniques.<br />
Les groupements méthyles équatoriaux <strong>de</strong>s positions 2’ <strong>et</strong> 2’’ ont une orientation<br />
antiparallèle.<br />
Les distances interatomiques, les angles <strong>de</strong> liaisons ont <strong>de</strong>s valeurs<br />
normales <strong>et</strong> les valeurs <strong>de</strong>s angles <strong>de</strong> torsion confirment la conformation chaise<br />
<strong>de</strong>s <strong>de</strong>ux cycles 1,3-dioxaniques. 1<br />
7<br />
R<br />
O<br />
R<br />
R<br />
R<br />
R<br />
R<br />
R<br />
R<br />
axiale, équatoriale<br />
H 3C<br />
O<br />
N<br />
O<br />
CH3<br />
R<br />
O<br />
O<br />
R<br />
R<br />
R<br />
équatoriale, équatoriale
Figure 5. Diagramme ORTEP du composé 5.<br />
La structure anancomérique en solution est justifiée par les spectres RMN<br />
qui présentent <strong>de</strong>s signaux distincts pour les protons axiaux <strong>et</strong> équatoriaux <strong>de</strong>s<br />
cycles 1,3-dioxaniques <strong>et</strong> pour les protons <strong>et</strong> les atomes <strong>de</strong> carbone <strong>de</strong>s<br />
groupements axiaux <strong>et</strong> équatoriaux dans les positions 5’ <strong>et</strong> 5 ’’ <strong>de</strong>s cycles<br />
dioxaniques.<br />
Dans le cas <strong>de</strong> l’empêchement à la rotation <strong>de</strong>s cycles 1,3-dioxaniques<br />
autour <strong>de</strong>s liaisons avec le cycle pyridinique, ces liaisons <strong>de</strong>viennent <strong>de</strong>s axes <strong>de</strong><br />
chiralité (C 2 -C 2’ ; C 6 -C 2” Figure 7). Les diverses configurations <strong>de</strong>s <strong>de</strong>ux axes <strong>de</strong><br />
chiralité déterminent la présence <strong>de</strong> <strong>de</strong>ux diastéréoisomères. Un pour lequel les<br />
<strong>de</strong>ux axes ont la même configuration aRaR, aSaS (isomère like) <strong>et</strong> l’autre pour<br />
lequel les axes ont <strong>de</strong>s configurations différentes aRaS (isomère unlike).<br />
R<br />
R<br />
6" 1" 5 3 1' 6'<br />
BrH2C O<br />
O CH<br />
6 2<br />
2Br<br />
5" 2" 2' 5'<br />
N<br />
BrH2C O CH 1 O CH<br />
3 H 2Br<br />
4"<br />
3C<br />
3"<br />
3' 4'<br />
O<br />
O<br />
2"<br />
CH3<br />
6<br />
N<br />
2<br />
2'<br />
CH3<br />
O<br />
O<br />
R<br />
4<br />
R<br />
aRaR<br />
aRaS<br />
Figure 7. Les structures <strong>de</strong>s diastéréoisomères like (aRaR) <strong>et</strong> unlike (aRaS).<br />
8<br />
R<br />
R<br />
O<br />
O<br />
R<br />
5<br />
2"<br />
CH3<br />
6<br />
R<br />
N<br />
2<br />
O<br />
CH3<br />
2'<br />
O
Les spectres RMN enregistrés à température ambiante présentent une<br />
seule série <strong>de</strong> signaux ce qui prouve qu’à c<strong>et</strong>te température la rotation <strong>de</strong>s cycles<br />
1,3-dioxaniques autour <strong>de</strong> ces liaisons avec le noyau aromatique est pratiquement<br />
libre. Du fait <strong>de</strong> c<strong>et</strong>te libre rotation, les positions 4 <strong>et</strong> 6 sont rendues isochrones du<br />
point <strong>de</strong> vue <strong>de</strong> la RMN (ambiances magnétiques moyennes équivalentes). Pour<br />
observer l’empêchement <strong>de</strong> la rotation <strong>de</strong>s cycles 1,3-dioxaniques, nous avons<br />
effectué <strong>de</strong>s spectres à température variable.<br />
A basse température, les spectres RMN 1 H seront vraisemblablement très<br />
compliqués. L’allure complexe <strong>de</strong>s spectres pourrait être déterminée par la<br />
diastéréotopicité <strong>de</strong>s positions 4 <strong>et</strong> 6 <strong>et</strong> par l’apparition <strong>de</strong>s isomères like <strong>et</strong> unlike.<br />
Une analyse détaillée <strong>de</strong>s spectres enregistrés à température variable,<br />
nous a permis d’observer la coalescence <strong>de</strong>s signaux appartenant aux cycles 1,3dioxaniques<br />
dans l’intervalle 253 – 233 K. Dans la structure figée (à une<br />
température inférieure à 233 K) les différents diastéréoisomères <strong>et</strong> les protons<br />
diastéréotopiques présentent <strong>de</strong>s signaux superposés <strong>et</strong> ainsi leur discrimination<br />
n’est pas possible.<br />
C<strong>et</strong>te situation particulière est due probablement aux faibles modifications<br />
d’ambiance magnétique dans les possibles isomères <strong>et</strong> au niveau <strong>de</strong>s protons<br />
diastéréotopiques.<br />
2.3. A partir du méso 2,4-pentanediol. Détermination <strong>de</strong>s valeurs <strong>de</strong>s<br />
enthalpies libres conformationnelles.<br />
2.3.2. <strong>Synthèse</strong><br />
Une nouvelle série <strong>de</strong> composés 1,3-dioxaniques substitués en positions 2,<br />
4 <strong>et</strong> 6 a été obtenue par la réaction d’acétalisation du méso-2,4-pentanediol<br />
(2R4S) avec divers aldéhy<strong>de</strong>s <strong>et</strong> cétones (Schéma 13). 42<br />
La réaction conduit à <strong>de</strong>s mélanges <strong>de</strong> diastéréoisomères (D1 <strong>et</strong> D2). Pour<br />
toutes les synthèses, nous avons séparé le mélange <strong>de</strong> diastéréoisomères <strong>de</strong> la<br />
masse réactionnelle soit par distillation à pression réduite soit par cristallisation<br />
fractionnée. Nous avons caractérisé les composés comme mélange d’isomères<br />
par RMN <strong>et</strong> spectrométrie <strong>de</strong> masse (GC-MS).<br />
9
R 2<br />
R 1<br />
O<br />
HO<br />
+<br />
HO<br />
benzène,<br />
APTS<br />
reflux<br />
63-80 %<br />
R 1<br />
R 2<br />
2<br />
10<br />
1<br />
O<br />
O<br />
3<br />
4<br />
D1<br />
6<br />
5<br />
+<br />
R 1<br />
R2<br />
O<br />
O<br />
Composé R 1<br />
R 2<br />
12 H -CH=CH-CH3<br />
13 H -CH=CH-C6H5<br />
14 CH3 CH2CH3<br />
15 CH3 CH2C6H5<br />
16 CH3 CH2OCH3<br />
17 CH3 CH2Cl<br />
18 CH3 CHCl2<br />
19 CH3 CH2COOC2H5<br />
20 C2H5 C6H5<br />
21 C6H5 CH2Br<br />
2.3.3. Aspects stéréochimiques<br />
Schéma 13<br />
Dans le diastéréoisomère D1, les groupes méthyles en positions 4 <strong>et</strong> 6<br />
présentent une orientation cis par rapport au substituant prioritaire <strong>de</strong> la position 2<br />
(R 2 ). Par contre, dans l’autre diastéréoisomère l’orientation <strong>de</strong>s groupes<br />
considérés est en trans.<br />
Les composés 12-21 ont <strong>de</strong>s structures anancomériques. Les groupes<br />
méthyles en positions 4 <strong>et</strong> 6 sont <strong>de</strong>s holding groups efficaces (AMe = 2.90<br />
kcal/mol). 10 Pour les composés étudiés, il y a <strong>de</strong>ux situations distinctes. Les<br />
composés 14-17 <strong>et</strong> 19 présentent les <strong>de</strong>ux diastéréoisomères dans <strong>de</strong>s<br />
proportions importantes alors que pour les autres composés (12, 13, 18, 20, 21)<br />
un <strong>de</strong>s isomères est n<strong>et</strong>tement majoritaire.<br />
Dans le premier cas, les spectres RMN présentent <strong>de</strong>ux séries <strong>de</strong> signaux<br />
qui peuvent être attribués aux <strong>de</strong>ux diastéréoisomères. Habituellement, pour les<br />
mêmes substituants en position axiale ou en position équatoriale en position 2 du<br />
cycle 1,3-dioxanique, les protons du groupe axial sont plus déblindés que les<br />
protons similaires du groupe équatorial. C<strong>et</strong>te différence perm<strong>et</strong> d’i<strong>de</strong>ntifier les<br />
diastéréoisomères D1 <strong>et</strong> D2. Dans le cas <strong>de</strong>s composés 15 <strong>et</strong> 17, nous avons<br />
enregistré <strong>de</strong>s spectres ROESY <strong>et</strong> NOEDiff. Ces spectres montrent <strong>de</strong> fortes<br />
interactions entre les protons <strong>de</strong>s groupes axiaux <strong>de</strong>s positions 2, 4 <strong>et</strong> 6.<br />
D2
La détermination exacte du rapport <strong>de</strong>s isomères a été réalisée par GC <strong>et</strong><br />
GC-MS. En utilisant les relations 1 <strong>et</strong> 2, du rapport <strong>de</strong>s diastéréoisomères, nous<br />
avons calculé les valeurs <strong>de</strong>s enthalpies libres conformationnels pour les<br />
équilibres conformationnels impliquant les composés 12-17 <strong>et</strong> 19-21 (Tableau 8).<br />
x II<br />
K = (1)<br />
x<br />
1<br />
AR = ∆G o = -RTlnK (2)<br />
Tableau 8. Données thermodynamiques pour les composés 12-17 <strong>et</strong> 19-21<br />
Composé R 1<br />
R 2 D2 (%) D1 (%) K = D2/D1 ∆G o<br />
(kcal/mol)<br />
12 H -CH=CH-CH3 7.0 93.0 0.075 1.80<br />
13 H -CH=CH-C6H5 3.8 96.2 0.039 2.25<br />
14 CH3 C2H5 39.2 60.8 0.640 0.31<br />
15 CH3 CH2C6H5 46.0 54.0 0.850 0.11<br />
16 CH3 CH2OCH3 53.1 46.9 1.130 -0.085<br />
17 CH3 CH2Cl 54.8 45.2 1.210 -0.13<br />
19 CH3 CH2COOC2H5 62.0 38.0 1.630 -0.34<br />
20 C2H5 C6H5 96.3 3.7 26.02 -2.30<br />
21 C6H5 CH2Br 4.2 95.8 0.044 2.18<br />
Pour le composé 15, nous avons réussi à séparer l’isomère D1 <strong>et</strong> nous<br />
l’avons soumis à une équilibration diastéréomérique en catalyse aci<strong>de</strong> (APTS). A<br />
l’équilibre, nous avons déterminé (par GC–MS) un rapport <strong>de</strong> diastéréoisomères<br />
(D2 / D1 = 0.90) proche <strong>de</strong> celui trouvé dans la synthèse du mélange d’isomères.<br />
Pour le composé 14, une étu<strong>de</strong> sur l’équilibre <strong>de</strong>s diastéréoisomères D1 <strong>et</strong> D2 a<br />
été réalisée par <strong>de</strong>s techniques calorimétriques <strong>et</strong> les résultats (détermination <strong>de</strong>s<br />
enthalpie libres conformationnelles) ont été publiés dans la littérature. 43 La valeur<br />
trouvée (∆G = 0.35 kcal/mol) est proche du résultat que nous avons obtenu (∆G =<br />
0.31 kcal/mol).<br />
2.3.4. Etu<strong>de</strong> par spectrométrie <strong>de</strong> masse<br />
L’analyse <strong>de</strong>s diastéréoisomères <strong>de</strong>s composés 14-17 <strong>et</strong> 19 par<br />
spectrométrie <strong>de</strong> masse a conduit à une observation inattendue. Il est connu que<br />
la spectrométrie <strong>de</strong> masse est une métho<strong>de</strong> d’analyse qui généralement ne peut<br />
pas être utilisée pour différencier les stéréoisomères. L’étu<strong>de</strong> <strong>de</strong>s données <strong>de</strong> la<br />
littérature montre qu’en utilisant <strong>de</strong>s techniques spéciales en CI-MS (l’isobutane<br />
est considéré comme le meilleur gaz pour réaliser l’ionisation) <strong>et</strong> dans le cas <strong>de</strong><br />
11
quelques substrats particuliers, les stéréoisomères présentent <strong>de</strong>s spectres<br />
différents.<br />
Des étu<strong>de</strong>s CI-MS ont donc été réalisées pour différencier les<br />
diastéréoisomères <strong>de</strong>s diols cycliques (cyclopentanediol, 44,45 cyclohexanediol, 46,47<br />
dihydroxyprotoadamantane 48 ), <strong>de</strong> quelques esters méthoxyalkylcarboxyliques, 49<br />
ou <strong>de</strong>s isomères cis <strong>et</strong> trans <strong>de</strong>s dérivés <strong>de</strong> 1,3-oxathiane. 50,51 Des exemples <strong>de</strong><br />
discrimination <strong>de</strong>s énantiomères (via la formation <strong>de</strong>s diastéréoisomères like <strong>et</strong><br />
unlike) ont été aussi rencontrés dans la littérature. 52,53 Les spectres CI-MS <strong>de</strong><br />
<strong>de</strong>ux (ou plusieurs) diastéréoisomères présentent les mêmes pics ; les seules<br />
différences observées sont au niveau <strong>de</strong>s intensités relatives <strong>de</strong>s pics.<br />
Dans un nombre encore plus réduit <strong>de</strong> cas, 48,54 <strong>de</strong>s différences entre les<br />
spectres EI-MS <strong>de</strong>s diastéréoisomères, ont été observées. Dans ces exemples,<br />
comme précé<strong>de</strong>mment, l’allure <strong>de</strong>s spectres est la même <strong>et</strong> les différences entre<br />
les spectres apparaissent seulement au niveau <strong>de</strong>s intensités <strong>de</strong>s signaux.<br />
Les spectres EI-MS <strong>de</strong>s diastéréoisomères D1 <strong>et</strong> D2 <strong>de</strong>s composés 14-17 <strong>et</strong><br />
19 montrent <strong>de</strong>s différences importantes 55 . Ces différences se situent au niveau<br />
<strong>de</strong>s intensités <strong>de</strong>s pics, mais aussi au niveau <strong>de</strong> la nature <strong>de</strong>s pics qui se<br />
r<strong>et</strong>rouvent dans les spectres <strong>de</strong>s <strong>de</strong>ux isomères.<br />
Les spectres CI-MS (le méthane a été utilisé pour faire l’ionisation) ont été<br />
obtenus seulement pour les composés 14, 15 <strong>et</strong> 19. D’une façon surprenante, les<br />
différences observées entre les spectres <strong>de</strong>s diastéréoisomères sont beaucoup<br />
plus faibles dans ce cas <strong>et</strong> se situent seulement au niveau <strong>de</strong>s intensités <strong>de</strong>s pics.<br />
A titre d’exemple, nous présenterons les spectres EI-MS <strong>de</strong>s isomères du<br />
composé 17 D2 (r-2-chlorométhyl-2,t-4,t-6-triméthyl-1,3-dioxane, Figure 11) <strong>et</strong> D1<br />
(r-2-chlorométhyl-2,c-4,c-6-triméthyl-1,3-dioxane, Figure 12). Les composés 14,<br />
15, 17 <strong>et</strong> 19 ont été analysés par GC/EI-MS basse résolution sur un spectromètre<br />
magnétique (EBE, avec E = secteur électrique <strong>et</strong> B=secteur magnétique).<br />
H3C<br />
Figure 11. Spectre EI-MS du diastéréoisomère D2 du composé 17<br />
12<br />
O<br />
O<br />
CH2Cl
ClH2C<br />
Figure 12. Spectre EI-MS du diastéréoisomère D1 du composé 17<br />
Les spectres <strong>de</strong> masse EI <strong>de</strong> ces dioxanes montrent <strong>de</strong>s ions fragments<br />
source caractéristiques dont les intensités relatives varient en fonction <strong>de</strong> la nature<br />
<strong>de</strong>s isomères D1 <strong>et</strong> D2 (Tableau 10). Notons qu’aucun ion radical moléculaire n’a<br />
été détecté sur les spectres EI. L’interprétation <strong>de</strong> ces spectres <strong>de</strong> masse conduit<br />
à un schéma général <strong>de</strong> fragmentations source pour ces isomères (Schéma 15).<br />
Tableau 10. Les abondances relatives <strong>de</strong>s différents ions en EI-MS pour les<br />
composés 14, 15, 17 <strong>et</strong> 19<br />
Abondances relatives <strong>de</strong>s ions détectés par GC-MS<br />
14 17 19 15<br />
R1 Et CH2Cl CH2CO2Et CH2-C6H5<br />
05:05 05:13 07:03 07:21 10:01 10:21 12:18 12:46<br />
Ion m/z Ar%<br />
69 100 100 100 100 68 100 98 84<br />
M-101 Nd Nd 1 19 3 48 5 0,6<br />
M-85 97 65 11 12 17 23 9 6<br />
87 12 34 30 16 24 17 30 30<br />
M-57 10 0,4 0,8 9 Nd Nd Nd Nd<br />
129 24 88 97 31 100 37 100 100<br />
M-15 71 3 0,2 45 0,8 51 8 0,4<br />
13<br />
CH 3<br />
O<br />
O
CO<br />
R<br />
M + - 85<br />
R<br />
R O CH CH3<br />
O<br />
O<br />
M + -15<br />
O<br />
O<br />
M + - 57<br />
a<br />
O<br />
CH3<br />
CH3<br />
R C O<br />
M + -101<br />
H3C<br />
R<br />
Schéma 15<br />
* L’ion à m/z 59 n’a pas été observé car la gamme <strong>de</strong> masse utilisée est <strong>de</strong> .<br />
14<br />
O<br />
O<br />
M<br />
R<br />
CO<br />
b<br />
H3C<br />
H3C<br />
O<br />
O<br />
CH3 O CH CH3<br />
O<br />
O<br />
87<br />
129<br />
O<br />
59 43<br />
CH3<br />
CH3 C O
On observe la préférence, pour la fragmentation, du départ <strong>de</strong>s substituants<br />
en position 2 <strong>et</strong> la formation <strong>de</strong>s ions M + -15 <strong>et</strong> 129. Ces ions subissent <strong>de</strong>s<br />
fragmentations rétro Diels-Al<strong>de</strong>r qui génèrent les ions M + -57 <strong>et</strong> 87. Ces ions se<br />
stabilisent par la perte d’une molécule <strong>de</strong> monoxy<strong>de</strong> <strong>de</strong> carbone ou d’une<br />
molécule d’acétaldéhy<strong>de</strong> <strong>et</strong> donnent les ions M + -85 <strong>et</strong> M + -101.<br />
Il est dès lors nécessaire d’apporter <strong>de</strong>s preuves validant ces voies <strong>de</strong><br />
fragmentation. Ceci a été réalisé par:<br />
- la détermination <strong>de</strong>s formules brutes <strong>de</strong>s ions par mesure <strong>de</strong>s masses<br />
exactes en HR-MS,<br />
- l’analyse structurale <strong>de</strong>s ions fragments au moyen <strong>de</strong>s spectres d’ions<br />
produits obtenus par balayages combinés B/E = cste après sélection d’un<br />
ion précurseur.<br />
L’ensemble <strong>de</strong>s résultats obtenus pour les 4 molécules, soit 8 isomères<br />
séparés par GC <strong>et</strong> analysés par spectrométrie <strong>de</strong> masse haute résolution (HR-<br />
MS), est porté dans le tableau 11. Les masses exactes calculées <strong>de</strong>s ions ainsi<br />
que les masses exactes mesurées sont reportées. Les mesures <strong>de</strong> masse exacte<br />
sont validées lorsque les écarts entre la masse calculée <strong>et</strong> la masse mesurée ne<br />
dépassent pas 10 ppm ou 3 mDa.<br />
En plus <strong>de</strong>s résultats présentés dans le tableau 11, nous avons analysé par HR-<br />
MS les ions suivants:<br />
- C7H12O2 37 Cl = 165.0494 pour l’isomère 1 <strong>et</strong> 165.0495 pour l’isomère 2, la<br />
masse théorique étant <strong>de</strong> 165.0496 (composé 17)<br />
- C7H7 = 91.0556 pour l’isomère 1 <strong>et</strong> 91.0551 pour l’isomère 2, la masse<br />
théorique étant <strong>de</strong> 91.00548 (composé 15)<br />
L’ensemble <strong>de</strong> ces mesures vali<strong>de</strong>nt les formules brutes <strong>de</strong> tous les ions<br />
fragments proposés.<br />
Les spectres d’ions produits ont été enregistrés sur les ions fragments<br />
uniquement, puisque, comme nous l’avons déjà indiqué, aucun ion moléculaire n’a<br />
été présent sur les spectres EI (même en diminuant l’énergie <strong>de</strong>s électrons vers<br />
20 eV).<br />
Ainsi, ces expériences réalisées sur les ions M-15 (m/z 143, 163, 201 <strong>et</strong> 205), m/z<br />
129, M-57 (m/z 121 <strong>et</strong> 101) <strong>et</strong> m/z 87 ont démontré les filiations suivantes :<br />
- M-15 -> M-57 -> M-85 <strong>et</strong> M-101<br />
- 129 -> 87 -> 43<br />
L’ensemble <strong>de</strong>s expériences , HRMS <strong>et</strong> balayages combinés B/E = cste,<br />
ont permis <strong>de</strong> vali<strong>de</strong>r le schéma <strong>de</strong> fragmentation proposé pour ces dioxanes.<br />
L’analyse comparative <strong>de</strong>s spectres <strong>de</strong>s diastéréoisomères <strong>de</strong>s composés<br />
14, 15, 17 <strong>et</strong> 19 nous perm<strong>et</strong> <strong>de</strong> conclure que, pour les groupements en position 2<br />
15
du cycle 1,3-dioxanique, il y a, sous EI-MS, un départ préférentiel du groupement<br />
en position axiale. C<strong>et</strong>te fragmentation préférentielle détermine <strong>de</strong>s différences<br />
notables pour les spectres <strong>de</strong>s diastéréoisomères étudiés.<br />
Tableau 11. Détermination* <strong>de</strong> masses exactes <strong>et</strong> formules brutes par mesure<br />
HR-MS.<br />
Composé<br />
14<br />
17<br />
19<br />
15<br />
Ion étudié Masse<br />
exacte<br />
théorique<br />
M-15<br />
129<br />
M-57<br />
87<br />
M-85<br />
M-101<br />
M-15<br />
129<br />
M-57<br />
87<br />
M-85<br />
M-101<br />
M-15<br />
129<br />
M-57<br />
87<br />
M-85<br />
M-101<br />
M-15<br />
129<br />
M-57<br />
87<br />
M-85<br />
M-101<br />
143<br />
129<br />
101<br />
87<br />
73<br />
57<br />
163<br />
129<br />
121<br />
87<br />
93<br />
77<br />
201<br />
129<br />
159<br />
87<br />
131<br />
115<br />
205<br />
129<br />
163<br />
87<br />
135<br />
119<br />
143.1072<br />
129.0915<br />
101.0603<br />
87.0446<br />
73.0653<br />
163.0526<br />
129.0915<br />
121.0056<br />
87.0446<br />
93.0107<br />
76.9794<br />
201.1127<br />
129.0915<br />
159.0657<br />
87.0446<br />
131.0708<br />
115.0395<br />
205.1229<br />
129.0915<br />
163.0759<br />
87.0446<br />
135.0810<br />
119.0497<br />
Masse exacte<br />
expérimentale<br />
Isomère 1/ Isomère<br />
2<br />
143.1069 / 143.1075<br />
129.0918 / 129.0913<br />
101.0606 / 101.0604<br />
87.0447 / 87.0448<br />
73.0650 / 73.0648<br />
Nd / Nd<br />
163.0525 / 163.0524<br />
129.0914 / 129.0920<br />
Nd / 121.0051<br />
87.0445 / 87.0452<br />
- / 93.0114<br />
76.9789 / 76.9790<br />
201.1125 / 201.1126<br />
129.0914 / 129.0918<br />
Nd / Nd<br />
87.0447 / 87.0449<br />
131.0712/ 131.0720<br />
115.0395 / 115.0401<br />
205.1234 / 205.1220<br />
129.0916 / 129.0912<br />
Nd / Nd<br />
87.0445 / 87.0440<br />
135.0809 / 135.0814<br />
119.0509 / Nd<br />
16<br />
ppm Formule<br />
brute<br />
2.2 / 2.1<br />
2.3 / 2.1<br />
3.9 / 1.2<br />
1.4 / 1.8<br />
4.1 / 7.6<br />
-<br />
0.3 / 1.0<br />
1.4 / 3.6<br />
- / 4.0<br />
0.8 / 7.0<br />
-/ 7.5<br />
7.2 / 5.4<br />
1.1 / 0.2<br />
1.2 / 2.3<br />
Nd<br />
2.0 / 6.9<br />
3.4 / 9.4<br />
0.1 / 5.5<br />
3.1 / 4.3<br />
0.7 / 2.5<br />
Nd<br />
1.4 / 6.9<br />
0.5 / 3.4<br />
10.1 / -<br />
C8H15O2<br />
C7H13O2<br />
C5H9O2<br />
C4H7O2<br />
C4H9O<br />
C7H12O2 35 C<br />
l<br />
C7H13O2<br />
C4H6O2 35 Cl<br />
C4H7O2<br />
C3H6O 35 Cl<br />
C2H2 O 35 Cl<br />
C10H17O4<br />
C7H13O2<br />
-<br />
C4H7O2<br />
C6H11O3<br />
C5H7O3<br />
C13H17O2<br />
C7H13O2<br />
-<br />
C4H7O2<br />
C9H11O<br />
C8H7O<br />
*les mesures ont été effectuées au minimum 5 fois pour chaque signal.<br />
Nd : signal non détecté sur le spectre d’ions source (haute, voire basse<br />
résolution);
3. Conclusions <strong>de</strong> la première partie<br />
Nous avons analysé, par RMN, rayons X, GC-MS <strong>et</strong> GC, 16 nouveaux<br />
composés en série 1,3-dioxanique. Notre étu<strong>de</strong> a mis en évi<strong>de</strong>nce la structure<br />
anancomérique <strong>de</strong>s composés <strong>et</strong> la préférence conformationnelle <strong>de</strong> divers<br />
substituants aromatiques ou aliphatiques.<br />
Les barrières d’énergie d’isomérisation très faible <strong>et</strong> la similitu<strong>de</strong> <strong>de</strong>s<br />
propriétés <strong>de</strong>s diastéréoisomères ont rendu impossible la différenciation <strong>de</strong>s<br />
atropoisomères par analyse RMN à basse température.<br />
Les expériences EI-MS ont montré <strong>de</strong>s différences importantes entre les<br />
spectres <strong>de</strong>s divers diastéréoisomères 1,3-dioxaniques. Nous avons observé que<br />
la fragmentation en α <strong>de</strong>s dérivés 2,2-disubstitués <strong>de</strong> 1,3-dioxanes étudiés se<br />
réalise préférentiellement avec le clivage du groupement axial.<br />
17
DEUXIEME PARTIE<br />
2.4. <strong>Synthèse</strong> <strong>de</strong>s composés macrocycliques<br />
La stéréochimie particulière <strong>de</strong>s composés spiraniques 151,152,156,157 justifie la<br />
présence du motif spiranique dans la synthèse <strong>de</strong>s macrocycles. Les dérivés<br />
spiraniques 1,3-dioxaniques à squel<strong>et</strong>te 2,4,8,10-tétraoxa-spiro[5.5]undécane<br />
substitués par <strong>de</strong>s groupements phénoliques, par leur structure <strong>et</strong> fonctionnalité,<br />
ont été considérés comme <strong>de</strong>s substrats versatiles pour la synthèse <strong>de</strong>s nouveaux<br />
dérivés macrocycliques <strong>de</strong> la classe <strong>de</strong>s coronands. 66,164<br />
Nous avons obtenu <strong>de</strong> nouveaux macrocycles à motif spiranique par<br />
réaction <strong>de</strong> macrocyclisation <strong>de</strong>s spiranes 12 <strong>et</strong> 13 avec divers<br />
polyéthylèneglycols ditosylés (Schéma 10). 164 Les réactions se sont déroulées<br />
avec <strong>de</strong> bons ren<strong>de</strong>ments (27-61 %, Tableau 3) en utilisant Cs2CO3 comme base<br />
<strong>et</strong> template dans l’acétonitrile comme solvant.<br />
H3C O O CH3 O<br />
OH OH<br />
méta (12), para (13)<br />
Schéma 10<br />
Tableau 3. Résultats <strong>de</strong>s synthèses <strong>de</strong>s macrocycles 18-25<br />
Composé n Isomère Rdt. %<br />
global*<br />
O<br />
TsO(CH2CH2O)nTs<br />
Cs2CO3, CH3CN<br />
n = 2-6<br />
18<br />
H3C O O CH3<br />
(O CH2 CH2)n O<br />
m<br />
para: n=2, m=2,3,4 18b, 18c, 18d<br />
n=3, m=2 19b<br />
n=4, m=1,2,3,4 20a, 20b, 20c, 20d<br />
n=5, m=1,2,3,4 21a, 21b, 21c, 21d<br />
n=6, m=1,2,3,4 22a, 22b, 22c, 22d<br />
méta: n=2, m=2 23b<br />
n=3, m=1,2 24a, 24b<br />
n=4, m=1,2 25a, 25b<br />
Macrocycles observés (rdt. %<br />
termes séparés)<br />
18 2 para 53 dimère (24), trimère, tétramère (2)<br />
19 3 para 34 dimère (34)<br />
20 4 para 41 monomère (6), dimère (18), trimère, tétramère<br />
21 5 para 56 monomère (20), dimère (22), trimère, tétramère<br />
22 6 para 61 monomère (17), dimère (15), trimère, tétramère<br />
23 2 méta 27 dimère (27)<br />
24 3 méta 38 monomère (15), dimère (17)<br />
25 4 méta 32 monomère (16), dimère<br />
* Les ren<strong>de</strong>ments globaux ont été calculés en utilisant les quantités <strong>de</strong> macrocycles séparées<br />
comme termes uniques <strong>et</strong> mélanges <strong>de</strong> termes.<br />
O<br />
O
Les réactions conduisent à l’obtention <strong>de</strong> macrocycles monomères,<br />
dimères, trimères <strong>et</strong> tétramères observés par spectrométrie <strong>de</strong> masse. Ces termes<br />
sont présentés dans la figure 7.<br />
O O<br />
n<br />
monomère<br />
O O<br />
O<br />
n<br />
n<br />
dimère<br />
O<br />
+<br />
+<br />
O<br />
OH HO<br />
O<br />
Figure 7. Formules générales <strong>de</strong> macrocycles (monomère, dimère, trimère <strong>et</strong><br />
tétramère)<br />
n<br />
19<br />
O<br />
O<br />
O O<br />
n<br />
trimère<br />
O<br />
n<br />
O<br />
O<br />
O<br />
n<br />
O<br />
n O n<br />
t<strong>et</strong>ramère<br />
O<br />
H3C O O CH3 O<br />
O<br />
OH OH<br />
+<br />
O<br />
n
Les mélanges <strong>de</strong>s différents termes sont très complexes <strong>et</strong> la séparation<br />
quantitative <strong>de</strong>s différents macrocycles (<strong>de</strong> monomère à tétramère) n’est pas<br />
possible d’une manière quantitative. En dépit <strong>de</strong> la difficulté <strong>de</strong> séparation <strong>de</strong>s<br />
termes, les monomères <strong>et</strong> les dimères pour la série para ont été isolés (par<br />
chromatographie éclair sur silice). La structure <strong>de</strong>s termes isolés a été déterminée<br />
par RMN haut champs (500 <strong>et</strong> 600 MHz), par spectrométrie <strong>de</strong> masse (EI-MS, CI-<br />
MS, FAB, MALDI <strong>et</strong> ESI-MS) <strong>et</strong> par diffractométrie <strong>de</strong> rayons X.<br />
Le tétramère 18d a été isolé comme produit unique avec un ren<strong>de</strong>ment<br />
faible (2 %). Dans le cas <strong>de</strong>s autres termes supérieurs (trimères 20c, 21c, 22c <strong>et</strong><br />
tétramères 20d, 21d, 22d), les séparations par chromatographie éclair sur silice<br />
ne conduisent qu’à <strong>de</strong>s fractions enrichies <strong>de</strong> trimère <strong>et</strong> tétramère. Les analyses<br />
par HPLC (en utilisant <strong>de</strong>s monomères <strong>et</strong> <strong>de</strong>s dimères purs <strong>et</strong> <strong>de</strong>s bruts) sur les<br />
composés 21 <strong>et</strong> 22 nous perm<strong>et</strong>tent d’établir le rapport entre mono, di <strong>et</strong> trimère<br />
dans le brut.<br />
Pour le composé 21, le rapport monomère/dimère/trimère est 48/44/8 alors<br />
que ce rapport pour le composé 22 est 50/45/5. La préférence dans la réaction <strong>de</strong><br />
macrocyclisation pour les divers termes peut être corrélée avec la longueur <strong>de</strong> la<br />
chaîne <strong>de</strong>s polyéthylèneglycols ditosylés <strong>et</strong> avec la position para ou méta <strong>de</strong>s<br />
groupes phénols substituant les noyaux aromatiques. Dans la série para, si la<br />
chaîne est assez longue (n = 4-6) tous les termes se forment (monomèr<strong>et</strong>étramère).<br />
Les monomères <strong>et</strong> les dimères sont obtenus en quantités<br />
comparables. Ce sont les produits majoritaires <strong>de</strong>s réactions.<br />
Dans la série méta, pour n = 2, le dimère est le produit unique <strong>de</strong> la<br />
réaction alors que pour <strong>de</strong>s chaînes plus longues (n = 3,4), le brut contient <strong>de</strong>s<br />
quantités comparables <strong>de</strong> monomères <strong>et</strong> dimères. Dans c<strong>et</strong>te série, pour n = 4, le<br />
seul produit isolé est le monomère, le dimère n’étant pas isolé avec une pur<strong>et</strong>é<br />
convenable.<br />
2.5. Aspects structuraux à l’état soli<strong>de</strong><br />
La structure moléculaire à l’état soli<strong>de</strong> a été déterminée, pour les<br />
monomères 21a <strong>et</strong> 22a <strong>et</strong> pour le dimère 18b (Figures 8, 9 <strong>et</strong> 10), en utilisant la<br />
diffractométrie <strong>de</strong> rayons X. Dans toutes les structures analysées, le cycle 1,3dioxanique<br />
présente une conformation chaise. Les longueurs <strong>et</strong> les angles <strong>de</strong>s<br />
liaisons présentent <strong>de</strong>s valeurs normales. 166 Dans toutes les structures, nous<br />
avons observé l’orientation axiale <strong>de</strong> tous les noyaux aromatiques par rapport aux<br />
hétérocycles saturés.<br />
20
Figure 8. Diagramme ORTEP du composé 21a<br />
Figure 9. Diagramme ORTEP du composé 22a<br />
21
Figure 10. Diagramme ORTEP du composé 18b<br />
Pour le composé 21a (Figure 8), les angles dièdres entre les plans <strong>de</strong><br />
référence <strong>de</strong> chaque hétérocycle <strong>et</strong> le plan du noyau aromatique indiquent <strong>de</strong>s<br />
valeurs proches <strong>de</strong> 90° (C 21 C 22 C 40 / C 21 C 20 C 19 C 18 C 32 C 33 = 82.4(4)° <strong>et</strong> C 29 C 28 C 41 /<br />
C 1 C 31 C 30 C 29 C 38 C 39 = 80.4(4)°) ce qui démontre l’orientation orthogonale <strong>de</strong>s<br />
groupements aryles. C<strong>et</strong>te disposition <strong>de</strong>s noyaux aromatiques est en accord avec<br />
la préférence <strong>de</strong>s substituants aromatiques axiaux (dans la partie acétalique du<br />
cycle 1,3-dioxanique) pour le rotamère orthogonal.<br />
La structure moléculaire du monomère 22a (Figure 9) montre la<br />
cristallisation du composé avec l’inclusion d’une molécule d’eau. Le cristal contient<br />
<strong>de</strong>ux types <strong>de</strong> molécules. Chacune <strong>de</strong> ces molécules inclue une molécule d’eau<br />
par liaison hydrogène. Les molécules présentent un désordre au niveau d’une<br />
partie <strong>de</strong> la chaîne <strong>et</strong> la position <strong>de</strong>s atomes d’hydrogène <strong>de</strong> la molécule d’eau n’a<br />
pas pu être déterminée. L’existence <strong>de</strong> liaisons hydrogène est déduite <strong>de</strong>s valeurs<br />
<strong>de</strong>s distances entre l’atome d’oxygène <strong>de</strong> l’eau <strong>et</strong> l’atome d’oxygène <strong>de</strong> la chaîne<br />
impliqué dans c<strong>et</strong>te liaison (d = 2.781 ; 2.598 Å). De même que pour le composé<br />
21a, la structure du composé 22a indique l’orientation axiale <strong>de</strong>s substituants<br />
aromatiques <strong>et</strong> leurs préférences pour le rotamère orthogonal. Les angles dièdres,<br />
entre les plans <strong>de</strong> référence <strong>de</strong> chaque hétérocycle <strong>et</strong> le plan du noyau<br />
aromatique correspondant, indiquent <strong>de</strong>s valeurs proches <strong>de</strong> 90° (C 24 C 25 C 43 /<br />
C 24 C 23 C 22 C 21 C 35 C 36 = 87.6(8)° <strong>et</strong> C 31 C 32 C 44 / C 32 C 41 C 42 C 1 C 34 C 33 = 88.5(7)°).<br />
Le cristal analysé (provenant d’un mélange d’isomères d’une manière<br />
aléatoire) du composé 18b (Figure 10) est un isomère like. Le cristal est<br />
centrosymétrique (groupe P 21/a) <strong>et</strong> représente un racémate (la molécule<br />
présentée dans le diagramme ORTEP, Figure.10, est l’énantiomère <strong>de</strong><br />
configuration PP). La disposition orthogonale <strong>de</strong>s substituants aromatiques a été<br />
déterminée par les valeurs <strong>de</strong>s angles dièdres <strong>de</strong> référence (C 12 C 13 C 61 /<br />
22
C 9 C 10 C 11 C 12 C 46 C 45 = C 34 C 35 C 63 / C 31 C 32 C 33 C 34 C 54 C 53 = 81.5(1)° <strong>et</strong> C 20 C 19 C 62 /<br />
C 20 C 21 C 22 C 23 C 52 C 51 = C 42 C 41 C 64 / C 1 C 44 C 43 C 42 C 59 C 60 = 81.3(1)°).<br />
Les noyaux aromatiques sont proches <strong>et</strong> ont une disposition orthogonale ce<br />
qui correspond à un arrangement en T (edge-to-face) 167 . Les angles dièdres entre<br />
les <strong>de</strong>ux noyaux aromatiques impliqués dans la structure en T ont <strong>de</strong>s valeurs<br />
proches <strong>de</strong> 90º [C 1 C 44 C 43 C 42 C 59 C 60 / C 9 C 10 C 11 C 12 C 46 C 45 = 78.3(1)° <strong>et</strong><br />
C 20 C 21 C 22 C 23 C 52 C 51 / C 31 C 32 C 33 C 34 C 54 C 53 = 81.3(1)°].<br />
La disposition <strong>de</strong>s cycles aromatiques suggère <strong>de</strong>s interactions π-π<br />
stacking importantes. La distance entre les centres <strong>de</strong>s noyaux aromatiques en<br />
interaction est <strong>de</strong> d = 5.489 Å <strong>et</strong> 5.763 Å. La distance entre l’atome d’hydrogène<br />
H52 (H60) <strong>et</strong> le centre du noyau aromatique opposé est <strong>de</strong> d= 3.340 Å (3.760 Å).<br />
La structure du macrocycle suggère la possibilité <strong>de</strong> générer <strong>de</strong>ux cavités.<br />
De ce fait, ce macrocycle pourrait agir comme un ligand ditopique. En général, les<br />
molécules qui fonctionnent comme <strong>de</strong>s ligands polytopiques présentent <strong>de</strong>ux ou<br />
plusieurs cavités différentes. 1,61,109,168,169,170,171,172 Des macrocycles dans lesquels<br />
<strong>de</strong>ux cations sont piégés par le même cycle sont décrits dans la littérature.<br />
173,174,175<br />
2.6. Aspects structuraux en solution<br />
La structure <strong>de</strong>s composés en solution a été étudiée par RMN haut<br />
champ (500 <strong>et</strong> 600 MHz). Les macrocycles monomères sont obtenus comme<br />
racémique (configuration P ou M <strong>de</strong> l’hélice appartenant aux unités spiraniques).<br />
Les dimères, trimères <strong>et</strong> tétramères sont obtenus comme <strong>de</strong>s mélanges <strong>de</strong><br />
diastéréoisomères. Les dimères présentent <strong>de</strong>s diastéréoisomères like (PP, MM)<br />
<strong>et</strong> unlike (PM). Les structures like <strong>et</strong> unlike n’ont pas pu être attribuées aux <strong>de</strong>ux<br />
isomères issus <strong>de</strong> la réaction.<br />
En conséquence, pour pouvoir discuter les résultats <strong>de</strong>s synthèses <strong>et</strong> <strong>de</strong>s<br />
analyses RMN, nous avons noté avec D1 l’isomère majoritaire <strong>et</strong> avec D2 l’isomère<br />
minoritaire. Deux diastéréoisomères sont possibles pour le trimère (chacun d’entre<br />
eux est chiral <strong>et</strong> présente <strong>de</strong>s énantiomères; D3: MMM, PPP <strong>et</strong> D4: MPP, PMM).<br />
Le tétramère présente quatre diastéréoisomères (D5: MMMM, PPPP; D6: MPPP,<br />
PMMM; D7: PPMM, <strong>et</strong> D8: PMPM), <strong>de</strong>ux d’entre eux étant achiraux (D7 <strong>et</strong> D8). Les<br />
différents termes sont isolés comme mélanges <strong>de</strong> stéréoisomères. Les analyses<br />
structurales montrent <strong>de</strong>s différences importantes entre les divers termes<br />
(monomère, dimère).<br />
Les <strong>de</strong>ux isomères du dimère, like <strong>et</strong> unlike, présentent <strong>de</strong>s signaux<br />
différents pour certaines parties <strong>de</strong> la molécule <strong>et</strong> ils peuvent être différenciés.<br />
L’intégration <strong>de</strong>s signaux séparés ont permis <strong>de</strong> calculer les rapports entre les<br />
<strong>de</strong>ux isomères (D1/D2) : 18b (60/40) ; 19b (55/45) ; 20b (55/45) ; 21b (50/50) ; 22b<br />
(55/45).<br />
23
L’analyse <strong>de</strong>s spectres correspondant à la partie dioxanique montre la<br />
nature anancomérique <strong>de</strong> la partie spiranique, les protons équatoriaux <strong>et</strong> axiaux<br />
étant différenciés dans les spectres RMN. La chiralité <strong>de</strong> la molécule induit la<br />
diastéréotopicité <strong>de</strong>s groupements CH2 du même hétérocycle à cycle à six. Un<br />
<strong>de</strong>s groupements CH2 est orienté vers les atomes d’oxygène du cycle 1,3dioxanique<br />
voisin (vers l’intérieur <strong>de</strong> ce cycle; groupement CH2 “insi<strong>de</strong>”; positions<br />
1 <strong>et</strong> 11, Figure 11) <strong>et</strong> les signaux <strong>de</strong> ces protons (surtout les équatoriaux) sont<br />
fortement déblindés.<br />
L’autre groupement CH2 se trouve <strong>de</strong> l’autre côté du cycle 1,3-dioxanique<br />
voisin (groupement CH2 “outsi<strong>de</strong>” positions 5 <strong>et</strong> 7, Figure 11) ; les protons <strong>de</strong> ces<br />
groupements présentent <strong>de</strong>s valeurs δ habituelles. 176,177,178<br />
outsi<strong>de</strong><br />
Ar<br />
O<br />
O<br />
CH3<br />
O CH3 O<br />
Figure 11. Disposition spatiale du squel<strong>et</strong>te spiranique<br />
La partie <strong>de</strong>s spectres RMN correspondant aux protons <strong>de</strong> la chaîne est<br />
relativement simple pour les premiers termes (n=2, 3). Mais les spectres <strong>de</strong>s<br />
termes supérieurs (composés 20-22) présentent <strong>de</strong>s signaux bien séparés<br />
uniquement pour les protons <strong>de</strong>s groupements éthyléneoxy<strong>de</strong>s les plus déblindés,<br />
ceux qui sont plus proches <strong>de</strong>s noyaux aromatiques. Les autres protons <strong>de</strong>s<br />
chaînes donnent <strong>de</strong>s signaux superposés.<br />
Parce qu’il y a une similitu<strong>de</strong> entre les spectres <strong>de</strong>s divers termes <strong>de</strong> la<br />
série para, par la suite, nous ferons une présentation détaillée seulement pour un<br />
<strong>de</strong>s monomères <strong>de</strong> c<strong>et</strong>te série. L’attribution <strong>de</strong>s signaux pour les protons a été<br />
effectuée à partir <strong>de</strong>s spectres 1 H 1D <strong>et</strong> 2D COSY <strong>et</strong> celle <strong>de</strong>s signaux <strong>de</strong>s<br />
atomes <strong>de</strong> carbone à l’ai<strong>de</strong> <strong>de</strong>s spectres RMN 13 C 1D <strong>et</strong> 13 C 2D 1 H / 13 C (HSQC,<br />
HMBC).<br />
Le spectre RMN 1 H du monomère 22a (Figures 12 <strong>et</strong> 13) présente pour la<br />
partie aromatique un système AB (<strong>de</strong>ux doubl<strong>et</strong>s à δ = 7.36 ppm <strong>et</strong> δ = 7.01 ppm)<br />
<strong>et</strong> un seul singul<strong>et</strong> (δ = 1.66 ppm) pour les protons <strong>de</strong>s groupes méthyles <strong>de</strong> la<br />
partie acétalique <strong>de</strong>s cycles 1,3-dioxaniques.<br />
L’analyse totale <strong>de</strong> ce composé 22a est indiquée au niveau <strong>de</strong> la Figure 18,<br />
après avoir obtenu les différentes informations <strong>de</strong>s diverses analyses RMN.<br />
24<br />
Ar<br />
insi<strong>de</strong>
34<br />
33<br />
26<br />
23<br />
22<br />
O<br />
O<br />
1<br />
32<br />
O<br />
30 31<br />
29<br />
28<br />
27<br />
24<br />
21<br />
2 3<br />
25<br />
O<br />
20<br />
CH 3<br />
O<br />
O<br />
42<br />
41<br />
40<br />
39<br />
38<br />
37<br />
CH 3<br />
36<br />
35<br />
18<br />
19<br />
4 5<br />
Figure 12. Spectre RMN 1 H (600 MHz, [D]6-benzène) du composé 22a<br />
Figure 13. Spectre RMN 1 H (600 MHz, [D]6-benzène, fragments) du composé 22a<br />
O<br />
O<br />
17<br />
25<br />
6<br />
16<br />
9<br />
7<br />
13<br />
O<br />
O<br />
15<br />
8<br />
O<br />
14<br />
10<br />
11<br />
12
Les protons <strong>de</strong>s hétérocycles <strong>et</strong> <strong>de</strong> la chaîne polyéthoxylée se trouvent<br />
dans l’intervalle 3.01-4.31 ppm. L’attribution <strong>de</strong>s protons pour la partie spiranique<br />
a été réalisée en considérant les données observées <strong>et</strong> publiées pour d’autres<br />
composés (synthétisés dans notre groupe) comportant la même partie spiranique.<br />
Dans ce cas là, l’attribution a été réalisée à partir <strong>de</strong>s résultats <strong>de</strong>s expériences<br />
NOESY ou ROESY.<br />
La conclusion <strong>de</strong> ces analyses est que les protons du groupement<br />
méthylène “insi<strong>de</strong>” sont plus déblindés que ceux du groupement méthylène<br />
“outsi<strong>de</strong>”. Pour les groupements méthylènes “insi<strong>de</strong>”, les protons équatoriaux sont<br />
beaucoup plus déblindés (∆δ = 0.46 ppm) que les axiaux. D’autre part, pour les<br />
groupements méthylènes “outsi<strong>de</strong>”, les protons axiaux sont plus déblindés <strong>et</strong> les<br />
différences <strong>de</strong> déplacement axiaux-équatoriaux sont plus faibles (∆δ = 0.06 ppm).<br />
La position axiale orthogonale <strong>de</strong>s groupes aromatiques <strong>et</strong> l’anisotropie<br />
magnétique <strong>de</strong> ces noyaux expliquent (par un déblindage à travers l’espace) les<br />
valeurs élevées <strong>de</strong>s diastéréotopicités mesurées pour ces protons. A partir <strong>de</strong>s<br />
spectres RMN 1 H 1D <strong>et</strong> 2D COSY 1 H / 1 H (Figure 14), il est aisé d’i<strong>de</strong>ntifier les<br />
protons aromatiques, spiraniques <strong>et</strong> les protons <strong>de</strong> la chaîne qui appartiennent<br />
aux groupements éthylèneoxy<strong>de</strong>s liés directement au squel<strong>et</strong>te spiranique. Par<br />
contre, les autres protons <strong>de</strong> la chaîne possédant <strong>de</strong>s déplacements chimiques<br />
très proches ne peuvent être i<strong>de</strong>ntifiés.<br />
Figure 14. Spectre COSY (600 MHz, [D]6-benzène, fragment) du composé 22a<br />
Le groupe CH2 “insi<strong>de</strong>” présente un doubl<strong>et</strong> à δ = 4.31 ppm pour les<br />
protons équatoriaux <strong>et</strong> un autre doubl<strong>et</strong> à δ = 3.85 ppm pour les protons axiaux.<br />
26
Le groupe “outsi<strong>de</strong>” présente un système AB correspondant aux protons<br />
axiaux (δ = 3.07 ppm) <strong>et</strong> équatoriaux (δ = 3.01 ppm). Dans la carte 2D COSY 1 H /<br />
1 H, on observe aussi la tache <strong>de</strong> corrélation entre les protons équatoriaux <strong>de</strong>s<br />
groupes “insi<strong>de</strong>” avec les protons équatoriaux <strong>de</strong>s groupes “outsi<strong>de</strong>” due à un<br />
couplage à longue distance.<br />
Du fait <strong>de</strong> la chiralité <strong>de</strong> la molécule, les protons géminaux <strong>de</strong> la chaîne<br />
sont différents. Mais, du fait <strong>de</strong> la faible différence d’environnement magnétique,<br />
une bonne partie <strong>de</strong> ces signaux se superpose. La diastéréotopicité <strong>de</strong>s protons<br />
<strong>de</strong>s groupes méthylénes les plus proches <strong>de</strong> la partie spiranique s’observe très<br />
bien. Les <strong>de</strong>ux types <strong>de</strong> protons (proR <strong>et</strong> proS) <strong>de</strong> ces centres prochiraux donnent<br />
<strong>de</strong>s doubl<strong>et</strong>s <strong>de</strong> doubl<strong>et</strong>s <strong>de</strong> doubl<strong>et</strong>s bien résolus (δ = 3.95 <strong>et</strong> 3.81 ppm).<br />
Après avoir i<strong>de</strong>ntifié les protons (Figures 12-14) <strong>et</strong> réalisé le spectre RMN<br />
13 C 1D (Figure 15), l’attribution <strong>de</strong> chaque atome <strong>de</strong> carbone est possible à partir<br />
<strong>de</strong>s expériences 2D hétéronucléaire 1 H / 13 C [HSQC, HMBC (Figure 18)].<br />
Figure 15. Spectre RMN 13 C (600 MHz, [D]6-benzène) du composé 22a<br />
A <strong>de</strong>s champs plus faibles apparaît l’atome <strong>de</strong> carbone <strong>de</strong> la partie<br />
acétalique substitué par le noyau aromatique (δ = 101.74 ppm). Les atomes <strong>de</strong><br />
carbone aromatique donnent <strong>de</strong>s signaux au-<strong>de</strong>là <strong>de</strong> 116 ppm. Les signaux <strong>de</strong>s<br />
atomes <strong>de</strong> carbone aromatique <strong>de</strong>s positions 23, 33, 36, 41 ne sont pas visibles<br />
du fait <strong>de</strong> la superposition avec le signal du solvant <strong>de</strong>utéré (C6D6). Entre 64 <strong>et</strong> 71<br />
ppm apparaissent les atomes <strong>de</strong> carbone dioxaniques (δ = 64.89 ppm en position<br />
38 <strong>et</strong> 39 <strong>et</strong> δ = 66.10 ppm en position 27, 29) <strong>et</strong> les atomes <strong>de</strong> carbone <strong>de</strong> la<br />
chaîne (δ = 68.62; 71.28; 71.33; 71.36; 71.43; 71.54 ppm en position 3, 19, 4, 18,<br />
6, 16, 7, 15, 9, 13, 10, 12). Le spectre montre un seul signal pour les groupements<br />
27
méthyles (δ = 31.64 ppm) <strong>et</strong> aussi un seul signal pour l’atome <strong>de</strong> carbone<br />
spiranique (δ = 33.89 ppm).<br />
d<br />
b<br />
a<br />
f<br />
e<br />
c<br />
34<br />
33<br />
26<br />
23<br />
22<br />
O<br />
O<br />
1<br />
32<br />
2 3<br />
O<br />
30 31<br />
29<br />
28<br />
27<br />
24<br />
21<br />
25<br />
O<br />
20<br />
CH 3<br />
O<br />
O<br />
CH 3<br />
ceq<br />
19<br />
42<br />
41<br />
40<br />
39<br />
38<br />
37<br />
36<br />
35<br />
4 5<br />
18<br />
O<br />
O<br />
17<br />
aH<br />
6<br />
16<br />
9<br />
7<br />
13<br />
cax<br />
O<br />
O<br />
15<br />
8<br />
O<br />
14<br />
aH’<br />
Figure 18. Spectre HMBC (600 MHz, [D]6-benzène, fragment) du composé 22a<br />
28<br />
10<br />
11<br />
12<br />
a:3,19-CH2<br />
b: 27, 29-CH2<br />
c: 38, 39-CH2<br />
d: 4, 6, 7, 9, 10, 12, 13, 15, 16, 18-CH2<br />
e: 28-C<br />
f: 25, 31-CH3<br />
d<br />
bax<br />
beq
L’allure <strong>de</strong>s spectres RMN (à l’exception <strong>de</strong> la partie aromatique qui est<br />
plus complexe) <strong>de</strong>s composés <strong>de</strong> la série méta est comparable à ceux <strong>de</strong>s termes<br />
<strong>de</strong> la série para. On r<strong>et</strong>rouve <strong>de</strong>s valeurs similaires <strong>de</strong>s diastéréotopicités <strong>de</strong>s<br />
protons <strong>de</strong>s cycles 1,3-dioxaniques <strong>et</strong> <strong>de</strong>s groupements éthylènoxy<strong>de</strong>s qui font la<br />
jonction avec les unités phénoliques.<br />
La structure <strong>de</strong>s nouveaux macrocycles a été aussi déterminée par<br />
spectrométrie <strong>de</strong> masse en utilisant les métho<strong>de</strong>s EI-MS, CI-MS, FAB (Fast Atom<br />
Bombardment) <strong>et</strong> MALDI (Matrix Assisted Laser Desorption Ionization). Les <strong>de</strong>ux<br />
<strong>de</strong>rnières étant <strong>de</strong>s techniques adéquates pour les macromolécules à masse<br />
moléculaire élevée 64 (par exemple <strong>de</strong> 486.50 pour 24a à 2474.84 pour le terme le<br />
plus élevé i<strong>de</strong>ntifié).<br />
Les spectres MALDI nous ont permis aussi d’i<strong>de</strong>ntifier les trimères <strong>et</strong> les<br />
tétramères formés dans la réaction. Les espèces cationiques [M+Na] + <strong>et</strong> [M+K] +<br />
sont favorisées par rapport à l’ion moléculaire protoné [M+H] + (Figure 25).<br />
La suite <strong>de</strong> ce travail est consacrée à l’étu<strong>de</strong> <strong>de</strong> la sélectivité <strong>et</strong> <strong>de</strong> la<br />
stabilité <strong>de</strong>s complexes coronand/cation alcalin par spectrométrie <strong>de</strong> masse avec<br />
ionisation électrospray.<br />
H3C O O CH3<br />
O<br />
(O CH2 CH2)6 O<br />
m<br />
Figure 25. Spectre MALDI d’une fraction enrichie en dimère (D), trimère (T) <strong>et</strong><br />
tétramère (∆) du 22<br />
29<br />
O<br />
m = 1- 4
2.7. Applications <strong>de</strong> la technique <strong>de</strong> l’électrospray: Etu<strong>de</strong> <strong>de</strong> la sélectivité <strong>de</strong><br />
complexation <strong>de</strong>s macrocycles, <strong>de</strong> la stabilité <strong>de</strong>s complexes <strong>et</strong> recherche<br />
d’espèces sandwich<br />
Aujourd’hui la spectrométrie <strong>de</strong> masse avec ionisation électrospray (ESI-<br />
MS) joue un rôle capital dans l’analyse <strong>de</strong>s protéines utilisées en thérapie<br />
humaine, puisqu’elle perm<strong>et</strong> une détermination sûre (0.01 % <strong>de</strong> précision sur la<br />
mesure <strong>de</strong> masse ESI) <strong>et</strong> rapi<strong>de</strong> <strong>de</strong> leur structure, <strong>de</strong> leur pur<strong>et</strong>é pour <strong>de</strong>s masses<br />
moléculaires allant jusqu’à 200 kDa, avec <strong>de</strong>s sensibilités <strong>de</strong> l’ordre <strong>de</strong> la<br />
picomole.<br />
La spectrométrie <strong>de</strong> masse avec ionisation électrospray (ESI-MS) perm<strong>et</strong><br />
d’effectuer, tout comme dans le cas <strong>de</strong>s protéines, un progrès considérable dans<br />
l’étu<strong>de</strong> <strong>de</strong>s édifices supramoléculaires, c’est à dire <strong>de</strong>s systèmes <strong>de</strong> plus en plus<br />
grands, complexes <strong>et</strong> labiles. En eff<strong>et</strong>, dans ce type <strong>de</strong> chimie, la détermination<br />
non ambiguë <strong>de</strong> la structure <strong>et</strong> <strong>de</strong> la pur<strong>et</strong>é <strong>de</strong>s molécules, indispensable à l’étu<strong>de</strong><br />
<strong>de</strong> leurs propriétés physico-chimiques, est parfois difficile par les seules métho<strong>de</strong>s<br />
d’analyses classiques (spectroscopie RMN, cristallographie RX, analyse<br />
élémentaire, spectrométrie <strong>de</strong> masse FAB…).<br />
Le but <strong>de</strong> notre travail consiste à rechercher par ESI-MS en ions positifs:<br />
• une sélectivité <strong>de</strong> complexation avec <strong>de</strong>s cations alcalins<br />
• la stabilité <strong>de</strong>s complexes coronand/cation<br />
• une éventuelle formation d’espèces sandwich,<br />
ceci pour 8 composés macrocycliques (18b, 18d¸ 19b, 20b, 21a, 21b, 22a, 22b).<br />
Les éthers couronnes forment <strong>de</strong>s complexes stables avec les cations métalliques<br />
alcalins, alcalino-terreux <strong>et</strong> les cations ammoniums primaires.<br />
La complexation est faible lorsque la couronne du polyéther est trop large:<br />
le cation ne peut être simultanément assez proche <strong>de</strong> tous les oxygènes, ou bien<br />
lorsqu’elle est trop p<strong>et</strong>ite pour le cation: il n’y a pas assez <strong>de</strong> charges négatives<br />
pour maintenir le cation.<br />
La taille <strong>de</strong>s éther-couronnes n’est pas la seule responsable <strong>de</strong> la stabilité<br />
<strong>de</strong>s complexes: celle <strong>de</strong>s cations intervient également. Les p<strong>et</strong>its cations<br />
développent un fort champ électrique qui attire les ligands <strong>et</strong> les molécules <strong>de</strong><br />
solvants dipolaires. Ces molécules <strong>de</strong> solvant gênent la formation <strong>de</strong>s complexes.<br />
Quant aux plus gros cations, ils ont <strong>de</strong>s constantes <strong>de</strong> stabilité faibles car<br />
ils n’attirent pas beaucoup les polyéthers.<br />
Les valeurs relatives <strong>de</strong>s diamètres <strong>de</strong> la couronne <strong>et</strong> <strong>de</strong>s cations ne sont<br />
pas les seuls critères à prendre en compte pour expliquer les différences entre les<br />
constantes <strong>de</strong> stabilité. La flexibilité <strong>de</strong> la structure, ou la tendance <strong>de</strong>s éthercouronnes<br />
à adopter plusieurs conformations sous différentes conditions <strong>et</strong> la<br />
spécificité du cation sont également importantes.<br />
30
Les énergies mises en jeu dans la complexation <strong>de</strong>s cations par les éthercouronnes,<br />
proviennent d’un compromis entre les énergies <strong>de</strong> solvatation <strong>de</strong>s ions<br />
<strong>et</strong> les énergies d’interaction entre les atomes d’oxygène <strong>et</strong> les cations.<br />
La stoechiométrie <strong>de</strong>s complexes éther-couronne/cation dépend bien<br />
entendu <strong>de</strong>s tailles respectives <strong>de</strong> la cavité <strong>de</strong> l’éther-couronne <strong>et</strong> du cation. Ainsi,<br />
lorsque le cation est trop volumineux pour la cavité, il se forme <strong>de</strong>s complexes 2/1<br />
(éther-couronne/cation) <strong>de</strong> type sandwich.<br />
Chaque composé a été analysé après dilution dans une solution<br />
CH3CN/MeOH (50/50) en premier lieu, puis dans un second temps après dilution<br />
<strong>et</strong> addition d’une solution équimolaire <strong>de</strong>s sels LiI, NaI, KI, RbI <strong>et</strong> CsI dans <strong>de</strong>s<br />
rapports <strong>de</strong> concentrations macrocycle/sels 1/1 (solution A), 1/2 (solution B), 2/1<br />
(solution C) (les solutions finales sont <strong>de</strong> l’ordre <strong>de</strong> 10 -6 M). Dans le cas du<br />
composé 18b, <strong>de</strong>s rapports <strong>de</strong> concentrations macrocycle/sels 3/1, 10/1 ont<br />
également été examinés.<br />
Nous avons également fait varier les paramètres <strong>de</strong> la source du<br />
spectromètre <strong>de</strong> masse telles que la tension <strong>de</strong> cône <strong>et</strong> la température <strong>de</strong><br />
désolvatation, afin d’évaluer la ”solidité” <strong>de</strong>s complexes non covalents. Il faut<br />
préciser que l’augmentation <strong>de</strong> la tension <strong>de</strong> cône, notée Vc, induit <strong>de</strong>ux eff<strong>et</strong>s: le<br />
premier est <strong>de</strong> favoriser la transmission <strong>de</strong>s espèces ioniques <strong>de</strong> valeurs <strong>de</strong> m/z<br />
élevées <strong>et</strong> par conséquent d’augmenter l’abondance <strong>de</strong> ces ions sur les spectres ;<br />
le second est <strong>de</strong> provoquer la fragmentation d’ions dans la source du<br />
spectromètre par collision dissociative avec l’azote, gaz <strong>de</strong> désolvatation.<br />
Ainsi, lorsque Vc augmente, les adduits non covalents ont tendance à<br />
disparaître tandis que les assemblages covalents persistent.<br />
Les pics observés dans les spectres <strong>de</strong> masse ESI correspon<strong>de</strong>nt aux<br />
différents complexes 1/1 macrocycle/cation alcalin formés en solution, aux<br />
complexes 2/1 macrocycle/cation <strong>de</strong> type sandwich <strong>et</strong> aux complexes<br />
multicationiques. L’ionisation <strong>de</strong>s complexes est i<strong>de</strong>ntique <strong>et</strong> se fait par la perte du<br />
contre-ion I − . L’étu<strong>de</strong> <strong>de</strong>s affinités <strong>de</strong>s macrocycles pour Li + , Na + , K + , Rb + <strong>et</strong> Cs +<br />
consiste en fait à déterminer les proportions <strong>de</strong> divers complexes formés dans les<br />
solutions A, B <strong>et</strong> C.<br />
Les composés étudiés après addition <strong>de</strong> la solution équimolaire <strong>de</strong> sels ont<br />
présenté <strong>de</strong>s ions moléculaires cationiques [M+Li] + , [M+Na] + , [M+K] + , [M+Rb] + , <strong>et</strong><br />
[M+Cs] + , avec une forte prédominance pour les adduits [M+K] + <strong>et</strong> surtout [M+Na] + ,<br />
ceci quelque soit le rapport macrocycle/sels. L’ion moléculaire protoné [M+H] + est<br />
présent mais minoritaire.<br />
Les espèces cationiques [M+Na] + <strong>et</strong> [M+K] + étaient déjà observées lors <strong>de</strong><br />
l’analyse ESI-MS <strong>de</strong>s macrocycles en solution méthanolique sans ajout <strong>de</strong> sels.<br />
La formation d’ions [M+Na] + <strong>et</strong> [M+K] + plutôt que [M+H] + s’explique par la faible<br />
basicité en phase gazeuse <strong>de</strong>s macrocycles. En revanche, ils sont capables <strong>de</strong><br />
crypter <strong>de</strong>s sels alcalins même à l’état <strong>de</strong> traces.<br />
31
En eff<strong>et</strong>, l’affinité <strong>de</strong> K + <strong>et</strong> Na + pour ces macrocycles est si gran<strong>de</strong>, que les<br />
concentrations <strong>de</strong>s autres complexes formés dans la solution (complexes<br />
sandwich) sont trop faibles pour être détectés correctement par spectrométrie <strong>de</strong><br />
masse ESI.<br />
Les variations <strong>de</strong> la stoechiométrie macrocycle/cation <strong>et</strong> <strong>de</strong> la température<br />
<strong>de</strong> la source ESI modifient d’une manière faible l’allure <strong>de</strong>s spectres obtenus.<br />
La variation <strong>de</strong>s rapports macrocycle/sels doit, d’une part, nous perm<strong>et</strong>tre<br />
d’évaluer la possibilité <strong>de</strong> formation d’espèces sandwich (Figure 27). Les<br />
proportions <strong>de</strong>s complexes sandwich déduites du spectre <strong>de</strong> masse ESI sont<br />
corrélées avec la dimension du macrocycle, le rapport macrocycle/sels <strong>et</strong> la<br />
tension <strong>de</strong> cône utilisée.<br />
Figure 27. Spectre ESI (Vc = 25 V) <strong>de</strong> la solution C pour le composé 18b<br />
Sur les 8 composés analysés dans <strong>de</strong>s rapports macrocycle/sels 1/1, 2/1 <strong>et</strong><br />
1/2, seul le macrocycle 18b, <strong>de</strong> taille peu élevée (PM = 884.4 Da) forme <strong>de</strong>s<br />
complexes sandwich dans <strong>de</strong>s quantités plus importantes. Le caractère non<br />
covalent <strong>de</strong> ces complexes est vérifié par leurs disparitions lors <strong>de</strong> l’augmentation<br />
<strong>de</strong> la tension <strong>de</strong> cône. L’abondance <strong>de</strong> ces complexes non covalent n’augmente<br />
pas <strong>de</strong> façon importante lorsque l’on augmente la quantité <strong>de</strong> macrocycle par<br />
apport aux sels. Par exemple, pour le composé 18b l’abondance relative <strong>de</strong> l’ion<br />
[M2+Na] + reste entre 20 <strong>et</strong> 30% pour les rapports macrocycle/sels 3/1 <strong>et</strong> 10/1 <strong>et</strong> sa<br />
formation ne semble pas être affectée par une augmentation <strong>de</strong> température :<br />
l’abondance <strong>de</strong> c<strong>et</strong> ion est i<strong>de</strong>ntique à 40 ° C <strong>et</strong> 80 ° C. Cependant, notons que ces<br />
divers rapports ne favorisent pas l’apparition <strong>de</strong> trimère non covalent, ce qui laisse<br />
supposer une spécificité pour la stoechiométrie 2/1 macrocycle/sels.<br />
Par diminution du rapport macrocycle/sels (1/2), il est aussi possible <strong>de</strong><br />
rechercher une éventuelle formation d’espèces multicationiques. L’espèce<br />
cationique au sodium [M+2Na] 2+ existe déjà pour le rapport macrocycle/sels 1/1<br />
pour les macrocycles <strong>de</strong> PM > 900 Da, soit les composés 18d, 19b 20b, 21b, 22b.<br />
Les composés <strong>de</strong> plus p<strong>et</strong>ite taille ne présentent pas d’ions dichargés en raison <strong>de</strong><br />
trop fortes répulsions coulombiennes. Les ions dichargés observés (Figure 28)<br />
pour le rapport 1/2 (macrocycle/sels) sont majoritairement [M+Na+Li] 2+ ,<br />
32
[M+2Na] 2+ , [M+2K] 2+ . L’importance <strong>de</strong> ces espèces augmente avec la taille du<br />
macrocycle.<br />
Figure 28. Spectre ESI (Vc = 17 V) <strong>de</strong> la solution B pour le composé 22b<br />
Nous allons, durant c<strong>et</strong>te étu<strong>de</strong>, observer l’influence <strong>de</strong> la tension <strong>de</strong> cône<br />
sur la réponse <strong>de</strong>s complexes coronand/cation alcalin. Nous allons donc pouvoir<br />
comparer la stabilité <strong>de</strong>s complexes entre eux <strong>et</strong> voir si c<strong>et</strong> apport d’énergie<br />
entraîne <strong>de</strong>s modifications au niveau <strong>de</strong> la géométrie spatiale <strong>de</strong> la cavité <strong>de</strong><br />
l’éther couronne. Ce <strong>de</strong>rnier point pourrait se traduire par un comportement<br />
particulier du produit vis-à-vis <strong>de</strong> tel ou tel cation <strong>et</strong> donc, sur la réponse du<br />
complexe correspondant en fonction <strong>de</strong> la tension <strong>de</strong> cône.<br />
Nous avons pu constater que la stabilité <strong>de</strong> ces complexes est dépendante<br />
<strong>de</strong> la taille du cation. Plus le cation est p<strong>et</strong>it, plus la stabilité du complexe formé<br />
est importante. Ceci peut-être dû soit à une meilleure insertion du cation dans le<br />
coronand, soit par la formation <strong>de</strong> liaisons ioniques plus fortes à cause <strong>de</strong> la plus<br />
gran<strong>de</strong> <strong>de</strong>nsité ionique du cation (voire les <strong>de</strong>ux). Les travaux réalisés sur les<br />
éthers couronnes nous feraient opter pour la secon<strong>de</strong> solution. Cependant, l’étu<strong>de</strong><br />
<strong>de</strong>s complexes [M+Cs] + <strong>de</strong>s composés 18b, 21a <strong>et</strong> 22a en ESI montre un<br />
comportement un peu particulier. Leur stabilité serait plus importante que les<br />
complexes formés à partir du potassium <strong>et</strong> du rubidium. Par exemple, pour le<br />
composé 21a (Figure 29) les intensités relatives du complexe [M+Cs] + à<br />
différentes tension <strong>de</strong> cône (Vc = 25, 38, 72 V) sont : 12 %, 8 %, 98 %. Il est<br />
33
possible que ces complexes, dans un premier temps, avec l’augmentation <strong>de</strong> la<br />
tension <strong>de</strong> cône, subissent une légère déformation <strong>de</strong> la cavité du coronand<br />
renforçant ainsi leur stabilité par une insertion facilitée du césium.<br />
On ne peut, par contre, tirer aucune conclusion <strong>de</strong> ces différentes<br />
expériences en ce qui concerne leur spécificité par rapport à ces cations alcalins<br />
dû aux conditions <strong>de</strong> leur synthèse.<br />
Les résultats obtenus montrent une réponse importante <strong>de</strong> la capacité <strong>de</strong><br />
complexation <strong>de</strong>s macrocycles <strong>et</strong> <strong>de</strong> la stabilité <strong>de</strong>s complexes en fonction <strong>de</strong>s<br />
paramètres (tension <strong>de</strong> cône, rapport macrocycle/sels, taille <strong>de</strong> macrocycle).<br />
Pour obtenir <strong>de</strong>s résultats quantitatifs, c<strong>et</strong>te étu<strong>de</strong> préliminaire sera<br />
poursuivie par une étu<strong>de</strong> plus élaborée.<br />
Figure 29. Spectres ESI <strong>de</strong> la solution A pour 21a (a : Vc = 25 V, b : Vc = 38<br />
V ; c : Vc = 72 V)<br />
34
3. <strong>Synthèse</strong> <strong>et</strong> analyse structurale <strong>de</strong> nouveaux cyclophanes comportant<br />
<strong>de</strong>s cycles 1,3-dioxaniques. Premier “rocking chair” moléculaire.<br />
3.1. Introduction<br />
Les cyclophanes sont <strong>de</strong>s composés cycliques dont la structure est formée<br />
<strong>de</strong> <strong>de</strong>ux cycles aromatiques reliés par <strong>de</strong>s chaînes aliphatiques. Ce sont <strong>de</strong>s<br />
cibles attractives du fait <strong>de</strong>s propriétés chimiques, physicochimiques <strong>et</strong><br />
biologiques particulières présentées par ces structures. 179<br />
Les cyclophanes sont <strong>de</strong>s composés typiques comportant <strong>de</strong> la chiralité<br />
planaire. 180,181<br />
Le plus connu <strong>et</strong> à la fois le premier terme synthétisé <strong>de</strong> la série est le<br />
[2.2]cyclophane. La première synthèse a été réalisée par Cram <strong>et</strong> Steinberg<br />
(1951). 182 Au début, les dérivés du [2.2]paracyclophane ont été synthétisés pour<br />
étudier les interactions entre les cycles aromatiques. Puis, ces <strong>de</strong>rnières années,<br />
on a observé un fort intérêt pour la synthèse <strong>de</strong>s ligands chiraux <strong>et</strong> l’utilisation <strong>de</strong><br />
ces composés dans <strong>de</strong>s synthèses asymétriques. 183,184,185,186,187,188,189,190,191<br />
Quelques exemples <strong>de</strong> ces composés sont présentés dans la figure 30.<br />
P(Ph)2<br />
P(Ph) 2<br />
R<br />
N<br />
Me<br />
Ph<br />
R = Me, Ph<br />
Figure 30. [2.2]cyclophanes chiraux utilisés en synthèse asymétrique<br />
La conception <strong>et</strong> la synthèse <strong>de</strong>s cyclophanes macrocycliques comme<br />
molécules hôtes 28,84,120,192,193,194,195,196,197,198,199,200 sont une branche fascinante <strong>de</strong><br />
la chimie supramoléculaire. Il est bien connu que les cyclophanes forment une<br />
famille <strong>de</strong> composé importante dans la technologie avancée (récepteurs<br />
synthétiques dans le processus <strong>de</strong> reconnaissance moléculaire, sensors <strong>et</strong> <strong>de</strong>s<br />
éléments <strong>de</strong>s machines moléculaires…).<br />
A partir du modèle naturel <strong>de</strong> la F0F1-ATP synthase 201,202 qui a démontré<br />
qu’on peut construire <strong>de</strong>s dispositifs à l’échelle moléculaire pour transformer<br />
l’énergie en travail mécanique, beaucoup <strong>de</strong> travaux ont présenté la synthèse <strong>de</strong><br />
machines moléculaires 203,204,205,206 ou <strong>de</strong> dispositifs <strong>et</strong> d’outils moléculaires<br />
(compas, 182,207 gyroscopes, 182,207 freins (brakes), 208 cliqu<strong>et</strong>s (ratch<strong>et</strong>s), 209<br />
tourniqu<strong>et</strong>s (turnstiles), 210 nav<strong>et</strong>tes, (shuttles), 211 selles (saddles), 109 piège à souris<br />
(mouse traps). 212<br />
35<br />
O<br />
O<br />
O
La plupart <strong>de</strong>s machines moléculaires apparentées à la famille <strong>de</strong>s<br />
rotaxanes, caténands, cryptants <strong>et</strong> cyclophanes à structures particulières sont<br />
utilisées pour proj<strong>et</strong>er <strong>de</strong>s “dispositifs à l’échelle moléculaire”.<br />
Un grand nombre <strong>de</strong>s propriétés <strong>de</strong>s cyclophanes macrocycliques à l’état<br />
soli<strong>de</strong> ou en solution est déterminé par <strong>de</strong>s interactions entre les cycles<br />
aromatiques.<br />
L’importance <strong>de</strong>s interactions π-π stacking est bien connue <strong>et</strong> elle peut être<br />
illustrée par la contribution <strong>de</strong> ces forces à la structure tertiaire <strong>et</strong> quaternaire <strong>de</strong>s<br />
protéines, 213,214,215 <strong>et</strong> à la construction <strong>de</strong>s systèmes “host-guest” <strong>et</strong> aux processus<br />
<strong>de</strong> reconnaissance moléculaire dans la chimie supramoléculaire. 49,216,217,218,219,220<br />
Beaucoup <strong>de</strong> travaux récents 167,221,222,223,224,225,226,227,228,229 portent sur la<br />
nature <strong>de</strong>s forces impliquées dans les interactions entre les cycles aromatiques <strong>et</strong><br />
les facteurs qui influencent l’importance <strong>de</strong> ces interactions.<br />
Les calculs effectués sur le dimère du benzène 167 ont mis en évi<strong>de</strong>nce, en<br />
plus <strong>de</strong>s arrangements classiques face-to-face (XI) <strong>et</strong> edge-to-face (nommé aussi<br />
structure T, XII), trois autres arrangements favorables (Figure 31) :<br />
a) un arrangement qui conserve l’orientation parallèle <strong>de</strong>s noyaux<br />
aromatiques (XIII: offs<strong>et</strong>-stacked)<br />
b) un autre dans lequel les <strong>de</strong>ux noyaux aromatiques sont<br />
perpendiculaires (XIV: structure edge-tilted-T) 221<br />
c) une <strong>de</strong>rnière structure dans laquelle un <strong>de</strong>s noyaux aromatique est<br />
penché vers l’autre (XV: face-tilted-T-structure).<br />
L’importance <strong>de</strong>s interactions entre les cycles aromatiques, qu’elles soient<br />
intermoléculaire ou intramoléculaire, dépen<strong>de</strong> en plus <strong>de</strong> la <strong>de</strong>nsité électronique<br />
<strong>de</strong> chaque cycle, <strong>de</strong> quelques caractéristiques stériques comme : l'angle entre les<br />
plans <strong>de</strong>s noyaux aromatiques (XI-XIV), <strong>de</strong> la distance entre les <strong>de</strong>ux centres <strong>de</strong>s<br />
noyaux aromatiques (XI-XIV), <strong>de</strong> la distance entre le centre d’un noyau<br />
aromatique <strong>et</strong> le plus proche atome d’hydrogène du noyau opposé (XII, XIV, XV)<br />
<strong>et</strong> du décalage entre les <strong>de</strong>ux noyaux (XIII).<br />
36
H<br />
H<br />
H<br />
XI<br />
H H<br />
XIV<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
XII<br />
Figure 31. Structures possibles du dimère du benzène favorisées par <strong>de</strong>s<br />
interactions aromatiques<br />
Nous avons choisi comme substrat <strong>de</strong>s dérivés bis(1,3-dioxane-2yl)benzéniques,<br />
étudiés par notre laboratoire, 230,231,232 qui présentent un élément<br />
<strong>de</strong> pré-organisation qui pourrait faciliter leur inclusion dans <strong>de</strong>s architectures<br />
moléculaires macrocycliques.<br />
3.2. <strong>Synthèse</strong> <strong>et</strong> analyse structurale <strong>de</strong>s précurseurs [dérivés bis(1,3dioxane-2-yl)benzénique]<br />
La stéréochimie <strong>de</strong>s dérivés 1,3-dioxaniques du 1,4-diacétylbenzène 232 est<br />
similaire à celle <strong>de</strong>s dérivés <strong>de</strong> la 2,6-diacétylpyridine. Les composés ont une<br />
structure anancomérique <strong>et</strong> le noyau aromatique présente une orientation axiale<br />
au niveau <strong>de</strong>s <strong>de</strong>ux cycles 1,3-dioxaniques. Des composés <strong>de</strong> ce type,<br />
comportant une fonctionnalité adéquate dans les positions 5’, 5” <strong>de</strong>s cycles 1,3dioxaniques,<br />
sont <strong>de</strong>s substrats intéressants pour la synthèse <strong>de</strong> macrocycles<br />
cyclophaniques.<br />
Ces composés s’obtiennent facilement par acétalisation du 1,4diacétylbenzene<br />
avec divers 1,3-propanediols. Pour accé<strong>de</strong>r à <strong>de</strong>s macrocycles<br />
cyclophaniques, nous avons utilisé le 2-hydroxyméthyl-2-méthyl-1,3-propanediol<br />
(Schéma 16).<br />
37<br />
H<br />
H<br />
H<br />
H<br />
XIII<br />
H<br />
XV<br />
H<br />
H<br />
H<br />
H
H 3C<br />
H3C<br />
C<br />
C<br />
O<br />
O<br />
+<br />
HO CH3<br />
benzène<br />
HO CH2OH APTS<br />
Schéma 16<br />
38<br />
H 3C<br />
H 3C<br />
O<br />
O<br />
O<br />
O<br />
28<br />
CH 3<br />
CH2OH<br />
CH 2OH<br />
CH3<br />
rdt: 60 %<br />
Le composé 28 présente trois isomères dus à l’orientation en cis ou en<br />
trans du groupe CH2OH, par rapport au phényle occupant toujours une position<br />
axiale dans les <strong>de</strong>ux cycles: cis-cis; cis-trans; trans-trans (Figure 32).<br />
Les isomères trans-trans <strong>et</strong> cis-trans sont obtenus dans un rapport proche<br />
<strong>de</strong> 1:1. L’isomère cis-cis est obtenu dans <strong>de</strong>s quantités très faibles (environ 2%).<br />
La solubilité très faible <strong>et</strong> la polarité très proche <strong>de</strong>s isomères du composé 28<br />
ren<strong>de</strong>nt très difficile leur séparation. Afin d’augmenter la solubilité, nous avons<br />
transformer les alcools en dérivés benzoylés (Schéma 17).<br />
Les isomères benzoylés (trans-trans/cis-trans/cis-cis = 50/50/5) ont été<br />
séparés par cristallisation fractionnée (dans l’éther). Les alcools ont été<br />
déprotégés par hydrolyse <strong>de</strong>s esters benzoïques (LiOH dans MEOH / THF / H2O =<br />
1 / 1 / 0.5, Schéma 17) à température ambiante.<br />
H3C<br />
H3C<br />
O<br />
O<br />
O<br />
O<br />
cis<br />
cis<br />
CH 3<br />
CH3<br />
CH2OH<br />
CH2OH<br />
H3C<br />
H3C<br />
O<br />
O<br />
O<br />
O<br />
cis<br />
CH3<br />
CH2OH<br />
trans trans<br />
CH3<br />
CH2OH<br />
H3C<br />
H3C<br />
Figure 32. Les isomères du composé 28<br />
O<br />
O<br />
O<br />
O<br />
CH2OH<br />
trans<br />
cis-cis cis-trans trans-trans<br />
CH3<br />
CH3<br />
CH2OH
O<br />
H3C<br />
H 3C<br />
O<br />
O<br />
O<br />
28<br />
CH3<br />
CH2OH<br />
CH 2OH<br />
CH 3<br />
C6H5COCl<br />
Py, t.a.<br />
O<br />
H3C<br />
rdt: 84 %<br />
O<br />
O<br />
CH3<br />
O<br />
H3C<br />
H3C<br />
O<br />
39<br />
O<br />
O<br />
29<br />
CH3<br />
CH2OOCC6H5<br />
CH2OOCC6H5<br />
CH3<br />
mélange<br />
d'isomères<br />
CH2OOCC6H5<br />
H3C<br />
O<br />
CH2OOCC6H5<br />
CH3<br />
29<br />
isomères separés<br />
rdt: 96 - 98 %<br />
Schéma 17<br />
LiOH<br />
cristallisation<br />
fractionée<br />
MeOH/H 2O/THF<br />
t.a.<br />
O<br />
H3C<br />
H3C<br />
O<br />
O<br />
O<br />
28<br />
CH3<br />
CH2OH<br />
CH2OH<br />
CH3<br />
isomères separés<br />
Nous avons envisagé d’utiliser les isomères du substrat 28 pour la<br />
synthèse <strong>de</strong> cyclophanes macrocycliques. De tous ces isomères, seul l’isomère<br />
cis-cis présente l’arrangement favorable à la macrocyclisation.<br />
3.3. <strong>Synthèse</strong> <strong>de</strong>s cyclophanes<br />
La synthèse <strong>de</strong> nouveaux cyclophanes macrocycliques 30-32 233 a été<br />
réalisée (en utilisant une procédure typique pour la synthèse <strong>de</strong>s esters<br />
macrocycliques) 104,105,108,110,211 par la réaction <strong>de</strong> l’isomère cis-cis du composé 28<br />
avec les chlorures <strong>de</strong>s aci<strong>de</strong>s phtaliques (ortho, méta <strong>et</strong> para) (Schéma 18). Le<br />
solvant est l’acétonitrile, la réaction se déroule à température ambiante en<br />
présence <strong>de</strong> DMAP.
H 3C<br />
H 3C<br />
Nous avons séparé <strong>et</strong> isolé les produits <strong>de</strong> la réaction par flashchromatographie.<br />
On obtient <strong>de</strong>s monomères, <strong>de</strong>s dimères <strong>et</strong> <strong>de</strong>s trimères avec<br />
<strong>de</strong>s ren<strong>de</strong>ments globaux variant <strong>de</strong> 35 á 67 % (Figure 33, Tableau 12).<br />
O<br />
O<br />
O<br />
O<br />
CH 3<br />
CH 3<br />
28 (cis-cis)<br />
CH 2<br />
+<br />
CH 2<br />
OH<br />
OH<br />
Cl<br />
Schéma 18<br />
Tableau 12. Données concernant la synthèse <strong>de</strong>s composés 30-32<br />
Composé Position <strong>de</strong>s n Macrocycle Rdt. *<br />
40<br />
Rdt. global<br />
groupes esters (%) (%)<br />
30a para 1 monomère 63<br />
30b para 2 dimère < 2 67<br />
30c para 3 trimère < 2<br />
31a méta 1 monomère 32<br />
31b méta 2 dimère 11 53<br />
31c méta 3 trimère 10<br />
32a ortho 1 monomère 16<br />
32b ortho 2 dimère 12 35<br />
32c ortho 3 trimère 7<br />
* Ren<strong>de</strong>ments en produit isolé pur<br />
C O<br />
O<br />
C<br />
Cl<br />
ortho, méta<br />
ou para<br />
DMAP<br />
CH3CN<br />
t.a.<br />
30-32<br />
Les tentatives <strong>de</strong> synthèse <strong>de</strong>s esters macrocycliques à partir <strong>de</strong>s <strong>de</strong>ux<br />
autres isomères du composé 28 (cis-trans <strong>et</strong> trans-trans) en réaction avec le<br />
dichlorure <strong>de</strong> l’aci<strong>de</strong> téréphthalique ont échoué.<br />
Ce résultat peut s’expliquer par le fait que les <strong>de</strong>ux groupements<br />
hydroxyméthyles <strong>de</strong>s <strong>de</strong>ux isomères sont trop éloignés dans l’espace pour pouvoir<br />
réagir avec le dichlorure <strong>de</strong> l’aci<strong>de</strong> téréphtalique d’une façon favorable à la<br />
ferm<strong>et</strong>ure du macrocycle.<br />
H3C<br />
H 3C<br />
O<br />
A<br />
O<br />
n<br />
C D<br />
O<br />
O<br />
B<br />
CH3<br />
CH 3<br />
CH2<br />
CH 2<br />
O<br />
O<br />
C<br />
O<br />
n = 1, 2, 3<br />
C O<br />
ortho, méta<br />
ou para
Un autre inconvénient dans c<strong>et</strong>te réaction est l’encombrement stérique<br />
causé par le groupe méthyle en position équatoriale <strong>de</strong> la partie alkyle <strong>de</strong>s cycles<br />
1,3-dioxaniques (positions 5’ <strong>et</strong> 5”).<br />
H3C<br />
O<br />
H3C CH2<br />
H 3C<br />
O<br />
C<br />
O<br />
monomère: [7.7]cyclophane<br />
para 30a, méta 31a, ortho 32a<br />
H3C<br />
CH3<br />
O O<br />
O O<br />
CH2<br />
O<br />
O<br />
O<br />
O<br />
C O<br />
CH 2<br />
CH3<br />
CH 3<br />
CH 2 O<br />
H3C CH3<br />
O O<br />
O O<br />
H3C O<br />
H2C<br />
O<br />
C<br />
O<br />
H2C<br />
O<br />
C<br />
O<br />
CH 3<br />
C O<br />
C O<br />
CH3<br />
dimère: [7.7.7.7]cyclophane<br />
para 30b, méta 31b, ortho 32b<br />
H3C<br />
H3C<br />
O<br />
O<br />
O<br />
O<br />
Figure 33. Formules structurales <strong>de</strong>s cyclophanes 30-32 (monomères, dimères <strong>et</strong><br />
trimères)<br />
Le ren<strong>de</strong>ment pour le monomère 30a est très bon (63 %), le dimère <strong>et</strong> le<br />
trimère correspondant étant obtenus dans <strong>de</strong>s quantités très faibles (< 2 %). Dans<br />
la synthèse <strong>de</strong>s composés 31 <strong>et</strong> 32, on obtient <strong>de</strong>s quantités importantes <strong>de</strong><br />
dimère (31: 11 %; 32: 12 %) <strong>et</strong> <strong>de</strong> trimère (31: 10 %; 32: 7 %). Il est important <strong>de</strong><br />
41<br />
H3C CH3 O O<br />
O O<br />
H3C CH3<br />
CH2<br />
H2C<br />
O<br />
O<br />
C<br />
CH3<br />
O<br />
CH2<br />
CH 3<br />
CH2<br />
C<br />
O<br />
O<br />
C<br />
O<br />
C<br />
O<br />
O<br />
O<br />
C O<br />
C O<br />
CH3 O<br />
CH2<br />
CH 2<br />
trimère: [7.7.7.7.7.7]cyclophane<br />
para 30c, méta 31c, ortho 32c<br />
O<br />
O<br />
CH3<br />
O<br />
O<br />
CH 3<br />
CH3
emarquer que les taux <strong>de</strong> conversion en macrocycles diminue dans la série para<br />
(63 %), méta (53 %), ortho (35 %).<br />
Ces résultats indiquent que les groupes hydroxyméthyles <strong>de</strong> l’isomère ciscis<br />
du composé 28 présentent la géométrie idéale pour conduire à la<br />
macrocyclisation. D’autre part, les pourcentages en monomères isolés (30a : 63<br />
% ; 31a : 32 % ; 32a : 16 %) indiquent que c’est pour l’isomère para que les <strong>de</strong>ux<br />
fonctions du dichlorure d’aci<strong>de</strong> sont en position idéale pour l’accés au monomère.<br />
Dans ce cas, la distance entre les groupes du dichlorure d’aci<strong>de</strong> <strong>et</strong> les groupes<br />
hydroxyméthyles du composé 28 semble optimum.<br />
Les différents composés isolés ont été analysés par RMN <strong>et</strong> spectrométrie<br />
<strong>de</strong> masse EI-MS (pour les monomères) <strong>et</strong> MALDI + (pour les dimères <strong>et</strong> les<br />
trimères) (Tableau 13).<br />
Le composé 30a a été isolé comme un seul produit par chromatographie<br />
éclair sur silice alors que le dimère 30b <strong>et</strong> le trimère 30c ont été isolé comme un<br />
mélange <strong>de</strong> trois structures: le macrocycle <strong>et</strong> <strong>de</strong>s complexes avec une <strong>et</strong> <strong>de</strong>ux<br />
molécules <strong>de</strong> DMAP. Ces complexes ont été observés lors <strong>de</strong> l’étu<strong>de</strong> par<br />
spectrométrie <strong>de</strong> masse (MALDI, Figures 34 <strong>et</strong> 35).<br />
Tableau 13. Données concernant l’analyse par spectrométrie <strong>de</strong> masse (EI-MS # <strong>et</strong><br />
MALDI) <strong>de</strong>s composés 30-32<br />
Composé Macrocycle Technique Ions<br />
30a monomère EI-MS 481<br />
30b dimère MALDI 1015.3, 1031.3, 1115.3, 1237.3<br />
30c trimère MALDI 1512.7. 1527.7, 1612.7<br />
31a monomère EI-MS 481<br />
31b dimère MALDI 993.3, 1015.3, 1031.3<br />
31c trimère MALDI 1512.2, 1528.2<br />
32a monomère EI-MS 496<br />
32b dimère MALDI 992.7, 1015.0, 1030.9<br />
32c trimère MALDI 1511.5, 1527.4<br />
# On considère les pics M + <strong>et</strong> (M-15) + ; le pic moléculaire est instable <strong>et</strong> par fragmentation (perte<br />
d’un méthyle <strong>de</strong> la partie acétalique) on observe le pic le plus stable (M-15). +<br />
42
H3C<br />
H3C<br />
O<br />
O<br />
O<br />
O<br />
CH3<br />
CH 3<br />
CH2<br />
CH 2<br />
O<br />
C<br />
O<br />
O<br />
C<br />
O<br />
Figure 34. Spectre MALDI du dimère 30b<br />
43<br />
[M+Na] +<br />
O<br />
C<br />
O<br />
C<br />
O<br />
O<br />
CH 2<br />
CH2<br />
CH3<br />
O<br />
O<br />
CH 3<br />
O<br />
O<br />
[M+K] +<br />
CH3<br />
CH3<br />
[M+H+DMAP] +<br />
[M+H+2DMAP] +
H 3C<br />
H 3C<br />
O<br />
O<br />
O<br />
O<br />
CH3<br />
CH3<br />
[M+Na] +<br />
H3C CH3 O O<br />
O O<br />
H3C CH3<br />
H2C<br />
CH 2<br />
CH2<br />
O<br />
C<br />
CH 2<br />
O<br />
[M+K] +<br />
Figure 35. Spectre MALDI (fragment) du trimère 30c<br />
44<br />
O<br />
C O<br />
C<br />
O<br />
O<br />
C<br />
O O<br />
O<br />
C<br />
O<br />
O<br />
C<br />
O<br />
CH 2<br />
CH 2<br />
CH3<br />
O<br />
O<br />
CH 3<br />
O<br />
O<br />
[M+H+DMAP] +<br />
CH3<br />
CH3
3.4. <strong>Analyse</strong> structurale<br />
Les analyses structurales <strong>de</strong>s composés 30-32 montrent <strong>de</strong>s différences<br />
importantes entre les divers macrocycle (monomère, dimère, trimère) obtenus <strong>de</strong>s<br />
isomères ortho, méta <strong>et</strong> para.<br />
3.4.1. Structure du composé 30a. Rocking Chair moléculaire<br />
La formation du macrocycle dans le cas du composé 30a se réalise grâce à<br />
une modification conformationnelle importante du motif <strong>de</strong> départ. Un <strong>de</strong>s cycles<br />
dioxaniques (que nous notons Ar-ax) conserve l’orientation axiale du noyau<br />
aromatique (le noyau C) alors que le <strong>de</strong>uxième cycle dioxanique subit une<br />
inversion, imposant une position équatoriale au noyau aromatique (C) (Ar-eq,<br />
Schéma 19). Ce nouvel arrangement <strong>de</strong>s hétérocycles est nécessaire à la<br />
ferm<strong>et</strong>ure du macrocycle.<br />
Deux structures (XVI <strong>et</strong> XVII) équivalentes (homomériques) <strong>de</strong> 30a sont<br />
possibles. L’encombrement stérique du méthyle axial, situé dans la partie<br />
acétalique (cycle A, position 13, structure XVI ou cycle B, position 8, structure<br />
XVII), détermine l’inversion du cycle A (dans la structure XVI) ou B (XVII).<br />
L’inversion <strong>de</strong>s cycles dioxaniques ne peut pas se faire d’une manière<br />
indépendante. Le cycle 1,3-dioxanique qui subit l’inversion pousse le noyau<br />
aromatique D qui à son tour pousse le cycle dioxanique opposé <strong>et</strong> détermine son<br />
inversion. Ainsi, l’équilibre conformationnel pour le composé 30a implique la<br />
conjugaison <strong>de</strong>s inversions <strong>de</strong>s <strong>de</strong>ux cycles 1,3-dioxaniques.<br />
L’énergie conformationnelle (interactions syn-axiale) due à la compression<br />
stérique du méthyle axial (positions 8 <strong>et</strong> 13) est libérée par l’inversion du cycle 1,3dioxanique<br />
(Ar-eq). Durant l’inversion <strong>de</strong> ce cycle 1,3-dioxanique le noyau<br />
aromatique D est poussé vers l’autre hétérocycle en provoquant son inversion.<br />
Par l’intermédiaire du mouvement du cycle D, l’inversion <strong>de</strong>s cycles 1,3dioxaniques<br />
se déroule en tan<strong>de</strong>m.<br />
Les interactions syn-axiale ren<strong>de</strong>nt l’énergie <strong>de</strong> l’état fondamental <strong>de</strong>s<br />
conformations XVI <strong>et</strong> XVII (Figure 36) suffisamment élevée par rapport à l’état <strong>de</strong><br />
transition pour faciliter leurs interconversions à température ambiante.<br />
L’inversion “en tan<strong>de</strong>m” <strong>de</strong>s hétérocycles saturés déterminent un<br />
mouvement <strong>de</strong> va-<strong>et</strong>-vient du cycle D par rapport au cycle C (qui a été choisi<br />
arbitrairement comme référence). Le mouvement régulier du cycle D peut servir<br />
comme modèle pour la construction d’un “Rocking Chair” moléculaire. Le “Rocking<br />
Chair” moléculaire fonctionne par la rotation <strong>de</strong> quatre unités considérées rigi<strong>de</strong>s<br />
autour <strong>de</strong>s axes C 6 C 23 , O 7 O 24 (cycle B) <strong>et</strong> O 14 O 27 , C 15 C 28 (cycle A).<br />
45
H3C eq<br />
O<br />
C<br />
O<br />
17<br />
CH2 16<br />
15<br />
18<br />
H<br />
H<br />
ax ax<br />
28<br />
19<br />
1<br />
O<br />
C<br />
O<br />
H 2C<br />
eq H<br />
CH3<br />
H eq<br />
O 27<br />
26 25 7 O<br />
A B<br />
O<br />
O<br />
13<br />
C<br />
12<br />
9 8<br />
H3C 11 10 CH3<br />
ax<br />
eq<br />
XVI<br />
14<br />
20<br />
21<br />
D<br />
29<br />
22<br />
30<br />
2<br />
6<br />
3<br />
4<br />
5<br />
23<br />
ax<br />
24<br />
30a<br />
Schéma 19<br />
Figure 36. Le schéma du « rocking chair » moléculaire : les différentes parties ont <strong>de</strong>s co<strong>de</strong>s <strong>de</strong><br />
couleur : bleu pour le cycle aromatique C; rouge pour les parties 1,3-dioxaniques ; vert pour la<br />
partie ester incluant le cycle D; magenta pour les protons protrans <strong>de</strong>s positions 6, 15, 23 <strong>et</strong> 28 (les<br />
protons procis <strong>de</strong> ces positions ne sont pas indiquées); cyane pour les groupes méthyles <strong>de</strong>s<br />
positions 8 <strong>et</strong> 13; noir pour les axes: O 7 O 24 , O 14 O 27 , C 6 C 23 <strong>et</strong> C 15 C 28<br />
Le spectre RMN du macrocycle 30a à température ambiante montre la<br />
structure flexible du composé. L’équilibre conformationnel (Schéma 19) rend les<br />
<strong>de</strong>ux cycles 1,3-dioxaniques équivalents <strong>et</strong> on observe un seul s<strong>et</strong> <strong>de</strong> signaux à<br />
<strong>de</strong>s valeurs moyennes <strong>de</strong>s déplacements chimiques (Figure 37, Tableau 14).<br />
Malgré l’inversion rapi<strong>de</strong> <strong>de</strong>s cycles 1,3-dioxaniques, les protons <strong>de</strong>s<br />
noyaux 1,3-dioxaniques donnent <strong>de</strong>ux signaux (doubl<strong>et</strong>s) car ils sont<br />
diastéréotopiques, étant procis ou protrans (la référence est le groupement -<br />
CH2O-). Les expériences RMN à température variable ([D]8-THF) montrent <strong>de</strong>s<br />
modifications majeures. En diminuant la température, on observe beaucoup <strong>de</strong><br />
points <strong>de</strong> coalescence. Dans le spectre enregistré à 165 K, un signal<br />
correspondant aux protons du cycle aromatique D (Figure 2b: δ = 7.3 ppm) est à la<br />
coalescence (Figure 37, Spectre NOESY).<br />
46<br />
ax<br />
H3C<br />
eqH<br />
27<br />
28<br />
16<br />
O A<br />
O<br />
O<br />
Heq<br />
13<br />
14<br />
O<br />
CH2<br />
C<br />
15<br />
C<br />
D<br />
24<br />
O<br />
B<br />
O<br />
H3C CH3 eq<br />
ax<br />
XVII<br />
8<br />
C<br />
23<br />
7<br />
O<br />
O<br />
H2C<br />
5<br />
6<br />
H H<br />
ax<br />
ax<br />
eq<br />
CH 3
eq<br />
H3C<br />
H<br />
eq<br />
H<br />
ax<br />
a<br />
O<br />
C<br />
O<br />
CH2 ax<br />
A<br />
O<br />
O<br />
H3C<br />
ax<br />
D<br />
a<br />
ax H<br />
C<br />
C<br />
O<br />
b<br />
O<br />
eq H2C<br />
eq H<br />
b<br />
B<br />
O<br />
O<br />
ax<br />
CH3<br />
eq<br />
CH3<br />
Figure 37. Spectre RMN 1H (500 MHz) du composé 30a dans le [D8]-THF: [a: 1H à 283 K; b: 1H à<br />
165 K; c,d: région <strong>de</strong> la carte ROESY à 165 K; les signaux représentant l'échange chimique entre les<br />
<strong>de</strong>ux conformations (a) sont corrélés par <strong>de</strong>s pics croisés positifs (noir - par rapport à la diagonale<br />
positive) alors que les pics croisés négatifs (en rouge) représentent l'eff<strong>et</strong> NOE (b) dans le référentiel<br />
tournant (ROE), avec <strong>de</strong>s “suppression TOCSY” expériences 234,235<br />
47<br />
eq<br />
H3C ax<br />
ax<br />
O<br />
C<br />
O<br />
CH2 ax<br />
ax<br />
eq<br />
a b<br />
procis protrans<br />
A<br />
O<br />
O<br />
H3C<br />
ax<br />
eq<br />
D<br />
C<br />
ax eq<br />
C<br />
O<br />
O<br />
eq H2C B<br />
O<br />
eq<br />
ax<br />
O<br />
ax<br />
CH3 eq<br />
CH3<br />
eq
A basse température les équilibres conformationnels sont figés <strong>et</strong> le spectre<br />
montre <strong>de</strong>s signaux différents pour les protons équatoriaux <strong>et</strong> axiaux <strong>de</strong>s <strong>de</strong>ux<br />
types <strong>de</strong> cycles 1,3- dioxaniques (Ar-ax <strong>et</strong> Ar-eq), un possédant le cycle<br />
aromatique en position axiale (Ar-ax) <strong>et</strong> l’autre en position équatoriale (Ar-eq)<br />
(Tableau 14).<br />
Les spectres NOESY <strong>et</strong> ROESY à basse température perm<strong>et</strong>tent<br />
l’attribution <strong>de</strong>s signaux <strong>et</strong> confirment le flipping <strong>de</strong> la molécule. Les tâches <strong>de</strong><br />
corrélations positives (interactions scalaires) avec les signaux <strong>de</strong>s groupes<br />
méthyles ou méthylènes similaires (pour les positions axiales <strong>et</strong> équatoriales)<br />
m<strong>et</strong>tent en évi<strong>de</strong>nce l’échange chimique <strong>de</strong> ces groupements (Figure 37, spectre<br />
ROESY, en noir).<br />
Tableau 14. Données RMN 1 H (500 MHz, [D8]-THF) pour le composé 30a.<br />
T (K) Noyaux aromatiques CH3 CH2 Cycles 1,3dioxaniques<br />
(10,25;11,26) (21,29;22,30) (8,13) (5,16) (4,17) Ar eq Ar-ax<br />
C D ax eq ax eq ax eq ax eq ax eq<br />
283 7.36 7.66 1.46 1.10 4.15 procis: 4.07;<br />
48<br />
protrans: 3.76<br />
165 7.36, 7.50 7.91 # 1.62 1.37 1.28 0.91 4.31 4.05 4.24 4.12 4.08 3.51<br />
# Le signal correspondant (du système AB) est en coalescence (J ≈ 7.30 ppm)<br />
On observe aussi l’échange chimique pour les protons aromatiques <strong>et</strong> pour<br />
quelques protons <strong>de</strong>s <strong>de</strong>ux types <strong>de</strong> cycle 1,3-dioxaniques (<strong>de</strong>s taches <strong>de</strong><br />
corrélations à valeur positives, Figure 37). L’eff<strong>et</strong> ROE (<strong>de</strong>s taches <strong>de</strong> corrélations<br />
négatives, dues aux interactions dipolaires, représentées en rouge), observé pour<br />
les signaux <strong>de</strong>s protons aromatiques, montre la proximité dans l’espace <strong>de</strong>s<br />
noyaux aromatiques du fait <strong>de</strong>s interactions π-stacking intramoléculaires.<br />
Quelques interactions NOE inattendues (par exemple pour les protons <strong>de</strong>s<br />
différents cycles 1,3-dioxaniques <strong>et</strong> pour les groupes méthyles <strong>de</strong>s différents<br />
cycles 1,3-dioxaniques) suggèrent la formation d’aggrégats à basse température<br />
par les interactions π-stacking intermoléculaires.<br />
La structure moléculaire à l’état soli<strong>de</strong> <strong>de</strong> 30a (Figure 38) montre les<br />
conformations différentes (Ar-ax <strong>et</strong> Ar-eq) <strong>de</strong>s <strong>de</strong>ux cycles 1,3-dioxaniques avec<br />
les noyaux aromatiques. Le cycle aromatique <strong>de</strong> la partie acétalique du<br />
macrocycle préfère le rotamère orthogonal (angle dièdre <strong>de</strong> référence proche <strong>de</strong><br />
90°). Les valeurs <strong>de</strong>s distances interatomiques, <strong>de</strong>s angles <strong>de</strong> liaison <strong>et</strong> <strong>de</strong> torsion<br />
montrent la conformation chaise <strong>de</strong>s cycles 1,3-dioxaniques.
Des interactions π-stacking intra <strong>et</strong> intermoléculaires importantes ont été<br />
observées. Les <strong>de</strong>ux noyaux aromatiques du cyclophane adoptent un<br />
arrangement proche <strong>de</strong> la structure edge-tilted-T avec une distance entre les<br />
centres <strong>de</strong>s cycles benzéniques <strong>de</strong> 4.899(2) Å. Les distances entre les atomes<br />
d’hydrogène <strong>de</strong>s positions 30 <strong>et</strong> 29 <strong>et</strong> le centre du cycle aromatique opposé sont<br />
<strong>de</strong> 3.330(3) <strong>et</strong> 3.535(1) Å. L’angle dièdre entre les noyaux aromatiques est<br />
d’environ 60° (59.8°).<br />
H<br />
H<br />
H H<br />
H<br />
H<br />
H<br />
H<br />
b<br />
Figure 38. Diagramme ORTEP (a) <strong>et</strong> vue <strong>de</strong> la maille (b) pour 30a.<br />
Dans la maille, on observe que tous les cycles aromatiques similaires sont<br />
parallèles. On observe <strong>de</strong>s interactions intéressantes entre les cycles aromatiques<br />
qui comportent la partie ester. On rencontre <strong>de</strong>ux situations, dans lesquelles les<br />
<strong>de</strong>ux cycles (<strong>de</strong>s molécules différentes) sont dans une disposition offs<strong>et</strong>- face-toface.<br />
Dans la maille, ces cycles peuvent être proches ou éloignés l’un par rapport<br />
à l’autre. La distance, pour le premier cas, entre les centres <strong>de</strong>s cycles<br />
aromatiques est <strong>de</strong> 4.477(4) Å alors que pour le <strong>de</strong>uxième cas la distance est <strong>de</strong><br />
l’ordre <strong>de</strong> 7 Å. Des interactions favorables <strong>de</strong>s groupements carbonyles avec le<br />
49<br />
a<br />
a
noyau aromatique opposé peuvent être observées (la distance entre l’atome <strong>de</strong><br />
carbone du groupe carbonyle <strong>et</strong> le centre du cycle C est <strong>de</strong> 3.538 (3) Å.<br />
3.4.2. Méta <strong>et</strong> ortho cyclophanes<br />
Les méta <strong>et</strong> ortho cyclophanes, qu’ils soient <strong>de</strong>s monomères, <strong>de</strong>s dimères<br />
ou <strong>de</strong>s trimères présentent <strong>de</strong>s cycles 1,3-dioxaniques anancomériques. Dans<br />
tous les cas, la structure initiale <strong>de</strong> la partie dioxanique <strong>de</strong>s macrocycles est<br />
conservée <strong>et</strong> le noyau benzénique (C) montre une orientation axiale pour les <strong>de</strong>ux<br />
hétérocycles saturés. Ceci est confirmé par les spectres RMN à température<br />
ambiante, les ROESY (effectuées sur les composés 31a <strong>et</strong> 32a) <strong>et</strong> les<br />
expériences RMN à température variable effectuées sur le composé 31a.<br />
Le spectre ROESY (à t.a.) du composé 31a montre <strong>de</strong>s interactions<br />
intenses entre le singul<strong>et</strong> (δ = 7.30 ppm) correspondant aux protons aromatiques<br />
du cycle <strong>de</strong> la partie acétalique <strong>et</strong> le doubl<strong>et</strong> le plus déblindé (δ = 3.80 ppm) <strong>de</strong>s<br />
protons axiaux <strong>de</strong>s cycles 1,3-dioxaniques. Le doubl<strong>et</strong> (δ = 3.30 ppm)<br />
correspondant aux protons équatoriaux <strong>de</strong>s cycles 1,3-dioxaniques montrent <strong>de</strong>s<br />
interactions fortes avec le singul<strong>et</strong> observé pour les protons du groupe méthyle<br />
axial <strong>de</strong> la partie aliphatique <strong>de</strong>s cycles 1,3-dioxaniques.<br />
Malgré le nombre réduit <strong>de</strong> signaux <strong>et</strong> l’allure simple <strong>de</strong>s spectres, si on<br />
compare les spectres RMN 1 H <strong>de</strong>s monomères avec les spectres <strong>de</strong>s dimères ou<br />
trimères correspondants, <strong>de</strong>s modifications importantes <strong>de</strong>s positions <strong>de</strong>s signaux<br />
pour les protons <strong>de</strong>s noyaux aromatiques ainsi que pour ceux <strong>de</strong>s protons <strong>de</strong>s<br />
hétérocycles peuvent être observées. Ces différences sont dues aux interactions<br />
π-stacking <strong>de</strong>s monomères.<br />
Dans les monomères, les noyaux aromatiques C <strong>et</strong> D sont proches dans<br />
l’espace. Par contre, dans les dimères <strong>et</strong> trimères, ces noyaux aromatiques<br />
(Figure 33) se trouvent à une distance plus gran<strong>de</strong> l’un par rapport à l’autre.<br />
Dans le dimère 31b <strong>et</strong> le trimère 31c, les protons ortho, ortho (du cycle D<br />
méta-substitué) sont plus déblindés (δ30b = 8.44 <strong>et</strong> δ30c = 8.45 ppm). Dans le<br />
monomère 31a, ces protons sont plus blindés (δ30a = 7.61 ppm).<br />
Le fort blindage (∆δ = 0.8 ppm) <strong>de</strong> ces protons est dû à la préférence <strong>de</strong>s<br />
<strong>de</strong>ux noyaux aromatiques pour la structure edge-to-face (T-). Les protons ortho,<br />
ortho se trouvent à proximité <strong>de</strong> la zone <strong>de</strong> blindage <strong>de</strong> l’autre noyau<br />
aromatique. 236,237 C<strong>et</strong>te proximité <strong>de</strong>s noyaux aromatiques est démontrée par les<br />
interactions observées dans le spectre ROESY.<br />
L’arrangement particulier <strong>de</strong>s noyaux aromatiques détermine le déblindage<br />
<strong>de</strong>s protons axiaux <strong>et</strong> le blindage <strong>de</strong>s protons équatoriaux <strong>de</strong>s cycles 1,3dioxaniques<br />
(ax: δ30a = 3.99, δ30b = 3.74 ppm <strong>et</strong> δ30c = 3.73 ppm; eq : δ30a = 3.47,<br />
δ30b = 3.66 <strong>et</strong> δ30c = 3.63 ppm). Les interactions π-stacking (intramoléculaire <strong>et</strong><br />
intermoléculaire) peuvent être aussi observées à l’état soli<strong>de</strong>.<br />
50
Le diagramme ORTEP du composé 31a (Figure 39) montre la disposition<br />
edge-to-face <strong>de</strong>s noyaux aromatiques. La valeur d’angle dièdre (99.6°) formé par<br />
les noyaux aromatiques montre une disposition perpendiculaire <strong>de</strong> ceux-ci. Les<br />
valeurs <strong>de</strong>s distances interatomiques, <strong>de</strong>s angles <strong>de</strong> liaison <strong>et</strong> <strong>de</strong> torsion montrent<br />
la conformation chaise <strong>de</strong>s cycles 1,3-dioxaniques. La distance entre les centres<br />
<strong>de</strong>s noyaux aromatiques est <strong>de</strong> d = 7.140(17) Å <strong>et</strong> la distance du proton H(30) au<br />
centre du noyau aromatique opposé est <strong>de</strong> 4.853(12) Å.<br />
H<br />
H<br />
H<br />
H<br />
H H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
H<br />
Figure 39. Diagramme ORTEP (a) <strong>et</strong> vue <strong>de</strong> la maille (b) pour 31a.<br />
51<br />
b<br />
a
Le cycle C présente une disposition orthogonale par rapport aux <strong>de</strong>ux<br />
hétérocycles. Le cristal contient dans ses interstices <strong>de</strong>s molécules <strong>de</strong> solvant<br />
(CHCl3). Un <strong>de</strong>s atomes <strong>de</strong> chlore (Cl 2 dans la Figure 39) est proche du cycle C [d<br />
= 3.711(11) Å].<br />
Dans la maille (Figure 39), les molécules du cyclophane 31a présentent un<br />
assemblage tête-queue (head-to-tail packing), qui génère trois arrangements<br />
différents <strong>de</strong>s noyaux aromatiques. Les cycles C similaires sont coplanaires <strong>et</strong> les<br />
cycles D similaires présentent un arrangement offs<strong>et</strong> face-to-face. La distance<br />
entre les centres <strong>de</strong>s noyaux aromatiques [6.991(17) Å] suggère <strong>de</strong>s interactions<br />
π-stacking faibles dans ce cas.<br />
Les cycles C <strong>et</strong> D présentent une structure stacked edge-tilted-T dans<br />
laquelle la distance du centre d’un noyau aromatique au centre d’un autre noyau<br />
aromatique est <strong>de</strong> 4.915(21) Å <strong>et</strong> la distance <strong>de</strong> l’hydrogène au centre du cycle est<br />
<strong>de</strong> 4.069(13) Å.<br />
Les spectres RMN <strong>de</strong>s composés 32a, 32b <strong>et</strong> 32c se ressemblent. Le<br />
déblindage du signal appartenant aux groupes équatoriaux –CH2O dans le<br />
composé 32a est (δ31a = 4.18 <strong>et</strong> δ31b = δ31c = 3.90 ppm) dû à l’influence du noyau<br />
aromatique D.<br />
La structure moléculaire du composé 32a (Figure 40) montre l’orientation<br />
axiale orthogonale du cycle C aromatique. Les valeurs <strong>de</strong>s distances<br />
interatomiques, <strong>de</strong>s angles <strong>de</strong> liaison <strong>et</strong> <strong>de</strong> torsion montrent la conformation<br />
chaise <strong>de</strong>s cycles 1,3-dioxaniques.<br />
On peut aussi observer un désordre au niveau d’un <strong>de</strong>s atomes d’oxygène<br />
<strong>de</strong>s groupes carbonyles, du à un <strong>de</strong>gré <strong>de</strong> liberté supplémentaire pour la vibration<br />
<strong>de</strong> celui-ci. Ceci détermine l’existence <strong>de</strong> <strong>de</strong>ux types <strong>de</strong> molécules qui diffèrent<br />
par la position <strong>de</strong> c<strong>et</strong> atome d’oxygène.<br />
a b<br />
Figure 40. Diagramme ORTEP (a) <strong>et</strong> vue <strong>de</strong> la maille (b) pour 32a.<br />
52
4. Conclusion <strong>de</strong> la <strong>de</strong>uxième partie<br />
Nous avons synthétisé <strong>de</strong>ux séries <strong>de</strong> composés macrocycliques : <strong>de</strong>s<br />
coronands comportant <strong>de</strong>s unités spiraniques <strong>et</strong> <strong>de</strong>s cyclophanes comportant <strong>de</strong>s<br />
unités 1,4-bis(1,3-dioxanyl)benzène. La métho<strong>de</strong> <strong>de</strong> macrocyclisation a été basée<br />
sur l’eff<strong>et</strong> template. Les réactions ont conduit à la formation <strong>de</strong> nouveaux<br />
monomères, dimères, trimères <strong>et</strong> tétramères.<br />
Pour tous les coronands, les monomères (5 composés) <strong>et</strong> les dimères (7<br />
composés) ont été isolés <strong>et</strong> été analysés Pour le composé possédant <strong>de</strong>ux unités<br />
éthylèneoxy<strong>de</strong>, le tétramère a été également isolé.<br />
Dans le cas <strong>de</strong>s cyclophanes, tous les monomères (3 composés), les<br />
dimères (2 composés) <strong>et</strong> les trimères (2 composés) <strong>de</strong>s para-méta <strong>et</strong> para-ortho<br />
cyclophanes ont été séparés <strong>et</strong> analysés.<br />
L’analyse structurale qui a été réalisée par RMN haut champ (incluant <strong>de</strong>s<br />
expériences ROESY <strong>et</strong> NOESY <strong>et</strong> <strong>de</strong>s étu<strong>de</strong>s à température variable), diffraction<br />
<strong>de</strong> rayons X (six structures moléculaires) <strong>et</strong> spectrométrie <strong>de</strong> masse (MALDI <strong>et</strong><br />
ESI-MS) a montré :<br />
• <strong>de</strong>s interactions intra <strong>et</strong> intermoléculaires entre les cycles<br />
aromatiques (π-stacking),<br />
• un équilibre conformationnel particulier (inversion en tan<strong>de</strong>m d’après<br />
la dynamique d’un rocking chair) pour les cycles 1,3-dioxaniques du<br />
para-para cyclophane 30a,<br />
• la préférence <strong>de</strong>s coronands pour la compléxation <strong>de</strong>s cations <strong>de</strong><br />
Na + <strong>et</strong> K + .<br />
• la modification <strong>de</strong> la dimension <strong>de</strong>s cavités <strong>de</strong>s coronands à haute<br />
énergie (par la rupture <strong>de</strong>s interactions intramoléculaires) ayant<br />
comme conséquence une augmentation <strong>de</strong> la préférence pour la<br />
complexation <strong>de</strong> cations <strong>de</strong> gran<strong>de</strong> taille (Cs + ),<br />
• la formation d’aggrégats supramoléculaires comportant <strong>de</strong>s<br />
macrocycles <strong>et</strong> <strong>de</strong>s molécules <strong>de</strong> solvant pour le macrocycle<br />
spiranique 22a (inclusion d’eau) <strong>et</strong> pour le para-méta cyclophane<br />
31a (inclusion <strong>de</strong> chloroforme)<br />
L’analyse structurale <strong>de</strong>s substrats utilisés pour la synthèse <strong>de</strong>s coronands<br />
<strong>et</strong> cyclophanes, a montré un important <strong>de</strong>gré <strong>de</strong> préorganisation (arrangement<br />
structural) favorable à la macrocyclisation.<br />
53
5. Conclusion générale<br />
Lors <strong>de</strong> ce travail, nous avons réalisé la synthèse <strong>et</strong> l’analyse structurale <strong>de</strong><br />
16 nouveaux composés 1,3-dioxaniques substitués en position 2 par divers<br />
substituants aromatiques ou aliphatiques <strong>et</strong> <strong>de</strong> 20 nouveaux composés<br />
macrocycliques (13 coronands à motif spiranique <strong>et</strong> 7 cyclophanes) sous forme <strong>de</strong><br />
8 monomères, 9 dimères, 2 trimères <strong>et</strong> 1 tétramère. Nous avons synthétisé <strong>et</strong><br />
analysé 12 nouveaux composés spiraniques <strong>et</strong> dérivés 1,3-dioxaniques à partir du<br />
1,4-diacétyl benzène. Ceux-ci ont été utilisés comme intermédiaires pour la<br />
synthèse <strong>de</strong> composés macrocycliques.<br />
La conception <strong>de</strong>s composés macrocycliques a été basée sur la<br />
connaissance <strong>de</strong> la stéréochimie <strong>de</strong> ces précurseurs <strong>et</strong> sur la préorganisation <strong>de</strong><br />
ces molécules, favorable à la ferm<strong>et</strong>ure <strong>de</strong>s macrocycles.<br />
L’analyse structurale a été élaborée à partir <strong>de</strong>s résultats <strong>de</strong>s expériences à<br />
l’état soli<strong>de</strong> par diffraction <strong>de</strong> rayons X (7 structures moléculaires) <strong>et</strong> en solution<br />
par RMN haut champ (ROESY, NOESY <strong>et</strong> spectres à température variable). Ces<br />
étu<strong>de</strong>s ont été complétées par <strong>de</strong>s expériences <strong>de</strong> spectrométrie <strong>de</strong> masse (CI-<br />
MS <strong>et</strong> EI-MS, MALDI <strong>et</strong> ESI-MS pour les macrocycles <strong>et</strong> HRMS <strong>et</strong> balayages<br />
combinés B/E = cste sur les ions fragments <strong>de</strong>s composés disubstitués en position<br />
2,2 sur les systèmes 1,3-dioxaniques).<br />
Ces résultats nous ont permis <strong>de</strong> :<br />
• déterminer la préférence conformationnelle <strong>de</strong> divers substituants du<br />
cycle 1,3-dioxanique,<br />
• démontrer la différence <strong>de</strong> fragmentation en EI-MS entre <strong>de</strong>s<br />
diastéréoisomères cis <strong>et</strong> trans <strong>de</strong>s dérivés 1,3-dioxaniques <strong>et</strong> la<br />
préférence pour la fragmentation impliquant le clivage <strong>de</strong>s<br />
groupements axiaux en position 2 du cycle 1,3-dioxanique,<br />
• synthétiser <strong>de</strong>s composés possédant <strong>de</strong>s cavités différentes,<br />
d’obtenir divers termes (<strong>de</strong>s monomères aux tétramères), grâce à la<br />
géométrie particulière <strong>de</strong>s composés <strong>de</strong> départ <strong>et</strong> à l’utilisation d’une<br />
large gamme <strong>de</strong> réactifs (di à hexa éthylène glycol),<br />
• déterminer les interactions π-stacking intra <strong>et</strong> intermoléculaires pour<br />
les macrocycles à motif spiranique <strong>et</strong> pour les cyclophanes,<br />
• m<strong>et</strong>tre en évi<strong>de</strong>nce une inversion en tan<strong>de</strong>m <strong>de</strong>s cycles 1,3dioxaniques<br />
du para-para cyclophane <strong>et</strong> le mouvement régulier <strong>de</strong>s<br />
cycles aromatiques d’après une mécanique i<strong>de</strong>ntique à celle d’un<br />
« rocking chair ». Ce type d’équilibre conformationnel n’a jamais été<br />
observé ; il a fait l’obj<strong>et</strong> d’une <strong>de</strong> nos récentes publications ;<br />
• m<strong>et</strong>tre en évi<strong>de</strong>nce la formation <strong>de</strong>s agrégats supramoléculaires<br />
entre les composés macrocycliques <strong>et</strong> les molécules <strong>de</strong> solvants <strong>et</strong><br />
<strong>de</strong>s autoassemblages particuliers dans les réseaux par <strong>de</strong>s<br />
interactions supramoléculaires.<br />
54
PREMIERE PARTIE<br />
REFERENCES<br />
1 Anteunis, M.J.O. ; Tavernier, D. ; Borremans, F. H<strong>et</strong>erocycles 1976, 4, 293.<br />
8 Muntean, L. ; Balog, M. ; Florian, C. ; Terec, A. ; Grosu, I. ; Mager, S. ; Margineanu, D. Stud.<br />
Univ. « Babes-Bolyai », Chem. 2002, 47, 195.<br />
10 Eliel, E.L.; Knoeber, M.C. J. Am. Chem. Soc 1968, 90, 3444.<br />
33 Balog, M.; Tötös, S.; Florian, C.M.; Grosu, I.; Plé, G.; Toup<strong>et</strong>, L.; Ramon<strong>de</strong>nc, Y.; Dinca, N.<br />
H<strong>et</strong>erocyclic Commun. sous presse.<br />
34 Constable, E.C.; Smith, D.R. T<strong>et</strong>rahedron 1997, 53, 1715.<br />
37 Grosu, I.; Balog, M.; Paisz, C.; Plé, G.; Irimie, F.; Mager, S.; Po<strong>de</strong>a, R. Rev. Roum. Chim. 2000,<br />
45, 877.<br />
42 Balog, M.; Ramon<strong>de</strong>nc, Y.; Plé, G.; Oprean, I.; Grosu, I. H<strong>et</strong>erocyclic Commun. en preparation.<br />
43 Bailey, W.F.; Connon, H.; Eliel, E.L.; Wiberg, K.B. J. Am. Chem. Soc 1978, 100, 2202.<br />
44 Van <strong>de</strong> San<strong>de</strong>, C.C.; Van Gaever, F.; Hanselaer, R.; Van<strong>de</strong>walle, M. Z. Naturforsch.1977, 32b,<br />
810.<br />
45 Claeys, M.; Van Haver, D. Org. Mass Spectrom. 1977, 12, 531.<br />
46 Dhaenens, L.; Van <strong>de</strong> San<strong>de</strong>, C.C.; Van Gaever, F. Org. Mass Spectrom. 1979, 14, 145.<br />
47 Dhaenens, L.; Van <strong>de</strong> San<strong>de</strong>, C.C.; Schelfaut, M.; Van<strong>de</strong>walle, M. Org. Mass Spectrom. 1987,<br />
22, 330.<br />
48 Munson, B.; Jelus, B. L.; Hatch, F.; Morgan Jr.,T.K.; Murray Jr., R.K. Org. Mass Spectrom. 1980,<br />
15, 161.<br />
49 Van Gaever, F.; Monstrey, J.; Van <strong>de</strong> San<strong>de</strong>, C.C. Org. Mass Spectrom. 1977, 12, 200.<br />
50 Pihlaja, K.; Jalonen, J. Org. Mass. Spectrom. 1971, 5, 1363.<br />
51 Jalonen, J.; Pihlaja, K. Org. Mass. Spectrom. 1973, 7, 1203.<br />
52 Chen, Y.Z.; Li, H.; Yang, H.J.; Hua, S.M.; Li, H.Q.; Zhao, F.Z.; Chen, N.Y. Org. Mass Spectrom.<br />
1988, 23, 821.<br />
53 Suming, H.; Yaozu, C.; Longfei, J.; Shuman, X. Org. Mass Spectrom. 1986, 21, 7.<br />
54 Green, M.M. Mass Spectrom<strong>et</strong>ry and the Stereochemistry of organic molecules in Topics in<br />
Stereochemistry eds.: Eliel, E.L.; Allinger, N.L.; 1975, 9, p.35.<br />
55 Loutelier, C.; Balog, M.; Grosu, I.; Ramon<strong>de</strong>nc, Y., Plé. G.; Lange, C.; Rapid Commun. Mass<br />
Spectrom., soumise.<br />
DEUXIEME PARTIE<br />
1 Izatt, R.M.; Pawlak, K.; Bradshaw, J.S.; Bruening, R.L. Chem. Rev. 1991, 91, 1721.<br />
28 Bauer, H.; Stier, F.; P<strong>et</strong>ry, C.; Knorr, A.; Stadler, C.; Staab, H. A. Eur. J. Org. Chem. 2001, 3255.<br />
49 Korybut-Daszkiewicz, B.; Wiéckowska, A.; Bilewicz, R.; Domagala, S.; Woźniak, K. J. Am.<br />
Chem. Soc., 2001, 123, 9356.<br />
61 Tozawa, T.; Misawa, Y.; Tokita, S.; Kubo, Y. T<strong>et</strong>rahedron L<strong>et</strong>ters 2000, 41, 5219.<br />
66 Grosu, I.; Bogdan, E.; Plé, G.; Toup<strong>et</strong>, L.; Ramon<strong>de</strong>nc, Y.; Condamine, E.; Peulon-Agasse, V.;<br />
Balog, M. Eur. J. Org. Chem. 2003, 3153.<br />
84 Park, K. K.; Lim, H.; Kim, S.-H.; Bae, D.-H. J. Chem. Soc. Perkin Trans 1 2002, 310.<br />
104 Mertens, I.J.A.; Jenneskens, L.W.; Vli<strong>et</strong>stra, E.J.; van <strong>de</strong>r Kerk-van Hoof, A.C.; Zwikker, J.W.; Sme<strong>et</strong>s,<br />
W.J.J.; Spek, A.L. J. Chem. Soc., Chem. Commun. 1995, 1621.<br />
105 Ranganathan, D.; Haridas, V.; Karle, I.L. T<strong>et</strong>rahedron 1999, 55, 6643.<br />
108 Godbert, N.; Batsanov, A. S.; Bryce, M. R.; Howard, J. A. K. J. Org. Chem. 2001, 66, 713.<br />
109 Christensen, C. A.; Batsanov, A. S.; Bryce, M. R.; Howard, J. A. K. J. Org. Chem. 2001, 66, 3313.<br />
110 Wang, T.; Bradshaw, J.S.; Huszthy, P.; Kou, X.; Kent Dalley, N.; Izatt, R.M. J. H<strong>et</strong>erocyclic<br />
Chem 1993, 31, 1.<br />
120 Tae, J.; Yang, Y.-K. Org. L<strong>et</strong>t. 2003, 5, 741.<br />
151 Grosu, I.; Mager, S.; Plé, G.; Horn, M. J. Chem. Soc. Chem. Commun. 1995, 167.<br />
152 Grosu, I.; Mager, S.; Plé, G. J. Chem. Soc. Perkin Trans. 2 1995, 1351.<br />
156 Terec, A.; Grosu, I.; Muntean, L.; Toup<strong>et</strong>, L.; Plé, G.; Socaci, C.; Mager, S T<strong>et</strong>rahedron 2001,<br />
57, 8751.<br />
157 Muntean, L.; Grosu, I.; Mager, S.; Plé, G.; Balog, M.; T<strong>et</strong>rahedron L<strong>et</strong>t. 2000, 41, 1967.<br />
55
164 Balog, M.; Grosu, I.; Plé, G.; Ramon<strong>de</strong>nc, Y.; Toup<strong>et</strong>, L.; Condamine, E.; Lange, C.; Loutelier,<br />
C.; Peulon-Agasse, V.; Bogdan, E. T<strong>et</strong>rahedron 2004 accepté.<br />
166 Anteunis, M.J.O.; Tavernier, D.; Borremans, F. H<strong>et</strong>erocycles 1976, 4, 293.<br />
167 Jennings, W.B.; Farrell, B.M.; Malone, J.F. Acc. Chem. Res. 2001, 34, 885.<br />
168 Naumann, C.; Román, E.; Peinador, C.; Ren, T.; Patrick, B.O.; Kaifer, A.E.; Sherman, J.C.;<br />
Chem. Eur. J. 2001, 7, 1637.<br />
169 Bryce, M.R.; Basanov, A.S.; Finn, T.; Hansen, T.K.; Moore, A.J.; Howard, J.A.K.; Kamenjicki,<br />
M.; Lednev, I.G.; Asher, S.A. Eur. J. Org. Chem 2001, 933.<br />
170 Dam, M.A.; Weitz, A.; Helgensen, R.; Wu<strong>de</strong>, B.M.F. J. Org. Chem. 2000, 65, 3941.<br />
171 Schenning, A.P.H.J.; Escu<strong>de</strong>r, B.; van Nunen, J.L.M.; <strong>de</strong> Bruin, B.; Löwik, D.W.P.M.; Rowan,<br />
A.E.; van <strong>de</strong>r Gaast, S.J.; Feiters, M.C.; Nolte, R.J.M. J. Org. Chem. 2001, 66, 1538.<br />
172 Steed, J.W.; Atwood, J.L. Supramolecular Chemistry, Wiley, Chichester, 2000, p.156.<br />
173 Merz, A.; Schnei<strong>de</strong>r, O.; Parkanyi, L. Angew. Chem. Int. Ed. Engl. 1996, 35(20), 2369.<br />
174 Bouas-Laurent, H.; Castellan, A.; Daney, M.; Desvergne, J.P.; Guinand, G.; Marsau, P.; Riffaud,<br />
M.H. J. Am. Chem. Soc. 1986, 108, 315.<br />
175 Inoue, Y.; Liu, Y.; Amano, F.; Ouchi, M.; Tai, A.; Hakusi, T. J. Chem. Soc. Dalton Trans. 1988,<br />
2735.<br />
176 Grosu, I.; Plé, G.; Mager, S. T<strong>et</strong>rahedron 1995, 51, 2659.<br />
177 Crabb, T.A.; Porssa, M.; Elmore, N.E. Magn. Reson. Chem. 1991, 29, 613.<br />
178 Juaristi, E.; Martinez, R.; Men<strong>de</strong>z, R.; Soriano-Garcia, M.; Eliel, E.L.; P<strong>et</strong>son, A.; Glass, R.S. J.<br />
Org. Chem. 1987, 52, 3806.<br />
179 Vögtle, F. Cyclophane Chemistry: Synthesis, Structures and Reactions; John Wiley and Sons:<br />
Chichester, UK, 1993.<br />
180 Eliel, E. L.; Wilen, S. Stereochemistry of Organic Compounds, Wiley & Sons, New York 1994, p.<br />
1166.<br />
181<br />
Smith, M.B.; March, J. Advanced Organic Chemistry Wiley, New York, 2001, p. 135.<br />
182<br />
Dominguez, Z.; Dang, H.; Strouse, M. J.; Garcia-Garibay, A. J. Am. Chem. Soc. 2002, 124,<br />
7719.<br />
183<br />
Gibson, S.E.; Knight, J.D. Org. Biomol. Chem. 2003, 1, 1256.<br />
184<br />
Rozenberg, V.I.; Danilova, T.I.; Sergeeva, E.V.; Shouklov, I.A.; Starikova, Z.A.; Hopt, H.;<br />
Kühlein, K. Eur. J. Org. Chem. 2003, 432.<br />
185 Islas-Gonzales, G.; Bois-Choussy, M.; Zhu J. Org. Biomol. Chem. 2003, 1, 30.<br />
186 Wu, X.–W.; Yuan, K.; Sun, W.; Zhang M.–J.; Hou, X.–L. T<strong>et</strong>rahedron Asymm<strong>et</strong>ry 2003, 14, 107.<br />
187 Braddock, D.C.; MacGilp, I.D.; Perry, B.G. J. Org. Chem. 2002, 67, 8679.<br />
188 Cipiciani, A.; Fringuelli, F.; Piermatti, O.; Pizzo, F.; Ruzziconi, R. J. Org. Chem. 2002, 67, 2665.<br />
189 Taticchi, A.; Minuti, L.; Marrocchi, A.; Lanari, D.; Gacs-Baitz, E. T<strong>et</strong>rahedron Asymm<strong>et</strong>ry 2002,<br />
13, 1331.<br />
190 Sergeeva, E.V.; Rozenberg, V.I.; Antonov, D.Y.; Vorontsov E.V.; Starikova, Z.A.; Hopt, H.;<br />
T<strong>et</strong>rahedron Asymm<strong>et</strong>ry 2002, 13, 1121.<br />
191 Minuti, L.; Taticchi, A.; Rosini, C.; Lanari, D.; Marrocchi, A.; Superchi, S. T<strong>et</strong>rahedron<br />
Asymm<strong>et</strong>ry 2002, 13, 1257.<br />
192 Smith, B.B.; Hill, D.E.; Cropp, T.A.; Walsh, R.D.; Cartr<strong>et</strong>te, D.; Hipps, S.; Shachter, A.M.;<br />
Pennington, W.T.; Kwochka, W.R. J. Org. Chem. 2002, 67, 5333.<br />
193 Collins, S.K.; Yap, G.P.A.; Fallis, A.G. Organic L<strong>et</strong>ters 2002, 4, 11.<br />
194 Nielsen, K.A.; Jeppesen, J.O.; Levillain, E.; Thorup, N.; Becher, J. Organic L<strong>et</strong>ters 2002, 4,<br />
4189.<br />
195 Rajakumar, P.; Murali, V.; T<strong>et</strong>rahedron L<strong>et</strong>t. 2002, 43, 7695.<br />
196 Srinivasan, M.; Sankararaman, S.; Hopf, H.; Dix, I.; Jones, P.G. J. Org. Chem. 2001, 66, 4299.<br />
197 Yamato, T.; Fujita, K.; Tsuzuki, H. J. Chem. Soc. Perkin Trans. 1 2001, 2089.<br />
198 Benniston, A.C.; Clegg, W.; Harriman, A.; Harrington, R.W.; Li, P.; Sams, C. T<strong>et</strong>rahedron L<strong>et</strong>t.<br />
2003, 44, 2665.<br />
199 Srinivasan, M.; Sankararaman, S.; Hopf, H.; Varghese B. Eur. J. Org. Chem. 2003, 660.<br />
200 Prautzsch, V.; Ibach, S.; Vögtle, F. J. Inclusion Phenom. Macrocyclic Chem. 1999, 33, 427.<br />
201 Boyer, P.D. Angew. Chem. 1998, 110, 2424-2307; Angew. Chem. Int. Ed. 1998, 37, 2296.<br />
202 Walker, J.E. Angew. Chem. 1998, 110, 2438-2450; Angew. Chem. Int. Ed. 1998, 37, 2308.<br />
203 Schalley, C.A.; Beizai, K.; Vögtle, F. Acc. Chem. Res. 2001, 34, 465.<br />
204 Balzani, V.; Credi, A.; Raymo F.M.; Stoddart, J.F. Angew. Chem. Int. Ed. 2000, 39, 3348.<br />
205 Kelly, T.R.; Silva, R.A.; De Silva, H.; Jasmin, S.; Zhao, Y. J. Am. Chem. Soc. 2000, 122, 6935.<br />
206 Balzani, V.; Gómez-López, M.; Stoddart, J.F. Acc. Chem. Res. 1998, 31, 405.<br />
56
207 Dominguez, Z.; Dang, H.; Strouse, M.J.; Garcia-Garibay, A. J. Am. Chem. Soc. 2002, 124,<br />
2398.<br />
208 Kelly, T.R.; Bowyer, M.C.; Bhaskar, K.V.; Bebbington, D.; Garcia, A.; Lang, F.; Kim, M.H.; J<strong>et</strong>te,<br />
M.P. J. Am. Chem. Soc. 1994, 116, 3657.<br />
209<br />
Kelly, T.R.; Sestelo, J.P.; Tellitu, M.P. J. Org. Chem. 1998, 63, 3655.<br />
210<br />
Bedard, T.C.; Moore, J.S. J. Am. Chem. Soc. 1995, 117, 10662.<br />
211<br />
Cao, J.; Fyfe, M.C.T.; Stoddart, J.F.; Cousins G.R.L.; Glink, P.T. J. Org. Chem. 2000, 65, 1937.<br />
212<br />
Julian, R.R.; May, J.A.; Stoltz, B.M.; Beauchamp, J.L. Angew. Chem. Int. Ed. 2003, 42, 1012.<br />
213<br />
Burley, S.K.; P<strong>et</strong>sko G.A. Science 1985, 229, 23.<br />
214<br />
Burley, S.K.; P<strong>et</strong>sko G.A. Adv. Protein Chem. 1988, 39, 125.<br />
215<br />
Brandl, M.; Weiss, M.S.; Jabs, A.; Sühnel, J.; Hilgenfeld, R. J. Mol. Biol. 2001, 307, 357.<br />
216<br />
Fyfe, M.C.T.; Stoddart, J.F. Acc. Chem. Res. 1997, 30, 393.<br />
217<br />
Kim, K.S.; Tarakeshwar, P.; Lee, J.Y. Chem. Rev. 2000, 100, 4145.<br />
218<br />
Brutschy, B. Chem. Rev. 2000, 100, 3891.<br />
219<br />
Mahoney, J.M.; Shukla, R.; Marshall, R.A.; Beatty, A.M.; Zajicek, J.; Smith B.D. J. Org. Chem.<br />
2002, 67, 1436.<br />
220<br />
Kishikawa, K.; Tsubokura, S.; Kohmoto, S.; Yamamoto, M.; Yamaguchi, K. J. Org. Chem. 1999,<br />
64, 7568.<br />
221 Chessari, G.; Hunter, C.A.; Low, C.M.R.; Packer, M.J.; Vinter, J.G.; Zonta, C. Chem. Eur. J.<br />
2002, 8, 2860.<br />
222 Ribas, J.; Cubero, E.; Luque, F.J.; Orozco, M. J. Org. Chem. 2002, 67, 7057.<br />
223 Carver, F.J.; Hunter, C.A.; Livingstone, D.J.; McCabe, J.F.; Seward, E.M. Chem. Eur. J. 2002, 8,<br />
2847.<br />
224 Cozzi, F.; Annunziata, R.; Benaglia, M.; Cinquini, M.; Raimondi, L.; Baldridge, K.K.; Siegel, J. S.<br />
Org. Biomol. Chem. 2003, 1, 157.<br />
225 Rashkin, M.J.; Walters, M.L. J. Am. Chem. Soc. 2002, 124, 1860.<br />
226 Kim, C.-Y.; Chandra, P.P.; Jain, A.; Christianson, D.W. J. Am. Chem. Soc. 2001, 123, 9620.<br />
227 Acharya, P.; Plashkevych, O.; Morita, C.; Yamada, S.; Chattopadhyaya, J. J. Org. Chem. 2003,<br />
68, 1529.<br />
228<br />
Nakamura, K.; Houk, K.N. Org. L<strong>et</strong>t. 1999, 1, 2049.<br />
229<br />
Martin, C.B.; Mulla, H.R.; Willis, P.G., Cammers-Goodwin, A. J. Org. Chem. 1999, 64, 7802.<br />
230<br />
Grosu, I.; Mager, S.; Plé, G.; Plé, N.; Toscano, A.; Mesaros, E.; Martinez, R. Liebigs<br />
Annalen/Recueil, 1997, 2371.<br />
231<br />
Grosu, I.; Mager, S.; Toup<strong>et</strong>, L.; Plé, G.; Mesaros, E.; Mihis, A. Acta Chem. Scand. 1998, 52,<br />
366.<br />
232<br />
Grosu, I.; Muntean, L.; Toup<strong>et</strong>, L.; Plé, G.; Pop, M.; Balog, M.; Mager, S.; Bogdan, E. Monatsh.<br />
Chem., 2002, 133, 631.<br />
233 Balog, M.; Grosu, I.; Plé, G.; Ramon<strong>de</strong>ncCondamine, E.; Varga, R. J. Org. Chem. 2004, 69,<br />
1337.<br />
234 Hwang, T.L.; Shaka, A.J. J. Am. Chem. Soc. 1992, 114, 3157.<br />
235 Bax, A.; Davis, D.G. J. Magn. Reson. 1985, 63, 207.<br />
236 Haigh, C.W.; Mallion, R.B. Org. Magn. Reson. 1972, 4, 203.<br />
237 Boyd, J.; Skrynnikov, N.R. J. Am. Chem. Soc. 2002, 124, 1832.<br />
57