- Page 1 and 2:
H PRÉPA TOUT EN UN CHIMIE PCSI •
- Page 3 and 4:
HPRÉPA TOUTENUN CHIMIE PCSI André
- Page 5 and 6:
Cet ouvrage est conforme aux progra
- Page 7 and 8:
1 OBJECTIFS • Connaître les quat
- Page 9 and 10:
a) b) 700 l (nm) 600 500 400 Doc. 2
- Page 11 and 12:
E E n E n l’absorption d’un pho
- Page 13 and 14:
E 1s Doc. 13 Configuration électro
- Page 15 and 16:
•La configuration électronique d
- Page 17 and 18:
Le métal cuivre Cu, l’hydroxyde
- Page 19 and 20:
Doc. 23 Nombre maximal d’élémen
- Page 21 and 22:
Le terme générique d’élément
- Page 23 and 24:
Doc. 27 a) 3 Cl 2(g) + 2 Al(s) = 2
- Page 25 and 26:
a) b) N + 2p 2 N2p 3 O +2p3 O2p 4 D
- Page 27 and 28:
1 2 3 4 5 6 7 1 1 H χ M : 2,21 χ
- Page 29 and 30:
Les nombres quantiques CQFR L’ét
- Page 31 and 32:
Applications directes du cours 1 D
- Page 33 and 34:
15 Ionisation 1 • Indiquer dans q
- Page 35 and 36:
26 L’élément cuivre Le cuivre e
- Page 37 and 38:
(*) Un corps simple est constitué
- Page 39 and 40:
a) H-F b) H-O-H c) d) H H-N-H H H-C
- Page 41 and 42:
a) b) Cl F F Cl Cl P Cl Cl F S F Do
- Page 43 and 44:
(*) La prise en compte des doublets
- Page 45 and 46:
Établir la représentation de Lewi
- Page 47 and 48:
+ d - d A B p→ Doc. 13 Orientatio
- Page 49 and 50:
(*) La première formule ci-dessus
- Page 51 and 52:
Déterminer les principales formule
- Page 53 and 54:
(*) Dans le propénal, les deux dou
- Page 55 and 56:
■ m + n = 2 AX 2E 0 : l’édific
- Page 57 and 58:
a) b) c) H H - C - H H H - N - H H
- Page 59 and 60:
a) b) Cl 120° Cl Cl Cl P PCl 5 typ
- Page 61 and 62:
- 1 2 + 1 O G + - 1 2 ep O • O
- Page 63 and 64:
III - Espèces à liaisons délocal
- Page 65 and 66:
Applications directes du cours 1 Co
- Page 67 and 68:
1 • Préciser le caractère polai
- Page 69 and 70:
3 OBJECTIFS • Savoir définir et
- Page 71 and 72:
(*) Soit un système fermé, siège
- Page 73 and 74:
Sens direct ou sens 1 → Sens inve
- Page 75 and 76:
0 [B i] M 1 t 1 ' Doc. 10 Interpré
- Page 77 and 78:
La pyrolyse de l’éthanal selon :
- Page 79 and 80:
(*) La combustion du mélange d’a
- Page 81 and 82:
a a/2 a/4 [A] -a . k . t [A] = a .
- Page 83 and 84:
• On réduit au même dénominate
- Page 85 and 86:
(*) • Pour la réaction d’équa
- Page 87 and 88:
Vitesses de réaction 8 Déterminat
- Page 89 and 90:
Vitesses de réaction • p ≠ 1 :
- Page 91 and 92:
Vitesses de réaction COURS On en d
- Page 93 and 94:
Facteurs cinétiques Vitesses de r
- Page 95 and 96:
6 Décomposition de l’anion perox
- Page 97 and 98:
2 • Le suivi de la réaction est
- Page 99 and 100:
18 Oxydation des ions iodure par le
- Page 101 and 102:
c. Expliquez comment vous préparer
- Page 103 and 104:
CH 3 (1) + HNO 3 (2) CH 3 CH 3 NO 2
- Page 105 and 106:
2.2.3. Généralisation ; contrôle
- Page 107 and 108:
n 0 2 n 0 3 n 0 3 0 nCH3COOH (t) nC
- Page 109 and 110:
(*) Bien que la désintégration de
- Page 111 and 112:
1,0 0,8 0,6 0,4 0,2 0 [X] a A 2 B 4
- Page 113 and 114:
1,0 0,8 0,6 0,4 0,2 0 v k 1.a V fB
- Page 115 and 116:
CQFR Dans un processus complexe met
- Page 117 and 118:
En déduire l’expression des conc
- Page 119 and 120:
a. Établir le système d’équati
- Page 121 and 122:
. Tracer ln = f(t) ou effectuer u
- Page 123 and 124:
2 • Déterminer, tout d’abord,
- Page 125 and 126:
a. Quel est l’intérêt d’avoir
- Page 127 and 128:
5 OBJECTIFS • Savoir distinguer l
- Page 129 and 130:
(*) Au niveau moléculaire : la not
- Page 131 and 132:
I H I H Cl I H I H Doc. 3 Chocs bim
- Page 133 and 134:
À tout instant : Ep(t) + Ec(t) = E
- Page 135 and 136:
Cl C Cl C H Doc. 13 L’énergie li
- Page 137 and 138:
Exemple : L’action du permanganat
- Page 139 and 140:
1,0 0,8 0,6 0,4 0,2 0 [X] a B A 50
- Page 141 and 142:
Mécanismes réactionnels en cinét
- Page 143 and 144:
(*) Pour un acte élémentaire, l
- Page 145 and 146:
Mécanismes réactionnels en cinét
- Page 147 and 148:
Doc. 26 Maillons de la chaîne réa
- Page 149 and 150:
Mécanismes réactionnels en cinét
- Page 151 and 152:
Mécanismes réactionnels en cinét
- Page 153 and 154:
Intermédiaires réactionnels Méca
- Page 155 and 156:
2 • Un récipient transparent, co
- Page 157 and 158:
13 Théorie de Lindeman Il arrive s
- Page 159 and 160:
1 • Le mécanisme réactionnel su
- Page 161 and 162:
CH • 3 + HBr c CH 4 + Br • (4)
- Page 163 and 164:
2 • Donc seule la réaction (1) e
- Page 165 and 166:
6 OBJECTIFS • Connaître les repr
- Page 167 and 168:
formule semidéveloppée formule to
- Page 169 and 170:
a) b) H H H H C H H H H H C 109 pm
- Page 171 and 172:
1 modèle éclaté en perspective D
- Page 173 and 174:
APPLICATION 1 Représentations de N
- Page 175 and 176:
a) b) a) inversion de conformation
- Page 177 and 178:
configuration q fus (°C) qéb (°C
- Page 179 and 180:
Classer les groupes substituants de
- Page 181 and 182:
Déterminer la configuration absolu
- Page 183 and 184:
a) b) H H HOOC H 3C H H OH H H H H
- Page 185 and 186:
observateur rayon lumineux plan de
- Page 187 and 188:
(*) Racémique vient du latin racem
- Page 189 and 190:
HO H H COOH COOH COOH HOOC H H OH O
- Page 191 and 192:
(R)-B + (S)-B + (R)-A énantiomère
- Page 193 and 194:
Doc. 55 Exemples de propriétés di
- Page 195 and 196:
Stéréochimie des molécules organ
- Page 197 and 198:
Applications directes du cours REPR
- Page 199 and 200:
*Conformation - configuration Les c
- Page 201 and 202:
) d. e. ) f. g) g. Double liaison (
- Page 203 and 204:
41 *Combien d’atomes de carbone a
- Page 205 and 206:
Atome asymétrique et double liaiso
- Page 207 and 208:
(*) Les phéromones sont des substa
- Page 209 and 210:
(*) Énergies de liaison : DC=C = 6
- Page 211 and 212:
La flèche traduit le mouvement du
- Page 213 and 214:
(*) Lorsque les deux substituants R
- Page 215 and 216:
3.1.2.3. Caractère ionique de la r
- Page 217 and 218:
H 3C H C C C 2H 5 H Doc. 13 Les qua
- Page 219 and 220:
(*) Selon le solvant utilisé, l’
- Page 221 and 222:
(*) L’effet attracteur du groupe
- Page 223 and 224:
alcène 3.3.2. Observations expéri
- Page 225 and 226:
(*) M.S. KHARASCH, (1895-1957), Uni
- Page 227 and 228:
(*) Il se forme une mince couche d
- Page 229 and 230:
Réactivité de la double liaison c
- Page 231 and 232:
Réactions d’addition (*) conditi
- Page 233 and 234:
Conseils : Dans les exercices, il c
- Page 235 and 236:
14 Proposer une suite de réactions
- Page 237 and 238:
(*) Dans l’industrie, l’éthoxy
- Page 239 and 240:
(*) L'hydrolyse du produit de la sy
- Page 241 and 242:
Ph Br Mg 2 C2H5 O O C2H5 C2H5 C2
- Page 243 and 244:
H 2O , H R -MgX R-H (*) Il ne s’
- Page 245 and 246:
R' C • Le schéma général est l
- Page 247 and 248:
R -Mg-X + H 2C= CH - X Pd(PPh 3) 4
- Page 249 and 250:
Organomagnésiens mixtes 8 COURS
- Page 251 and 252:
Doc. 12 Présentation des dérivés
- Page 253 and 254:
Doc. 12 Arrêt à la cétone dans l
- Page 255 and 256:
Organomagnésiens mixtes 6 Réactio
- Page 257 and 258:
Préparation R X + Mg dérivé halo
- Page 259 and 260:
Applications directes du cours 1 Hy
- Page 261 and 262:
Action d’un organomagnésien sur
- Page 263 and 264:
9 OBJECTIFS • Savoir décrire les
- Page 265 and 266:
(*) On utilise fréquemment la cons
- Page 267 and 268:
(*) En notant EOP = r . rur, les fo
- Page 269 and 270:
L z → L noyau Doc. 10 Moment cin
- Page 271 and 272:
Y2,1,0 = (2 pz) = Y2,1,±1 = (2 py)
- Page 273 and 274:
x O z G plan(p), de cote z o (S ) s
- Page 275 and 276:
99 % 50 % 99 % 99 % 2s 50 % 50 % 99
- Page 277 and 278:
Doc. 25 Courbes représentant gross
- Page 279 and 280:
(*) En Mécanique Quantique, un niv
- Page 281 and 282:
Doc. 30 Nombre quantique de spin s
- Page 283 and 284:
électron i électron j 1s ns, np n
- Page 285 and 286:
7 6 5 4 3 2 1 n 7 6 6 6 5 5 5 5f 4
- Page 287 and 288:
Le cas des éléments du bloc d est
- Page 289 and 290:
Doc. 37 Évolution du rayon atomiqu
- Page 291 and 292:
Modèle quantique de l’atome •
- Page 293 and 294:
Données : constante de Boltzmann :
- Page 295 and 296:
14 **Éléments de transition 1 •
- Page 297 and 298:
24 *Excitation par choc Les niveaux
- Page 299 and 300:
(*) La masse des noyaux étant beau
- Page 301 and 302:
Structure électronique des molécu
- Page 303 and 304:
a) 1s 1 b) 1s 1 c ou j H 1 c ou j H
- Page 305 and 306:
(*) b12 0 0 S 1 S 1 0 Doc. 9 Var
- Page 307 and 308:
E E H ∆E s ∗ 1s 1 ∆E s H 1 H
- Page 309 and 310:
Structure électronique des molécu
- Page 311 and 312:
Doc. 18 Interactions 2p-2pconduisan
- Page 313 and 314:
E s ∗ z s z s ∗ s s s 3.3.2. Di
- Page 315 and 316:
Doc. 27 La liaison dans la molécul
- Page 317 and 318:
Doc. 33 Les lignes d’isodensité
- Page 319 and 320:
Le recouvrement est d’autant plus
- Page 321 and 322:
E s * p * Doc. 36 Représentation s
- Page 323 and 324:
Doc. 41 Spectre d’absorption du b
- Page 325 and 326:
Cas des molécules diatomiques hét
- Page 327 and 328:
5 La molécule de difluor 1 • Que
- Page 329 and 330:
13 La molécule de diazote 1 • a.
- Page 331 and 332:
11 OBJECTIFS • Définitions, cara
- Page 333 and 334:
a) b) G - rp(X2) = r0 rp G + + - d
- Page 335 and 336:
espèce EK ED EL Cl2 0 0 49,5 CH4 0
- Page 337 and 338:
alcane Doc. 16 Températures d’é
- Page 339 and 340:
H C O H Doc. 21 Formation d’une l
- Page 341 and 342:
R C R O N H H a) N O R C R H N C H
- Page 343 and 344:
H O C a) O H O O H b) Doc. 33 Acide
- Page 345 and 346:
Les interactions de van der Waals C
- Page 347 and 348:
Pour certains calculs on pourra uti
- Page 349 and 350:
8 Températures de changement d’
- Page 351 and 352:
. La densité et la viscosité de c
- Page 353 and 354:
12 OBJECTIFS • Connaître les pos
- Page 355 and 356:
(*) Lorsque la masse molaire de l
- Page 357 and 358:
(*) La réaction d’un acide de Le
- Page 359 and 360:
Doc. 8 Types de réactions selon la
- Page 361 and 362:
(*) En présence d’un grand excè
- Page 363 and 364:
Doc. 12 Influence de la nature du g
- Page 365 and 366:
E p stabilisation de l'anion nuclé
- Page 367 and 368:
Doc. 18 Influence du groupe R de R-
- Page 369 and 370:
mécanisme étapes vitesse stéréo
- Page 371 and 372:
(*) Br 71 % Et-O , K , -HBr et Et
- Page 373 and 374:
E p H 3 C Br 2 CH 2 CH 3 H CH3 H H
- Page 375 and 376:
Br CH3 23 CH2CH3 H CH3 H -Br Compo
- Page 377 and 378:
Doc. 32 Une réaction se produisant
- Page 379 and 380:
H 3C H H3C-C-O CH3 CH 3 t-Bu-O CH
- Page 381 and 382:
Les dérivés halogénés CQFR •
- Page 383 and 384:
Applications directes du cours 1 Vo
- Page 385 and 386:
Réactions à compléter (ex. 18 à
- Page 387 and 388:
■ Réactions de type S N2 Réacti
- Page 389 and 390:
13 OBJECTIFS • Identifier les tro
- Page 391 and 392:
CH3 -CH2 -CH2 -NH2 propylamine N(CH
- Page 393 and 394:
formule NH (CH3)3N - (CH3CH2)3N - N
- Page 395 and 396:
100 80 60 40 20 0 2,5 Composés à
- Page 397 and 398:
(*)L’expression de cette constant
- Page 399 and 400:
(*) CH3(CH2) 6CH2Br 1 mol NH3 (2 mo
- Page 401 and 402:
Composés à liaison simple carbone
- Page 403 and 404:
4 • On fait réagir le mélange r
- Page 405 and 406:
14 OBJECTIFS • Connaître la synt
- Page 407 and 408:
fonction alcool phénol formule R-O
- Page 409 and 410:
La nomenclature officielle (recomma
- Page 411 and 412:
a) R O b) a) 100 % transmission H O
- Page 413 and 414:
molécule H3C-OH H3C-CH2-OH Doc. 14
- Page 415 and 416:
(*) Pour un étheroxyde aromatique
- Page 417 and 418:
(*) HO - ArO - pKA 14 H2O 10 Réact
- Page 419 and 420:
(*) Cette réaction constitue le pr
- Page 421 and 422:
E p (CH 3 ) 3 COH + HBr (CH3 ) 3CO
- Page 423 and 424:
R Facilité de déshydratation d’
- Page 425 and 426:
OH H2 SO4 ∆ pentan-3-ol c (E)-pen
- Page 427 and 428:
(*) C’est le plus souvent aussi l
- Page 429 and 430:
Définitions CQFR • Alcool R-OH p
- Page 431 and 432:
tribromure de phosphore Transformat
- Page 433 and 434:
8 Suite de réactions Réactions su
- Page 435 and 436:
Déshydratation (ex. 17 et 18) 18 1
- Page 437 and 438:
c. Préciser la nature du mécanism
- Page 439 and 440:
15 OBJECTIFS • Savoir décrire le
- Page 441 and 442:
paroi fixe système frontière mobi
- Page 443 and 444:
CaCO 3 (s) CO 2 (g) CaO (s) Doc. 5
- Page 445 and 446:
H (T 1 , x 2 ) H (T 1 , x 1 ) entha
- Page 447 and 448:
1CH 4 (g) + 2 O 2 (g) = 1 CO 2 (g)
- Page 449 and 450:
(*) Historiquement les relations (1
- Page 451 and 452:
Le volume des phases condensées es
- Page 453 and 454:
∆ r H 0 0 : réaction endothermi
- Page 455 and 456:
5.2.2. Températures de flamme adia
- Page 457 and 458:
T 2 T 1 température T du système
- Page 459 and 460:
6.2 Détermination par le calcul CO
- Page 461 and 462:
Déterminer, à 298 K, ∆ r1H 0 ,
- Page 463 and 464:
1 UO 2 (s) + 4 HF (g) 1 (a) + 4 (b)
- Page 465 and 466:
formule Vion DionU 0 atomes H 13,6
- Page 467 and 468:
Dfus H 0 corps purs Tfus (K) (kJ .m
- Page 469 and 470:
La dissociation d’une liaison O
- Page 471 and 472:
États et grandeurs standard CQFR
- Page 473 and 474:
Applications du premier principe à
- Page 475 and 476:
Cette réaction se déroule dans un
- Page 477 and 478:
Sous la pression de 101,3 kPa, le m
- Page 479 and 480:
Masses molaires (g . mol −1 ):Ca:
- Page 481 and 482:
(*) Dans une solution, les solutés
- Page 483 and 484:
Le plus souvent c 0 n’est pas men
- Page 485 and 486:
a) Q c K0 Q évolution dans le sens
- Page 487 and 488:
(*) L’Union Internationale de Chi
- Page 489 and 490:
température (°C) KA pKA 0 8,0 . 1
- Page 491 and 492:
a) a) % 90 % HNO2 - % NO2 % 90 80 7
- Page 493 and 494:
1) L’équation de la réaction qu
- Page 495 and 496:
DpH 0,01 2,3 % 0,05 11,5 % 0,1 23 %
- Page 497 and 498:
(*) Comme nous l’avons vu en Term
- Page 499 and 500:
Déterminer à 25 °C le pH d’une
- Page 501 and 502:
solution pH initial nature de l’a
- Page 503 and 504:
2,3.c 4 0 pseudo-tampon dû au coup
- Page 505 and 506:
pH s pH E 0 dpH ( dV ) V E E teinte
- Page 507 and 508:
14 pH 13 12 11 10 9 8 7 6 5 4 3 2 1
- Page 509 and 510:
(*) Lorsque la réaction de titrage
- Page 511 and 512:
H 2A H 2A HA - pK A1 pK A1 +2 pH pK
- Page 513 and 514:
Doc. 43 Simulation du titrage d’u
- Page 515 and 516:
• Pour tout couple acide-base (HA
- Page 517 and 518:
1 Activités d’espèces chimiques
- Page 519 and 520:
9 Réactions acido-basiques On cons
- Page 521 and 522:
1 • Déterminer le volume V 2E d
- Page 523 and 524:
31 Exercices en relation avec les t
- Page 525 and 526:
17 OBJECTIFS • Savoir définir et
- Page 527 and 528:
(*) Pour alléger l’écriture, no
- Page 529 and 530:
Doc. 4 Diagramme de prédominance d
- Page 531 and 532:
a) O CH -CO 2C-H2C 2 2 N-CH -CH -N
- Page 533 and 534:
(*) K f1 = K f2 = Doc. 11 Domaines
- Page 535 and 536:
Doc. 15 Un excès de lignand favori
- Page 537 and 538:
Doc. 18 Graphes simulés des pource
- Page 539 and 540:
accepteurs d'ions Fe3+ de plus en p
- Page 541 and 542:
c’est-à-dire :pF = - log [F - ]
- Page 543 and 544:
accepteurs d'ions Ca2+ de plus en p
- Page 545 and 546:
Réactions compétitives entre comp
- Page 547 and 548:
1 • On prépare 250 mL de solutio
- Page 549 and 550:
a. Quel ion est dosé en premier ?
- Page 551 and 552:
18 OBJECTIFS • Définition du pro
- Page 553 and 554:
composé AgCl AgBr AgI Ag2CrO4 Fe(O
- Page 555 and 556:
APPLICATION 1 Le précipité de sul
- Page 557 and 558:
Doc. 10 Pourcentage d’ions argent
- Page 559 and 560:
Une quantité n 0 = 1,0 . 10 -3 mol
- Page 561 and 562:
0 - 1 - 2 - 3 - 4 - 5 - 6 - 7 log s
- Page 563 and 564:
Une solution est maintenue saturée
- Page 565 and 566: 2) Exprimer la solubilité de Al(OH
- Page 567 and 568: - 2 - 3 - 4 - 5 - 6 - 7 - 8 - 9 log
- Page 569 and 570: On introduit, dans un bécher, les
- Page 571 and 572: 1 Formation et dissolution de préc
- Page 573 and 574: 13 Solubilité du nitrite d’argen
- Page 575 and 576: 1 • Que représente (s sol - s ea
- Page 577 and 578: Al 3+ (aq) + 3 e - = Al (s) Fe 3+ (
- Page 579 and 580: Dans l’eau H 2O, dans l’ion oxo
- Page 581 and 582: zinc COM Zn 2+ , SO 4 2- mA R pont
- Page 583 and 584: ) électrolyte (K zinc cuivre + + C
- Page 585 and 586: (*) Certains auteurs notent a l’e
- Page 587 and 588: tête isolante bouchon du tube de p
- Page 589 and 590: Dans tout exercice, il faudra, sur
- Page 591 and 592: (*) Ce résultat sera démontré en
- Page 593 and 594: Considérons la pile formée par l
- Page 595 and 596: APPLICATION 3 Couples Cu 2+ /Cu et
- Page 597 and 598: Ce4+ a) b) Fe 2+ K + SCN - solution
- Page 599 and 600: 2 1 0 E (V) E 0 (Ce 4+ /Ce 3+ ) E 0
- Page 601 and 602: Équilibres d’oxydoréduction CQR
- Page 603 and 604: 1 Nombre d’oxydation 1 • Après
- Page 605 and 606: 2 • Déterminer la composition de
- Page 607 and 608: V 2 (mL) % (mV) V2 (mL) % (mV) V2 (
- Page 609 and 610: Chapitre 1 1 1) Quatre niveaux d’
- Page 611 and 612: a) b) c) 9 H C 10 O C H CH2 CH2 H
- Page 613 and 614: 2) H H N ⇒ hybride de résonance
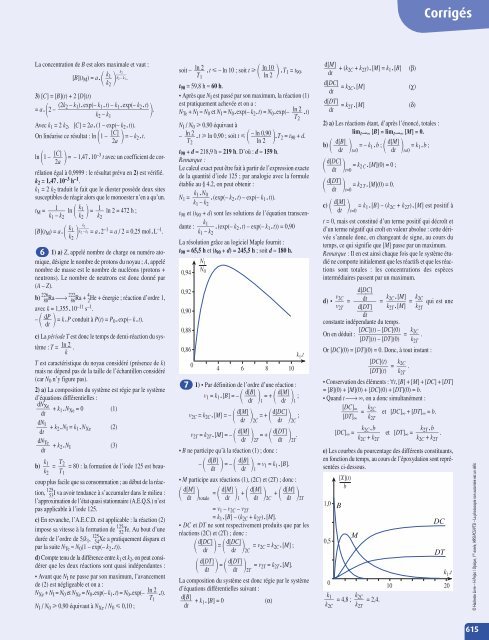
- Page 615: À tout instant, P CO + P Cl2 = (P
- Page 619 and 620: La courbe ln(a - x)=f(t) étant une
- Page 621 and 622: 1) Propane : CH3CH2CH3 ; éthoxyét
- Page 623 and 624: tion, la concentration de I reste f
- Page 625 and 626: a) CH a) 2CH3 CHO b) CH3 HO H c) C2
- Page 627 and 628: 31 Voir document ci-dessous : A (A,
- Page 629 and 630: • 5 étheroxydes avec liaison C=C
- Page 631 and 632: 2) HOOC C H H + D2O C anti COOH H D
- Page 633 and 634: 2) I2 + 2 S2O 2- 3 c 2 I - + S4O 2-
- Page 635 and 636: 3 e ionisation :E i3 = e(Co 3+ ) -
- Page 637 and 638: 2) a) Il diminue. L’O.M. p est d
- Page 639 and 640: 2) H O + 4) 5) H3N + 6) 7) Ph 8) 4
- Page 641 and 642: 3) (CH3) 3N CH3 (CH3) 3N + CH3 (CH3
- Page 643 and 644: Mécanisme S N1 : Le carbocation -C
- Page 645 and 646: c) d) A : R-OH ZnCl2 c HCl R-Cl où
- Page 647 and 648: 2) a) Action de l’ozone O3 puis h
- Page 649 and 650: 2) ∆' fH 0 [C 3H 4O (liq)] = 2 D
- Page 651 and 652: 2) Il suffit de tracer F = V. 10 -p
- Page 653 and 654: • V > V éq (V en mL) : [[HgCl 2]
- Page 655 and 656: 2) a) 2 NaN 3 = 2 Na + 3 N 2 b) Dan
- Page 657 and 658: 1 Interaction lumière - matière L
- Page 659 and 660: 1 Conductivité d’un électrolyte
- Page 661 and 662: ■ Dosages Les documents 5 et 6 do
- Page 663 and 664: 1 Principe de la pH-métrie Une él
- Page 665 and 666: 1 Noms de quelques anions Le tablea
- Page 667 and 668:
Les règles de nomenclature en Chim
- Page 669 and 670:
classe fonctionnelle groupe caract
- Page 671 and 672:
méthode recherche successive : gro
- Page 673 and 674:
célérité de la lumière dans le
- Page 675 and 676:
B. Constantes de formation complexe
- Page 677 and 678:
D. Produits de solubilité à 25 °
- Page 679 and 680:
• Pour un changement de niveau d
- Page 681 and 682:
Le nombre d’onde correspondant es
- Page 683 and 684:
liaison nature nombre d’onde (cm
- Page 685 and 686:
III. Structure, réactivité et syn
- Page 687 and 688:
A Absorbance 84 Acide 484 Acide de
- Page 689 and 690:
Molécularité 127 Moment cinétiqu
- Page 692:
H PRÉPA TOUT EN UN La collection H