Carcinomes infiltrants du sein - epathologies
Carcinomes infiltrants du sein - epathologies
Carcinomes infiltrants du sein - epathologies
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
<strong>Carcinomes</strong> <strong>infiltrants</strong><br />
Corrélations morphologiques<br />
et biologiques
a.Carcinome infiltrant de type non spécifique ( canalaire TNS)<br />
b.Carcinome lobulaire infiltrant<br />
c.Carcinome tubuleux<br />
d.Carcinome mé<strong>du</strong>llaire<br />
e.<strong>Carcinomes</strong> pro<strong>du</strong>isant de la mucine<br />
f.Carcinome cribriforme infiltrant<br />
g.<strong>Carcinomes</strong> endocrines <strong>du</strong> <strong>sein</strong><br />
e.Carcinome métaplasique<br />
f.Carcinome apocrine<br />
g.Carcinome à cellules riches en lipides<br />
k.Carcinome sécrétant (juvénile)<br />
l.Carcinome adénoïde kystique<br />
m.Carcinome à cellules acineuses<br />
n.Carcinome à cellules claires (riches en glycogène)<br />
o.Carcinome mammaire avec cellules géantes ostéoclastiques<br />
p.Carcinome mammaire avec faits choriocarcinomateux<br />
q.Carcinome oncocytique<br />
r.Tumeurs mélanocytaires<br />
s.Carcinome sébacé<br />
t.Carcinome micropapillaire infiltrant<br />
u.Carcinome mucoépidermoïde<br />
Classification OMS – 2002-2003<br />
<strong>Carcinomes</strong> <strong>infiltrants</strong> : 21 types, 75 à 80% des carcinomes dépistés par mammographie
<strong>Carcinomes</strong> <strong>infiltrants</strong> <strong>du</strong> <strong>sein</strong><br />
Types histologiques<br />
• Canalaires 70 à 75%<br />
• Lobulaires 10 à 15 %<br />
• Autres 15 %<br />
• Bon pronostic :<br />
• tubuleux, mucineux, cribriforme, sécrétant juvénile,<br />
adénoïde kystique<br />
• Mauvais pronostic loco-régional ou général :<br />
• micropapillaire, métaplasiques<br />
• Forme particulière : mé<strong>du</strong>llaires
Carcinome canalaire infiltrant<br />
• Présentation clinique :<br />
• masse palpable 70%<br />
• dépistage mammographique<br />
• Age médian : 56 ans<br />
• Bilatéralité : 6 à 8 % des cas<br />
• Emboles vasculaires : 20 à 27% des cas<br />
• Atteinte ganglionnaire axillaire : 20 à 50%<br />
• Aspects mammographiques :<br />
Masse spiculée visible sur toutes les incidences
Carcinome de type canalaire (CCI)<br />
ou de type non spécifique<br />
Carcinome in situ<br />
70 à 80 % des cas
Classification selon le grade histopronostique<br />
de Elston et Ellis<br />
• scores 3 à 5 = grade I<br />
29% des CCI<br />
• scores 6, 7 = grade II<br />
41% des CCI<br />
• scores 8, 9 = grade III<br />
30% des CCI<br />
Elston C, Ellis I, Histopathology 1991, 19: 403-410<br />
Blamey et al ONCOPOOL, Eur J Cancer 2010
<strong>Carcinomes</strong> LOBULAIRES <strong>infiltrants</strong><br />
Macroscopie<br />
• Masse irrégulière et mal définie<br />
• Taille supérieure : CLI 19% > 5cm / CCI 12% > 5cm<br />
CLI<br />
CCI
Présentation clinique<br />
• Age :<br />
– age median 45 à 57 ans ( = CCI)<br />
– 2% des carcinomes <strong>du</strong> <strong>sein</strong> avant 35ans<br />
– 11% après 75 ans<br />
• Examen clinique :<br />
– Épaississement vague ou in<strong>du</strong>ration <strong>du</strong> <strong>sein</strong><br />
– Rétraction cutanée et <strong>du</strong> mamelon<br />
– En position centrale<br />
– Pas de Paget<br />
• Cancer Controlatéral : risque supérieur que les CCI (RR=1.5 à 1.8)<br />
(metachrone ou synchrone )<br />
• Multicentricité : 31% (x2 supérieure aux CCI)
Mammographie<br />
• distortion architecturale<br />
Aspects radiologiques<br />
• microcalcifications non fréquente<br />
• lesion non visible sur ttes les vues<br />
• taille difficile à évaluer<br />
Echographie<br />
• masse hypoéchogène irrégulière,<br />
• ombre postérieure<br />
IRM<br />
Meilleure évaluation de la multifocalité et de la taille
• Aspects spécifiques > 90% de la tumeur<br />
• type classique<br />
• variants :<br />
CLI : Aspects histologiques<br />
aspects architecturaux<br />
alveolaire<br />
massif aspects mixtes<br />
aspects cytologiques<br />
pleomorphique<br />
cellules en bague à chaton<br />
en commun : absence de cohesion intercellulaire
CLI classique
CLI classique<br />
Travées d’une seule épaisseur de cellules
Carcinome lobulaire in situ<br />
associé dans 60 à 90% des cas
Emboles intravasculaires péritumoraux<br />
taux faibles : < 5 à 17% des cas<br />
Atteinte ganglionnaire axillaire des CLI<br />
• ~ 40% de N+<br />
• Parfois cellules isolées dans les sinus<br />
• IHC avec anticorps anti KL1:<br />
– non recommandé<br />
– utile en cas de doute avec des histiocytes<br />
KL1
Variant alvéolaire Variant massif
CLI variant pléomorphe<br />
Cellules non cohésives, grade nucléaire 3,<br />
Nombre de mitoses plus élevé ( 2.5 à > 10 mitoses /10 x g400)
CLI variant à cellules en bague à chaton<br />
Cellules isolées renfermant une vacuole<br />
intracytoplasmique qui refoule le noyau<br />
Bleu Alcian
CLI<br />
immunophénotype- caractéristiques biologiques<br />
CLI CCI<br />
RO + 95% 75%<br />
RP + 75% 75%<br />
HER 2 + 0 - 5% 15 %<br />
Ki67 + 10% 17%<br />
Bcl2 +++ + + (RO+)<br />
Mutations PI3KCA<br />
TP53<br />
46%<br />
12%<br />
22%<br />
30%
E-cadherine<br />
Gene: chromosome16 en q22.1, gène supresseur de tumeur<br />
Protéine: transmembranaire, adhérence inter-cellulaire<br />
E-cadherin<br />
p120<br />
-catenin or<br />
plakoglobin<br />
-catenin<br />
ctn catenin<br />
F-actin<br />
Schéma adapté de van Roy
Contrôle positif<br />
interne<br />
E-cadherine dans les CLI<br />
Absence d’expression dans 80 à 100%
E-cadherine dans les CCI<br />
Diminution <strong>du</strong> marquage dans 30 à 60% des cas
Quand utiliser la E-cadhérine ?<br />
• Non requise pour la définition des CLI<br />
• Dans les cas présentant des aspects histologiques<br />
équivoques (traitement néoadjuvant)<br />
• Distinction des variants des CCI<br />
pleomorphe, massif et alvéolaire<br />
• Pour identifier les carcinomes mixtes CLI + CCI et le<br />
carcinome tubulo-lobulaire
Pronostic des CLI<br />
Grade histologique (Elston and Ellis)<br />
grade I (12%) grade II (76%) grade III (12%)<br />
Tubes : 3<br />
Pléomorphisme nucléaire : 1, 2 >> 3<br />
Mitoses : 1 >> 2 >>> 3
• Déterminé par<br />
– Statut ganglionnaire<br />
– Taille tumorale<br />
Pronostic des CLI<br />
– Grade histopronostique<br />
Rakha et al, Breast Can Res and TTT 2007
• os<br />
• tube digestif<br />
• ovaires<br />
• uterus<br />
• méninges<br />
Profil métastatique des CLI<br />
Sites préférentiels<br />
• autres (peau, péritoine, plèvre …)
CLI : métastase gastrique<br />
Biopsie fundique<br />
CK 7<br />
RO
CLI<br />
<strong>Carcinomes</strong> mixtes canalaires et lobulaires<br />
2 à 5% des carcinomes mammaires<br />
Au moins 10% de la surface tumorale de type canalaire<br />
CCI
Les ILC sont différents des IDC luminaux<br />
Analyse génomique<br />
Gruel et al Eur J Can 2010
Les ILC sont différents des IDC luminaux<br />
Analyse transcriptomique<br />
Korkola et al, Cancer Res, 2003<br />
Zhao et al, Mol Biol Cell, 2004<br />
Bertucci et al, Oncogene 2008<br />
Gruel et al, Eur J Can 2010<br />
Weigelt et al J Pathol 2010
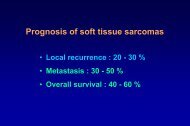
CARCINOMES INFILTRANTS DE BON PRONOSTIC<br />
90% de survie à 10 ans<br />
Critères morphologiques stricts
Carcinome TUBULEUX<br />
• Fréquence : 4 à 7%; 9-19% dans des séries de dépistage<br />
• Age médian : 60 à 70 ans<br />
• Détection: 60 – 70% lésion mammographique, spiculée<br />
• Taille moyenne : 10 mm (
Carcinome TUBULEUX<br />
Histologie<br />
~ 100 % de la surface tumorale<br />
– tubes : d’une seule épaisseur de cellules,<br />
sans cellule myoépithéliale,<br />
ovoïdes, contours anguleux, lumières ouvertes<br />
– cellules : noyaux de bas grade,<br />
Lésions associées<br />
polarisés autour de la lumière<br />
pôle apical sécrétoire<br />
– > 50% des cas : CIS bas grade nucléaire<br />
– lésions de métaplasie cylindrique<br />
– < 50% des cas : CLIS
Carcinome TUBULEUX
p63<br />
ASA<br />
Carcinome TUBULEUX
Carcinome TUBULEUX<br />
• Profil biologique : carcinome bien différencié :<br />
– RO + : 98 à 100%<br />
– RP + : 60 à 70%<br />
– HER2 0%<br />
• Anomalies cytogénétiques :<br />
– Perte fréquente <strong>du</strong> 16q et rare <strong>du</strong> 17p
Carcinome TUBULEUX<br />
pronostic<br />
• Atteinte ganglionnaire axillaire :<br />
– 0 à 18%<br />
– Dépend de la taille (>1cm)<br />
• Meilleur pronostic / aux carcinomes canalaires <strong>infiltrants</strong>,<br />
– NSABP 06 : meilleure survie à 10 ans<br />
chez les N- (analyse multivariée)<br />
– métastase à 10 ans<br />
– tubuleux : 0 à 1%<br />
– carcinome grade I : 6% à 10%<br />
• survie globale à 10ans<br />
• carcinome grade I 88 %<br />
• Tubuleux 94% à 99%<br />
Goldstein et al Am J Clin Pathol 2004<br />
Liu et al, Int J Radiat Oncol Biol Phys. 2009<br />
Rakha et al JCO 2010
• Cicatrice radiaire<br />
Carcinome tubuleux<br />
Diagnostic différentiel<br />
• Adénoses, adénose microglan<strong>du</strong>laire<br />
• CCI bien différencié
Marqueurs de cellules myoépithéliales<br />
Marqueur Localisation<br />
marquage<br />
actine<br />
musculaire<br />
lisse<br />
cellules<br />
myoépith<br />
vaisseaux myofibroblastes<br />
C +++++ +++ +++<br />
p63 N ++++ - -<br />
calponine C +++++ +++ ++<br />
CK 5/6 C +++ - -<br />
CD10 C ++ - +
Attention<br />
• Modification de l’immunophénotype des cellules<br />
myoépithéliales dans les lésions de carcinome in situ<br />
par rapport aux cellules myoépithéliales normales !!!<br />
Schnitt USCAP 2007
• Fréquence :<br />
– purs : 2,5%<br />
– composante mucineuse : 5 %<br />
• Age médian : 71 ans<br />
Carcinome MUCINEUX<br />
• Anomalie mammographique : 30 à 70% des cas<br />
• Aspect mammographique : masse mal définie ou lobulée,<br />
microcalcifications rares<br />
• Taille moyenne : 3cm<br />
• Aspect macroscopique: masse bien limitée, souple, gélatineuse
Carcinome MUCINEUX<br />
Histologie :<br />
• Tumeur pro<strong>du</strong>isant de la mucine en quantité variable<br />
• Cellules tumorales en petits amas, cordons, papilles disposées<br />
dans de la mucine extracellulaire, sur > 90% de la surface<br />
tumorale.<br />
• Cellularité variable<br />
quand ils sont riches en cellules tumorales (mucineux B)<br />
proches des carcinomes neuro endocrines.<br />
• Cellules : grade nucléaire faible ou intermédiaire<br />
• CIS souvent associé
Carcinome MUCINEUX
Carcinome mucineux
Carcinome MUCINEUX<br />
• Profil biologique :<br />
– RO + : 92 à 100 %<br />
– RP + : 63 à 68%<br />
– HER2 – dans la majorité des cas (97%)<br />
• Différentiation neuroendocrine :<br />
– 73% des cas meilleur pronostic<br />
• Anomalies génétiques :<br />
– moins nombreuses que dans les CCI<br />
– Mucineux purs : sont diploïdes<br />
– 1q+, 16p+, 16q-, 22q-<br />
(Mod Pathol 2005 Rakha et al)<br />
(Mod Pathol 2004 Tse et al)<br />
(Lacroix-Tikri et al J Pathol 2010)
Diagnostic différentiel <strong>du</strong> carcinome mucineux<br />
Lésion de type mucocèle<br />
Présence de cellules myoépithéliales
• Métastases axillaires :<br />
– 3-15% mucineux purs<br />
Carcinome MUCINEUX<br />
pronostic<br />
•
<strong>Carcinomes</strong> mucineux <strong>infiltrants</strong> = entité moléculaire<br />
différente des carcinomes canalaires luminaux A<br />
Weigelt et al, Modern Pathology Nov 2009
<strong>Carcinomes</strong> mucineux <strong>infiltrants</strong> A (paucicellulaires) =<br />
entité moléculaire différente<br />
des carcinomes mucineux B (riches en cellules) et neuroendocrine<br />
Weigelt et al, Modern Pathology Nov 2009
Carcinome adénoïde kystique<br />
•
KIT<br />
Sur microbiopsies:<br />
Dc différentiel avec sphérulose collagène<br />
AML CK5/6<br />
CK8/18 p63
Carcinome sécrétant juvénile<br />
• carcinome mammaire à translocation t(12;15) ETV6/ NTRK3.<br />
• Immunophénotype basal-like<br />
Lae et al, Mod Path 2009
<strong>Carcinomes</strong> de mauvais pronostic
Carcinome micropapillaire (< 4% des cas)<br />
Tumeur mammaire
Carcinome micropapillaire
grade III de 30 à 87% des cas<br />
Embole<br />
60 - 90 %<br />
Carcinome<br />
micropapillaire<br />
Métastase<br />
axillaire 72 à 95%
Immunophénotype<br />
des carcinomes micropapillaires<br />
• RO + 56 à 93%<br />
• RP + 40 à 82%<br />
• HER2 + 21%<br />
• CK7 +<br />
• CK5/6 , EGFR, c-KIT : -<br />
• Pole apical inversé<br />
- MUC1 +<br />
- E-cadherine -<br />
• VEGF-C / VEFGR3 fortement exprimés<br />
• Forte densité vasculaire<br />
Pettinato et al, Am J Clin Pathol, 2004<br />
Li et al Pathol Int, May 2006<br />
Kim et al, Arch Pathol Lab Med, 2005<br />
Gong et al Histopathology 2005<br />
Marchio et al J Pathol, 2008
E-cadhérine<br />
ERBB2<br />
MUC1/CA15 3
Altérations génomiques des carcinomes<br />
micropapillaires<br />
• Par CGH classique :<br />
– 100% 8p-<br />
– 88% 8q+<br />
• Par puces CGH :<br />
– 8p-/8q+<br />
– 16p+/ 16q-<br />
– Nombreux amplicons (chr 17q, 20q)<br />
• Par séquençage massif parallèle à partir de l’ARN :<br />
– Translocations inter-chromosomiques<br />
• 3 dans un même échantillon<br />
• 1 récurrente entre deux cas différents.<br />
Thor AD , Human Pathol 2002<br />
Marchio et al J Pathol 2008<br />
Données U830 INSERM I CURIE<br />
Natratjan et al AACR 2010 abstract
<strong>Carcinomes</strong> métaplasiques<br />
Caractéristiques anatomo-cliniques<br />
• Age médian : 55 ans<br />
• Imagerie: lésion bien limitée<br />
• Taille au diagnostic : 3-4 cm à croissance rapide<br />
• Métastases au diagnostic : 8,6% // 2% des CCI<br />
• Contours bien limités mais infiltration <strong>du</strong> tissu adipeux<br />
• Présence de lésions associées de CIS +++<br />
• <strong>Carcinomes</strong> de grade 2 ou 3 (66% //41% des CCI)<br />
• Activité mitotique élevée<br />
• Localisation ganglionnaire métastatique (5-25%)<br />
• Localisation métastatique (poumons) 21-46%<br />
• Survie Globale à 5 ans 28-68%<br />
Carter et al AJSP 2006<br />
Jung et al, Br Can Res and TTT
Tumeurs biphasiques<br />
= carcinosarcome<br />
Composante glan<strong>du</strong>laire ou épidermoïde<br />
+<br />
contingent métaplasique :<br />
<strong>Carcinomes</strong> métaplasiques<br />
1% tumeurs malignes infiltrantes mammaires<br />
Classification OMS 2002<br />
- cellules fusiformes<br />
- tissus hétérologues<br />
osseux /cartilagineux,<br />
ostéosarcome,<br />
chondrosarcome,<br />
liposarcome,<br />
rhabdomyosarcome<br />
Tumeurs monophasiques<br />
- épidermoide<br />
- cellules fusiformes
<strong>Carcinomes</strong> métaplasiques<br />
Diagnostics différentiels<br />
•Sarcomes primitifs mammaires<br />
•Tumeurs phyllodes,<br />
•Tumeurs fibreuses bénignes, fibromatose<br />
•Mélanome<br />
•Cicatrice (biopsie, chirurgie)
Devant une prolifération à cellules fusiformes malignes<br />
carcinome métaplasique ou sarcome ?<br />
recherche d’une différenciation épithéliale :<br />
• expression de cytokératines ( focale ++)<br />
KL1, CK5/6/14/17, 34beta E12, CK8/18, CK7,<br />
• p63 + dans environ 50% des cas<br />
• E-cadhérine, EMA<br />
• AML + dans 70% des cas.<br />
Diagnostic différentiel
• Après avoir éliminé un carcinome métaplasique :<br />
• Le diagnostic d’une lésion à cellules fusiformes <strong>du</strong> <strong>sein</strong> repose sur<br />
– l’aspect morphologique +++<br />
– l’immunophénotype<br />
• Panel d’anticorps : CD34, Fc VIII, CD31, CD 68, desmine, actine musculaire lisse<br />
• Diagnostics les + fréquents :<br />
– Tumeur phyllode (intérêt sur microbiopsie <strong>du</strong> CD34 dans le stroma des phyllodes)<br />
– Fibromatose ( 80 % expression nucléaire de béta-caténine)<br />
– Myofibroblastome (desmine+, CD34 +, vimentine+, ASA+/-)<br />
– Fasciite no<strong>du</strong>laire (AML+/-, CD68 qq cellules +)<br />
– Angiosarcome (CD31 +, Fc VIII+, CD34 + )<br />
– PASH (CD34 +, CD31-, Fc VIII-)<br />
Diagnostic positif
KL1
Kératine de haut poids moléculaire
Cytokeratine 7<br />
vimentine
Immunophénotype et altérations génétiques<br />
des carcinomes métaplasiques<br />
• Triple négatifs : RO RP HER2 dans > 90% des cas<br />
• CytoKératines+ 100% avec CK14 ou CK5/6 ou AE1 /AE3<br />
• EMA 10-20%<br />
• ASA 70-80%<br />
• P63 50%<br />
• PS100 10%<br />
• 76% EGFR+ (dont 37% EGFR amplifié)<br />
• Analyse génomique fine des deux contingents : mêmes<br />
altérations clonales dans la majorité des cas.<br />
Reis Filho et al, Breast Cancer Research, 2005<br />
Geyer et al, J Pathol 2010
Altérations génomiques des carcinomes métaplasiques<br />
• Nombreuses altérations et pattern complexes<br />
• Mutations of CTNNB1 and PIK3CA<br />
• inactivation <strong>du</strong> pathway BRCA1<br />
Hennessey et al. Cancer Res 2009; Hayes et al. Clin Cancer Res 2008; Turner et al. Oncogene 2007<br />
Courtesy of Jorge Reis-Filho
Analyse génomique des carcinomes métaplasiques<br />
N=24 cas<br />
5 cas avec<br />
2 composantes separées<br />
SNP6 HT12 arrays PE RNA-Seq PE Exomic-Seq<br />
R Natrajan, A Mackay, M Lambros, T Popova, C Maher, A Vincent-Salomon, JS Reis-Filho (Unpublished)<br />
Courtesy of Jorge Reis-Filho
Analyse génomique et transcriptomique<br />
<strong>Carcinomes</strong> métaplasiques<br />
Natrajan et al<br />
AACR 2012
Les carcinomes métaplasiques sont hétérogènes sur le plan<br />
génomique<br />
Natrajan et al<br />
AACR 2012
Conclusions<br />
• Morphologie précise et fine indispensable :<br />
– à la prise en charge clinique adéquate des<br />
patientes<br />
– pour les analyses moléculaires pertinentes<br />
• Nécessité d’une technique de qualité +++