Dosis máximas de anestésicos locales - Sociedad de ...
Dosis máximas de anestésicos locales - Sociedad de ...
Dosis máximas de anestésicos locales - Sociedad de ...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Rev. Chil. Anestesia, 36: 71-76 (Junio), 200771REVISIÓNDOSIS MÁXIMAS DE ANESTÉSICOS LOCALESDR. FERNANDO R. ALTERMATTINTRODUCCIÓNAlguien alguna vez me dijo: «La anestesiaes el arte <strong>de</strong> usar una combinación <strong>de</strong> venenosen pequeñas dosis, suficientes para ejercerefecto <strong>de</strong>seado, pero no para matar al paciente».Esto es especialmente aplicable a los <strong>anestésicos</strong><strong>locales</strong>: Su utilidad en la práctica clínicaes indiscutible, pero hay un <strong>de</strong>licado equilibrioentre administrar una dosis suficiente para obtenerel efecto <strong>de</strong>seado (bloqueo <strong>de</strong> conducciónnerviosa), y evitar sus complicaciones (toxicidadsistémica) 1 .DOSIS MÁXIMAS RECOMENDADAS:FUNDAMENTOS DE SU EXISTENCIAEl tema <strong>de</strong> la vali<strong>de</strong>z <strong>de</strong> las dosis <strong>máximas</strong>recomendadas no es nuevo, ha estado en discusión<strong>de</strong>s<strong>de</strong> hace más <strong>de</strong> 30 años. Por una parte,las recomendaciones existentes; por otra, voces«disi<strong>de</strong>ntes» que alertan sobre la falta <strong>de</strong> fundamento<strong>de</strong> estas dosis 2,3 .La Tabla 1 muestra un ejemplo <strong>de</strong> las dosis<strong>máximas</strong> recomendadas en distintos países. Estasdosis, <strong>de</strong>finidas por las compañías farmacéuticasen su mayoría, son usualmente <strong>de</strong>terminadas apartir <strong>de</strong>:Profesor Auxiliar, Departamento <strong>de</strong> Anestesiología, Escuela <strong>de</strong>Medicina, Pontificia Universidad Católica <strong>de</strong> Chile.– datos obtenidos en estudios en animales,– investigación clínica en voluntarios,– datos extrapolados <strong>de</strong>s<strong>de</strong> pequeñas seriesclínicas,– información extraída <strong>de</strong> casos <strong>de</strong> toxicidadsistémica en pacientes.Sin necesidad <strong>de</strong> mayor análisis, <strong>de</strong> lainformación <strong>de</strong> la tabla surgen muchas dudas:¿De qué tipo <strong>de</strong> bloqueo hablamos?, ¿sobre quéfundamento fisiológico o farmacológico seajustan las dosis al añadir vasoconstrictores?,¿cuál es la relevancia que estas recomendacionesdan al uso <strong>de</strong> esteroisómeros puros por sobremezclas racémicas, consi<strong>de</strong>rando sus diferentesumbrales tóxicos?Por lo tanto, ¿qué po<strong>de</strong>mos sacar en limpio<strong>de</strong> todo esto?Antes que nada, que es casi <strong>de</strong> sentido comúnel reconocer que cualquier recomendación queno consi<strong>de</strong>re factores tales como las diferencias<strong>de</strong> absorción según los sitios <strong>de</strong> administración omás importante, las características <strong>de</strong> lospacientes (edad, peso, talla, patologías asociadas),son <strong>de</strong> escaso valor al momento <strong>de</strong> hacerun análisis serio.Para ir más allá, es necesario entoncespreguntarse cuáles son los mecanismosenvueltos en reacciones <strong>de</strong> toxicidad aguda por<strong>anestésicos</strong> <strong>locales</strong> (AL).El bloqueo <strong>de</strong> la conducción nerviosa porAL usados en anestesia regional implicainevitablemente que una parte <strong>de</strong> la droga
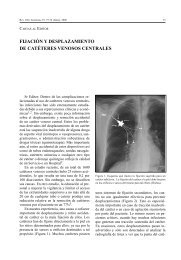
72 REVISTA CHILENA ANESTESIATABLA 1. RECOMENDACIONES OFICIALES DE DOSIS MÁXIMAS PERMITIDAS EN FINLANDIA(PHARMACA FENNICA 2004), ALEMANIA (ROTE LISTE 2004), SUECIA (FASS 2004),Y LOS ESTADOS UNIDOS (PHYSICIANS’ DESK REFERENCE 2004)Países (dosis en mg)Droga Finlandia Alemania Suecia Estados UnidosBupivacaína 175 150 150 175Bupivacaína + epi 175 150 150 225Levobupivacaína 150 150 150 150Levobupivacaína + epi — — — —Lidocaína 200 200 200 300Lidocaína + epi 500 500 500 500Ropivacaína 225 (300*) — 225 225 (300*)Ropivacaína + epi 225 225 225 (300*)*<strong>Dosis</strong> recomendada para bloqueos <strong>de</strong> plexo braquial. Modificado <strong>de</strong> (4).empleada sea absorbida <strong>de</strong>s<strong>de</strong> el sitio <strong>de</strong>administración al torrente sanguíneo. El efectoque esta porción <strong>de</strong> AL transportada por lasangre tenga sobre órganos distantes esfundamental, puesto que los límites <strong>de</strong>tolerancia <strong>de</strong> éstos son los que <strong>de</strong>terminan ladosis máxima <strong>de</strong> la droga a emplear.Característicamente las reacciones <strong>de</strong> toxicidadsistémica a AL son reacciones dosis-<strong>de</strong>pendientes,con manifestaciones clínicas progresivas,observables a medida que ascien<strong>de</strong>n sus nivelesplasmáticos. A más rápido este ascenso, más rápidala progresión <strong>de</strong> los síntomas/signos. A mayorascenso, mayor gravedad <strong>de</strong>l cuadro clínico.La causa <strong>de</strong> ese ascenso pue<strong>de</strong> ser:– Inyección intraarterial <strong>de</strong> AL (especialmenteen bloqueos regionales a nivel <strong>de</strong>l cuello,bloqueos <strong>de</strong> plexo braquial, bloqueos <strong>de</strong>ganglio estrellado). Se caracteriza por unaaparición súbita <strong>de</strong> los síntomas/signos,dado que el AL entra directamente a la circulacióncerebral en pocos segundos.– Inyección intravenosa <strong>de</strong> AL ya sea inadvertida(comúnmente en bloqueos epidurales o<strong>de</strong> nervio periférico) o advertida (anestesiasregionales endovenosas).– Absorción <strong>de</strong> AL <strong>de</strong>s<strong>de</strong> el sitio <strong>de</strong> inyección,como en bloqueos epidurales, <strong>de</strong> nervio periféricoo anestesia tumescente (Ej: en procedimientos<strong>de</strong> cirugía plástica).Frente a las dos primeras situaciones<strong>de</strong>scritas (inyecciones intravasculares inadvertidas),no hay consi<strong>de</strong>ración respecto a dosisque valga, puesto que pue<strong>de</strong>n <strong>de</strong>senca<strong>de</strong>narsereacciones <strong>de</strong> toxicidad con una masa <strong>de</strong> drogamuy por <strong>de</strong>bajo <strong>de</strong> las dosis en discusión. Lascrisis <strong>de</strong> toxicidad sistémica <strong>de</strong>rivadas <strong>de</strong> ellasson violentas, con un perfil temporalestrechamente relacionado a la inyección <strong>de</strong> ladroga. El uso <strong>de</strong> dosis fraccionadas, lainyección gradual y el uso <strong>de</strong> marcadores <strong>de</strong>inyección intravascular son las claves paraevitarlas.Es en el caso <strong>de</strong> la absorción masiva <strong>de</strong><strong>anestésicos</strong> <strong>locales</strong> que, habitualmente, laaparición <strong>de</strong> los síntomas pue<strong>de</strong> tardar 20 a 30minutos. Los niveles plasmáticos resultantes<strong>de</strong>pen<strong>de</strong>rán <strong>de</strong> la masa total <strong>de</strong> drogaadministrada, el sitio <strong>de</strong> la inyección, y el uso<strong>de</strong> vasoconstrictores, es en estos casos en losque conceptos como la disposición local <strong>de</strong> ladroga, su distribución sistémica y losmecanismos <strong>de</strong> eliminación cobran realimportancia.Las concentraciones plasmáticas <strong>de</strong> los ALalcanzadas tras su inyección en anestesiaregional <strong>de</strong>pen<strong>de</strong>n <strong>de</strong> tres fenómenosfundamentales (Figura 1):– Absorción: Factores como la velocidad <strong>de</strong>inyección <strong>de</strong> la solución, la vascularización<strong>de</strong>l sitio <strong>de</strong> administración 5 , las características<strong>de</strong> ese tejido (grasa o músculo, porejemplo 6 ), flujos sanguíneos regionales, propieda<strong>de</strong>sfísico-químicas <strong>de</strong> la droga o laadición <strong>de</strong> vasoconstrictores 7 son algunos <strong>de</strong>
Rev. Chil. Anestesia, 36: 71-76 (Junio), 200773Concentración plasmática(ug/ml)1.61.41.210.80.60.40.2AbsorciónDistribuciónEliminación00 60 120 180 240 300 360Tiempo (min)Figura 1. Perfil temporal <strong>de</strong> los niveles arteriales <strong>de</strong> anestésico local tipo amino-amida <strong>de</strong>spués <strong>de</strong> un bloqueo <strong>de</strong> nervio periférico.los factores que influyen en su velocidad <strong>de</strong>absorción, y por tanto en el ascenso <strong>de</strong> laconcentración plasmática <strong>de</strong> los AL.– Distribución: Los niveles plasmáticos caen enel tiempo como resultado <strong>de</strong> dos fenómenos:por una parte, distribución <strong>de</strong> la droga <strong>de</strong>s<strong>de</strong>tejidos <strong>de</strong> alta perfusión y baja capacidad (Ej:cerebro, corazón) hacia aquellos <strong>de</strong> baja perfusióny alta capacidad (tejido adiposo); por otra,eliminación <strong>de</strong> la droga a través <strong>de</strong> metabolismoy/o excreción. En la distribución <strong>de</strong> la drogael pulmón tiene un rol fundamental,actuando como «reservorio», secuestrando unaporción <strong>de</strong> la droga y por tanto modulando laconcentración arterial inicial <strong>de</strong> ésta. La captura<strong>de</strong> droga en el territorio pulmonar <strong>de</strong>pen<strong>de</strong><strong>de</strong> factores como la afinidad iónica entre el tejidopulmonar más ácido y la droga <strong>de</strong> pK amás básico 8 . Este efecto <strong>de</strong> «primer paso»,disminuye la cantidad <strong>de</strong> droga que entra encontacto con los órganos susceptibles <strong>de</strong> <strong>de</strong>senca<strong>de</strong>narsignos <strong>de</strong> toxicidad (corazón, cerebro)9 . En el plasma, el pKa <strong>de</strong> los AL máspotentes y lipofílicos hace que éstos se unan aproteínas como la α1-glicoproteína (AAG). Laconcentración <strong>de</strong> estas proteínas aumentasignificativamente en estados <strong>de</strong> stresspostquirúrgico 10 , y patologías como el cáncero la artritis reumatoí<strong>de</strong>a, disminuyendo la fracciónlibre <strong>de</strong> los AL en el plasma. Es esta porción<strong>de</strong> los AL la que es crítica en la génesis <strong>de</strong>los fenómenos <strong>de</strong> toxicidad sistémica. Lamentablemente,la capacidad <strong>de</strong> conjugación <strong>de</strong> lasproteínas plasmáticas es ampliamente superadapor el ascenso <strong>de</strong> los niveles <strong>de</strong> AL en caso<strong>de</strong> sobredosis, por lo que su efecto «protector»es limitado.– Eliminación: Dado que los AL son moléculasrelativamente liposolubles, una extensareabsorción a nivel tubular limita la excreciónrenal <strong>de</strong> la droga no conjugada a 1-6%<strong>de</strong> la dosis total administrada 11 . En el caso<strong>de</strong> las amino-amidas, este enlace es estableen el plasma y son metabolizadas en el hígado.En el caso <strong>de</strong> las amino-ésteres, el metabolismoplasmático es consi<strong>de</strong>rable, ycomienza incluso antes <strong>de</strong> la fase <strong>de</strong> distribución.Esto limita su capacidad <strong>de</strong> <strong>de</strong>sarrollarreacciones <strong>de</strong> toxicidad sistémica aunusando altas dosis.De acuerdo, pero finalmente, ¿cómo esto sepue<strong>de</strong> traducir en recomendaciones para unpaciente <strong>de</strong>terminado?Se <strong>de</strong>bería consi<strong>de</strong>rar:• Edad. Al nacer, la concentración plasmática<strong>de</strong> AAG es aproximadamente 50% <strong>de</strong> la observadaen los adultos 12 . La consiguiente
74 REVISTA CHILENA ANESTESIAmayor proporción <strong>de</strong> droga libre <strong>de</strong>scrita enprematuros y neonatos 13 , asociada a la inmadurez<strong>de</strong> sus sistemas <strong>de</strong> excreción, representaríaa un potencial mayor riesgo <strong>de</strong>toxicidad, aun con dosis menores <strong>de</strong> AL. Esrecomendable entonces disminuir la dosis enaproximadamente 15% cuando se tratan reciénnacidos o prematuros 14 .En la vejez, por su parte, se han <strong>de</strong>scrito cambiosfarmacocinéticos y farmacodinámicos enla disposición <strong>de</strong> los AL. El <strong>de</strong>terioro <strong>de</strong> laperfusión y <strong>de</strong>l funcionamiento <strong>de</strong> los órganosdisminuye el Clearance (CL) <strong>de</strong> los AL.Cambios <strong>de</strong>generativos propios <strong>de</strong> la edadaumentan la sensibilidad <strong>de</strong>l sistema nerviosoa la acción <strong>de</strong> los AL (atrofia <strong>de</strong> las vainas <strong>de</strong>mielina 15 , <strong>de</strong>generación axonal 16 . Dado loanterior, sería recomendable reducir las dosis<strong>de</strong> AL usadas en los ancianos.• Sexo. Diferencias en los volúmenes <strong>de</strong> distribucióno <strong>de</strong>l CL <strong>de</strong>terminan que la vidamedia <strong>de</strong> eliminación <strong>de</strong> la lidocaína sea50% más larga en mujeres que en hombres17 . En la práctica, sin embargo, esto nose traduce en gran<strong>de</strong>s cambios <strong>de</strong> dosificación,excepto en los extremos <strong>de</strong> las curvas<strong>de</strong> normalidad.• Peso. No existiría una relación entre peso,superficie corporal o masa magra y la disposición<strong>de</strong> los <strong>anestésicos</strong> <strong>locales</strong> en sujetoscon relaciones peso/talla normales 18 . Sinembargo, el incremento en los volúmenes <strong>de</strong>distribución en pacientes obesos pue<strong>de</strong> incrementarla vida media <strong>de</strong> eliminación <strong>de</strong>la lidocaína en 50% 19 .• Embarazo. Los cambios hormonales <strong>de</strong>l embarazoaumentan la sensibilidad al bloqueonervioso producido por los AL 20 , y a sutoxicidad sistémica 21,22 . En las fases finales<strong>de</strong> la gestación, el estado hiperdinámico asociadoa éste aumenta la absorción <strong>de</strong> los AL.Por lo tanto, es recomendable reducir las dosis<strong>de</strong> AL durante el embarazo.• Disfunción renal. Los trastornos <strong>de</strong> la funciónrenal disminuyen el CL <strong>de</strong> la Bupivacaína yRopivacaína, sin comprometer su vida media<strong>de</strong> eliminación. Las concentracionesplasmáticas ascien<strong>de</strong>n rápidamente, <strong>de</strong>spués<strong>de</strong> bloqueos <strong>de</strong> plexo braquial, probablementeasociado a los estados hiperdinámicos observadosen los pacientes urémicos, queincrementan la absorción <strong>de</strong> los AL 23 . Es recomendableentonces reducir las dosis <strong>de</strong> ALa usar en pacientes con disfunción renal en10-20%.• Disfunción hepática. La farmacocinética <strong>de</strong>la mayoría <strong>de</strong> los AL se ve afectada por ladisfunción hepática, disminuyendo el CL,pero aumentando el volumen <strong>de</strong> distribución<strong>de</strong> la droga, por lo que el resultado neto esque la concentración plasmática no se modifica.Sin embargo, la coexistencia <strong>de</strong> otraspatologías como renal o cardíaca hace recomendableel disminuir las dosis en estos pacientes.• Insuficiencia cardíaca. El <strong>de</strong>terioro <strong>de</strong> la perfusióntisular compromete el CL <strong>de</strong> los AL.La autorregulación <strong>de</strong> la circulación cerebral<strong>de</strong>termina que en condiciones <strong>de</strong> bajo débito,existe un flujo preferente hacia este territorio,aumentando la proporción <strong>de</strong> droga en esteórgano, agravando la toxicidad. Este efectotiene su contraparte en la disminución <strong>de</strong> laabsorción secundaria al bajo débito cardíaco.En casos <strong>de</strong> disfunción leve o compensada,no habría razón para ajustar las dosis <strong>de</strong> AL.Es recomendable hacerlo en casos <strong>de</strong>disfunción severa o <strong>de</strong>scompensación.Pue<strong>de</strong> que más <strong>de</strong> alguien a estas alturasempiece a sentirse <strong>de</strong>samparado, preguntándose¿cuáles serían entonces las dosis a usar? O mejoraún, ¿cómo <strong>de</strong>finir esas dosis?Niveles plasmáticosSi asumimos una relación directa entre lossíntomas y signos <strong>de</strong> toxicidad sistémica y losniveles plasmáticos alcanzados por la droga,podríamos <strong>de</strong>cir que ése es el parámetro a usar.Pero, ¿estamos hablando <strong>de</strong> niveles arteriales?,¿venosos?, ¿hay alguna diferencia?Lo cierto es que aunque los niveles arterialesserían los que mejor representarían la cantidad<strong>de</strong> droga que el órgano blanco recibe, y a su vezson más homogéneos (lo que mido en el brazo esmuy similar a lo que mediría en la circulacióncerebral). Sin embargo, en la práctica no es tanasí, y los valores arteriales asociados a convulsiones,por ejemplo, son altamente <strong>de</strong>pendientes
Rev. Chil. Anestesia, 36: 71-76 (Junio), 2007<strong>de</strong> la velocidad <strong>de</strong> administración (a más rápido,menos niveles arteriales son requeridos), y muestranuna significativa histéresis (el nivel arterialasociado al inicio <strong>de</strong> la convulsión es consi<strong>de</strong>rablementemás alto que el correspondiente al cese<strong>de</strong> las convulsiones), principalmente por la metodologíausada en los mo<strong>de</strong>los animales <strong>de</strong> don<strong>de</strong>provienen los datos.Los niveles venosos, en cambio, pese a tenermayor variación regional (lo que mido en elbrazo no es necesariamente lo que mido en elórgano blanco), muestran mayor in<strong>de</strong>pen<strong>de</strong>nciarespecto a la velocidad <strong>de</strong> infusión, y menorhistéresis. Por lo tanto, los niveles venosos seríanlos <strong>de</strong> mayor relevancia clínica al momento<strong>de</strong> <strong>de</strong>finir una «concentración tóxica» 24 .Dicho esto, la Tabla 2 (que en ningún casopreten<strong>de</strong> <strong>de</strong>rivar en recomendaciones), resume amodo <strong>de</strong> ejemplo los niveles venosos alcanzadostras diferentes tipos <strong>de</strong> bloqueos <strong>de</strong> plexos y nerviosperiféricos, con distintas drogas, por la masa<strong>de</strong> droga usada comúnmente, ya sea en técnicasúnicas o combinadas, como inyección única.Como referencia, y en su sentido más general,el umbral tóxico <strong>de</strong>scrito para las drogas señaladassería:Lidocaína y MepivacaínaBupivacaínaLevobupivacaínaRopivacaína5-7 µg/ml2,5 µg/ml2-4 µg/ml2-4 µg/ml75La relación existente entre estos valores y elcuadro clínico <strong>de</strong> toxicidad sistémica es altamente<strong>de</strong>pendiente <strong>de</strong> factores como el sitio <strong>de</strong>muestreo, velocidad <strong>de</strong>l ascenso, características<strong>de</strong>l paciente (edad, patologías asociadas, etc.) 25 .Un <strong>de</strong>tallado análisis <strong>de</strong> estos elementos estámás allá <strong>de</strong> los objetivos <strong>de</strong> este artículo.En resumen...Más que pensar las dosis <strong>de</strong> <strong>anestésicos</strong> <strong>locales</strong>en términos absolutos, las dosis <strong>de</strong>ben consi<strong>de</strong>rarfactores como las características <strong>de</strong>l paciente,el tipo <strong>de</strong> bloqueo, y la droga empleada.No se <strong>de</strong>be olvidar que pue<strong>de</strong>n producirsecuadros <strong>de</strong> toxicidad sistémica aún con dosisbajas <strong>de</strong> <strong>anestésicos</strong> <strong>locales</strong>, tras su inyecciónintravascular inadvertida. El uso <strong>de</strong> dosis <strong>de</strong>prueba, dosis fraccionadas, y la inyección lenta,son maniobras irreemplazables en la prevención<strong>de</strong> cuadros <strong>de</strong> toxicidad sistémica.TABLA 2. NIVELES PLASMÁTICOS VENOSOS ALCANZADOS TRAS LA ADMINISTRACIÓNDE DISTINTAS SOLUCIONES DE ANESTÉSICOS LOCALESBloqueo Droga (s) <strong>Dosis</strong> (mg) Concentración Referenciavenosa (µg/ml)Interescalénico Lidocaína 400 5,6 (26)Bupivacaína 200 1,95 (27)Ropivacaína 200 1,38 (27)Axilar Bupivacaína 225 1,5 (28)Levobupivacaína 250 1,6 (29)Ropivacaína 300 2,3 (30)Paravertebral torácico Levobupivacaína 50 0,51 (31)Ropivacaína ≈100 ≈1,7 (7)Ropivacaína + epi ≈100 ≈1,2 (7)Plexo lumbar Bupivacaína 100 1,93 (32)Bupivacaína + epi 100 1,04 (32)Ropivacaína + epi 175 0,9 (33)Femoral Ropivacaína + epi 150 0,68 (34)Plexo lumbar + ciático Bupivacaína+ epi 300 1,3 (35)Lidocaína + epi 680 3,7 (36)Ropivacaína+ epi 300 1,6 (33)Femoral + ciático Bupivacaína 200 0,9 (37)Bupivacaína + epi 400 1,6 (38)Mepivacaína 800 4,3 (39)Epi= epinefrina en la solución.
76 REVISTA CHILENA ANESTESIAREFERENCIAS1. Albright GA. Cardiac arrest following regional anesthesia withetidocaine or bupivacaine. Anesthesiology 1979; 51: 285-7.2. Moore DC, Bri<strong>de</strong>nbaugh LD, Thompson GE et al. Factors<strong>de</strong>termining dosages of ami<strong>de</strong>-type local anesthetic drugs.Anesthesiology 1977; 47: 263-8.3. Scott DB. «Maximum recommen<strong>de</strong>d doses» of local anaestheticdrugs. Br J Anaesth 1989; 63: 373-4.4. Rosenberg PH, Veering BT, Urmey WF. Maximum recommen<strong>de</strong>ddoses of local anesthetics: a multifactorial concept.Reg Anesth Pain Med 2004; 29: 564-75; discussion 24.5. Safran D, Kuhlman G, Orhant EE et al. Continuous intercostalblocka<strong>de</strong> with lidocaine after thoracic surgery. Clinicaland pharmacokinetic study. Anesth Analg 1990; 70: 345-9.6. Clement R, Malinovsky JM, Le Corre P et al. Cerebrospinalfluid bioavailability and pharmacokinetics of bupivacaineand lidocaine after intrathecal and epiduraladministrations in rabbits using microdialysis. J PharmacolExp Ther 1999; 289: 1015-21.7. Karmakar MK, Ho AM, Law BK et al. Arterial andVenous Pharmacokinetics of Ropivacaine with and withoutEpinephrine after Thoracic Paravertebral Block. Anesthesiology2005; 103: 704-11.8. Palazzo MG, Kalso EA, Argiras E et al. First pass lung uptakeof bupivacaine: effect of acidosis in an intact rabbitlung mo<strong>de</strong>l. Br J Anaesth 1991; 67: 759-63.9. Tucker GT, Boas RA. Pharmacokinetic aspects of intravenousregional anesthesia. Anesthesiology 1971; 34: 538-49.10. Burm AG, Stienstra R, Brouwer RP et al. Epidural infusionof ropivacaine for postoperative analgesia after majororthopedic surgery: pharmacokinetic evaluation. Anesthesiology2000; 93: 395-403.11. Tucker GT, Mather LE. Clinical pharmacokinetics of localanaesthetics. Clin Pharmacokinet 1979; 4: 241-78.12. McNamara PJ, Alcorn J. Protein binding predictions in infants.AAPS PharmSci 2002; 4: E4.13. Tucker GT, Boyes RN, Bri<strong>de</strong>nbaugh PO, Moore DC.Binding of anili<strong>de</strong>-type local anesthetics in human plasma.II. Implications in vivo, with special reference to transplacentaldistribution. Anesthesiology 1970; 33: 304-14.14. Meunier JF, Goujard E, Dubousset AM et al. Pharmacokineticsof bupivacaine after continuous epidural infusion in infants withand without biliary atresia. Anesthesiology 2001; 95: 87-95.15. Igarashi T, Hirabayashi Y, Shimizu R et al. The lumbar extraduralstructure changes with increasing age. Br J Anaesth1997; 78: 149-52.16. Kurokawa K, Mimori Y, Tanaka E et al. Age-related change inperipheral nerve conduction: compound muscle action potentialduration and dispersion. Gerontology 1999; 45: 168-73.17. Wing LM, Miners JO, Birkett DJ et al. Lidocaine disposition—sexdifferences and effects of cimetidine. Clin PharmacolTher 1984; 35: 695-701.18. Tucker GT. Properties, absorption, and disposition of local anestheticagents. 3 rd ed.: Lippincott-Raven, Phila<strong>de</strong>lphia, 1998.19. Abernethy DR, Greenblatt DJ. Lidocaine disposition inobesity. Am J Cardiol 1984; 53: 1183-6.20. Butterworth JFt, Walker FO, Lysak SZ. Pregnancy increasesmedian nerve susceptibility to lidocaine. Anesthesiology1990; 72: 962-5.21. Moller RA, Covino BG. Effect of progesterone on thecardiac electrophysiologic alterations produced by ropivacaineand bupivacaine. Anesthesiology 1992; 77:735-41.22. Moller RA, Datta S, Fox J et al. Effects of progesterone onthe cardiac electrophysiologic action of bupivacaine andlidocaine. Anesthesiology 1992; 76: 604-8.23. Pere P, Salonen M, Jokinen M et al. Pharmacokinetics ofropivacaine in uremic and nonuremic patients after axillarybrachial plexus block. Anesth Analg 2003; 96: 563-9,table of contents.24. Mather LE, Copeland SE, Ladd LA. Acute toxicity of localanesthetics: un<strong>de</strong>rlying pharmacokinetic and pharmacodynamicconcepts. Reg Anesth Pain Med 2005; 30: 553-66.25. De Jong RH. Local Anesthetics. 1 st ed.: Mosby-YearBook, 1994.26. McEllistrem RF, Schell J, O’Malley K et al. Interscalene brachialplexus blocka<strong>de</strong> with lidocaine in chronic renal failure—a pharmacokinetic study. Can J Anaesth 1989; 36: 59-63.27. Borgeat A, Ekatodramis G, Blumenthal S. Interscalenebrachial plexus anesthesia with ropivacaine 5 mg/mL andbupivacaine 5 mg/mL: effects on electrocardiogram. RegAnesth Pain Med 2004; 29: 557-63.28. Vainionpaa VA, Haavisto ET, Huha TM et al. A clinical andpharmacokinetic comparison of ropivacaine and bupivacainein axillary plexus block. Anesth Analg 1995; 81: 534-8.29. Wank W, Buttner J, Maier KR et al. Pharmacokinetics an<strong>de</strong>fficacy of 40 ml ropivacaine 7.5 mg/ml (300 mg), for axillarybrachial plexus block—an open pilot study. Eur JDrug Metab Pharmacokinet 2002; 27: 53-9.30. Crews JC, Weller RS, Moss J, James RL. Levobupivacaine foraxillary brachial plexus block: a pharmacokinetic and clinicalcomparison in patients with normal renal function or renal disease.Anesth Analg 2002; 95: 219-23, table of contents.31. Burlacu CL, Frizelle HP, Moriarty DC, Buggy DJ. Pharmacokineticsof levobupivacaine, fentanyl, and clonidineafter administration in thoracic paravertebral analgesia.Reg Anesth Pain Med 2007; 32: 136-45.32. Odoom JA, Zuurmond WW, Sih IL et al. Plasma bupivacaineconcentrations following psoas compartment block.Anaesthesia 1986; 41: 155-8.33. Vanterpool S, Steele SM, Nielsen KC et al. Combined lumbarplexusand sciatic-nerve blocks: an analysis of plasma ropivacaineconcentrations. Reg Anesth Pain Med 2006; 31: 417-21.34. Kaloul I, Guay J, Cote C et al. Ropivacaine plasma concentrationsare similar during continuous lumbar plexus blocka<strong>de</strong>using the anterior three-in-one and the posterior psoascompartment techniques. Can J Anaesth 2004; 51: 52-6.35. Eljebari H. Comparison of arterial and venous pharmacokineticsof bupivacaine after combined sciatic and lumbarplexus blocks. Reg Anesth Pain Med 2005.36. Farny J, Girard M, Drolet P. Posterior approach to thelumbar plexus combined with a sciatic nerve block usinglidocaine. Can J Anaesth 1994; 41: 486-91.37. Misra U, Pridie AK, McClymont C, Bower S. Plasma concentrationsof bupivacaine following combined sciatic andfemoral 3 in 1 nerve blocks in open knee surgery. Br J Anaesth1991; 66: 310-3.38. Moore DC, Mather LE, Bri<strong>de</strong>nbaugh LD et al. Arterialand venous plasma levels of bupivacaine following peripheralnerve blocks. Anesth Analg 1976; 55: 763-8.39. Agostoni M, Fanelli G, Nobili F et al. [Plasma levels ofmepivacaine in the double block of the sciatic and thefemoral nerve]. Minerva Anestesiol 1992; 58: 281-4.