SÃndromes mielodisplásicos - The Leukemia & Lymphoma Society
SÃndromes mielodisplásicos - The Leukemia & Lymphoma Society
SÃndromes mielodisplásicos - The Leukemia & Lymphoma Society
- No tags were found...
Create successful ePaper yourself
Turn your PDF publications into a flip-book with our unique Google optimized e-Paper software.
Síndromesmielodisplásicos
Un mensaje de John WalterPresidente y Director General de LLSLa Sociedad de Lucha contra la Leucemia y el Linfoma (LLS, por sus siglas eninglés) tiene el compromiso de ofrecerle la información más actualizada sobrelos distintos tipos de cáncer de la sangre. Sabemos lo importante que es parausted comprender con exactitud su diagnóstico, su tratamiento y sus opcionesde apoyo. Con este conocimiento, puede trabajar junto con los miembrosde su equipo de profesionales de la oncología para seguir adelante, con laesperanza de lograr la remisión y recuperarse.Nuestra visión es que, algún día, la gran mayoría de las personasdiagnosticadas con síndromes mielodisplásicos (MDS, por sus siglas eninglés) se curen o puedan manejar la enfermedad con una buena calidad devida. Esperamos que la información de este librito lo ayude en su camino.LLS es la organización voluntaria de salud más grande del mundo, dedicadaa financiar la investigación médica, la educación y los servicios al pacientesobre el cáncer de la sangre. Desde su fundación en 1954, LLS ha invertidomás de $750 millones en la investigación médica específicamente dirigidaa los distintos tipos de cáncer de la sangre. Seguiremos invirtiendo en lainvestigación médica para buscar curas, así como en programas y serviciosque mejoren la calidad de vida de los pacientes con MDS y sus familias.Le deseamos lo mejor.John WalterPresidente y Director General
ContenidoIntroducción 2Estamos aquí para ayudar 3Síndromes mielodisplásicos 6Incidencia 7Causas y factores de riesgo 8Signos y síntomas 8Diagnóstico 8Clasificación de los MDS y el SistemaInternacional de Puntaje Pronóstico 9Tratamiento 12Investigación médica y ensayos clínicos 20Sangre y médula ósea normales 22Términos médicos 24Más información 40página 1
IntroducciónEste librito ofrece información sobre los síndromes mielodisplásicos(MDS, por sus siglas en inglés) a pacientes y sus familias. Se reportaronaproximadamente 62,880 casos de MDS en los Estados Unidos entre 2004y 2008, con un promedio estimado de 12,570 casos por año (fuente:Surveillance, Epidemiology, and End Results [SEER] Program; National CancerInstitute, 2011). No obstante, algunos investigadores estiman que las cifrastal vez sean mucho más altas.El término “síndromes mielodisplásicos” o MDS se ha usado desde finesde la década del 70 para describir un grupo de enfermedades de la sangrey de la médula ósea, con grados variados de gravedad, necesidades detratamiento y expectativa de vida. Muchos pacientes preguntan si los MDSson “cáncer”. Los MDS son un tipo de cáncer. Vea la página 6 para obtenermás información.En este librito se ofrecen breves descripciones de la sangre y la médulaósea normales y definiciones de algunos términos médicos. Algunos delos términos médicos pueden ser sinónimos de otras palabras o frasesempleadas por los profesionales médicos. Por ejemplo, los MDS se hanconocido como “leucemia latente”, “preleucemia” u “oligoleucemia”. Si tienepreguntas sobre cómo se aplican a usted los términos usados en este librito,consulte a su médico.Esta publicación se diseñó para brindar información precisa y fidedigna relacionada con el tema en cuestión.Es distribuida por <strong>The</strong> <strong>Leukemia</strong> & <strong>Lymphoma</strong> <strong>Society</strong> (La Sociedad de Lucha contra la Leucemia y el Linfoma, LLS porsus siglas en inglés) como un servicio público, entendiéndose que LLS no se dedica a prestar servicios médicos ni otrosservicios profesionales.página 2
Estamos aquí para ayudarEste librito lo ayudará a hablar con su médico sobre las pruebas médicas y el tratamientoque usted necesita. Lo animamos a tomar la iniciativa en hacer preguntas y hablar sobresus temores e inquietudes. Estas acciones les darán a los miembros de su equipo deprofesionales médicos la oportunidad de responder a sus preguntas, brindarle apoyoemocional y facilitarle las consultas necesarias con especialistas.Un diagnóstico de MDS suele causar conmoción al paciente, a sus familiares y a susamigos. Algunas de las reacciones o emociones que las personas pueden tener sonnegación, depresión, desesperanza y miedo. Tenga en cuenta que• Muchas personas sobrellevan su situación mejor una vez que su plan de tratamientose ha establecido y pueden empezar a pensar en su recuperación• El pronóstico para las personas con MDS sigue mejorando. Se están estudiandonuevos enfoques de terapia en ensayos clínicos para pacientes de todas las edadesy en cada etapa del tratamiento.LLS tiene recursos para ayudar. El tratamiento para el MDS afectará su vida diaria,al menos durante un tiempo. Es posible que durante y después del tratamiento usteddesee que sus amigos, familiares o cuidadores lo ayuden a obtener información.Las decisiones sobre el tratamiento, el pago de la atención médica, la comunicación conlos profesionales médicos, familiares y amigos son algunas de las causas del estrés quesurgen como resultado de un diagnóstico de cáncer. LLS ofrece información y serviciosgratis para los pacientes y las familias afectadas por el cáncer de la sangre.Hable con un especialista en información. Los especialistas en información sonprofesionales de la oncología titulados a nivel de maestría. Ofrecen información precisay actualizada sobre la enfermedad y el tratamiento, y están disponibles para hablar conquienes llamen de lunes a viernes, de 9 a.m. a 6 p.m. hora del Este, al (800) 955-4572.Puede enviar un correo electrónico a infocenter@LLS.org o hablar por Internet con unespecialista en www.LLS.org.Servicios de idiomas. Hay servicios de interpretación gratis disponibles cuando secomunica con un especialista en información. Dígale a su médico si desea la presenciade un intérprete médico profesional durante su consulta, que hable su lengua maternao use lenguaje de señas. Muchas veces este servicio es gratis.Información en español. LLS tiene varios recursos disponibles en español para lospacientes, los cuidadores y los profesionales médicos. Puede leer y descargar estosrecursos por Internet visitando www.LLS.org/espanol, o pedir copias impresas por correo.página 3
Síndromes mielodisplásicosLos MDS se originan a partir de mutaciones de una célula madre normal (una célulahematopoyética multipotencial) en la médula ósea (vea la Figura 2 en la página 23).En los MDS, la producción de células sanguíneas en la médula suele aumentar, yla médula se llena de una cantidad mayor de lo normal de células sanguíneas endesarrollo. Sin embargo, por lo general hay una deficiencia de células en la sangre,porque las células en desarrollo en la médula mueren en cuanto se acercan a lamadurez, antes del momento en el que normalmente serían liberadas a la sangre.Esto causa una reducción de la cantidad de glóbulos rojos (anemia), neutrófilos(neutropenia) y plaquetas (trombocitopenia) que hay en circulación.Los trastornos celulares en la médula de los pacientes con MDS pueden ser desdeleves a muy graves. En ciertos pacientes, las células mielodisplásicas siguen funcionandoy entran en la sangre. Los glóbulos rojos que se producen transportan oxígeno, losglóbulos blancos (neutrófilos y monocitos) pueden ingerir y destruir bacterias, y lasplaquetas pueden tapar las lesiones de los vasos sanguíneos. En casos más graves deMDS, la formación de células sanguíneas es más desordenada y se acumulan célulasblásticas anormales en la médula y en la sangre. Estas células no maduran en célulasfuncionales. En particular, las células son mucho menos capaces que sus contrapartesnormales de madurar y convertirse en glóbulos rojos, neutrófilos y plaquetas.Normalmente, las células inmaduras conocidas como “blastos” constituyen menos del5 por ciento del total de las células en la médula. En pacientes con MDS, los blastosa menudo constituyen más del 5 por ciento de las células. La cantidad de célulasblásticas (de casos con menores proporciones de células blásticas, a casos con mayoresproporciones de este tipo de células) es uno de los principales factores determinantesde la gravedad de la enfermedad. Un paciente con más de 20 por ciento de blastosen la médula tendrá un diagnóstico de leucemia mieloide aguda (AML, por sus siglasen inglés).Los MDS pueden ser crónicos (no progresan) o de bajo grado de malignidad(de progresión muy lenta), y tal vez sean evidentes en primer lugar por una anemiade leve a moderada. O puede que los MDS se caractericen por• Disminuciones graves de los conteos de glóbulos rojos, glóbulos blancos y plaquetasen la sangre• La presencia de células blásticas leucémicas en la médula ósea y en la sangre.Los MDS pueden progresar de tal modo que las células blásticas anormales invadanla médula y la enfermedad se “evolucione” para transformarse en AML. (Para obtenermás información sobre la AML, consulte el librito gratuito de LLS titulado Leucemiamieloide aguda).página 6
Los MDS se han conocido como “leucemia latente”, “preleucemia” u “oligoleucemia”.Es posible que estos términos resulten confusos, al sugerir que un caso de MDS sólo esproblemático y potencialmente mortal una vez que se transforma en AML. Muchos pacientespreguntan si los MDS son “cáncer”. MDS sí constituye un diagnóstico de cáncer. Cáncersignifica que una mutación de una célula normal resulta en el desarrollo de células que yano se comportan de manera normal. No obstante, el efecto de una enfermedad en la vidade un paciente es más importante que el término empleado para describir la enfermedad. Esimportante saber que la evolución de los MDS puede ser más lenta e interferir menos con lacalidad de vida que la evolución de enfermedades que no se consideren “cáncer”, como lainsuficiencia cardíaca congestiva, el enfisema o la enfermedad de Parkinson.IncidenciaSe diagnosticaron aproximadamente 62,880 casos de MDS en los Estados Unidos entre2004 y 2008, con un promedio estimado de 12,570 casos por año (fuente: Surveillance,Epidemiology, and End Results [SEER] Program; National Cancer Institute, 2011). Noobstante, algunos investigadores estiman que las cifras tal vez sean mucho más altas.Síndromes mielodisplásicos (MDS)Tasas de incidencia por edad (2004-2008)Incidencia (cant. por cada 100,000)50454035302520151050
La incidencia de los MDS aumenta con la edad, y la mayoría de los pacientes sonmayores de 60 años (vea la Figura 1 en la página 7). Los hombres se ven un poquitomás afectados que las mujeres. Los MDS son mucho menos comunes en los niños, enquienes la enfermedad suele asociarse con células anormales que tienen una pérdidaadquirida del cromosoma 7.Causas y factores de riesgoLos MDS pueden ser “primarios” (también llamados “de novo”) o “relacionados con eltratamiento” (también llamados “secundarios”). A la mayoría de las personas que tienenMDS se les diagnostica MDS primario. Con MDS primario, generalmente no existencausas obvias que expliquen la causa de la enfermedad. Un factor de riesgo conocido esla exposición repetida a la sustancia química benceno, que daña el ADN de las célulasmadre normales. El benceno del humo de los cigarrillos actualmente es la causa conocidamás común de exposición a esta toxina. El benceno también se encuentra en ciertosentornos industriales. No obstante, la regulación estricta sobre su uso ha disminuido laexposición al benceno en los lugares de trabajo.Sólo una pequeña proporción de las personas expuestas a quimioterapia y/o radioterapiapresentan MDS relacionado con el tratamiento. Una de las principales teorías sobre porqué los MDS se presentan en algunas personas y no en otras es que las personas quepresentan MDS heredaron genes que limitan su capacidad de eliminar la toxicidad de losagentes causantes.Signos y síntomasLo más frecuente es que los pacientes busquen atención médica debido a la fatiga y lafalta de aliento durante la actividad física, causadas por la disminución de la cantidad deglóbulos rojos (lo que se llama “anemia”). Con mucha menor frecuencia, los pacientesno tienen síntomas, y el diagnóstico de MDS sigue un examen físico de rutina acompañadode una prueba de sangre llamada “hemograma completo” (CBC, por sus siglas en inglés).DiagnósticoUn diagnóstico de MDS se hace midiendo las cantidades o “conteos” de célulassanguíneas de una persona y examinando el aspecto de las células sanguíneas de lasangre y de la médula al microscopio. Un CBC confirma la presencia de anemia y, enalgunos pacientes, bajos conteos de neutrófilos y plaquetas. Se examinan los glóbulosrojos para descubrir si la anemia se debe a un caso de MDS o a otras causas, tales comodeficiencias de hierro, ácido fólico o vitamina B 12, otros tipos de cáncer, o problemasmédicos que llevan a una destrucción acelerada (hemólisis) de los glóbulos rojos.página 8
Si las pruebas no confirman una de estas otras causas de anemia, se obtiene unamuestra de médula ósea mediante una aspiración y una biopsia de médula ósea,para fines de examen.Un diagnóstico de MDS requiere la presencia en la médula ósea de al menos uno de lossiguientes elementos:1. Blastos que constituyan más del 5 por ciento de las células de la médula ósea2. Anomalías citogenéticas. “Citogenéticas” se refiere a los cromosomas. Las célulasde MDS suelen tener anomalías (daños al ADN) citogenéticas (cromosómicas).Las anomalías se describen como “simples” (menos de tres cromosomas afectados)o “complejas” (tres o más cromosomas afectados). Las anomalías citogenéticas máscomunes que se observan en casos de MDS están relacionadas con(a) La eliminación del brazo largo (q) de uno de los dos cromosomas 5, indicadacomo “del(5q)” o “5q-”; cromosomas 7, (del[7q] o 7q-); o cromosomas 20,(del[20q] o 20q-)(b) La pérdida completa de uno de los dos cromosomas 5, indicado comodel(5) o -5; o de uno de los dos cromosomas 7, indicado como del(7) o -7(c) La trisomía 8 (una copia adicional del cromosoma 8, por lo que hay trescromosomas 8 en vez de dos).3. Cambios obvios en la estructura o la forma de la médula (displasia).La hibridación in situ con fluorescencia, a menudo denominada “FISH”, por sus siglasen inglés, es un método que se usa para identificar células cuyos núcleos contienenanomalías cromosómicas. La prueba FISH puede usarse para identificar células anormalescon fines de diagnóstico y para seguir los efectos de la terapia.La presencia de sólo una leve displasia, en ausencia de más del 5 por ciento de blastoso de una anomalía citogenética, posiblemente sea insuficiente para diagnosticar unMDS. En dichos casos, es importante que las muestras de médula ósea del pacientesean examinadas por un hematopatólogo y en algunos casos por un segundohematopatólogo. También es importante asegurarse de que no existan otras causasde anemia o conteos bajos de plaquetas o neutrófilos.Clasificación de los MDS y el SistemaInternacional de Puntaje PronósticoUna gran cantidad de médicos que tratan a pacientes con MDS usan el SistemaInternacional de Puntaje Pronóstico (IPSS, por sus siglas en inglés), que se resumeen la Tabla 1 de la página 11, y en la Tabla 2 de la página 12. El IPSS, presentado en1997, fue creado para traducir el grado de gravedad de la enfermedad de un paciente,resumiendo amplias descripciones en un estándar objetivo. El IPSS asigna el riesgo delpágina 9
paciente a una de cuatro categorías: bajo, intermedio-1, intermedio-2, o alto.Las categorías IPSS de bajo e intermedio-1 a veces se combinan en un grupo demenor riesgo; las categorías intermedio-2 y alto a veces se combinan en un grupo demayor riesgo. El puntaje de IPSS de un paciente se integra con las observaciones delpaciente por el médico, porque el IPSS por sí solo no es un pronóstico exacto del riesgo.El IPSS no toma en cuenta muchos aspectos del tratamiento de los pacientes de edadavanzada, tales como enfermedades concomitantes, antecedentes de cáncer y otrosproblemas. La investigación médica actual tiene como objetivo identificar mejor losfactores de riesgo del paciente.Históricamente, los MDS se han clasificado en cuatro subtipos diferentes basados enla apariencia de la médula del paciente y en los resultados de los conteos de célulassanguíneas. En 1982, el Grupo de Trabajo Franco-Américo-Británico (FAB, por sus siglasen inglés) creó una clasificación de los MDS. La clasificación FAB de los MDS consiste encinco subtipos:1. Anemia refractaria (RA, por sus siglas en inglés)2. Anemia refractaria con sideroblastos anillados (RARS, por sus siglas en inglés)3. Anemia refractaria con exceso de blastos (RAEB, por sus siglas en inglés)4. Anemia refractaria con exceso de blastos en transformación (RAEB-T, por sus siglasen inglés)5. Leucemia mielomonocítica crónica (CMML, por sus siglas en inglés).En 1999, la Organización Mundial de la Salud (OMS) modificó la clasificación FAB de losMDS. La clasificación modificada por la OMS difiere en varias maneras de la original delFAB. La clasificación de la OMS• Incorpora datos moleculares y citogenéticos• Define que los pacientes con más del 20 por ciento de blastos en la médulatienen AML• Tiene una nueva categoría de “síndromes mielodisplásicos/neoplasiasmieloproliferativas” (MDS/MPN, por sus siglas en inglés) que incluye la leucemiamielomonocítica juvenil (JMML, por sus siglas en inglés) y la leucemia mielomonocíticacrónica (CMML, por sus siglas en inglés)• Añade los subtipos síndrome 5q-, citopenia refractaria con displasia multilinaje(RCMD, por sus siglas en inglés) y MDS inclasificable (MDS-u, por sus siglas en inglés)• Considera a la RAEB-T como una leucemia más que como un subtipo de MDS.Sin embargo, a diferencia del IPSS, ni el FAB ni la OMS incorporan datos de conteosanguíneo; el IPSS es más valioso para estimar un pronóstico que las clasificacionesdel FAB o la OMS. El IPSS y otras clasificaciones también son útiles para interpretarlos resultados de los ensayos clínicos cooperativos con participación de pacientes endiferentes centros de tratamiento.Tenga en cuenta que las definiciones de los subtipos de MDS se incluyen en la secciónTérminos médicos, que comienza en la página 24.página 10
Tabla 2. Categorías de riesgo de IPSSPuntaje de IPSS*0 = IPSS bajo0.5-1.0 = IPSS intermedio 11.5-2.0 = IPSS intermedio 2≥ 2.5 = IPSS alto*Vea la Tabla 1 en la página 11.Categoría de riesgoTabla 2. Los puntajes individuales asignados al porcentaje de blastos en la médula, a lacitogenética (cambios cromosómicos) y a citopenias (bajo conteo de glóbulos rojos, bajo conteode neutrófilos y/o bajo conteo de plaquetas) se combinan para asignar el puntaje total según elIPSS. Vea a continuación los ejemplos de puntajes totales.Ejemplos de puntajes totales:• Un paciente con 5 por ciento o menos de blastos en la médula, sin anomalíascitogenéticas, con una hemoglobina de menos de 10 gramos por decilitro(
iesgo, que contó con un hermano o hermana donante compatible. Actualmente eltrasplante se hace a pacientes de entre 60 y 70 años de edad e incluso mayores,siempre que los pacientes gocen por lo demás de buena salud. Además, los datossugieren que los pacientes obtienen los mismos resultados con un donante compatibleno relacionado que con un donante compatible hermano. Estos dos hallazgos hanampliado enormemente la cantidad de pacientes que son candidatos para trasplantes.Sin embargo, debido a que el trasplante supone un riesgo considerable, el procedimientoestá restringido comúnmente a pacientes cuya expectativa de vida sin un tratamientoexitoso justifica el riesgo de someterse a un procedimiento de trasplante. Hay muchospacientes con MDS cuyo pronóstico se considera lo suficientemente bueno como paraque no sea necesario recibir un alotrasplante de células madre. Específicamente parapacientes con MDS de riesgo más bajo, los beneficios de este tratamiento generalmenteno superan los riesgos que implica.Hay una serie de enfoques generales para el tratamiento, que se pueden usar solos o encombinación (vea la Tabla 3 en la página 15). Entre ellos se incluyen• Observación con conteos sanguíneos periódicos (observar y esperar)• Transfusiones y terapia quelante de hierro• Administración de eritropoyetina (EPO) y otros factores de crecimiento• Terapia con globulina antitimocito (ATG, por sus siglas en inglés)• Farmacoterapia con azacitidina (Vidaza ® ), decitabina (Dacogen ® ), o lenalidomida(Revlimid ® )• Quimioterapia del tipo que se usa para tratar la leucemia mieloide aguda (AML, porsus siglas en inglés)• Quimioterapia del tipo que se usa para tratar la AML, seguida de un alotrasplante decélulas madre• Alotrasplante de células madre.Observación (observar y esperar). Se suele recomendar la observación con conteossanguíneos periódicos, lo que se llama “observar y esperar”, en casos de pacientescon un riesgo bajo o intermedio 1 según el IPSS, un nivel de hemoglobina superiora 10 g/dL (>10 g/dL) y un conteo de plaquetas superior a 50,000 por microlitro(>50,000/μL) a 100,000 por microlitro (100,000/μL) sin necesidad de transfusión.Dichos pacientes tal vez puedan mantener sus niveles normales de actividad sintratamiento.Es importante contar con un médico familiarizado con los MDS para que evalúe alpaciente y examine sus conteos de células sanguíneas periódicamente. Es posible quesu estado cambie poco en años o décadas. No obstante, es importante examinar alpaciente periódicamente, ya que existe el riesgo de evolución a un trastorno más graveen la formación de células sanguíneas, que se convierte en AML en casos extremos.página 13
Transfusiones. En algunos pacientes, el tratamiento para mejorar las cantidades decélulas sanguíneas puede aliviar los síntomas. Es posible que se necesiten transfusionesperiódicas de glóbulos rojos o plaquetas. La decisión de administrar transfusiones deglóbulos rojos se basa en una combinación de factores, entre los que se incluyen el nivelde hemoglobina del paciente, sus síntomas (por ejemplo, sensación de fatiga o dificultadpara respirar) y cualquier otra complicación médica, como enfermedad del corazón.Los glóbulos rojos contienen hierro, y puede que los pacientes con una necesidadcontinua de transfusiones (de menos de 2 unidades a 4 o más unidades de sangreen un mes) corran el riesgo de presentar una “sobrecarga de hierro”, un problema quepuede dañar el corazón y el hígado. Para observar al paciente se usa una prueba desangre llamada “nivel de ferritina en suero” que mide las reservas de hierro del cuerpo.Hay dos medicamentos llamados “quelantes de hierro” aprobados por la FDA paraeliminar el exceso de hierro del cuerpo como consecuencia de anemias con necesidadde transfusiones. El deferasirox (Exjade ® ) es un medicamento oral (una tabletapara disolver en líquido) que se toma una vez al día. El mesilato de deferoxamina(DFO; Desferal ® ) se administra como infusión lenta en forma subcutánea ointramuscular, durante de 8 a 12 horas por día, de cinco a siete días por semana.Sin embargo, no se sabe si el uso de estos medicamentos prolonga la vida.Las transfusiones de plaquetas son generalmente necesarias cuando la cantidadde plaquetas de un paciente es inferior a 10,000/µL. No obstante, las indicacionesprincipales de la necesidad de una transfusión de plaquetas son un sangrado inusualo la formación de moretones.LLS ofrece un librito gratuito titulado Blood Transfusion (en inglés), con informacióncompleta sobre la transfusión de glóbulos rojos, glóbulos blancos, plaquetas y otroscomponentes de la sangre para los pacientes con MDS y otros tipos de cáncer de la sangre.Eritropoyetina (EPO) y otros factores de crecimiento. En algunos pacientes condisminuciones problemáticas de los conteos de células sanguíneas, pueden ser útileslos fármacos que estimulan la producción de células sanguíneas, llamados “factoresde crecimiento”. La EPO es una hormona producida en los riñones que estimula laproducción de glóbulos rojos. Los factores de crecimiento de glóbulos rojos, llamados“agentes estimulantes de eritropoyetina” (ESA ,por sus siglas en inglés), tales comoepoyetina alfa (Procrit ® ) y darbepoyetina alfa (Aranesp ® ), son formas sintéticas de EPOy se administran mediante inyección subcutánea (inyección por debajo de la piel).Aranesp ® es una forma de EPO de acción más prolongada que Procrit ® .Los ESA pueden usarse para tratar entre el 10 y el 20 por ciento de los pacientes conMDS que tienen anemia asociada con bajas concentraciones de EPO. Para este subgrupo,generalmente de pacientes de riesgo bajo o intermedio-1 según el IPSS, el tratamiento conEPO disminuirá la necesidad de transfusiones y posiblemente mejore la supervivencia.La mayoría de los pacientes con MDS no tienen concentraciones bajas de EPO,y la administración de ESA no resulta útil para tratar su anemia. No obstante, todoslos pacientes con MDS deben consultar a sus médicos para que les examinen laspágina 14
concentraciones de EPO. Algunos pacientes con MDS con bajas concentraciones deEPO tal vez no se beneficien de los ESA por sí solos, pero la combinación de éstoscon el factor estimulante de colonias de granulocitos (G-CSF, por sus siglas en inglés,una hormona que aumenta la producción de glóbulos blancos), puede aumentar susconcentraciones de hemoglobina.Usados solos, el G-CSF u otro factor de crecimiento de glóbulos blancos llamado factorestimulante de colonias de granulocitos y macrófagos (GM-CSF, por sus siglas en inglés)no desempeñan ningún papel en el tratamiento de los MDS. No obstante, el G-CSFo el GM-CSF se pueden usar para tratar a pacientes con bajos conteos de neutrófilosque presenten infecciones. Es importante atender con prontitud las infecciones o fiebresinexplicadas. Cuando se identifica o se sospecha que hay infecciones bacterianas o porhongos, puede ser necesario administrar los antibióticos adecuados. Para el tratamientode ciertas infecciones virales es posible usar medicamentos antivíricos.Romiplostim (Nplate ® ), anteriormente AMG 531, está aprobado actualmente para eltratamiento de la trombocitopenia en pacientes con púrpura trombocitopénica crónica(idiopática) inmune (ITP, por sus siglas en inglés) que han tenido una respuestainsuficiente a corticosteroides, inmunoglobinas o esplenectomía. Se está investigandoRomiplostim para el tratamiento de pacientes con MDS que tienen bajos conteosde plaquetas.Tabla 3. Algunos tipos de terapia para síndromesmielodisplásicosFactores de crecimiento(Ejemplos: epoyetina alfa, darbepoyetina alfa y factor estimulantede colonias de granulocitos [G-CSF])Farmacoterapia(Ejemplos: azacitidina, decitabina, lenalidomida)Quimioterapia de tipo AML(Ejemplos: citarabina y daunorrubicina, citarabina,idarrubicina, mitoxantrona y talidomida)Trasplante de células madre(Ejemplos: alotrasplante, alotrasplante de intensidad reducida)Globulina antitimocito (ATG por sus siglas en inglés; Thymoglobulin ® , Atgam ® ).Algunos pacientes con MDS tienen una enfermedad caracterizada por linfocitos quedestruyen a los precursores de glóbulos rojos, neutrófilos y plaquetas normales. La ATG,una inmunoglobulina que se obtiene de conejos o caballos que se administra en formaintravenosa, destruye estos linfocitos y mejora los conteos sanguíneos en algunospágina 15
pacientes con MDS. Es común que se presenten fiebre y escalofríos inmediatamentedespués de la administración de ATG. Los pacientes deberían hablar con sus médicospara determinar si se beneficiarían del tratamiento con ATG.Farmacoterapia. Hay tres enfoques de tratamiento con fármacos individuales, azacitidina(Vidaza ® ), decitabina (Dacogen ® ) y lenalidomida (Revlimid ® ), que fueron aprobados porla FDA para el tratamiento de los MDS.• Azacitidina (Vidaza ® ). Este fármaco, conocido como agente “hipometilante” o“demetilante”, está aprobado por la FDA para el tratamiento de pacientes de bajo y altoriesgo. Aparentemente, ayuda a que la médula ósea del paciente comience a funcionarcon más normalidad. También destruye las células enfermas de la médula ósea quese han reproducido en forma anormal. Vidaza se administra por inyección subcutánea(debajo de la piel), por lo general durante siete días consecutivos, cada cuatro semanas.El tratamiento debería administrarse por lo menos durante cuatro ciclos.En promedio, alrededor del 40 por ciento de los pacientes responde a Vidaza. Se hademostrado que el tratamiento con este fármaco tiene como beneficio mejoras en lacalidad de vida, según la comparación de dos grupos de pacientes en dos estudios deasignación al azar en varios centros. En ambos estudios, un grupo de pacientes recibióobservación con transfusiones cuando fueron necesarias. El otro grupo de pacientes,en ambos estudios, recibió observación con transfusiones cuando fueron necesarias,y también Vidaza. Al agregar Vidaza, en ambos estudios, disminuyó la necesidad detransfusiones. Vidaza causa efectos secundarios, tales como náuseas, vómitos y diarrea,y también reduce temporalmente los conteos de células sanguíneas. No obstante,los conteos de células sanguíneas suelen volver a los niveles previos al tratamiento,o sobrepasarlos, antes de la siguiente serie semanal de inyecciones.En pacientes con MDS de mayor riesgo se ha demostrado que el tratamiento con Vidaza,en lugar de las transfusiones solas, prolonga la supervivencia. Sin embargo, no queda claroa partir de los datos si las mejoras, que tienen una duración en promedio de nueve meses,es suficiente para garantizar el uso de Vidaza en lugar de ingresar a un ensayo clínico.La Vidaza de administración oral se está estudiando en ensayos clínicos de fase 1 y 2para determinar la dosificación más adecuada y su eficacia.• Decitabina (Dacogen ® ). Este fármaco, otro agente hipometilante/demetilante aprobadopor la FDA para pacientes de riesgo bajo y alto, se administra en forma intravenosa.La decitabina también se ha estudiado en un ensayo de asignación al azar que comparóel tratamiento mediante observación y transfusiones solamente, con el tratamientomediante observación y transfusiones con decitabina. Al igual que Vidaza, la decitabinaredujo la necesidad de transfusiones y mejoró los conteos de células sanguíneas enaproximadamente el 30 al 40 por ciento de los pacientes. No obstante, será necesarioestudiarla más para determinar las dosis más efectivas de decitabina. Esto se estáinvestigando actualmente en otros ensayos de asignación al azar. Hasta ahora, la decitabinano ha demostrado aumentar la supervivencia en pacientes con MDS de alto riesgo.página 16
• Lenalidomida (Revlimid ® ). Este es un fármaco aprobado por la FDA para eltratamiento de pacientes que tienen anemia con necesidad de transfusiones debidoa un caso de MDS de riesgo bajo o intermedio 1 asociado con la eliminación delbrazo largo del cromosoma 5, indicada como “del(5q)”, con o sin otras anomalíascitogenéticas, y es la terapia de preferencia para tales pacientes. Puede que la deleción5q esté implicada en el 20 al 30 por ciento de todos los casos de MDS. Revlimid esun fármaco inmunomodulador que es un derivado no neurotóxico y no sedante dela talidomida.Produce y mantiene la independencia de la transfusión de glóbulos rojos en la mayoríade los pacientes con del(5q) de bajo riesgo durante aproximadamente dos años.Revlimid también reduce los requisitos de transfusión de glóbulos rojos en pacientes debajo riesgo sin del(5q), pero no en forma tan eficaz como en los pacientes con del(5q).Se necesitan más estudios para comprender el efecto de Revlimid sobre la expectativade vida y sus beneficios para pacientes con MDS con riesgo intermedio 2 o alto segúnel IPSS, con o sin del(5q).Se necesitan más estudios para determinar cuáles de estos fármacos (Vidaza, decitabinao Revlimid) son mejores para pacientes con MDS de bajo riesgo sin deleción 5q quetengan concentraciones altas de EPO y para quienes, por ende, sea improbable querespondan a los ESA.Quimioterapia. Puede que los pacientes en las categorías de riesgo intermedio 2y alto según el IPSS requieran tratamiento con el mismo tipo de quimioterapia que se usapara tratar la leucemia mieloide aguda (AML, por sus siglas en inglés). La planificación deesta forma de tratamiento también toma en cuenta la edad del paciente y los problemasmédicos coexistentes.Estos son algunos de los fármacos que es posible usar:• Citarabina (citosina arabinosida, ara-C, Cytosar-U ® )• Idarrubicina (Idamycin ® )• Daunorrubicina (Cerubidine ® )• Mitoxantrona (Novantrone ® ).Los fármacos tal vez se administren solos o en combinaciones de dos o tres agentesdiferentes (quimioterapia de combinación). En algunos casos, se usan protocolos dedosis bajas. Al principio, la administración de quimioterapia empeorará las cantidadesde células sanguíneas del paciente. Esto quiere decir que el médico deberá evaluar sise justifica una quimioterapia intensiva, teniendo en cuenta tanto la gravedad de lostrastornos celulares como el potencial del paciente para responder a la quimioterapiacon una remisión.página 17
La quimioterapia ha curado a pacientes con tipos comunes de MDS en casos muy pocofrecuentes (aquellos pacientes con anomalías de los cromosomas 5 y/o 7). Algunosfármacos nuevos, como la clofarabina (Clolar ® ), se están estudiando en ensayos clínicospara tratar tanto a los pacientes con MDS como a los pacientes con AML. (Vea la secciónInvestigación médica y ensayos clínicos que empieza en la página 20).Se puede encontrar más información sobre estos fármacos en el librito gratuito de LLStitulado Farmacoterapia y manejo de los efectos secundarios.Alotrasplante de células madre. El alotrasplante de células madre es unprocedimiento de alto riesgo, y la decisión de realizar un trasplante depende de variosfactores. Para pacientes más jóvenes, así como para pacientes de 60 a 80 años de edadque por lo demás gozan de buena salud, están en la categoría IPSS intermedia 2 o dealto riesgo y tienen un donante de células madre con HLA compatible (hermano/a ono emparentado), el tratamiento que tiene el mejor potencial conocido para curar laenfermedad es la radiación intensiva y/o la quimioterapia, seguida de un alotrasplantede células madre.Alrededor del 40 a 50 por ciento de los pacientes que se hagan un alotrasplante decélulas madre se curarán de su MDS. Los resultados de los trasplantes con célulasmadre de donantes compatibles no emparentados son buenos en comparación con lostrasplantes de donantes compatibles emparentados. Algunos pacientes recaen luego deltrasplante, aunque si ocurre, habitualmente sucede en los primeros años.El alotrasplante de células madre ha estado generalmente limitado a los pacientes conMDS de alto riesgo, debido a las tasas de mortalidad asociadas a este procedimiento(del 10 al 30 por ciento). Los beneficios del alotrasplante de células madre de intensidadreducida aún no se han establecido claramente en pacientes de más edad. Los trasplantesde intensidad reducida (también llamados “trasplantes no mieloablativos de célulasmadre”) son casi tan efectivos para eliminar los MDS como los alotrasplantes estándar(totalmente mieloablativos), y pueden tener tasas de mortalidad inferiores a las asociadascon los alotrasplantes estándar. Como resultado, el trasplante puede ser una opción detratamiento para pacientes de más de 70 años, quienes conforman la gran mayoría de lospacientes con MDS.Para obtener información completa sobre el trasplante de células madre, consulte laspublicaciones gratuitas de LLS tituladas Trasplante de células madre sanguíneas y demédula ósea y Trasplante de células madre de la sangre del cordón umbilical.página 18
Atención de seguimiento. Algunas de las pruebas que se hacen para diagnosticar losMDS pueden repetirse para• Observar los efectos del tratamiento• Tomar decisiones respecto a continuar, intensificar, cambiar o suspender el tratamiento.Después del tratamiento, un paciente que esté en remisión y haya terminado eltratamiento continúa siendo examinado regularmente por sus médicos. Es necesarioevaluar periódica y minuciosamente la salud del paciente, los conteos de célulassanguíneas y, si está indicado, la médula ósea. Con el tiempo, las evaluaciones puedenser menos frecuentes, pero deberían continuar indefinidamente. Es importante llevar unregistro del tratamiento para el cáncer que recibe, de modo que su médico pueda hacerel seguimiento de ciertos efectos tardíos específicos que pueden estar asociados a sutratamiento. Esta información incluiría su diagnóstico, los nombres de los fármacos dequimioterapia que toma, información sobre el tratamiento de radioterapia, las cirugías,el trasplante y cualquier otro tratamiento que haya recibido, y los nombres y las fechasde cualquier complicación relevante y el tratamiento recibido para dichas complicaciones.Esto puede ayudar a su médico a planificar las consultas de seguimiento para usted.Infórmese acerca de cómo manejar la fatiga, la ansiedad, la depresión y el dolor a travésde las experiencias de dos sobrevivientes, con comentarios de sus profesionales médicos.Puede mirar el programa gratis de LLS titulado Paths To Recovery—Stories From TwoBlood Cancer Survivors en www.LLS.org/webcasts (en inglés).Resultados del tratamiento. La mejor atención de apoyo, el tratamiento con fármacosmás nuevos (Revlimid ® , Vidaza ® y decitabina), los avances en el alotrasplante de célulasmadre y los estudios sobre nuevos fármacos en ensayos clínicos, todo esto contribuye a lamejora de los resultados y de la calidad de vida de los pacientes con MDS. No obstante,el pronóstico para los pacientes con un tipo de MDS varía ampliamente, y se recomiendaa todos los pacientes que hablen con sus médicos sobre la supervivencia. Los pacientestal vez deseen tener en cuenta que las estadísticas de supervivencia existentes quizássubestimen la supervivencia un poco, ya que estos datos no incorporan los resultadosde las opciones de tratamiento actuales. Por otro lado, los datos obtenidos durante lasprimeras etapas de los ensayos clínicos pueden sobrestimar el beneficio de la supervivenciadebido a que los pacientes que participaron en estos ensayos pueden ser más sanos queel paciente promedio con MDS. Se recomienda a los pacientes de alto riesgo que hablencon sus médicos sobre si sería beneficioso participar en un ensayo clínico.página 19
Investigación médica y ensayos clínicosLLS está financiando estudios de investigación médica que podrían llevar a la identificaciónprecisa y la caracterización de las células en las que evolucionan los MDS, usando marcadoresde proteínas de la superficie de las células y patrones de actividad de los genes. LLS tambiénestá financiando estudios sobre un nuevo fármaco que inhibe de forma selectiva las moléculasinvolucradas de forma crítica en el crecimiento y la proliferación de las células cancerosas.Ensayos clínicos. Cada fármaco o tratamiento nuevo pasa por una serie de ensayosclínicos antes de llegar a formar parte de la terapia estándar. Los ensayos clínicos estánmeticulosamente diseñados y son rigurosamente supervisados por profesionales médicos einvestigadores expertos para garantizar la mayor seguridad y precisión científica posibles. Laparticipación en un ensayo clínico que se lleve a cabo de forma muy cuidadosa tal vez sea la“mejor opción disponible” de tratamiento.Enfoques de la investigación médica. Existen ensayos clínicos para pacientes reciéndiagnosticados y para pacientes que sufren una recaída o que tienen una enfermedadresistente al tratamiento. Hay varios enfoques de tratamiento en fase de estudio en ensayosclínicos para el tratamiento de pacientes con MDS.Farmacoterapia. Hay varios ensayos clínicos para estudiar tratamientos con combinacionesde fármacos aprobados por la FDA, tales como Vidaza ® o decitabina, y quimioterapia del tipousado para tratar la AML. El motivo de combinar fármacos es que, ya que cada uno de ellosactúa de manera diferente para destruir las células cancerosas, al usarlos juntos tal vez sedestruyan más células de MDS, o quizás sean tan eficaces como las terapias estándar para losMDS pero con menos efectos secundarios tóxicos. La Vidaza también se está usando comoterapia de mantenimiento para los pacientes con MDS que logren una remisión total o parcialluego de recibir quimioterapia intensiva. El propósito del estudio es determinar si la duración dela respuesta del paciente mejora con el tratamiento de mantenimiento con Vidaza. ON 01910.Na (Estybon ® ) es un fármaco que aumenta la muerte de las células de los MDS, con datosmuy precoces que sugieren la eficacia en pacientes con MDS que hayan dejado de respondera la Vidaza.Tabla 4. Algunos fármacos en fase de estudio en ensayosclínicos para el tratamiento de los síndromes mielodisplásicosClofarabina (Clolar ® )ON 01910.Na (Estybon ® )Lonafarnib (Sarasar ® )Ácido valproico (Depakene ® )Vorinostat (Zolinza ® )Tabla 4. Algunos de los fármacos en estudio para el tratamiento de los MDS ya están aprobadospara el tratamiento de otras enfermedades o problemas médicos. Por ejemplo, el ácido valproicoestá aprobado para el tratamiento de ciertos trastornos de convulsiones y el vorinostat estáaprobado para el tratamiento de una forma de linfoma.página 20
Algunos ejemplos de las combinaciones de fármacos en estudio son• Clofarabina (Clolar ® ), un fármaco aprobado para tratar la leucemia linfoblástica aguda(ALL, por sus siglas en inglés) en niños, en casos de recaída o de resistencia altratamiento, en combinación con quimioterapia de tipo de AML• ON 01910.Na (Estybon ® ), un nuevo fármaco que se está estudiando con pacientes deriesgo intermedio 1 y 2 o de alto riesgo• Lonafarnib (Sarasar ® ), es un inhibidor de la farnesiltransferasa (FTI, por sus siglas eninglés) que se está estudiando en pacientes con MDS que reciben entre una y ochotransfusiones de plaquetas cada cuatro semanas• El ácido valproico (Depakene ® ), un inhibidor de la histona deacetilasa (HDAC, por sussiglas en inglés), combinado con decitabina (Dacogen ® )• El vorinostat (Zolinza ® ), un inhibidor de la HDAC, combinado con azacitidina (Vidaza ® ).Terapia de vacunas. Hay ensayos clínicos en proceso para determinar si una vacunapara los MDS podría ser efectiva en el tratamiento de pacientes de 18 años de edaden adelante con MDS de bajo riesgo. La vacuna está hecha a partir de los elementosfundamentales de las proteínas (llamados “péptidos”) que pueden ayudar al cuerpoa preparar una respuesta inmunitaria eficaz contra las células de MDS. La terapia devacunas y las infusiones de linfocitos de donantes también se están estudiando parael tratamiento de los MDS (y otros tipos de cáncer de la sangre) en pacientes con unaenfermedad progresiva o en recaída luego de un alotrasplante de células madre.Trasplante de células madre de intensidad reducida. Los pacientes que se estánacondicionando para un trasplante no mieloablativo reciben dosis más bajas de fármacosde quimioterapia y/o radioterapia como preparación para el trasplante. Los fármacosinmunosupresores se usan para evitar el rechazo del injerto, y es posible que el injertode los inmunocitos del donante permita que estas células ataquen la enfermedad (efectoinjerto contra cáncer). En estudios actuales se están investigando el uso de este tipo detrasplante en adultos mayores con enfermedad resistente al tratamiento y/o en recaída,así como el uso de sangre del cordón umbilical de un donante no emparentado.Lo animamos a comunicarse con un especialista en información y a visitarwww.LLS.org/clinicaltrials (en inglés) para obtener más información sobre los tratamientosespecíficos que se están estudiando en ensayos clínicos actuales.página 21
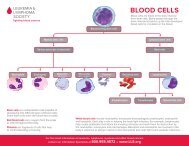
Sangre y médula ósea normalesSangre y médula ósea. La sangre está compuesta de plasma y células suspendidasen el plasma. El plasma está compuesto principalmente de agua, en la cual hay muchassustancias químicas disueltas. Entre estas sustancias químicas se incluyen• Proteínas• Albúmina, la proteína más abundante de la sangre• Proteínas que coagulan la sangre, producidas por el hígado• Eritropoyetina, una proteína producida por los riñones que estimula la producciónde glóbulos rojos• Inmunoglobinas, anticuerpos producidos por las células plasmáticas en respuestaa infecciones, como los que producimos cuando recibimos vacunas (como losanticuerpos contra el virus de la poliomielitis, que son producidos por célulasplasmáticas normales en la médula ósea)• Hormonas (tales como la hormona tiroidea y el cortisol)• Minerales (tales como el hierro y el magnesio)• Vitaminas (tales como el ácido fólico y la vitamina B 12)• Electrolitos (tales como el calcio, el potasio y el sodio).Las células suspendidas en el plasma incluyen glóbulos rojos, plaquetas y glóbulosblancos (neutrófilos, monocitos, eosinófilos, basófilos y linfocitos).• Los glóbulos rojos constituyen un poco menos de la mitad del volumen de la sangre.Están llenos de hemoglobina, la proteína que recoge el oxígeno en los pulmonesy la transporta a las células de todo el cuerpo; la hemoglobina recoge luego el dióxidode carbono de las células del cuerpo y lo devuelve a los pulmones, de donde seelimina cuando exhalamos aire. Las plaquetas son células pequeñas (de un décimodel tamaño de los glóbulos rojos) que ayudan a detener las hemorragias en el sitio deuna lesión en el cuerpo. Por ejemplo, cuando una persona se corta, se desgarran losvasos sanguíneos que transportan la sangre. Las plaquetas se adhieren a la superficiedesgarrada del vaso sanguíneo, se amontonan y tapan el sitio de la hemorragia, con laayuda de las proteínas que coagulan la sangre, como la fibrina y electrolitos, como elcalcio. Posteriormente se forma un coágulo firme. Entonces la pared del vaso sanguíneose cura en el sitio del coágulo y vuelve a su estado normal.• Los neutrófilos y los monocitos son glóbulos blancos. Se denominan “fagocitos” (célulasque ingieren) porque pueden ingerir las bacterias o los hongos y destruirlos. A diferenciade los glóbulos rojos y las plaquetas, los monocitos salen de la sangre y entran enlos tejidos, donde pueden atacar a los organismos invasores y ayudar a combatir lasinfecciones. Los eosinófilos y los basófilos son tipos de glóbulos blancos que reaccionanante alérgenos o parásitos.página 22
• La mayoría de los linfocitos, otro tipo de glóbulo blanco, se encuentra en los ganglioslinfáticos, el bazo y los conductos linfáticos, pero algunos entran en la sangre. Existentres tipos principales de linfocitos: linfocitos T, linfocitos B y células citolíticas naturales.Estas células forman parte fundamental del sistema inmunitario.Desarrollo de las células sanguíneas y de los linfocitosCÉLULAS MADRECélulas hematopoyéticasmultipotencialesCélulas linfoidesmultipotencialesSe diferencian y maduran paratransformarse en seis tipos decélulas sanguíneasSe diferencian y maduran paratransformarse en tres tipos delinfocitosGlóbulos rojosNeutrófilosEosinófilosBasófilosMonocitosPlaquetasLinfocitos TLinfocitos BCélulas citolíticas naturalesFigura 2. Este diagrama representa el modo en que las células madre se transforman en célulassanguíneas y linfáticas.La médula ósea es un tejido esponjoso donde tiene lugar la producción de las célulassanguíneas. Ocupa la cavidad central de los huesos. En los recién nacidos, todos los huesostienen médula activa. Para cuando una persona comienza su edad adulta, los huesos delas manos, los pies, los brazos y las piernas ya no tienen médula en funcionamiento.La columna vertebral (vértebras), los huesos de las caderas y los omóplatos, las costillas,el esternón y el cráneo contienen médula que produce las células sanguíneas en losadultos. El proceso de la formación de células sanguíneas se denomina “hematopoyesis”.Un pequeño grupo de células, las células madre, se desarrollan en todas las célulassanguíneas de la médula mediante el proceso de diferenciación (vea la Figura 2).En las personas sanas hay suficientes células madre para seguir produciendo nuevascélulas sanguíneas continuamente. La sangre pasa a través de la médula y recoge losglóbulos rojos y blancos y las plaquetas, todos plenamente desarrollados y funcionales,para que circulen en la sangre.Algunas células madre entran en la sangre y circulan. Se encuentran en cantidades tanpequeñas que no pueden contarse ni identificarse en los conteos sanguíneos estándar.Su presencia en la sangre es importante porque pueden ser recolectadas mediante unapágina 23
técnica especial. También hay métodos para inducir que más células madre salgan de sulugar de origen en la médula y circulen en la sangre, permitiendo una mayor recolecciónde células madre. Si se recolectan suficientes células madre de un donante compatible,se pueden trasplantar a un receptor.La circulación de las células madre, desde la médula hacia la sangre y de regreso, tambiénocurre en el feto. Después del parto, la sangre de la placenta y del cordón umbilical sepuede recolectar, almacenar y usar como fuente de células madre para trasplantes.Términos médicosADN. El material genético de la célula. El ácido desoxirribonucleico es el nombre científicodel ADN, que está formado por un esqueleto de azúcares y fosfatos con “escalones”compuestos por purinas y pirimidinas (los elementos fundamentales de los ácidosnucleicos). La secuencia de las purinas y las pirimidinas en el ADN es la responsable depasar la información genética a las células nuevas durante el proceso de división celular,de pasar la información genética de una generación a la siguiente durante la reproduccióny de proporcionar las instrucciones para la formación de proteínas,las que a su vez llevan a cabo las funciones principales de una célula. Una mutación esgeneralmente un cambio o una pérdida de la secuencia de las purinas o pirimidinas delADN. Las mutaciones pueden provocar la muerte celular, cambios en la forma en la quefunciona una célula y en algunos casos cáncer.Aféresis. El proceso de extraer componentes de la sangre de un donante y devolverlelos que no se necesitan. El proceso, también llamado “hemaféresis”, hace circular sangrede un donante a través de una máquina especializada y luego de vuelta al donante.La aféresis hace posible la extracción de los elementos deseados a partir de grandesvolúmenes de sangre. Se pueden extraer, por separado, plaquetas, glóbulos rojos, glóbulosblancos y plasma. Esta técnica también se usa para extraer células madre que circulan enla sangre, que pueden congelarse, almacenarse y utilizarse posteriormente para trasplante,en lugar de utilizar células madre de la médula ósea.Alotrasplante de células madre. Tratamiento que emplea células madre de un donantepara restituir la médula ósea y las células sanguíneas de un paciente. En primer lugar,el paciente recibe una “terapia de acondicionamiento” (quimioterapia de alta dosiso quimioterapia de alta dosis con radioterapia en todo el cuerpo) para tratar la leucemiay para “apagar” el sistema inmunitario del paciente, para que no rechace las células madredel donante. Se está estudiando un tipo de trasplante llamado trasplante “de intensidadreducida” o “no mieloablativo”. Utiliza dosis bajas de terapia de acondicionamientopágina 24
y podría ser más seguro, en especial en pacientes de más edad. Para obtener másinformación, consulte el librito gratuito de LLS titulado Trasplante de células madresanguíneas y de médula ósea.Alotrasplante no mieloablativo de células madre. Vea Trasplante de células madrede intensidad reducida.Análisis citogenético. El proceso de analizar la cantidad y la forma de los cromosomasde las células. Las alteraciones cromosómicas se pueden detectar, y en algunos casos esposible identificar los genes reales que se vieron afectados. Estos resultados son muy útilespara diagnosticar tipos específicos de cáncer de la sangre, a fin de determinar enfoques detratamiento y para observar la respuesta al tratamiento. La persona que prepara y examinalos cromosomas e interpreta los resultados se llama “citogenetista”.Anemia. Una disminución de la cantidad de glóbulos rojos y, por lo tanto, de laconcentración de hemoglobina en la sangre. Esto reduce la capacidad de la sangrepara transportar oxígeno. Si es grave, la anemia puede causar palidez, debilidad, fatigay dificultad para respirar al hacer esfuerzos. Vea Hematocrito; Hemoglobina.Anemia aplásica. Afección en la cual la médula ósea no puede producir célulassanguíneas. Algunas personas con anemia aplásica tienen células en la médula óseacon características anormales similares a las células de los MDS y no típicas de laanemia aplásica.Anemia clonal; Pancitopenia clonal. Términos que se pueden usar en lugar de anemia“adquirida” o “refractaria”. Los términos “adquirida” y “refractaria” no señalan la naturalezamaligna (cancerosa) de estos trastornos. Un trastorno “clonal” es un cáncer.Anemia refractaria (RA, por sus siglas en inglés). En algunos sistemas declasificación, es el nombre de un subtipo de síndromes mielodisplásicos. La anemiarefractaria es un trastorno mieloide clonal que afecta principalmente la producción deglóbulos rojos en la médula ósea. La RA a menudo se asocia con disminuciones levesa moderadas de los glóbulos blancos y las plaquetas. El trastorno también se denomina“mielodisplasia”.Anemia refractaria con exceso de blastos (RAEB, por sus siglas en inglés).Vea Leucemia mielógena oligoblástica.Anemia refractaria con exceso de blastos en transformación (RAEB-T, por sussiglas en inglés). Un subtipo de síndromes mielodisplásicos de la clasificación del grupofranco-américo-británico (FAB) en el cual la cantidad de blastos en la médula ósea varíadel 20 al 30 por ciento.página 25
Anemia refractaria con sideroblastos anillados (RARS, por sus siglas en inglés).En algunos sistemas de clasificación, el nombre de un subtipo de síndromesmielodisplásicos caracterizado por anemia refractaria (RA) con acumulación anormalde gránulos de hierro en torno al núcleo de las células. Dichas células se llaman“sideroblastos anillados”. Todos los glóbulos rojos de desarrollo normal contienen finaspartículas de hierro que se incorporan en la hemoglobina, la proteína transportadora deoxígeno que da a los glóbulos rojos su color y su función. En el caso de los sideroblastosanormales, grandes cantidades de hierro quedan atrapadas en los glóbulos rojos endesarrollo en sitios anormales. Al teñir las células de la médula ósea para detectar el hierroy examinarlas al microscopio se pueden identificar como sideroblastos anormales. La RAy la RARS a menudo se asocian con disminuciones leves a moderadas de los glóbulosblancos y las plaquetas. Este trastorno también se denomina “mielodisplasia” o “anemiasideroblástica adquirida”.Anemia sideroblástica adquirida. Vea Anemia refractaria con sideroblastos anillados.Anticuerpos monoclonales. Anticuerpos elaborados por células que pertenecena un único clon. Estos anticuerpos sumamente específicos pueden ser producidos enel laboratorio. Son reactivos muy importantes para identificar y clasificar la enfermedadmediante la inmunotipificación de células. Poseen aplicaciones clínicas para laadministración de fármacos dirigida a las células cancerosas y pueden utilizarse parapurificar células utilizadas para trasplantes de células madre.Antígeno. Una sustancia extraña, usualmente una proteína, que estimula una respuestainmunitaria cuando se ingiere, se inhala o entra en contacto con la piel o las membranasmucosas. Ejemplos de antígenos son bacterias, virus o alérgenos. Los antígenos estimulanlas células plasmáticas para producir anticuerpos.Antígenos leucocitarios humanos (HLA, por sus siglas en inglés).Estos antígenos son proteínas que están en la superficie de la mayoría de las célulasde los tejidos y le dan a una persona su tipo de tejido característico. Los factores deHLA se heredan de la madre y del padre, y la mayor probabilidad de tener el mismotipo de HLA ocurre entre hermanos. En promedio, es de esperar que uno de cadacuatro hermanos comparta el mismo tipo de HLA. La prueba de antígenos HLA se llama“tipificación de tejido”. Hay seis grupos principales de antígenos HLA: A, B,C, D, Dr, y Dq.Estas proteínas de la superficie de las células actúan como antígenos cuando son donadas(trasplantadas) a otra persona (el receptor). Si los antígenos de las células del donante sonidénticos (como en los gemelos idénticos) o muy similares (como en los hermanos conHLA compatible), el trasplante (las células madre donadas) tendrá más probabilidades desobrevivir (injertarse) en el receptor. Además, las células del cuerpo del receptor tendránmenos probabilidades de ser atacadas por las células inmunitarias donadas (el resultadose llama “reacción injerto contra huésped”).página 26
Aspiración de médula ósea. Una prueba para examinar células de la médula ósea afin de detectar anomalías celulares. La muestra de médula ósea por lo general se tomadel hueso ilíaco (de la cadera) del paciente. Una vez que se administra un medicamentopara anestesiar la piel, se extrae la muestra líquida mediante una aguja especial quese introduce en la médula ósea a través del hueso. La muestra se observa con unmicroscopio, para identificar células anormales. La muestra se evalúa no solo para sabersi hay MDS, sino también para saber qué cantidad hay. Las células obtenidas tambiénpueden emplearse en análisis citogenético, en citometría de flujo y en otras pruebas.Autosomas. Vea Cariotipo.Autotrasplante de células madre. Un tratamiento que usa las propias células madrede un paciente para retrasar la evolución de determinados tipos de cáncer de la sangre.El proceso de autotrasplante tiene lugar una vez que el paciente logra una respuestacompleta (remisión) o una buena respuesta parcial a la farmacoterapia de inducción.En este tratamiento 1) se recolectan células madre del paciente, por lo general dela sangre; 2) se congelan las células madre para uso posterior y el paciente recibefarmacoterapia de acondicionamiento; y 3) se descongelan las células madre y se vuelvena infundir al paciente a través de un catéter permanente (vía central). Los principalesefectos secundarios del trasplante son los resultados de la terapia de acondicionamiento;entre ellos se incluyen úlceras bucales, caída del pelo, náuseas, vómitos, diarrea y riesgode infección. Los pacientes reciben atención de apoyo para ayudar a prevenir y/ocontrolar los efectos secundarios. Por lo general, después de 10 a 14 días, se empiezana normalizar los conteos sanguíneos y comienzan a desaparecer los efectos secundariosde la terapia de acondicionamiento. Para obtener más información sobre todos los tiposde trasplante de células madre, consulte la publicación gratuita de LLS titulada Trasplantede células madre sanguíneas y de médula ósea.Basófilo. Un tipo de glóbulo blanco que participa en determinadas reacciones alérgicas.Biopsia de médula ósea. Una prueba para examinar células de la médula ósea a finde detectar anomalías celulares. Esta prueba difiere de la aspiración de médula ósea enque se extirpa una pequeña cantidad de hueso llena de médula ósea, por lo general delhueso ilíaco (de la cadera). Una vez que se administra un medicamento para anestesiar lapiel, se extirpa una muestra de hueso que contiene médula ósea con una aguja especialpara biopsias. La médula ósea se examina con el microscopio para determinar la presenciade células anormales. Es posible realizar la aspiración de médula ósea y la biopsia en elconsultorio del médico o en el hospital. Las dos pruebas casi siempre se hacen a la vez.Ambas pruebas se hacen también después del tratamiento, para determinar cuántascélulas sanguíneas cancerosas fueron eliminadas por la terapia.página 27
Cariotipo. El arreglo sistemático, mediante imágenes, de los 46 cromosomas humanosde una célula humana en 22 pares complementarios (un cromosoma materno y unopaterno en cada par) según su longitud, del más largo al más corto, y otras características,con los cromosomas sexuales mostrados como un par separado (ya sea XX o XY).Los 22 pares se denominan “autosomas”. Vea Hibridación in situ con fluorescencia.Catéter central. Un tubo especial que se introduce en una vena grande de la partesuperior del tórax. El catéter central, denominado a veces “catéter permanente”,hace un túnel por debajo de la piel del tórax, para mantenerse firme en su sitio.El extremo externo del catéter se puede utilizar para administrar medicamentos, líquidoso hemoderivados, o para extraer muestras de sangre. Con cuidado meticuloso, loscatéteres pueden permanecer en el lugar por períodos prolongados (varios meses),si es necesario. Se pueden tapar y utilizarse para quimioterapia ambulatoria o para laadministración de hemoderivados cuando un paciente deja el hospital. En los pacientesque reciben quimioterapia intensiva o suplementos nutricionales se pueden utilizar variostipos de catéteres (por ejemplo Groshong ® , Hickman ® y Broviac ® ). Hay esencialmentedos tipos de catéteres: el descrito anteriormente, en que parte del tubo está fuera dela piel y debe cuidarse diariamente y uno llamado “puerto” (acceso venoso), que seimplanta completamente por debajo de la piel. Se puede dejar un puerto colocadoindefinidamente, y se puede retirar cuando ya no se necesita. Los puertos debenenjuagarse periódicamente. Los pacientes y/o cuidadores reciben instrucciones parael cuidado del puerto. Vea Puerto.Catéter permanente. Vea Catéter central.Catéter venoso central de inserción percutánea (vía PICC o PIC, por sus siglasen inglés). Un tubo largo, delgado y flexible que se introduce en el cuerpo y se puededejar colocado durante semanas, o incluso meses, para administrar medicamentos,líquidos y nutrición. También se puede usar para obtener muestras de sangre. Antes dela introducción del PICC, el paciente recibe un anestésico local para adormecer el brazoen la zona entre el codo y el hombro. El PICC se introduce a través de la piel en unavena del brazo hasta alcanzar la vena cava superior, por arriba del corazón. La vena cavasuperior es una de las venas del sistema venoso central. El PICC elimina la necesidad deadministración intravenosa (IV) estándar.Células blásticas. Las primeras células de médula ósea identificadas mediante elmicroscopio óptico. Las células blásticas representan alrededor del uno al cinco por cientode las células de la médula ósea que se desarrollan con normalidad. En leucemias agudasy en algunos casos de MDS, se acumulan las células blásticas anormales (mieloblastosanormales) en la médula ósea. Esta acumulación está relacionada con la disminución dela función de la médula ósea normal, causando el descenso de la cantidad de glóbulosrojos, neutrófilos y plaquetas en la sangre. La cantidad reducida de células, particularmentede glóbulos rojos, es responsable de los síntomas de MDS y AML.página 28
Células madre. Células primitivas de la médula que son fundamentales para la formaciónde glóbulos rojos, glóbulos blancos y plaquetas. Las células madre se encuentran en granparte en la médula, pero algunas salen de ella y circulan en la sangre. Mediante el usode técnicas especiales, las células madre de la sangre pueden ser extraídas, conservadasmediante congelación, y posteriormente descongeladas y utilizadas en terapia de célulasmadre. Vea Hematopoyesis.Células madre del cordón umbilical. Las células madre que están presentes enla sangre extraída de la placenta y el cordón umbilical. Estas células madre tienen lacapacidad de repoblar la médula de un receptor compatible y producir células sanguíneas.La sangre del cordón umbilical congelada es una fuente de células madre de donante paraun trasplante a receptores con HLA compatibles. La mayoría de los trasplantes de sangredel cordón umbilical son posibles gracias a donantes no emparentados compatibles o casicompatibles.Células sanguíneas. Cualquiera de los tres tipos principales de células de la sangre:glóbulos rojos, que transportan oxígeno; glóbulos blancos, que principalmente previeneno combaten las infecciones, y plaquetas, que ayudan a prevenir hemorragias. Hay variostipos principales de glóbulos blancos en la sangre: cada tipo de célula está representadoen la sangre en la cantidad necesaria para cumplir su función. Una onza líquida de sangrecontiene alrededor de 150,000 millones de glóbulos rojos, 8,000 millones de plaquetasy 20 millones de glóbulos blancos. Los glóbulos rojos viven durante meses, las plaquetasviven una o dos semanas y los glóbulos blancos viven algunos días. La médula ósea debesustituir más de 100 millones de células de la sangre cada día.Citopenia. Una reducción de la cantidad de células que circulan en la sangre.Citopenia refractaria con displasia multilinaje (RCMD, por sus siglas en inglés).Un subtipo de MDS en la clasificación de la Organización Mundial de la Salud (OMS) queincluye a pacientes con menos del 10 por ciento de células anormales en dos o tres tiposde células sanguíneas con niveles de blastos de menos del 5 por ciento en la médulaósea y menos de 1 por ciento en la sangre, y menos del 15 por ciento de sideroblastosanillados en la médula ósea. La presencia de más del 15 por ciento de sideroblastosanillados se denomina “RCMD-RS”.Clonal. La designación de una población de células derivada de una sola célula originaltransformada. Prácticamente todos los tipos de cáncer se originan de una sola célula quesufre una lesión (mutación) en su ADN y, por lo tanto, son monoclonales. La leucemia,el linfoma, el mieloma y los síndromes mielodisplásicos son ejemplos de cáncer clonal,es decir, cáncer derivado de una única célula anormal.página 29
Conteo absoluto de neutrófilos (ANC, por sus siglas en inglés). La cantidad deneutrófilos (un tipo de glóbulo blanco) que una persona tiene para combatir infecciones.Se calcula multiplicando el número total de glóbulos blancos por el porcentaje deneutrófilos (células segmentadas y cayados).Conteo sanguíneo. Una prueba de laboratorio que requiere una pequeña muestra desangre que se usa para medir la cantidad de los tipos de células que circulan en la sangre.El término “hemograma” o “conteo sanguíneo completo” (CBC, por sus siglas en inglés)se utiliza a menudo para referirse a esta prueba.Cromosoma. Cualquiera de las 46 estructuras (en 23 pares) del núcleo de todas lascélulas del cuerpo humano (salvo los glóbulos rojos) que contienen un filamento de ADN.Este filamento está compuesto principalmente de genes, que son extensiones específicasde ADN. “Genoma” es el término para el conjunto completo de ADN de un organismo.Se ha estimado que el genoma humano contiene aproximadamente 30,000 genes.Los genes de los cromosomas X e Y, los cromosomas sexuales, son los que determinannuestro sexo: dos cromosomas X producen una mujer, y un cromosoma X con un Yproducen un hombre. Cada cromosoma tiene un brazo largo (llamado “q”) y un brazocorto (llamado “p”). La cantidad o el tamaño de los cromosomas puede ser modificadopor las células cancerosas como resultado de la ruptura y la redisposición cromosómicas(translocación).Deleción. Una anomalía cromosómica en la que se perdió parte o la totalidad de unsolo cromosoma.Diferenciación. Vea Hematopoyesis.Efecto injerto contra tumor (GVT, por sus siglas en inglés). La reacción inmunitariapotencial en la que los linfocitos T (trasplantados) del donante reconocen y atacan lascélulas malignas del receptor. Este efecto fue advertido cuando 1) se observó que larecidiva de la enfermedad luego de un trasplante era más probable si el donante y elreceptor eran gemelos idénticos que si eran hermanos no idénticos; 2) cuanto másimportante era la reacción injerto contra huésped, menos probable era la recidiva de laenfermedad; y 3) la extracción de los linfocitos T del donante disminuyó la incidencia dela reacción injerto contra huésped, pero también dio como resultado una mayor frecuenciade recaída de la enfermedad. Cada una de estas observaciones pudo explicarse mejor porun ataque inmunitario por parte de los linfocitos del donante contra las células tumoralesdel receptor que, junto con el tratamiento intensivo de acondicionamiento, sirvieronpara mantener la enfermedad controlada. Este efecto parece ser más activo en tipos deleucemia mieloide, aunque puede ocurrir también en pacientes con otros tipos de cáncerde la sangre.página 30
Enfermedad residual mínima (MRD, por sus siglas en inglés). Las pequeñascantidades de células cancerosas que pueden quedar después del tratamiento, inclusocuando la sangre y la médula parecen estar normales. Estas células residuales sólo puedenidentificarse mediante técnicas moleculares sensibles.Enfermedad resistente al tratamiento. Enfermedad que no entra en remisiónni mejora sustancialmente luego del tratamiento inicial con terapia estándar para laenfermedad.Eosinófilo. Un tipo de glóbulo blanco que participa en reacciones alérgicas y ayudaa combatir ciertas infecciones parasitarias.Eritrocitos. Vea Glóbulos rojos.Eritrocitosis. Vea Hematocrito.Eritropoyetina (EPO). Hormona necesaria para la producción normal de glóbulosrojos. Es producida principalmente por los riñones y se libera en la sangre en respuestaal descenso de niveles de oxígeno en la sangre. La epoyetina alfa (Procrit ® o Epogen ® )y la darbepoyetina alfa (Aranesp ® ) son formas de la hormona humana eritropoyetinaproducidas en el laboratorio, que pueden usarse para tratar la anemia. En oncología,estos fármacos se usan para ayudar en la recuperación de la anemia inducida por laquimioterapia o para tratar enfermedades crónicas en las que la anemia es un hallazgoproblemático, por ejemplo en síndromes mielodisplásicos de bajo riesgo. Estos fármacosestimulan la producción de glóbulos rojos mediante el mismo mecanismo que la EPO,es decir, interactuando con el receptor de EPO en los progenitores de glóbulos rojos.Factor de crecimiento. Una sustancia química que se usa para estimular la producciónde neutrófilos y para acortar el período de conteos bajos de neutrófilos en la sangredespués de la quimioterapia. El factor estimulante de colonias de granulocitos (G-CSF,por sus siglas en inglés) y el factor estimulante de colonias de granulocitos y macrófagos(GM-CSF, por sus siglas en inglés) son ejemplos de factores de crecimiento producidoscomercialmente. El GM-CSF también puede estimular monocitos.Factor de riesgo. Un factor que científicamente se establece como elemento queaumenta las probabilidades de una persona de padecer una enfermedad. Los factoresde riesgo pueden clasificarse como genéticos (heredados), relacionados con el estilo devida o medioambientales. La presencia de uno o más factores de riesgo no significa queuna persona necesariamente vaya a contraer la enfermedad. En el caso de exposiciónmedioambiental, la extensión de la exposición y su duración son consideracionesimportantes para determinar si aumenta el riesgo.página 31
Factor estimulante de colonias. Vea Factor de crecimiento.Fagocitos. Células que comen (ingieren) rápidamente los microorganismos tales comobacterias y hongos y que los pueden destruir como medio de protección del cuerpo contralas infecciones. Los dos principales fagocitos son los neutrófilos y los monocitos. Salende la sangre y entran en los tejidos donde se ha producido una infección. La principalcausa de susceptibilidad a las infecciones en pacientes tratados con radioterapia y/oquimioterapia intensivas es una grave disminución de la concentración de estas células enla sangre. Es posible que el tratamiento inhiba la producción de células sanguíneas en lamédula ósea, lo que produce una deficiencia de estas células fagocíticas.Fármacos citotóxicos. Vea Quimioterapia.G-CSF. Vea Factor de crecimiento.Glóbulos blancos. Cualquiera de los cinco tipos principales de leucocitos (literalmente“células blancas”) de la sangre que combaten infecciones: neutrófilos, eosinófilos,basófilos, monocitos y linfocitos.Glóbulos rojos. Células sanguíneas (eritrocitos) que transportan hemoglobina, quese une al oxígeno y lo lleva a los tejidos del cuerpo. Los glóbulos rojos constituyenaproximadamente del 40 al 45 por ciento del volumen de la sangre en las personas sanas.GM-CSF. Vea Factor de crecimiento.Granulocito. Un tipo de glóbulo blanco que tiene un gran número de gránulos en elcuerpo de la célula. Los neutrófilos, los eosinófilos y los basófilos son tipos de granulocitos.Hemaféresis. Vea Aféresis.Hematocrito. La proporción de la sangre ocupada por los glóbulos rojos. Los valoresnormales son de 40 a 54% en hombres y de 35 a 47% en mujeres. Si el hematocritoestá por debajo de lo normal, el problema médico se llama “anemia”. Si el hematocritoestá por encima de lo normal, la afección se llama “eritrocitosis”.Hematólogo. Médico especializado en el tratamiento de las enfermedades de las célulassanguíneas. Esta persona puede ser un internista, que trata a los adultos, o un pediatra,que trata a los niños.Hematopatólogo. Un hematopatólogo es un tipo de anatomopatólogo que estudialas enfermedades de las células sanguíneas observando exudados de sangre periférica,aspiraciones y biopsias de médula ósea, ganglios linfáticos y demás tejidos, y queusa su conocimiento experto para identificar enfermedades tales como el síndromemielodisplásico. Además del microscopio, el hematopatólogo también usa valores depágina 32
laboratorio, citometría de flujo y pruebas de diagnóstico molecular para llegar al diagnósticomás preciso. El hematopatólogo trabaja muy de cerca con el hematólogo/oncólogo queatiende al paciente y decide el mejor tratamiento según el diagnóstico.Hematopoyesis. El proceso de desarrollo de células sanguíneas en la médula ósea.Las células más primitivas de la médula son las células madre. Ellas comienzan el procesode desarrollo de células sanguíneas. Las células madre comienzan a transformarse englóbulos rojos, plaquetas o glóbulos blancos jóvenes o inmaduros (neutrófilos, monocitos,eosinófilos, basófilos y linfocitos). Este proceso se llama “diferenciación”. Las célulassanguíneas jóvenes o inmaduras luego se desarrollan aun más para convertirse en célulassanguíneas totalmente funcionales. Este proceso se llama “maduración”.Las células maduras salen de la médula ósea, entran en la sangre y circulan por el cuerpo.La hematopoyesis es un proceso continuo que está activo normalmente durante toda lavida. El motivo de esta actividad es que la mayoría de las células sanguíneas tienen unperíodo de vida corto y deben ser sustituidas constantemente. Los glóbulos rojos muerena los 4 meses, las plaquetas a los 10 días y la mayoría de los neutrófilos después de unoa tres días. Cada día se producen alrededor de cien mil millones de células sanguíneas.Cuando la médula es invadida por células cancerosas, no es posible satisfacer la constantedemanda de nuevas células sanguíneas, lo que da como resultado una grave deficienciaen los conteos de células sanguíneas.Hemoglobina. Pigmento en los glóbulos rojos que contiene hierro y que transporta eloxígeno a las células de los tejidos. Una disminución de la cantidad de glóbulos rojosreduce la cantidad de hemoglobina en la sangre. Una disminución de la concentración dehemoglobina se llama “anemia”. Una concentración baja de hemoglobina disminuye lacapacidad de la sangre de transportar oxígeno. Si fuera grave, esta capacidad disminuidapuede limitar la capacidad de una persona de hacer esfuerzos. Los valores normales de lahemoglobina en la sangre son de 12 a 16 gramos por decilitro (12-16 g/dL). Las mujeressanas tienen alrededor de 10% menos de hemoglobina en la sangre que los hombres.Hibridación in situ con fluorescencia (FISH, por sus siglas en inglés). Una técnicapara estudiar cromosomas en tejidos que utiliza sondas de ADN marcadas con moléculasfluorescentes que emiten luz de distintas longitudes de onda (y distintos colores).Las sondas se unen a los cromosomas dentro de las células, y los cromosomas fluorescencon cierto color.Infusión de linfocitos del donante (DLI, por sus siglas en inglés). Una terapiaque implica donar linfocitos del donante de células madre original a un paciente que sesometió a un alotrasplante de médula ósea con recaída de la enfermedad. Es posibleque la DLI induzca una reacción inmunitaria contra las células cancerosas del paciente.página 33
Esta terapia se ha mostrado más efectiva en pacientes con leucemia mieloide crónica quesufren una recaída luego del trasplante, pero se está estudiando para tratar pacientes consíndromes mielodisplásicos y otros tipos de cáncer de la sangre.Inmunofenotipificación. Método que utiliza la reacción de anticuerpos con antígenoscelulares para determinar un tipo específico de célula en una muestra de célulassanguíneas, células de la médula ósea o células de los ganglios linfáticos. Los anticuerposreaccionan con antígenos específicos en la célula. Se pone una marca a un anticuerpo parapoder detectarlo. La marca puede ser identificada con los equipos de laboratorio que seusan para la prueba. Debido a que las células que trasportan su conjunto de antígenos sonmarcadas con anticuerpos específicos, pueden ser identificadas.Leucemia latente. Vea Leucemia mielógena oligoblástica.Leucemia mielógena oligoblástica. Un término más preciso para describir el trastornodenominado “anemia refractaria con exceso de blastos” (RAEB, por sus siglas eninglés). Este último nombre se usa con frecuencia para designar un tipo de síndromemielodisplásico que exhibe una evidencia manifiesta de células blásticas leucémicasal examinar la sangre o la médula ósea. Puede que la proporción de células blásticasen la médula ósea sea pequeña pero suficiente como para indicar la presencia dehematopoyesis leucémica. El término “leucemia latente” también se ha empleado paraesta manifestación, pero la insinuación de progresión muy lenta no siempre demuestraser cierta.Leucemia mieloide aguda (AML, por sus siglas en inglés). Un cáncer progresivoque comienza con la transformación maligna de una célula inmadura en la médula ósea.La célula afectada suele ser una célula multipotencial primitiva, lo que quiere decir quesu contraparte normal puede dar origen a una variedad de tipos de células sanguíneas.La célula transformada se multiplica y se acumula en la médula ósea como mieloblastosleucémicos. Son sinónimos de AML “leucemia no linfocítica aguda”, “leucemia mielógenaaguda” y “leucemia mielocítica aguda”. Consulte el librito gratuito de LLS titulado Leucemiamieloide aguda.Leucocitos. Vea Glóbulos blancos.Leucopenia. La disminución de la concentración de leucocitos (glóbulos blancos) de lasangre por debajo de lo normal.Macrófago. Vea Monocito (macrófago).Maduración. Vea Hematopoyesis.página 34
MDS inclasificable (MDS-u, por sus siglas en inglés). Un subtipo de los síndromesmielodisplásicos de la clasificación de la Organización Mundial de la Salud (OMS) queincluye a pacientes que no tienen anemia refractaria ni otros subtipos de MDS, pero quetienen neutropenia o trombocitopenia con características inusuales, por ejemplo, fibrosismedular. No aumenta la cantidad de blastos en la sangre ni en la médula ósea.MDS-u. Vea MDS inclasificable.Médula. Vea Médula ósea.Médula ósea. Un tejido esponjoso en la cavidad central hueca de los huesos, dondetiene lugar la formación de las células sanguíneas. Al llegar a la pubertad, la médula óseade la columna vertebral, las costillas, el esternón, las caderas, los hombros y el cráneo es lamás activa en la formación de células sanguíneas. En los adultos, los huesos de las manos,los pies, las piernas y los brazos no contienen médula ósea que produzca sangre. En estossitios, la médula se llena de células adiposas. Cuando las células de la médula ósea hanmadurado para transformarse en células sanguíneas, entran en la sangre que pasa a travésde la médula y son transportadas por todo el cuerpo.Mielodisplasia. Vea Anemia refractaria; Anemia refractaria con sideroblastos anillados.Monocito (macrófago). Un tipo de glóbulo blanco que representa entre el 5 y el 10por ciento de las células en la sangre humana normal. Los monocitos y los neutrófilos sonlas dos células principales que ingieren y destruyen microbios en la sangre. Cuando losmonocitos salen de la sangre y entran en el tejido, se convierten en macrófagos.El macrófago es el monocito en acción: puede combatir infecciones en los tejidos, ingerircélulas muertas (en esta función se llama célula carroñera, “scavenger cell” en inglés)y ayudar a los linfocitos en sus funciones inmunitarias.Monoclonal. Vea Clonal.MPN. Vea Neoplasias mieloproliferativas.MRD. Vea Enfermedad residual mínima.Mutación. Una alteración en un gen como consecuencia de un cambio en una partedel ADN que representa el gen. Una “mutación de célula reproductora” está presenteen el óvulo o el espermatozoide, y se puede transmitir de padres a hijos. Una “mutaciónde célula somática” tiene lugar en la célula de un tejido específico y puede provocar laproliferación de células específicas de ese tejido hasta formar un tumor. La mayoría de lostipos de cáncer comienzan luego de una mutación somática. En la leucemia, el linfomao el mieloma, una célula primitiva de la médula ósea o de un ganglio linfático sufre unao varias mutaciones somáticas que provocan un tumor. Si la mutación es consecuenciapágina 35
de una anomalía cromosómica grave, como una translocación, se puede detectarmediante un examen citogenético. A veces, la alteración en el gen es más sutil yrequiere pruebas más sensibles para identificarla.Mutación de célula somática. Vea Mutación.Mutación de célula reproductora. Vea Mutación.Neoplasias mieloproliferativas (MPNs en inglés). Un grupo de enfermedadesen las que el cuerpo produce un exceso de determinados tipos específicos de célulassanguíneas. La trombocitopenia esencial, la policitemia vera y la mielofibrosis idiopáticason ejemplos de neoplasias mieloproliferativas. Algunas personas con MPD tienencélulas de aspecto anormal en la médula ósea similares a las células de los síndromesmielodisplásicos, y que no son típicas de las MPN. La clasificación de los MDS en laclasificación de la Organización Mundial de la Salud (OMS) incluye la categoría “trastornosmielodisplásicos/neoplasias mieloproliferativas” (también llamados “coincidencia deMDS/MPN”) que abarca a la leucemia mielomonocítica juvenil (JMML, por sus siglasen inglés) y la leucemia mielomonocítica crónica (CMML, por sus siglas en inglés).Neutrófilo. El principal fagocito (célula que ingiere microbios) de la sangre. El neutrófiloes la célula principal que combate infecciones. Es frecuente que no se encuentre encantidades suficientes en pacientes con síndromes mielodisplásicos o después de unaquimioterapia.Una deficiencia grave de neutrófilos aumenta la susceptibilidad del pacientea las infecciones. Un neutrófilo puede llamarse “polimorfonuclear” o “segmentado”porque su núcleo tiene varios lóbulos.Neutropenia. Disminución de la concentración de neutrófilos de la sangre, un tipo deglóbulos blancos, por debajo de lo normal.Oncólogo. Médico que diagnostica y trata a pacientes con cáncer. Por lo general, setrata de un internista que trata a pacientes adultos o de un pediatra que trata a niños.Los oncólogos con especialidad en radioterapia se especializan en el uso de radioterapiapara tratar el cáncer, y los cirujanos oncólogos se especializan en el uso de procedimientosquirúrgicos para diagnosticar y tratar el cáncer. Estos médicos cooperan y colaboranunos con otros para proporcionar el mejor plan de tratamiento (cirugía, radioterapia,quimioterapia o inmunoterapia) para el paciente.Pancitopenia. Disminución, por debajo de lo normal, de la concentración de los tres tiposprincipales de células sanguíneas: glóbulos rojos, glóbulos blancos y plaquetas.Patólogo. Un médico que identifica enfermedades mediante el estudio de célulasy tejidos bajo un microscopio. Vea Hematopatólogo.PICC o vía PIC. Vea Catéter venoso central de inserción percutánea.página 36
Plaquetas. Pequeñas células sanguíneas (de aproximadamente una décima partedel volumen de los glóbulos rojos) que se adhieren al sitio de una lesión de un vasosanguíneo, se unen unas a otras y sellan el vaso sanguíneo dañado para detener elsangrado. “Trombocito” es un sinónimo de plaqueta, y se usa a menudo como prefijoen términos que describen trastornos plaquetarios, tales como trombocitopenia(demasiado pocas) o trombocitemia (demasiadas).Puerto (acceso venoso). Un pequeño dispositivo que se usa junto con un catétercentral para tener acceso a una vena. El puerto se coloca por debajo de la piel del tórax.Una vez que el sitio cicatriza, no se necesitan vendajes ni cuidados especiales en casa.Para administrar medicamentos o elementos nutritivos, o para extraer muestras de sangre,el médico o la enfermera introducen una aguja en el puerto a través de la piel. Se puedeaplicar una crema adormecedora en la piel antes de usar el puerto.Quimioterapia. El uso de sustancias químicas (fármacos o medicamentos citotóxicos)para destruir células malignas. A estos efectos se han desarrollado diversas sustanciasquímicas, y la mayoría actúa dañando el ADN de las células. Cuando se daña el ADN, lascélulas no pueden crecer ni sobrevivir. Una quimioterapia exitosa depende del hecho deque las células malignas sean de algún modo más sensibles a las sustancias químicas quelas células normales. Como las células de la médula ósea, del tubo digestivo, de la piely de los folículos pilosos son las más sensibles a estas sustancias químicas, los dañosa estos órganos causan los efectos secundarios comunes de la quimioterapia, comoúlceras bucales y caída del cabello.RA. Vea Anemia refractaria.RAEB. Vea Leucemia mielógena oligoblástica.RAEB-T. Vea Anemia refractaria con exceso de blastos en transformación.RARS. Vea Anemia refractaria con sideroblastos anillados.RCMD. Vea Citopenia refractaria con displasia multilinaje.Recidiva (recaída). Reaparición de una enfermedad después de haber estado enremisión luego del tratamiento.Remisión. La desaparición de evidencia de una enfermedad, por lo general comoresultado de un tratamiento. Los términos “completa” o “parcial” se utilizan para modificarel término “remisión”. Remisión completa quiere decir que ha desaparecido todoindicio de la enfermedad. Remisión parcial quiere decir que la enfermedad ha mejoradonotablemente por el tratamiento, pero que aún hay evidencia residual de la misma.página 37
Resistencia al tratamiento. Capacidad de las células de subsistir y dividirse a pesar desu exposición a una sustancia química que generalmente destruye las células o inhibesu proliferación. El MDS refractario es la circunstancia en la que un porcentaje de célulascancerosas resiste los efectos dañinos de uno o varios fármacos. Las células desarrollanresistencia a los fármacos de varias maneras distintas.Síndrome 5q-, síndrome 5q menos. Un subtipo de síndromes mielodisplásicos dentrode la clasificación de la Organización Mundial de la Salud (OMS). Este subtipo provocaanemia refractaria (resistente al tratamiento) asociada con una deleción del brazo largo (q)del cromosoma 5, designada “del(5q).” Afecta aproximadamente de 20 a 30% delos pacientes con síndromes mielodisplásicos.Síndromes mielodisplásicos/neoplasias mieloproliferativas (MDS/MPN, por sussiglas en inglés). Vea Neoplasias mieloproliferativas.Transfusión de plaquetas. La transfusión de plaquetas de un donante que podría sernecesaria como apoyo para algunos pacientes tratados por MDS. Las plaquetas puedenextraerse de varios donantes no emparentados y administrarse como plaquetas extraídasde donantes escogidos al azar. Se necesitan plaquetas de aproximadamente 6 donantes,cada uno contribuyendo con una unidad de sangre, para elevar en forma importante lacantidad de plaquetas de un receptor. Pueden obtenerse suficientes plaquetas de unsolo donante mediante un procedimiento llamado “aféresis”. Las plaquetas se extraende grandes volúmenes de sangre que pasan a través de una máquina especializada.Los glóbulos rojos y el plasma se devuelven al donante. La ventaja de recibir plaquetasde un solo donante es que el paciente no se expone a los distintos antígenos de lasplaquetas de diferentes personas y tiene por eso menos probabilidades de produciranticuerpos contra las plaquetas del donante. La transfusión de plaquetas con HLAcompatible puede provenir de un donante emparentado que tenga un tipo de tejidocon HLA idéntico o muy similar. Vea Antígenos Leucocitarios Humanos (HLA, por sussiglas en inglés).Translocación. Una anomalía de los cromosomas en las células de la médula óseao los ganglios linfáticos que ocurre cuando se desprende una parte de un cromosoma y seadhiere al extremo de otro cromosoma. En una translocación balanceada, se intercambia elmaterial genético entre dos cromosomas distintos sin ganancia ni pérdida de informacióngenética. Cuando tiene lugar una translocación, se altera el gen en el que ocurre la ruptura.Ésta es una forma de mutación somática que puede transformar al gen en un oncogén.Vea Mutación.Trasplante de células madre de intensidad reducida. Una forma de alotrasplante.En un trasplante de intensidad reducida (también llamado “trasplante no mieloablativo decélulas madre”), los pacientes reciben dosis inferiores de fármacos de quimioterapia y/oradioterapia como preparación para el trasplante. Se usan fármacos inmunosupresores paraevitar el rechazo del injerto (tejido del donante). El injerto de los inmunocitos del donantepágina 38
puede permitir que estas células ataquen la enfermedad del receptor. Para obtener másinformación sobre todos los tipos de trasplantes de células madre, consulte la publicacióngratis de LLS titulada Trasplante de células madre sanguíneas y de médula ósea.Trasplante de células madre. Vea Alotrasplante de células madre; Autotrasplante decélulas madre.Trasplante de médula ósea. Vea Alotrasplante de células madre; Autotrasplantede células madre.Tratamiento de acondicionamiento. Terapia intensiva de un paciente con fármacoscitotóxicos o fármacos y radioterapia en todo el cuerpo justo antes de someterse aun trasplante de células madre. La terapia sirve para tres propósitos. En primer lugar,deprime en gran medida los linfocitos, que son las células clave del sistema inmunitariodel receptor. Esta acción ayuda a prevenir el rechazo del injerto (tejido del donante).En segundo lugar, disminuye notoriamente las células de la médula ósea, lo que quizássea importante para abrir los nichos especiales donde deben alojarse las células madretrasplantadas a fin de injertarse (sobrevivir). En tercer lugar, si el paciente recibe untrasplante por un tumor maligno, esta terapia intensiva sirve para disminuir en gran medidala cantidad de cualquier célula tumoral que quede.Trombocitopenia. Disminución de la concentración de plaquetas en la sangre por debajode lo normal.página 39
Más informaciónPara obtener más información, consulte las siguientes publicacionesgratuitas de LLSCada Día Nuevo: Consejos para sobrellevar el cáncer de la sangreLa guía sobre la AML: Información para pacientes y cuidadoresLeucemia mieloide agudaLeucemia mielomonocítica crónica (CMML) y leucemia mielomonocíticajuvenil (JMML)Mielofibrosis idiopáticaPolicitemia veraTrasplante de células madre sanguíneas y de médula óseaTrombocitemia esencial o primariaLas publicaciones con títulos en español están actualmente disponibles en español.Puede leer y descargar estas y otras publicaciones de LLS en español visitandowww.lls.org/#/espanol/materiales, o puede pedirlas comunicándose con un especialistaen información de LLS al (800) 955-4572.ReferenciasBlum W. How much? How frequent? How long? A clinical guide to new therapies inmyelodysplastic syndromes. Hematology/American <strong>Society</strong> of Hematology EducationProgram. 2010;2010:314-321.Garcia-Manero G. Prognosis of myelodysplastic syndromes. Hematology/American<strong>Society</strong> of Hematology Education Program. 2010;2010:330-337.Garcia-Manero G, Yang AS, Jagasia M. Evaluating new treatment options for MDS.Clinical Advances in Hematology & Oncology. 2007;5:1-9.Howlader N, Noone AM, Krapcho M, Neyman N, Aminou R, Waldron W, AltekruseSF, Kosary CL, Ruhl J, Tatalovich Z, Cho H, Mariotto A, Eisner MP, Lewis DR, Chen HS,Feuer EJ, Cronin KA, Edwards BK (eds). SEER Cancer Statistics Review, 1975-2008,National Cancer Institute. Bethesda, MD, http://seer.cancer.gov/csr/1975_2008/,basado en la presentación de datos de SEER en noviembre de 2010, publicadoen el sitio web de SEER, 2011.página 40
Kurzrock R, Talpaz M, Zhang F. Myelodysplastic syndromes. Medscape Portals. 1º defebrero de 2001. http://www.medscape.com/viewprogram/115_pnt. Consultado el 9de marzo de 2011.Liesveld JL, Lichtman MA. Chapter 88. Myelodysplastic syndromes, clonal cytopeniasand oligoblastic myelogenous leukemia. Lichtman MA, Kipps TJ, Seligsohn U,Kaushansky K, Prchal. Williams Hematology. 8ª ed.http://www.accessmedicine. com/content.aspx?aID=6139818.Consultado el 4 de abril de 2011.Rizzo JD, Somerfield MR, Hagerty KL, et al. Use of epoetin and darbepoetin inpatients with cancer: 2007 American <strong>Society</strong> of Hematology/American <strong>Society</strong> ofClinical Oncology clinical practice guideline update. Blood. 2008;111:25-41.AgradecimientosLa Sociedad de Lucha contra la Leucemia y el Linfoma expresa su gratitud, porsu revisión crítica y sus importantes contribuciones al material presentado en estapublicación, a:Elihu H. Estey, MDProfesor de MedicinaDivisión de Hematología, University of Washington Medical CenterFred Hutchinson Cancer Research Center, Seattle, WApágina 41
Para obtener más información, póngase en contacto con:o con:Oficina Central1311 Mamaroneck AvenueWhite Plains, NY 10605Comuníquese con nuestros especialistas en información llamando al 800.955.4572(puede solicitar los servicios de un intérprete)www.LLS.orgNuestra misión: Curar la leucemia, el linfoma,la enfermedad de Hodgkin y el mieloma, y mejorarla calidad de vida de los pacientes y sus familias.LLS es una organización sin fines de lucro que depende de la generosidad de las contribuciones particulares, corporativasy de fundaciones para continuar con su misión.PS23 3.5M 7/11